 图1
光气、神经毒剂及其替代物的结构式[20]
Figure1.
Structures of phosgene, nerve agents and their surrogates[20]
图1
光气、神经毒剂及其替代物的结构式[20]
Figure1.
Structures of phosgene, nerve agents and their surrogates[20]

Citation: CHEN Jianhua, LI Dongyang, LIU Shenghua, TAN Ying, YIN Jun. Recent Advances in Phosgene and Nerve Agents Responsive Fluorescent Probes[J]. Chinese Journal of Applied Chemistry, 2017, 34(12): 1413-1432. doi: 10.11944/j.issn.1000-0518.2017.12.170309

光气及神经毒剂类荧光探针的研究进展
English
Recent Advances in Phosgene and Nerve Agents Responsive Fluorescent Probes
-
Key words:
- fluorescent probes
- / phosgene
- / nerve agents
-
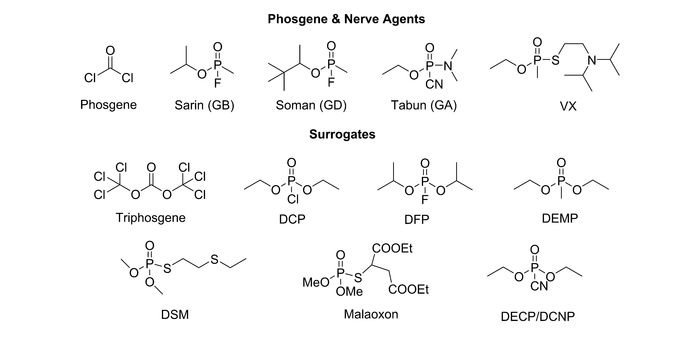
光气(Phosgene)和神经毒剂(Nerve Agents)是一类具有强亲电能力的剧毒性气体。其中光气是一类具有较高化学反应活性的酰氯衍生物,在工业上有着极为重要的应用价值,常被用于许多化学品的初始原料,尤其是在农药、医药、塑料等产品的合成方面发挥了巨大的作用[1]。然而,光气作为一种无色的剧毒性气体,通常是以呼吸道和皮肤渗透的方式侵入人体,并且在数小时内发挥其全部毒性,从而引起肺部严重损伤或窒息,严重的会导致死亡,通常,2×10-3 g/L的光气就足以致人死亡[2-3]。早在第一次世界大战时就被作为一种化学武器试剂应用于战争[4]。由此,光气无论是作为一种潜在的化学武器,还是在工业生产中的意外泄露,均将会对社会安全造成极大的威胁[5-6]。神经毒剂是一类有机磷酸酯类衍生物。因其易挥发,被人体吸入后,会阻塞神经元突触中的乙酰胆碱酯酶,造成神经脉冲传输混乱[7]。神经毒剂主要有两类:一类是G型神经毒剂,主要包括沙林(O-isopropyl methylphosphonofluoridate,GB)、索曼(3, 3-dimethyl-2-butyl methyl phosphonofluoridate, GD)和塔崩(N, N-dimethylethyl phosphoramidocyanidate, GA)等;另一类是V型神经毒剂,主要包含维埃克斯(O-ethyl-S-(2-diisopropylaminoethyl)methylphos-phonothioate)等。V类神经毒剂是一类磷酰基硫醇化合物,无色无味,毒性较G类神经毒性大[8]。神经毒剂的剧毒性主要源于它们极强的亲电能力,极易与人体重要的中枢神经酶乙酰胆碱酯酶作用,破坏神经冲动传导,导致器官衰竭,数秒后就可致人死亡[9-10]。由此,光气和神经毒剂因其剧毒特性,它们的泄露会对社会安全和人类健康造成重大灾难,因此对于此类剧毒物质的分析检测极为重要。
传统的光气和神经毒剂的分析方法主要有拉曼光谱、气相色谱-质谱联用仪、酶促生物传感等[11-13]。虽然这些方法能提供精确的检测结果,但通常受限于样品处理繁琐、操作复杂、时间较长、需要大型仪器设备等,特别是无法在生物体微环境体系下进行检测,极大地限制了它们的进一步应用[14-16]。近些年快速发展起来的荧光探针与生物成像技术,由于其灵敏度高、选择性好、操作简便、成本低,且能在微环境体系中进行实时原位检测等优点[17-19],而被科研人员大量地应用于光气和神经毒剂的检测[20]。由于光气和神经毒剂具有较高的化学反应活性,因此目前基于光气和神经毒剂响应的荧光探针主要是以化学反应型探针为主。考虑到目前该领域的快速发展,本文按照检测基团进行分类,综述了近年来在光气、神经毒剂类荧光探针领域所取得的最新研究进展,并对今后该领域的发展进行了展望。此外,由于光气和神经毒剂的剧毒特性给实验及相关研究带来了诸多困难,因此在实际的实验过程中,通常是以毒性较低的类似物来代替光气和神经毒剂。对于光气而言,其同类物三光气因其毒性小、不易挥发,且在强亲核性的三级胺类物质的存在下能转化为光气,因此在检测的过程中,普遍采用三光气作为光气的替代物(如图 1所示)。而对于神经毒剂而言,在检测的过程中,经常采用与神经毒剂结构相似的化合物作为检测对象,其中,G类神经毒剂的相似物有:氯磷酸二乙酯(Diethylchlorophosphate, DCP)、氟磷酸二异丙酯(Diisopropylfluorophosphate, DFP)、氰基磷酸二乙酯(Diethylcyanophosphonate, DECP/DCNP)和甲基磷酸二乙酯(Diethylmethylphosphonate, DEMP);V类神经毒剂的相似物有:内吸磷-S-甲基(Demeton-S-methyl, DSM)和马拉代氧气磷(1, 2-Bis(ethoxycarbonyl)ethyl-O, O-dimethyl phosphorothioate, Malaoxon)(图 1)。
1 光气荧光探针
光气的活性基团为羰基,含有两个易离去的氯原子,因此可与两分子的亲核物质氨基或羟基发生酰化反应。该类荧光探针的识别机理为光气与氨基发生分子间的交联反应,或是与分子内的氨基、羟基发生成环反应,从而使得荧光分子的光物理性质发生改变,并且以荧光信号或颜色变化的方式表现出来。
1.1 以氨基为反应基团的荧光探针
光气与氨反应是用来制备脲类化合物的重要方法之一,因此氨基也常被用作检测基团去检测光气。Rudkevich课题组[21]将氨基引入到官能化的香豆素1-1和1-2,组成复合探针1。由于氨基的存在,在CHCl3和Et3N混合溶液中,等摩尔量的化合物1-1和1-2能同时与光气进行交叉反应,生成产物1-3(如图 2所示)。其中,化合物1-1中的荧光团的最大发射波长位于343 nm处,其刚好可以作为化合物1-2的激发波长,因此在生成的产物1-3中,存在一个明显的荧光能量共振转移(Fluorescence Resonance Energy Transfer, FRET)过程,且在464 nm处出现荧光增强。该复合探针的检测限为5×10-5 mol/L,利用此方法可以实现对光气的有效检测。
类似的烷基胺也被引入罗丹明染料用于光气的检测。韩守法课题组[22]报道了一例可比色、荧光检测光气的高灵敏荧光探针2(图 3)。该探针以罗丹明脱氧内酰胺为荧光母体,以乙二氨为检测基团。向该探针的Et3N和N, N-二甲基甲酰胺(N, N-Dimethylformamide, DMF)混合溶液中通入三光气,溶液颜色由无色变为红色。同时,伴随着荧光从关到开的过程,其最大发射波长在590 nm处。最低检测极限可达到50 nmol/L,同时能可视化检测到0.4~8 mg/L的气态光气。究其机理,主要是因为探针2与光气发生酰胺化反应生成中间体2-1,随后脱氧内酰胺开环、分子内电子重排进而得到咪唑酮衍生物2-2。
最近,田志远课题组[23]报道了一例比例型荧光探针3,其对光气的响应时间为1.5 s,检测极限低至0.12 nmol/L(如图 4所示)。该探针以氟硼二吡咯(Boron-dipyrromethene, BODIPY)染料为荧光团,在8号位引入乙二胺作为检测基团。在Et3N和CH3CN混合溶液中,当激发波长为390 nm时,随着三光气的加入,探针3在445 nm处的蓝色荧光逐渐减弱,同时在512 nm处出现新的绿色荧光,其中蓝色和绿色荧光量子效率分别为0.15、0.65。而当激发波长为465 nm(更接近于产物的最大紫外-可见吸收)时,探针在512 nm处的荧光强度呈现更大转化比率。该探针的作用机理包含两个过程:首先是二级脂肪胺与光气发生反应生成高活性中间体3-1,随后发生分子内环化反应生成咪唑酮衍生物3-2。此检测过程中,原先探针分子中存在的分子内电荷转移(Intramolecular Charge Transfer, ICT)过程被抑制,从而实现了对光气的比例型响应。
相较于烷基的乙二胺检测基团,芳香环上氨基取代的邻苯二胺也能用于光气的高效检测。Lee课题组[24]报道了一系列高选择性、可比色检测光气的荧光探针4、5和6(如图 5所示)。该类探针以邻苯二胺为检测基团、分别以硝基苯并氧杂噁二唑(4-Chloro-7-nitrobenzo[c]-[1, 2, 5]oxadiazole, NBD),萘酰亚胺以及罗丹明为荧光团。当荧光团上的邻苯二胺与三光气进行反应时,形成苯并咪唑酮类产物4-1、5-1和6-1,从而引起紫外-可见吸收及荧光光谱的变化。探针4在CH3CN溶液中,随着三光气的加入,能够裸眼观察到溶液颜色从橘色变成淡黄色,同时出现蓝色荧光。探针5在CHCl3和p-xylene混合溶液中,随着光气的浓度增加,最大发射峰在480 nm处的绿色荧光逐渐增强;探针6在CHCl3和CH3OH的体系中,随着三光气的加入,溶液颜色从无色变成粉红色,其最大发射波长在575 nm处的红色荧光逐渐增强。该3种探针的检测极限分别为0.7×10-6、2.8×10-6和2.8×10-6 g/L。且探针4和5可分别嵌入到聚合物纤维中检测光气。
Yoon课题组[25]报道了第一例可利用不同的荧光通道区分光气和其他化学毒剂的荧光探针7(如图 6所示)。该探针以邻苯二胺为识别基团,派洛宁为荧光团,探针本身存在光诱导电荷转移(Photoinduced Electron Transfer, PET)过程,荧光淬灭。当探针与神经毒剂模拟物DCP发生磷酸化作用生成相应产物7-1时,在470 nm激发光条件下,其在538 nm处的最大发射峰逐渐增强。当荧光团上邻苯二胺与光气反应形成苯并咪唑酮7-2时,在CHCl3溶液中及580 nm激发光条件下,随着三光气的加入,可裸眼观察到溶液由黄色变为紫色,且在593 nm处出现新的发射峰并逐渐增强,其检测极限可达到20 nmol/L。此外,该探针对其他相似结构的氯化物、酰氯化物均无明显的荧光响应。此外,当探针被负载在滤纸上后,可同时实现对气态光气和DCP的有效检测。
宋钦华课题组[26]报道了一例可视化高选择性检测光气的荧光探针8(如图 7所示)。该探针以香豆素为荧光团,邻苯二胺为识别基团。由于分子内的PET效应,探针本身无荧光,当遇到光气后,可形成苯并咪唑酮类产物8-1,PET过程被抑制,从而实现荧光从关到开的过程。在含体积分数0.1%Et3N的CHCl3体系中加入5化学计量的三光气,探针在446 nm处的发射峰呈现533倍的增强,检测极限为3 nmol/L。该探针对三光气、其它酰基氯化物、神经毒剂模拟物均无明显的荧光响应,当该探针被负载在滤纸上后,可实现对气态光气的高效检测。
随后,他们进一步发展了一例能比率检测液态和气态光气的荧光探针9[27](如图 8所示)。该探针以4, 5-二氨基-1, 8-萘二甲酰亚胺为骨架,分子内位于4, 5-位点上的两个N-H能与光气发生氨甲酰化生成9-2,给电子能力降低,分子内ICT过程被削弱。在含Et3N的1, 2-二氯乙烷体系中,随着三光气的加入,在511 nm处的最大发射波长逐渐降低,而同时在442和467 nm处分别出现新的荧光发射峰,荧光量子产率从0.37变为0.87,实现对光气的比率荧光识别,检测极限为1.3 nmol/L。该探针对三光气、其它酰基氯化物、神经毒剂模拟物均无明显的荧光响应,将该探针负载在滤纸上可用于检测气态光气。
最近,他们还报道了一例具有高选择性的光气荧光探针10[28](如图 9所示)。该探针以BODIPY为荧光团,同样以邻苯二胺为检测基团。当探针与光气进行反应时,形成苯并咪唑酮类产物10-2,PET过程被抑制,从而实现荧光从关到开的过程。在含体积分数0.1%Et3N的CHCl3体系中加入5化学计量的三光气,探针在530 nm处的荧光强度呈现9800倍的增强。由于邻苯二胺不存在三级胺结构,且具有较强吸电子能力的BODIPY能显著降低邻苯二胺上氨基的亲核性,因此该探针10对光气的其它类似物以及神经毒剂均无响应,展现了良好的选择性。此外,该探针对光气具有较快的响应速率,检测极限为2.7 nmol/L。同样,该探针也能负载在滤纸上用于气态光气的检测。
1.2 以羧基为反应基团的荧光探针
羟基作为活性基团也可用作光气的检测基团。Hwang课题组[29]发现6种商业化的原料11~16同时含有羧基和羟基(如图 10所示),且光气能够与羟基反应、随后与羧基发生分子内环化反应,生成具有荧光的香豆素或喹啉酮衍生物11-1~16-1。在CHCl3中通入光气,该系列的探针均表现出蓝色的荧光,且对光气的最低检测极限在1~18 nmol/L范围内。
2 神经毒剂荧光探针
神经毒剂探针的工作方式较光气探针则更为多样化,其工作方式可分为两类:一类是直接检测被测物,既可与亲核物质氨基、肟基、吡啶等发生磷酸化反应导致荧光分子的光物理性质发生变化;若探针中存在孤对电子,则可进一步进攻神经毒剂产生环化产物,从而达到荧光信号的改变;也可与硫脲反应得到闭合产物或与螺吡喃反应开环后又形成新的闭合产物来达到荧光信号的改变。另一类则是通过检测被测物释放出的副产物,如氟离子,硫醇,利用信号放大的方法从而达到检测的目的。
2.1 以羟基为反应基团的荧光探针
早在2013年,王伟课题组[30]报道了一例基于FRET机理的比色和比率型DCP荧光探针17(如图 11所示)。该探针以罗丹明类似物作为荧光共振能量转移中的受体,以香豆素作为给体,通过哌嗪相连。在DMF溶剂中,随着DCP加入,溶液颜色由黄色变成无色;当激发波长为410 nm时,在460 nm处的最大发射峰逐渐降低,同时,在536 nm处的荧光强度逐渐增强,荧光由亮黄色变为蓝色,该探针对DCP的检测极限达到0.17×10-3 g/L。究其机理:主要是由于羧酸盐发生内酯化形成闭合的螺内酯,随后酚盐与DCP发生磷酸化作用后生成17-1,FRET作用被抑制,只出现香豆素荧光团信号,从而实现对DCP的比率检测。该探针也可检测其它相关的磷酸酯类化合物。由于探针中酚盐部分具有去质子化功能,因此不受酸的干扰,在碳酸钾存在条件下,可附着于pH试纸上用于检测气态DCP。
随后,Churchill课题组[31]报道了一例以商业化且水溶性好的荧光素作为神经毒剂的荧光探针18(图 12),首次实现了对有机磷酸酯类分子和超氧化物的同时检测。在4-羟乙基哌嗪乙硫磺酸(2-[4-(2-Hydroxyethyl)-1-piperazinyl]ethanesulfonic acid, HEPES)缓冲溶液中,当激发波长为490 nm时,随DCP的加入,最大荧光发射峰在511 nm处降低,检测极限为372 μmol/L。究其机理,主要是由于酚盐与DCP发生磷酸化作用,氯离子离去形成二亚膦酸盐,随后羧酸发生内酯化形成闭合的螺内酯18-1。此外,该探针还可用于DEMP的检测。有意思的是,产物18-1可通过超氧化物实现可逆,得到具有强荧光的荧光素。
Sancenón课题组[32]将苯酚引入到于BODIPY染料中,发现探针19可实现对DFP、DCNP的检测(如图 13所示)。该探针含有3个活性反应位点:分别为具有亲核性的苯酚,能与神经毒剂产生磷酸化作用;醛基可作为氰化物的识别位点;而三异丙基硅烷(Triisopropylsilane, TIPS)保护基团能与氟化物发生反应。在CH3CN溶液中,分子中的苯酚与DCNP发生磷酸化作用,释放出氰化物与羰基基团发生反应生成19-1,从而使溶液颜色由粉色变成橘色;同时苯酚与DFP发生磷酸化作用后,释放出的氟化物可脱掉TIPS基团生成19-2,溶液颜色由粉色变为蓝色。此外,DCNP、DFP均能使探针分子的荧光发生淬灭,检测极限分别为0.36×10-3和0.40×10-3 g/L。该探针还可附着于硅胶板上或制成聚乙烯氧化物薄膜用于检测气态和液态的DCNP、DFP。
2.2 以氨基为反应基团的荧光探针
Wang课题组[33]报道了一例基于氨基取代的荧光素染料通过纳米级自组装快速(10 s)检测DCP的荧光探针20(如图 14所示)。探针浸入到二氧化硅纳米粒子中,通过真空喷镀的方法添加铂,形成探针/二氧化硅-NH2/铂的微型电动机。利用此方法可在不同溶液中快速检测DCP。该探针的作用机理:利用荧光素上的氨基与DCP发生亲核取代生成20-1,从而达到检测的目的。
2.3 以羟基-氨、羧基-氨为反应基团的荧光探针
韩守法课题组[34]报道了一种基于罗丹明B脱氧内酰胺为荧光母体、羟基为反应基团的比色型DCP荧光探针21(如图 15所示)。在含体积分数3%Et3N的DMF溶液中,随着DCP的加入,溶液颜色由无色变为红色;当激发波长为560 nm时,在590 nm处的最大发射峰逐渐增强,从而实现对DCP的比色和荧光检测。究其机理:主要是由于DCP与探针分子的羟基发生磷酸化作用后,生成中间体21-1,随后脱氧内酰胺上的氮对磷酸酯亲核进攻,脱氧内酰胺开环生成新的五元环杂环21-2。
随后,Wu等[35]也报道了一例类似的快速检测DCP的荧光探针22(如图 16所示)。不同之处在于:该探针以罗丹明内酰胺作为荧光母体,探针分子中的羟基与DCP发生亲核取代形成中间体22-1后,内酰胺中酮上的氧对磷酸酯亲核进攻,随后磷酸酯离去,内酰胺开环并生成噁唑啉22-2。该探针同样能够实现对DCP比色和荧光检测:在DMF溶液中,随着DCP的加入,溶液由无色变为粉红色;当激发波长为520 nm时,在590 nm处的荧光逐渐增强,可快速检测10-3 g/L级的DCP。
Sancenón课题组[36]报道了一类基于BODIPY染料的能区分酸性物质和神经毒剂模拟物的荧光探针23、24(如图 17所示)。该探针含有羟基-氨识别位点,且更易质子化的吡啶部分避免了酸性物质的干扰。其作用过程:具有亲核性的羟基与神经毒剂更易磷酸化形成磷酸酯23-1和24-1,随后分子内氮原子对磷酸酯亲核进攻,导致磷酸酯基团离去,探针23形成五元环的四级铵盐23-2,而探针24形成六元环的吗啉阳离子24-2。在CH3CN溶液中,随着DCNP或DFP的加入,探针23的溶液由蓝色变成粉红色,探针24的溶液由紫色变成粉红色;当激发波长为530 nm时,在725 nm处的最大发射波长均有所降低,同时在570 nm处的荧光逐渐升高。此外,该组探针还可附着在硅胶板或者聚乙烯氧化物薄膜上制成比色试纸,用于检测气态和液态下的神经毒剂模拟物。
江云宝课题组[37]报道了一例以具有近红外发射的七甲川花菁染料为荧光母体的DCP荧光探针25(图 18)。该探针的反应机理:利用羧基与神经毒剂发生亲核取代反应形成酰化产物25-1,随后发生分子内酰胺化反应形成25-2,从而七甲川花菁染料的桥头胺基的给电子能力减弱,吸收波长红移。在CH3CN溶液中加入酰化反应催化剂4-二甲氨基吡啶(4-dimethylaminopyridine, DMAP),随DCP的加入,溶液颜色由蓝色变成浅绿色,紫外吸收由620 nm红移至790 nm;最大发射峰由750 nm逐渐红移至807 nm,并伴随荧光的增强,检测极限可达到0.136 nmol/L。且探针在其它含氯的相似有毒气体中,对DCP具有较高的选择性,且不受酸性物质的干扰。该探针可附着于滤纸上用于检测气态DCP。此外,当探针浓度高至1×10-5 mol/L时,可用于检测DCNP。
最近,Churchill课题组[38]报道一例以香豆素骨架为荧光团,羟基-氨为识别基团的DCP荧光探针26(如图 19所示)。在香豆素的4号位引入了二甲基氨基苯基团作为亲核基团,探针分子内存在PET效应,荧光淬灭。当在CHCl3溶液中加入DCP后,苄基醇与DCP发生磷酸化作用生成中间体26-1,随后发生分子内环化形成六元环的四级铵盐26-2,PET过程被抑制出现荧光。当激发波长为388 nm时,在460 nm处的最大发射峰逐渐增强,检测极限为44 nmol/L,且探针在其它含磷酸酯或者酸性物质中对DCP具有高的选择性。
2.4 以肟基为反应基团的荧光探针
2014年,Kim课题组[39]报道了一例以荧光素为荧光母体、肟基为检测基团的DCP荧光探针27(如图 20所示)。在HEPES溶液中,随着DCP的加入,溶液颜色由橘色变成绿色;当激发波长为460 nm时,在515 nm处的最大发射峰急剧升高,呈现出绿光荧光,检测极限为10 nmol/L。且该探针在其它有机磷类物质中对DCP表现出高选择性,但易受到酸性物质的干扰。究其机理:主要是探针与DCP发生环化反应,形成异噁唑中间体27-1,随后在碱性水溶液状态下开环生成产物27-2。
Churchill课题组[40]报道了一例可区别于DCP和DEMP的DECP荧光探针28(如图 21所示)。该探针以BODIPY为荧光团,肟基为检测基团。在HEPES溶液中,加入DEMP后,当激发波长为499 nm时,其在508 nm处的最大发射峰逐渐增强,检测极限为997 nmol/L。其作用机理是肟上的氮原子具有给电子能力,使得探针本身存在PET效应而无荧光,当与DECP发生亲核取代反应生成28-1,肟基脱水得到具有吸电子能力的氰基,从而抑制PET过程,荧光增强;而当其与DCP和DEMP发生亲核取代反应生成28-2,PET过程仍存在,因而没有出现荧光变化。
最近,Churchill课题组[41]还报道了一例快速检测DECP的双发射荧光探针29(如图 22所示)。该探针以1, 8-萘酰亚胺为荧光团,在3-位和4-位上分别引入羟基、肟作为识别位点,探针本身存在PET效应,荧光淬灭。在PBS缓冲溶液中,随着DECP的加入,当激发波长为354 nm时,在410 nm处的蓝色荧光逐渐增强,而当激发波长为458 nm时,其在570 nm处的黄色荧光逐渐增强,且在30 s可达到荧光最大值,检测极限为21.9 nmol/L。究其机理:主要是由于DECP首先与肟发生亲核取代反应生成29-1;随后,DECP再与酚羟基反应生成产物29-2。该探针仅适用于中性和碱性溶液中,在其它神经毒剂存在条件下,对DECP表现出较高的选择性,且可附着于硅胶板上实现对气态和液态DECP的双荧光检测。
2.5 以吡啶为反应基团的荧光探针
Churchill课题组[42]报道了一例基于BODIPY为荧光母体,吡啶为检测基团的DCP荧光探针30(如图 23所示)。在CH3CN溶液中,随着DCP的加入,溶液由黄色变为粉色;同时伴随绿色荧光减弱,检测极限为3.36 μmol/L;该探针可附着于滤纸上用于检测液态DCP。同时,该探针还可用于对神经毒剂GD本身及其替代物DCP的高选择性检测,呈现出明显的比色和荧光变化。
同时,吴水珠课题组[43]报道了一例检测气态DCP的双发射比率型荧光探针31(图 24)。该探针以具有聚集诱导发光(Aggregation-Induced Emission, AIE)的四苯乙烯(Tetraphenylethylene, TPE)作为荧光母体,吡啶作为检测基团,与具有吸电子能力的二苯胺形成推拉电子结构。该探针在溶液状态下无荧光,作用于试纸条上后呈聚集状态,表现出黄色的荧光。随气态DCP浓度增加,当激发波长为465 nm时,在546 nm处的最大发射峰降低并红移,当红移至624 nm处,发射峰逐渐升高,呈现出橘红色的荧光,检测极限可达1.82×10-6 g/L;且在其它磷酸酯类物质存在下对DCP表现出高选择性。究其机理:主要是由于吡啶较二苯胺具有更强的亲核性和更小的空间阻碍,因此DCP优先与吡啶发生亲核取代反应,形成不稳定的中间体31-1,水中的氧原子进攻P—N键,水解形成吡啶盐31-2,推拉电子能力增强。
最近,宋钦华课题组[44]报道了一系列基于不同N-取代的6-氨基喹啉类DCP荧光探针32~37(如图 25所示)。其作用机理:探针与DCP发生亲核取代反应后,催化水解得到相应的具有更强分子内电荷转移(ICT)的质子化产物。以探针37为例,其对DCP具有高选择检测,且出现比率荧光信号。在CH3CN溶液中,在377 nm处的最大发射峰逐渐降低,而476 nm处荧光增强,检测极限可达到8 nmol/L。该探针与聚环氧乙烷混合可附着于测试条上检测气态DCP。
2.6 以硫脲为反应基团的荧光探针
Son课题组[45]报道了一例以罗丹明6G为荧光母体、硫脲为检测基团的DCP荧光探针38(如图 26所示)。在含有Et3N的DMF溶液中,随着DCP的加入,溶液由无色变成粉色且伴随着黄色荧光增强,检测极限可达到0.142 μmol/L。究其机理:主要是由于DCP与硫脲发生反应,NH部分脱质子化,伴随罗丹明开环生成产物38-1。该探针还可附着于试纸条上用于检测气态DCP。
2.7 以螺吡喃为反应基团的荧光探针
Mandal课题组[46]报道了一例比色、比率型DCP荧光探针39(如图 27所示)。该探针以螺吡喃骨架为检测基团。在二甲基亚砜(Dimethyl sulfoxide, DMSO)和HEPES的混合溶液中,随着DCP的加入,溶液由绿色变为黄色;当激发波长为429 nm时,在498 nm处的最大发射峰逐渐降低,同时在633 nm处出现红色荧光,检测极限为17 nmol/L。究其机理:主要是由于探针在极性较大的溶剂中,易形成相应的两性离子,酚羟基与DCP发生反应,随后磷酸酯上的氧原子进攻吲哚位置形成八元环39-1。该探针可附着于滤纸上用于检测气态DCP,值得一提的是,该探针还可以用于生物活体水平上检测DCP。
与此同时,Aicha课题组[47]报道了一例荧光开的DCP探针40(如图 28所示)。其作用机理:螺吡喃上具有亲核性的氧原子进攻DCP的膦酰基,螺吡喃开环得到半花菁,并伴随有ICT效应,出现荧光增强。在CH3CN和H2O的混合溶液中,随着DCP的加入,30 s内可迅速反应,溶液颜色由无色变为黄色;当激发波长为460 nm时,在675 nm处的最大发射峰强度有84倍增强,检测极限为10 nmol/L。该探针在金属离子、过氧化物以及DCNP存在下对DCP表现出较高的选择性,且可附着于薄层色谱板用于检测气态的DCP。
最近,Mahapatra课题组[48]报道了一例基于羟基萘环-半花菁的比色、比率型DCP荧光探针41(如图 29所示)。向CH3CN-H2O的HEPES溶液中加入DCP,溶液由亮褐色变成橘黄色;当激发波长为354 nm时,荧光呈现出明显的比率变化,I602/I478值逐渐变大,表现出红光发射,检测极限为18.86 nmol/L。究其机理:主要是由于该探针在光辐射条件下可形成环化的异构体41-1,酚羟基与DCP发生亲核取代反应,随后在半花菁部分发生环化反应,形成产物41-2。该探针在磷酸酯以及酰氯类物质存在下对DCP表现出高选择性,且可作用于滤纸上检测气态DCP以及土壤中的DCP,同时可在生物活体水平上检测DCP。
2.8 以氟离子诱导的荧光探针
Rana课题组[49]报道了一例能可视化检测并区分V类神经毒剂和塔崩的荧光探针42(如图 30所示)。该探针以四元方酸染料为骨架,在CHCl3溶液中,其作用过程分为两步:Malaoxon、DCNP分别与氟离子反应生成CN-离子和硫离子,当它们与探针结合后,溶液颜色由蓝色变成无色,荧光淬灭;当向42-S-R中再加入汞离子后,荧光逐渐增强;而汞离子无法脱去42-CN上的氰离子,因此无明显变化。利用这一策略,该探针可以检测和区分塔崩和V类神经毒剂,并且在酰氯以及其它神经毒剂存在下,对该两种神经毒剂表现出较高的选择性。
最近,Anslyn课题组[50]报道了一例以萘酰亚胺为荧光母体的荧光探针43(如图 31所示)。利用间接检测含氟的G类神经毒剂的副产物氟离子以及串联反应达到信号放大的方法可实现对DFP的比色及比例荧光检测。其作用过程包含2步:首先是在异丙醇、水和吡啶的混合体系中,DFP与具有强亲核性的苯甲醛肟反应产生副产物氟离子;然后通过化合物43-1可使氟离子成指数倍的增长;再利用荧光探针43上的叔丁基二甲基硅醚(tert-Butyldimethylsilyl, TBS)基团检测氟离子,释放出三当量的具有绿色荧光信号的萘酰亚胺43-2。
随后,他们又对氟离子的放大方法进行了改进[51]。利用该探针与氟离子反应释放出的醇类物质和苯甲酰氟作用直接产生氟离子,从而加快了检测的速率。此外,采用Wang树脂-苯甲醛肟的结合体替换苯甲醛肟,可避免苯甲醛肟与苯甲酰氟发生反应产生错误信号,并且可通过过滤的方式得到含氟离子的滤液,从而实现了在同一溶剂条件下对DFP的定量检测(如图 32所示)。
2.9 以硫醇诱导的荧光探针
Anslyn课题组[52]报道了一例以2, 4-二硝基苯-磺酰基荧光素为荧光母体的V-类神经毒剂荧光探针44(如图 33所示)。该探针的作用策略主要分为两步:首先硫醇诱发剂与2, 2′-二硫二乙醇(2-Hydroxyethyl disulfide, BMEox)发生硫醇-二硫化物交换得到β-巯基乙醇(β-Mercaptoethanol, BME),当加入化合物44-1时,可以进一步裂分得到甲硫醇,其紫外吸收出现60 nm的蓝移,该过程可循环进行,然后采用硫醇荧光探针即可达到检测的效果。在HEPES溶液中,当加入探针后,当激发波长为490 nm时,在515 nm处的荧光强度逐渐增强。作者采用V类神经毒剂的相似物DSM,其在碱性条件下可释放出硫醇类物质,通过上述的串联闭合反应可达到信号放大,利用不同浓度的DSM与相应荧光或紫外吸收强度形成的线性校正曲线可实现对DSM的定量检测,检测极限可达到17×10-6 g/L。
3 结论和展望
本文综述了近年来在利用荧光探针技术检测光气及神经毒剂方面的最新研究进展,按照检测基团及反应机理的不同进行分类归纳,描述了这类探针基本的光学响应性质及其在实际检测中的应用。尽管基于荧光响应的光气及神经毒剂类检测手段已经取得了一定的进展,但是我们依然要清醒的认识到,目前该领域的研究仍然处于初级阶段。一方面,目前仍然缺乏具有高度选择性的荧光探针,受到类似物的干扰程度依然较大。另一方面,涉及光气及神经毒剂类荧光探针在细胞、活体水平方面的研究较少,对于它们的细胞毒副作用在今后的研究中还需要进一步阐明。
-
-
[1]
Price R. A Genealogy of the Chemical Weapons Taboo[J]. Int Org, 1995, 49(1): 73-103. doi: 10.1017/S0020818300001582
-
[2]
Sciuto A M, Stotts R R, Hurt H H. Efficacy of Ibuprofen and Pentoxifylline in the Treatment of Phosgene-induced Acute Lung Injury[J]. Appl Toxicol, 1996, 16(5): 381-384. doi: 10.1002/(ISSN)1099-1263
-
[3]
Noort D, Hulst A G, Fidder A. In Vitro Adduct Formation of Phosgene with Albumin and Hemoglobin in Human Blood[J]. Chem Res Toxicol, 2000, 13(8): 719-726. doi: 10.1021/tx000022z
-
[4]
Bast C B, Glass-Mattie D F. Handbook of Toxicology of Chemical Warfare Agents[M]. 2nd Ed. Boston:Academic Press, 2015:327-335.
-
[5]
Andersen L L. Influence of Psychosocial Work Environment on Adherence to Workplace Exercise[J]. J Occup Environ Med, 2011, 53: 182-184. doi: 10.1097/JOM.0b013e3181207a01f
-
[6]
Eckert H, Forster B. Triphosgene, a Crystalline Phosgene Substitute[J]. Angew Chem Int Ed, 1987, 26(9): 894-895. doi: 10.1002/(ISSN)1521-3773
-
[7]
Ehrich M. Organophosphates, in Encyclopedia of Toxicology[M]. San Diego:Academic Press, 1998:467-471.
-
[8]
Gupta R. Handbook of Toxicology of Chemical Warfare Agents[M], London:Academic Press, 2009.
-
[9]
Marrs T C. Organophosphate Poisoning[J]. Pharmacol Ther, 1993, 58: 51-66. doi: 10.1016/0163-7258(93)90066-M
-
[10]
Sidell F R, Borak J. Chemical Warfare Agents:Ⅱ[J]. Ann Emerg Med, 1992, 21(7): 865-871. doi: 10.1016/S0196-0644(05)81036-4
-
[11]
Hill Jr H H, Martin S J. Conventional Analytical Methods for Chemical Warfare Agents[J]. Pure Appl Chem, 2002, 74(12): 2281-2291.
-
[12]
Brown K. Up in the Air[J]. Science, 2004, 305(5688): 1228-1229. doi: 10.1126/science.305.5688.1228
-
[13]
Eubanks L M, Dickerson T J, Janda K D. Technological Advancements for the Detection of and Protection Against Biological and Chemical Warfare Agents[J]. Chem Soc Rev, 2007, 36(3): 458-470. doi: 10.1039/b615227a
-
[14]
Yao J, Fu Y, Xu W. Concise and Efficient Fluorescent Probe via an Intromolecular Charge Transfer for the Chemical Warfare Agent Mimic Diethylchlorophosphate Vapor Detection[J]. Anal Chem, 2016, 88(4): 2497-2501. doi: 10.1021/acs.analchem.5b04777
-
[15]
Kim K, Tsay O G, Atwood D A. Destruction and Detection of Chemical Warfare Agents[J]. Chem Rev, 2011, 111(9): 5345-5430. doi: 10.1021/cr100193y
-
[16]
Wu W, Dong J, Wang X. Fluorogenic and Chromogenic Probe for Rapid Detection of a Nerve Agent Simulant DCP[J]. Analyst, 2012, 137(14): 3224-3226. doi: 10.1039/c2an35428d
-
[17]
Yin J, Hu Y, Yoon J. Fluorescent Probes and Bioimaging:Alkali Metals, Alkaline Earth Metals and pH[J]. Chem Soc Rev, 2015, 44(14): 4619-4644. doi: 10.1039/C4CS00275J
-
[18]
Wu D, Chen L, Lee W. Recent Progress in the Development of Organic Dye Based Near-Infrared Fluorescence Probes for Metal Ions[J]. Chem Coord Rev, 2017, : . doi: 10.1016/j.ccr.2017.06.011
-
[19]
Xu Z, Chen J, Hu L L. Recent Advances Formaldehyde-responsive Fluorescent Probes[J]. Chinese Chem Lett, 2017, : . doi: 10.1016/j.cclet.2017.07.018
-
[20]
Zhou X, Lee S, Xu Z. Recent Progress on the Development of Chemosensors for Gases[J]. Chem Rev, 2015, 115(15): 7944-8000. doi: 10.1021/cr500567r
-
[21]
Zhang H, Rudkevich D M. A FRET Approach to Phosgene Detection[J]. Chem Commun, 2007, 12(12): 1238-1239.
-
[22]
Wu X, Wu Z, Yang Y. A highly Sensitive Fluorogenic Chemodosimeter for Rapid Visual Detection of Phosgene[J]. Chem Commun, 2012, 48(13): 1895-1897. doi: 10.1039/c2cc17411a
-
[23]
Zhang Y, Peng A, Jie X. A BODIPY-Based Fluorescent Probe for Detection of Subnanomolar Phosgene with Rapid Response and High Selectivity[J]. ACS Appl Mater Interfaces, 2017, 9(16): 13920-13927. doi: 10.1021/acsami.7b02013
-
[24]
Hu Y, Chen L, Jung H. Effective Strategy for Colorimetric and Fluorescence Sensing of Phosgene Based on Small Organic Dyes and Nanofiber Platforms[J]. ACS Appl Mater Interfaces, 2016, 8(34): 22246-22252. doi: 10.1021/acsami.6b07138
-
[25]
Zhou X, Zeng Y, Chen L. A Fluorescent Sensor for Dual-Channel Discrimination Between Phosgene and a Nerve-Gas Mimic[J]. Angew Chem Int Ed, 2016, 55(15): 4729-4733. doi: 10.1002/anie.201601346
-
[26]
Xia H C, Xu X H, Song Q H. Fluorescent Chemosensor for Selective Detection of Phosgene in Solutions and in Gas Phase[J]. ACS Sens, 2017, 2(1): 178-182. doi: 10.1021/acssensors.6b00723
-
[27]
Wang S L, Zhong L, Song Q H. A Ratiometric Fluorescent Chemosensor for Selective and Visual Detection of Phosgene in Solutions and in Gas Phase[J]. Chem Commun, 2017, 53(9): 1530-1533. doi: 10.1039/C6CC09361B
-
[28]
Xia H C, Xu X H, Song Q H. BODIPY-based Fluorescent Sensor for the Recognization of Phosgene in Solutions and in Gas Phase[J]. Anal Chem, 2017, 89(7): 4192-4197. doi: 10.1021/acs.analchem.7b00203
-
[29]
Kundu P, Hwang K C. Rational Design of Fluorescent Phosgene Sensors[J]. Anal Chem, 2012, 84(10): 4594-4597. doi: 10.1021/ac300737g
-
[30]
Xuan W, Cao Y, Zhou J. A FRET-based Ratiometric Fluorescent and Colorimetric Probe for the Facile Detection of Organophosphonate Nerve Agent Mimic DCP[J]. Chem Commun, 2013, 49(89): 10474-10476. doi: 10.1039/c3cc46095a
-
[31]
Jang Y J, Muralea D P, Churchill D G. Novel Reversible and Selective Nerve Agent Simulant Detection in Conjunction with Superoxide "Turn-On" Probing[J]. Analyst, 2014, 139(7): 1614-1617. doi: 10.1039/c3an02267f
-
[32]
Barba-Bon A, Costero A M, Gil S. Selective Chromo-Fluorogenic Detection of DFP(a Sarin and Soman mimic) and DCNP(a Tabun Mimic) with a Unique Probe Based on a Boron Dipyrromethene(BODIPY) Dye[J]. Org Biomol Chem, 2014, 12(43): 8745-8751. doi: 10.1039/C4OB01299B
-
[33]
Singh V V, Kaufmann K, Orozco J. Micromotor-Based On-Off Fluorescence Detection of Sarin and Soman Simulants[J]. Chem Commun, 2015, 51(56): 11190-11193. doi: 10.1039/C5CC04120A
-
[34]
Wu X, Wu Z, Han S. Chromogenic and Fluorogenic Detection of a Nerve Agent Simulant with a Rhodamine-Deoxylactam Based Sensor[J]. Chem Commun, 2011, 47(41): 11468-11470. doi: 10.1039/c1cc15250e
-
[35]
Wu W, Dong J, Wang X. Fluorogenic and Chromogenic Probe for Rapid Detection of a Nerve Agent Simulant DCP[J]. Analyst, 2012, 137(14): 3224-3226. doi: 10.1039/c2an35428d
-
[36]
Barba-Bon A, Costero A M, Gil S. Highly Selective Detection of Nerve-Agent Simulants with BODIPY Dyes[J]. Chem Eur J, 2014, 20(21): 6339-6347. doi: 10.1002/chem.201304475
-
[37]
Hu X X, Su Y T, Ma Y W. A Near Infrared Colorimetric and Fluorometric Probe for Organophosphorus Nerve Agent Mimics by Intramolecular Amidation[J]. Chem Commun, 2015, 51(82): 15118-15121. doi: 10.1039/C5CC04630K
-
[38]
Jang Y J, Mulay S V, Kim Y. Nerve Agent Simulant Diethyl Chlorophosphate Detection Using a Cyclization Reaction Approach with High Stokes Shift System[J]. New J Chem, 2017, 41(4): 1653-1658. doi: 10.1039/C6NJ03712G
-
[39]
Lee H, Kim H J. Novel Fluorescent Probe for the Selective Detection of Organophosphorous Nerve Agents Through a Cascade Reaction from Oxime to Nitrile via Isoxazole[J]. Tetrahedron, 2014, 70(18): 2966-2970. doi: 10.1016/j.tet.2014.03.026
-
[40]
Jang Y J, Tsay O G, Murale D P. Novel and Selective Detection of Tabun Mimics[J]. Chem Commun, 2014, 50(56): 7531-7534. doi: 10.1039/C4CC02689F
-
[41]
Kim Y, Jang Y J, Mulay S V. Fluorescent Sensing of a Nerve Agent Simulant with Dual Emission over Wide pH Range in Aqueous Solution[J]. Chem Eur J, 2017, 23(32): 7785-7790. doi: 10.1002/chem.v23.32
-
[42]
Kim Y, Jang Y J, Lee D. Real Nerve Agent Study Assessing Pyridyl Reactivity:Selective Fluorogenic and Colorimetric Detection of Soman and Simulant[J]. Sens Actuators B, 2017, 238: 145-149. doi: 10.1016/j.snb.2016.07.056
-
[43]
Huang S, Wu Y, Zeng F. Handy Ratiometric Detection of Gaseous Nerve Agents with AIE-Fluorophore-Based Solid Test Strips[J]. J Mater Chem C, 2016, 4(42): 10105-10110. doi: 10.1039/C6TC03116A
-
[44]
Cai Y C, Li C, Song Q H. Fluorescent Chemosensors with Varying Degrees of Intramolecular Charge Transfer for Detection of a Nerve Agent Mimic in Solutions and in Vapor[J]. ACS Sens, 2017, 2(6): 834-841. doi: 10.1021/acssensors.7b00205
-
[45]
So H S, Angupillai S, Son Y A. Prompt Liquid-Phase Visual Detection and Low-Cost Vapor-Phase Detection of DCP, a Chemical Warfare Agent Mimic[J]. Sens Actuators B, 2016, 235: 447-456. doi: 10.1016/j.snb.2016.05.106
-
[46]
Mahapatra A K, Maiti K, Manna S K. A Cyclization-Induced Emission Enhancement(CIEE)-Based Ratiometric Fluorogenic and Chromogenic Probe for the Facile Detection of a Nerve Agent Simulant DCP[J]. Chem Commun, 2015, 51(47): 9729-9732. doi: 10.1039/C5CC02991K
-
[47]
Goswami S, Dasa S, Aicha K. Fluorescent Chemodosimeter Based on Spirobenzopyran for Organophosphorus Nerve Agent Mimics(DCP)[J]. RSC Adv, 2015, 5(37): 28996-29001. doi: 10.1039/C5RA01216C
-
[48]
Ali S S, Gangopadhyay A, Maiti K. A Chromogenic and Ratiometric Fluorogenic Probe for Rapid Detection of a Nerve Agent Simulant DCP Based on a Hybrid Hydroxynaphthalene-Hemicyanine Dye[J]. Org Biomol Chem, 2017, 15(28): 5959-5967. doi: 10.1039/C7OB01252G
-
[49]
Kumar V, Rana H. Chromogenic and Fluorogenic Detection and Discrimination of Nerve Agents Tabun and Vx[J]. Chem Commun, 2015, 51(92): 16490-16493. doi: 10.1039/C5CC06580A
-
[50]
Sun X, Reuther J F, Phillips S T. Coupling Activity-Based Detection, Target Amplification, Colorimetric and Fluorometric Signal Amplification, for Quantitative Chemosensing of Fluoride Generated from Nerve Agents[J]. Chem Eur J, 2017, 23(16): 3903-3909. doi: 10.1002/chem.201604474
-
[51]
Sun X, Dahlhauser S D, Anslyn E V. New Autoinductive Cascade for the Optical Sensing of Fluoride:Application in the Detection of Phosphoryl Fluoride Nerve Agents[J]. J Am Chem Soc, 2017, 139(13): 4635-4638. doi: 10.1021/jacs.7b01008
-
[52]
Sun X, Anslyn E V. An Auto-Inductive Cascade for the Optical Sensing of Thiols in Aqueous Media:Application in the Detection of a VX Nerve Agent Mimic[J]. Angew Chem Int Ed, 2017, 56(32): 9522-9526. doi: 10.1002/anie.v56.32
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 42
- 文章访问数: 7757
- HTML全文浏览量: 670


































 下载:
下载:
































 下载:
下载:

