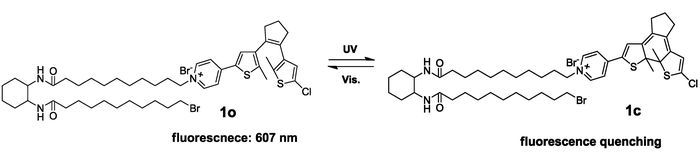
 图1
含有双酰胺基环己烷基团与吡啶鎓盐结构的二芳基乙烯荧光分子开关的结构与光开关过程[20]
Figure1.
The structure and photoswitching process of the photoswitchable fluorescent diaryethene based on a bis-amido cyclohexane unit and pyridinium moiety[20]
图1
含有双酰胺基环己烷基团与吡啶鎓盐结构的二芳基乙烯荧光分子开关的结构与光开关过程[20]
Figure1.
The structure and photoswitching process of the photoswitchable fluorescent diaryethene based on a bis-amido cyclohexane unit and pyridinium moiety[20]

Citation: LI Chong, CHEN Ying, XIE Nuohua, LIU Junxia, FAN Cheng, ZHOU Qiyuan, ZHU Mingqiang. Research Progress on Hydrophilic Photoswitchable Fluorescent Diarylethenes[J]. Chinese Journal of Applied Chemistry, 2017, 34(12): 1379-1402. doi: 10.11944/j.issn.1000-0518.2017.12.170304

亲水性二芳基乙烯荧光分子开关的研究进展
English
Research Progress on Hydrophilic Photoswitchable Fluorescent Diarylethenes
-
二芳基乙烯凭借其优异的热稳定性和耐疲劳性以及光异构化反应不易受环境介质影响等优点,而成为最有应用前景的光致变色材料之一[1-2]。光致变色行为是吸收光谱变化的体现,而对吸收信号的检测存在着灵敏度不够高、检出限不够低的限制,难以满足实际的应用需求。而在光致变色过程中,往往会伴随着其他物理性质的变化,如空间构型[3-4]、折射率[5]、红外光谱[6-7]、半导体性质[8-9]、介电常数[10]和荧光等。其中,荧光信号检测是一种高灵敏度、低检测限、且能够实现无损读出的方法[11],被更为广泛地研究与应用。荧光作为信息的载体,能够实现高精度高密度高速度的信号处理、传输和利用等过程。荧光开关的两个或多个荧光信号状态可以进行数字化操作,实现信号或功能的精准调控,使得其在光存储、光开关、全光晶体管等光电子器件等领域广泛地研究与应用;同时,荧光开关多状态的信号,能够帮助高分辨率地标识成像目标分子或结构,其在荧光传感、生物示踪、生物成像、超分辨成像等领域表现出极大的潜在应用价值[12-15]。对于前者光电子器件领域的一些应用,关于二芳基乙烯荧光分子开关性能的研究已经得到了快速的发展;然而对于后者生物或者荧光传感方面的应用,二芳基乙烯除了需保持良好的荧光开关性能外,一般还需要获得足够的亲水性。由于二芳基乙烯的母核结构具有较强的疏水性,在增加其它的功能性设计的基础上还需要克服疏水性,这给二芳基乙烯荧光分子开关的分子结构设计带来了复杂性和挑战,该方面的发展相对滞缓。另外,像其它有机荧光染料一样,二芳基乙烯荧光分子开关同样面临着在水溶液中荧光猝灭或大幅度降低的风险,如何保持在水溶液中的荧光发射和荧光开关能力,是不可避免需要攻克的一大难点。科学家们正力图发展解决二芳基乙烯荧光分子开关水溶性问题的有效方法,并取得了一系列的研究成果。但据我们所知,目前尚无关于亲水性的二芳基乙烯荧光分子开关的综述报道。本文试图通过综述当前的研究进展,对亲水性的二芳基乙烯荧光分子开关的分子结构种类、性质及应用进行归纳总结和展望,以促进该领域后续长足、快速地发展。
1 亲水性二芳基乙烯荧光分子开关的结构种类
1.1 小分子型
二芳基乙烯母核是一种强疏水性的有机分子结构,为了直接获得一定的亲水性或水溶性,通常需要在二芳基乙烯结构上引入亲水性的基团,如有机离子[16-17]、多甘醇链[18]、水溶性环腔[19]和生物分子[12]等结构。
考虑到二芳基乙烯基础结构通常只具有光致变色性能,而无荧光发射性质,若要实现荧光开关功能,一般需要引入荧光基团,若该荧光基团具有良好的水溶性,便可以同时赋予二芳基乙烯荧光发射能力和一定的亲水性。吡啶鎓盐基团经常被用到构造亲水性小分子型荧光分子开关。易涛课题组[16]在2007年报道了将二酰胺基环己烷(能形成较强的分子间氢键)与二芳基乙烯吡啶鎓盐通过长烷基链连接,获得了具有较强凝胶能力的荧光分子开关化合物1o(图 1),其在乙腈溶剂中荧光发射波长607 nm,荧光量子产率为2.3%,紫外光照后,荧光猝灭90%以上。该化合物的荧光激发波长与关环波长位移差较大,适合荧光的非破坏性读出,经过抗疲劳性测试,该化合物被认为可以应用于一个可写-读-擦多次循环的信息存储体系。为进一步增加荧光分子开关的水溶性,易涛等[16]通过引入季胺盐和乙二醇链合成了两亲性的二噻吩基乙烯荧光分子开关2o(图 2)。该分子在有机溶剂中无荧光,而在水溶液中自组装成尺寸均一的水溶性囊泡并具有绿色荧光,发射波长在510 nm,荧光量子产率为0.44%(0.1 μmol/L),随着水溶液中浓度提高至0.5 μmol/L,其荧光量子产率进一步增加至0.73%,波长蓝移40 nm,经365 nm紫外光照射后,开环态转变成闭环态,荧光猝灭,猝灭效率可达98%;在可见光的照射下,闭环态又能完全恢复到起始的开环态,表现出良好的可逆开关性能。
 图1
含有双酰胺基环己烷基团与吡啶鎓盐结构的二芳基乙烯荧光分子开关的结构与光开关过程[20]
Figure1.
The structure and photoswitching process of the photoswitchable fluorescent diaryethene based on a bis-amido cyclohexane unit and pyridinium moiety[20]
图1
含有双酰胺基环己烷基团与吡啶鎓盐结构的二芳基乙烯荧光分子开关的结构与光开关过程[20]
Figure1.
The structure and photoswitching process of the photoswitchable fluorescent diaryethene based on a bis-amido cyclohexane unit and pyridinium moiety[20]
朱明强课题组[21]模仿磷脂的两亲性结构设计并合成了高相对分子质量两亲性的荧光分子开关3o(图 3), 其中PMI为苝酰亚胺,peri-位通过高效的点击反应连接着一条PEG链(相对分子质量5000)提供整个分子的水溶性,同时PMI的两侧bay-位连接着两个带有C16链的二芳基乙烯基团,提供和磷脂相似的疏水链结构。3o在含有90%水的四氢呋喃混合溶液中最大发射峰位于627 nm,荧光量子产率高达27%,在302 nm光照下,30 s即可达到光饱和状态,闭环反应转化率可达98%;得益于这种多个二芳基乙烯取代单个荧光基团的特殊构造[22],苝的荧光的被加强调控,在有机溶剂中最高荧光开关比高达1400:1以上,而在水溶液中最大荧光开关比也可达357:1。在302 nm的紫外光和大于490 nm的可见光交替照射下,荧光开关循环10次以上,并未发现荧光信号衰减现象,展现出了良好的抗疲劳性。这种将二芳基乙烯荧光分子开关与水溶性低聚物直接共价连接的方式是一种构造亲水性二芳基乙烯荧光分子开关十分有效的策略。
当前,尽管有些方法已经实现了水溶化二芳基乙烯光致变色体系,但有关水溶性良好的小分子二芳基乙烯荧光分子开关体系的报道比较少。在一个有限的小分子空间里,既要实现水溶性,同时又要兼顾荧光性能、开关性能以及其它功能,对分子的化学设计提出了挑战。另外,由于二芳基乙烯母核结构的疏水性较强,即使引入水溶性基团或离子,也很难保证二芳基乙烯分子在水中不发生聚集,对一些不希望荧光探针分子发生聚集的应用带来不利影响。因此,开发新的化学修饰方法来获得良好的水溶性小分子二芳基乙烯荧光分子开关对于实现其生物成像、化学传感等应用具有重要的意义。
1.2 两亲性载体
近年来,发展了一种使二芳基乙烯荧光分子开关水溶化的普适方法,即采用两亲性小分子或高分子自组装体作为载体,可以将疏水性的探针物理包封于其微疏水环境中。Cheng等[23]将两个丹磺酰荧光基团对称引入到DTE骨架上,合成了一种疏水性的荧光分子开关4o(图 4),为了克服其疏水性,他们将它引入到脂质体的磷脂(二棕榈酰磷脂酰胆碱)双分子层,成功实现了水溶化。利用这种策略能够制备粒径约为25 nm的荧光分子开关-脂质体的水溶性纳米组装体,荧光开关性能甚至在脂质体中得到明显提升,并表现出较好的抗疲劳性。但是该工作并未报道使用该探针对脂质体进行荧光成像,脂质体的形貌仅由透射电镜表征获得。
朱明强课题组[21]将具有类似磷脂结构的两亲性荧光分子开关与蛋黄卵磷脂、胆固醇、十八胺一起通过薄膜分散法制备出脂质体,如图 5所示。PEG-PMI-2DTE(3o)均匀的分布在脂质体双磷脂层中,并保持着良好的光致变色性能和荧光开关性能。经302 nm紫外光照射30 s,脂质体悬浮液达到光稳态,荧光开关比达到97:1以上。利用302 nm紫外光源和473 nm激光交替照射能够实现几乎完全可逆的高对比度荧光开关,并被利用于脂质体的超分辨荧光成像(见后文),观察到了数十纳米的胶束、数百纳米的单层膜结构以及更大的多层膜结构脂质体,分辨率约为30 nm,而这些精细的结构无法利用常规荧光显微镜观测。该工作将二噻吩基乙烯荧光分子开关首次应用于脂质体的超分辨成像。
最近,以二芳基乙烯分子为基础的自组装体系因具有特殊的功能和应用引起了广泛的关注。Liu等[24]将二芳基乙烯5o与共轭聚合物PFBD、PEG化的磷脂DSPE-PEG-NH2共同自组装,获得了平均粒径为34 nm、可荧光开关的共轭聚合物纳米粒子(图 6)。其荧光发射峰在560 nm,荧光量子产率高达30%,使用紫外光照射,荧光猝灭高达95%以上,荧光开关比可达90:1。他们用此纳米粒子成功实现了细胞成像和肿瘤显像,并获得了10倍以上的荧光开关对比度。由于二噻吩基乙烯本身是疏水性的,不利于生物成像,将其掺杂到疏水的共轭聚合物,再与生物相容性的阳离子型PEG化的磷脂自组装成纳米粒子,即可进入细胞或实现活体的荧光成像。
在实际应用中,为了研究细胞的状态和生理活动,往往需要更清晰地呈现细胞器的结构,这就需要设计一些具有特异靶向性、亲水性和生物相容性的二噻吩基乙烯聚合物荧光开关。
1.3 聚合物型
二芳基乙烯与两亲性聚合物或具有疏水微环境的亲水性大分子(如蛋白质)复合,为探索其在水溶液中的性质与功能提供了一种有效的方法。例如,光致变色所依赖的疏水微环境可以通过高分子[25]或小分子胶束[26]来提供,但这种方式缺少共价键的结合使得其应用受限。直接共价键连接的方式是一种未来发展更具前景的可光控能量转移荧光探针的重要途径。
相对有机小分子而言,聚合物能够更方便且更丰富地构造出多功能性的荧光开关材料。将二芳基乙烯引入到水溶性或者亲水性聚合物主链或侧链上,是一种构造水溶性二芳基乙烯荧光分子开关的重要策略。Branda等[27-28]将小分子二噻吩基乙烯通过酰胺键直接引入到两亲性聚合物的侧链(图 7)。这种将二噻吩基乙烯荧光分子开关枝接到聚合物侧链的方法简单有效,在实际应用中具有很高的可行性,得到的二噻吩基乙烯聚合物荧光开关的结构也较为明确。通常,具有高活性的聚合物端基可以通过化学反应很容易地与其它功能基团相连接。由此得到启发,将二噻吩基乙烯光致变色单元与聚合物链的末端官能团直接进行偶联反应,即可得到末端基型二噻吩基乙烯聚合物荧光开关。一般地,为了得到均一的聚合物体系,要求聚合物端基的反应条件温和,转化率应尽可能地高,而且反应产物易于分离提纯。目前,常用的聚合物端基反应有催化加氢反应、环氧化反应、点击化学(click chemistry)。为了提高小分子二噻吩基乙烯荧光开关或其聚合物的反应产率,需要寻求更为高效的反应方法或分子构造途径。
朱明强课题组[29]在水溶性二芳基乙烯聚合物探针方面取得了一系列重要进展。他们在二噻吩基乙烯光致变色单元(DTE)结构上引入pH敏感的萘酰亚胺荧光基团(NI,具有一定的亲水性)和苯乙烯基,构造出可聚合的荧光pH敏感的二噻吩基乙烯荧光开关单体(DTE-NI)(如图 8)。DTE-NI单体与N-异丙基丙烯酰胺(NIPAM)共聚后获得了水溶性的聚合物PNIPAM-DTE,它继承了DTE-NI单体的全部功能和PNIPAM的温敏性,同时实现了良好的水溶性和生物相容性。PNIPAM-DTE在水溶液中光学性质受pH值影响。随着pH值的降低,吸收光谱蓝移,荧光光谱也蓝移,荧光量子产率增加。在pH=6.61附近,吸收和荧光光谱开始明显变化,pH=5.57时,吸收和荧光发生突变;pH值从7变成2.7,荧光量子产率由3.3%增加到14.5%。PNIPAM-DTE因为继承了PNIPAM的温敏性,使得其40 ℃时的荧光强度约为20 ℃时的两倍。DTE-NI单体在中性四氢呋喃溶液中,经302 nm紫外光照射20 s即可达到其光稳定态,这时光异构化转化率高达98%,开/闭环量子产率分别为0.007和0.46,荧光猝灭94%,荧光开关对比度为19:1;在酸性四氢呋喃中,光致变色速率不变,荧光猝灭效率增至97%,荧光开关对比度为27:1。实验结果表明,DTE-NI具有优异的光致变色性能,酸性环境不影响光致变色过程,但有利于提高荧光开关的对比度。PNIPAM-DTE在中性水溶液中的光致变色速率比DTE-NI单体在四氢呋喃溶剂中稍慢,40 s的302 nm紫外光照射可以达到光稳定态,但荧光的猝灭速率明显快于光致变色,这是由于DTE-NI结构单元的疏水性,它们在水溶液中容易发生一定程度的聚集,导致分子间能量转移的发生;在酸性水溶液中,质子化的哌嗪基使得PNIPAM-DTE的荧光增加,光致变色速度不受影响,但荧光猝灭效率高达99%,荧光开关比为110:1,使得PNIPAM-DTE非常适合酸性环境中的应用。基于酸性增强荧光和荧光开关对比度增强的事实,PNIPAM-DTE能够用于活细胞溶酶体的选择性标记。实验结果也表明,将二噻吩基乙烯引入聚合物侧链是一种构造功能性水溶性聚合物荧光开关的有效方法。
由于常规荧光分子开关不能提供高荧光开关对比度,难以满足实际应用的要求,基于李冲和朱明强等发展的多个二芳基乙烯取代单个荧光基团能够实现高荧光开关比的策略[[21-22],可以设计出各种功能性的水溶性高荧光开关比探针。同时,用作生物超分辨成像探针需具有水溶性与靶向性,二芳基乙烯荧光开关由于本身的疏水性而使其生物成像应用受限。线粒体是广泛存在于真核细胞中的重要细胞器,传统的光学显微镜因为衍射极限的限制满足不了观察线粒体生命活动的成像要求。为了实现活细胞线粒体的超分辨成像,朱明强等[30]设计并合成了一种新型的具有生物相容性和靶向线粒体功能的二噻吩基乙烯聚合物荧光开关(图 9)。他们以双二噻吩基乙烯取代的苝单酰亚胺荧光分子开关(peri-位有可聚合的苯乙烯基团)、亲水和生物相容性的异丙基丙烯酰胺、含线粒体靶向的三苯基膦盐的丙烯酸酯和具有线粒体固载功能的氯甲基苯乙烯为4种共聚单体,利用自由基聚合,制备出了一种新型的活细胞线粒体超分辨成像荧光开关探针聚合物10o,在四氢呋喃中具有较快的光响应速度,20 s即可达到光饱和状态,荧光开关比为22:1,最大荧光发射峰在573 nm;聚合物10o在室温时能溶于水,在水中二噻吩基乙烯聚合物荧光开关的响应速度降低,60 s可达到饱和态,仍具有较快的响应速度,开关比达到30:1,最大荧光发射峰在596 nm;开环态的相对荧光量子产率为0.31,光稳定态为0.0083。经过紫外光和可见光多次交替照射,产生可逆的光致变色和荧光开关行为,展示出优异的稳定性和抗疲劳性。聚合物10o能够靶向活细胞线粒体,表现出较好的生物相容性。利用聚合物10o的荧光开关性质,成功地实现了线粒体的超分辨荧光成像,获得分辨率为30 nm的图像,突破了光学衍射极限。这是二噻吩基乙烯通过聚合物实现复杂功能性的经典案例。
总的来说,聚合物能够更方便地构造功能性荧光分子开关,而且聚合物的相对分子质量、相对分子质量分布、分子构造、单体种类和单体比例等参数均可以用来调节荧光分子开关的性能,但目前二噻吩基乙烯聚合物的研究尚不完善,特别是水溶性荧光开关聚合物的研究相对匮乏,聚合物型水溶性荧光分子开关是未来发展的一个重要方向。
1.4 有机无机复合纳米粒子
半导体纳米晶(或量子点)拥有独特的荧光性质,在传感和探针的结构设计中被广泛使用。量子点通常在尺寸5~50 nm左右表现出高光稳定性,宽激发响应范围,窄发射光谱以及高荧光量子产率。同时,一些稀土成分的纳米粒子具有一些特殊的功能如上转换效应,使用近红外光即可激发上转换粒子的荧光,能够增加激发光源的渗透深度并避免紫外光源的使用。单个的量子点或纳米粒子可以在荧光显微镜中被观察到,光开关-无机纳米粒子复合后,能够通过特定光子能量的光照实现可逆地定量的光谱性质变化,获得精确的光学性质调控,并有望应用于单粒子的实验、长程的示踪以及设计强大的超分辨探针。无机纳米颗粒与分子开关的混合系统在生物催化、生物医学、细胞生物学等领域具有广泛的应用前景。
早期,二芳基乙烯通过光控荧光共振能量转移(FRET)来调制量子点的荧光发射[32]。最普遍的光控FRET策略是利用特定波长的光来改变有机染料的吸收光谱,从而改变FRET光谱重叠积分面积。但是对于生物体系的应用,纳米颗粒需要实现水溶性,可行的策略较多。通常使用两亲性聚合物通过疏水相互作用紧紧地粘附在纳米颗粒表面[33-34];聚合物亲水性基团或离子则提供纳米颗粒胶体在水溶液中的稳定性。光致变色结构可以用物理掺杂的方式“即插即用”地引入到聚合物包裹层[31](图 10),通过光照刺激调控量子点的荧光发射与否。同时也可以使用化学修饰直接通过共价键的方式结合到聚合物中,再通过“即插即用”的纳米自组装技术来制备荧光开关复合纳米颗粒[27],从而避免依赖配体交换的复杂工序。
上述策略也被用于向包裹层聚合物中引入另一种的荧光给体[33]或内标物[35],制备出双色光开关量子点。光致变色受体在这些应用中充当不发光的猝灭剂,本身无荧光。得益于Irie课题组[36-37]对于turn on模式荧光开关的开发,能够单独使用二芳基乙烯即可实现双光色荧光开关。Medintz和Jovin课题组[28]用枝接二杂芳环乙烯分子(11o)的聚(异丁烯马来酸酐)(PMA)包覆荧光量子点(蓝色荧光,发射峰425 nm)。如图 11所示。二芳基乙烯闭环态在440 nm具有吸收并在520~530 nm有最大荧光发射峰,因而能够作为荧光受体接收量子点的激发态的能量转移。通过340 nm紫外光和450 nm可见光的交替照射,二芳基乙烯在无吸收/无荧光的开环态和有颜色有荧光的闭环态之间可逆地转变。二芳基乙烯枝接在亲水性聚合物上并稳定地包裹在量子点表面,形成水溶性的光致变色量子点,该量子点经可见光照射后发射蓝色荧光,而经紫外光照射时产生绿色荧光,11c的荧光(530 nm)与量子点的荧光强度(425 nm)比率值上升至180%,但经过11次开关循环后降低一半,该分子体系的抗疲劳性有待进一步提高。
通过纳米结构的设计,能够有效地克服每一个单一组分的固有限制。二芳基乙烯被放置在聚合物的疏水环境中,保持了光异构化的能力;同时,二芳基乙烯与量子点表面保持足够近距离,保证产生有效的光控能量转移。最终获得的同时兼具水溶性、光致变色、荧光开关性能的复合纳米粒子荧光探针具有较小的尺寸、高亮的荧光以及良好的光稳定性。这种构造水溶性纳米粒子的方法也可以借鉴到其它有机、无机体系中,如文献报道的其它量子点体系、生物靶向分子、聚合物等,制备复杂功能的水溶性荧光开关复合粒子。然而,这种基于无机纳米粒子的光开关系统,除了荧光开关性能的问题外,还和其它量子点或无机离子一样,同样面临着其自身尺寸与生物毒性的限制,这也是未来该体系需要解决的一个大问题。
2 亲水性二芳基乙烯荧光分子开关的应用
2.1 生物传感
利用荧光分子开关的两种异构体的状态能够实现生物分子的传感与检测[38],大致有两种途径:1)生物分子作为客体,与相应的主体二芳基乙烯分子结合后,会显著地产生荧光变化,且该荧光能够在紫外光照和可见光的交替照射下实现可控开关,荧光开关能够赋予探针更高的识别性。2)另外,生物分子作为客体,选择性地稳定或者“锁住”二芳基乙烯的某一个异构体,使其丧失某一个方向的光异构化反应,这种与荧光开关行为产生的逻辑调控关系,能够有效提高对生物大分子传感的选择性与灵敏度。
易涛课题组[39]针对β-淀粉样蛋白(Amyloid-β)的病理检测,设计了一种新型的二芳基乙烯荧光分子开关。他们将四氢吡咯基萘基-2-氰基丙烯酸(ANCA)这种淀粉样蛋白靶向基团[40]通过亲水性四甘醇链连接到双吡啶基取代的环戊烯型二噻吩基乙烯结构两侧上,形成具有一定亲水性的吡啶鎓盐(如图 12)。它能够溶解在含5%的DMSO溶液中,向其中加入β-淀粉样蛋白聚集体时,荧光急剧增强并略微蓝移,而对于β-淀粉样蛋白单体或其它蛋白的聚集体则无明显的荧光响应。实验结果表明,这种荧光分子开关对β-淀粉样蛋白聚集体具有高度的亲和性。进一步的脑组织切片染色实验表明,它能够专一性地标记大脑中β-淀粉样蛋白聚集体,实验结果与细胞免疫法获得的结果相吻合,重要的是它的荧光能够在紫外光和可见光的调节下进行光开关控制,表现出良好的抗疲劳性。这种对脑组织切片中β-淀粉样蛋白聚集体的荧光开关的成像为未来活体的高分辨成像打开了一扇窗户。
最近易涛课题组[41]还设计了一种水溶性DNA-逻辑控制的光致变色体系。该分子由近红外发射的噻唑橙基团与二噻吩基乙烯共价键连接而成,分子内含有多个正电荷基团结构,具有一定水溶性。在有机溶剂中它能够顺利的发生可逆的光致变色反应,而在水溶液中,噻唑橙基团因强烈的疏水相互作用和平面结构的π-π堆积作用而容易聚集成分子内二聚体[42],从而使得二芳基乙烯处于折叠的平行结构状态(如图 13),锁住了水溶液中闭环反应的途径[41, 43]。该分子在水溶液中因为存在强烈的分子内扭转电荷转移而相对于有机溶剂具有增强并且红移至620 nm的荧光发射(荧光量子产率为0.25%)。噻唑橙作为一种常用的高特异性核酸染色剂,能够与DNA进行结合。当加入10个AT碱基对的寡聚DNA(AT10)时(每个分子光开关的平均碱基对个数<1.6),分子的荧光从620 nm蓝移至590 nm,荧光量子产率提高至2.5%,这时噻唑橙基团绑定于DNA分子AT碱基对的小沟区域。进一步增加DNA浓度(10>每个分子光开关的平均碱基对个数>1.6),荧光发射继续蓝移至550 nm,荧光量子产率提高到3.4%,这时噻唑橙基团插入到DNA分子碱基对之间。而当与10个CG碱基对的寡聚DNA(CG10)作用时,荧光蓝移至540 nm,荧光强度提高100倍以上,这时噻唑橙基团仅采用插入的模式绑定到CG碱基对中。然而,无论与哪种碱基对类型的DNA绑定,均能够使得原本在水溶液中失效的光致变色行为“解锁”。此二芳基乙烯荧光分子开关-DNA复合物在紫外光照射下,670 nm处出现新的属于闭环态的吸收峰,同时荧光显著降低;该过程也能够在可见光照射下完全可逆地进行。同时还发现,在碱基对浓度较低时,随着闭环态的增多,噻唑橙基团与DNA的绑定由小沟区域转向插入模式。实验结果表明,DNA充当一个触发器的角色来控制荧光分子开关的光致变色行为,同时光致变色的过程也能够反映出其与DNA碱基对的绑定方式。通过与商业细胞核染料共定位成像,发现该荧光分子开关探针能够高度选择性地染色固定的Hela细胞中核仁区域,并且其荧光能够在405 nm紫光和633 nm可见光的交替照射下,调控细胞的荧光开关成像。
噻唑橙基团还被发现能够与葫芦[7/8]脲形成主客体包含物[44-45],并且噻唑橙基团在主体疏水环腔中具有急剧增强的荧光发射性质,鉴于此,易涛课题组[46]同样发现该二芳基乙烯荧光分子开关13o同样能够与葫芦[8]脲发生主客体相互作用。在紫外光照射下,13o在水溶液中因为处于平行折叠状态而不能发生光致变色现象,即游离的二芳基乙烯分子丧失了发生光异构化闭环反应的能力(图 14)。当游离状态的13o分子中的噻唑橙基团与葫芦[8]脲形成主客体复合物后,噻唑橙基团处于葫芦[8]脲疏水微腔中,分子内扭转电荷转移被抑制,荧光发射从616 nm蓝移至546 nm。同时,分子平行折叠状态“解锁”,平行结构和反平行结构能够相互转化,使用紫外光照,开环态的二芳基乙烯分子能够顺利地转变成闭环态。葫芦[8]脲的加入使得原本被“封锁”的光致变色能力“解锁”。若再使用另一种客体(金刚烷胺盐酸盐)置换出13o的噻唑橙基团后,便重新产生无闭环反应能力的游离开环态二芳基乙烯分子13o,荧光发射峰又从552 nm还原至606 nm,并减弱。另外,只有使用金刚烷胺盐酸盐将闭环态的二芳基乙烯分子13c从葫芦[8]脲环腔中置换出来,才能够得到含有游离的闭环态13c的水溶液,因为闭环态的13c并不能直接从游离的13o水溶液中经紫外光照转化得到。闭环态的13c无论是处于游离状态还是主体的疏水腔中,均能够在可见光的照射下,回复至起始开环态13o。实验结果表明,通过葫芦[7/8]脲的加入与否,可以逻辑地“开”或“关”控制光异构化闭环反应的活性。
以上是一些生物或合成大分子逻辑控制光反应的典型例子。生物或合成大分子与对其响应识别的荧光分子开关的结合构造出了一种新型的分子功能器件,对未来的生物应用提供了新思维。二芳基乙烯具有特殊热稳定性和优良抗疲劳性,必将在生物传感、生物荧光开关、生物存储、生理活动示踪等领域具有广阔的应用前景。因此,亟待进一步研究更合理的分子设计与化学修饰,制备出满足实际生物应用性能要求的荧光分子开关。
2.2 化学传感
常规的化学传感器,只对某一化学刺激产生单一的响应,而引入分子开关后,在化学传感的层次上还会引入光开关的可逆调控。实现荧光开关的传感主要有两种方式:第一种是传感基团遇到化学刺激后荧光会发生变化,该荧光能够被二芳基乙烯可逆地开关调控;另一种是传感基团与二芳基乙烯结合后,除了产生荧光变化外,还会影响到光致变色反应的可逆性,这是又一层次的逻辑控制传感模式。光开关与化学传感的结合,能够提高传感的选择性,并有助于发展新的检测方法和传感应用。
将二芳基乙烯结构中引入能够与金属离子配位的荧光基团,有望实现二芳基乙烯的吸收和荧光光谱对金属离子的响应。例如,三联吡啶基团通过苯乙烯结构共轭连接到二芳基乙烯具有金属离子的选择性识别作用[47],向其溶液中加入Zn2+后,荧光发射从465 nm红移到570 nm,并且能够在紫外光和可见光的照射下实现可逆的开关循环,是一种潜在的Zn2+荧光开关探针。与之不同,若将三联吡啶通过二苯乙烯结构共轭连接到二芳基乙烯[48],则能够实现Hg2+的选择性荧光开关传感。
铝离子因为与钙、镁、铁离子的离子半径和价态相差不大,经常成为许多生物过程中所需金属离子的竞争抑制剂,它也因此与许多疾病,例如阿尔茨海默氏病和帕金森氏病[49-50]等有关,因此对铝离子的检测显得极其重要。常规的铝离子检测方法强烈依赖于昂贵的仪器并难以实时检测,相对而言,荧光分析法在经济性和简便性以及灵敏度上具有明显的优势。蒲守智等[51]将苯酚通过席夫碱连接到肼基吡啶结构上,并将其引入二芳基乙烯结构中(图 15),实验结果表明,14o中这样的一种含有酚羟基的肼基吡啶的多齿配位体[52],能够选择性地对Al3+响应。当向其乙腈溶液中加入硝酸铝水溶液,14o与Al3+配位成螯合物,并产生增强的、发射峰位于534 nm的绿色荧光,荧光量子产率为1.3%,而14o对其它离子如Cu2+、Zn2+、Cr3+、Co2+、Mn2+、Hg2+、Pb2+、Cd2+、K+、Ca2+、Fe3+、Mg2+、Ba2+、Sr2+、Sn2+和Ni2+等并无明显响应。使用297 nm的紫外光照射,随着开环态14o逐渐转变至闭环态,Al3+螯合物的绿色荧光变弱,荧光强度降低至起始值的14%;接着使用可见光照射,其荧光又能回复至开环态水平,在紫外光和可见光的交替照射下实现了荧光的可逆开关调控。同时,若使用EDTA从螯合物14o+ Al3+中夺取Al3+,暴露出游离的荧光分子开关14o,其荧光会明显减弱,待重新加入Al3+后能够再次形成螯合物而出现增强荧光,能够如此反复循环5次以上,表明Al3+的加入与否能够可逆调控14o的荧光发射行为。另外,14o分子结构中因含有活泼氢的羟基和胺,质子化后开环态颜色从无色变成淡黄色,而闭环态的颜色会从紫色变成蓝色,与其它文献报道的结果相似[53-54]。同时,去质子化后,14o的光致变色反应的可逆性也会受到控制,14c的开环反应过程被阻断,仅能发生14o的闭环反应;重新质子化后,又恢复至原来的颜色和可逆的光致变色性能。利用此荧光分子开关,以荧光和颜色作为输出信号,能够被Al3+、OH-、光等化学和物理刺激逻辑调控,形成复杂的多刺激响应逻辑元器件。
利用类似的策略,最近大量基于萘啶基团[55]对于Cd2+、基于2-(2′-羟基苯基)苯并噻唑基团[56]对Cu2+、基于罗丹明6G基团[57]对于Fe3+、基于咔唑基席夫碱基团[58]对于Sn2+和Cu2+、基于罗丹明B共价连接萘酰亚胺基团[59]对于Cr3+离子等众多离子检测的二芳基乙烯结构被相继报道。但这些化合物的亲水性都不够,需要溶解在甲醇、二氯甲烷、乙腈等有机溶剂或者部分水溶液的混合溶剂中才能实现金属离子的传感与检测。然而大多数离子的检测是在水溶液中或者生命体系中进行,当前的二芳基乙烯离子传感探针难以满足实际的应用需求。因此,设计亲水性的荧光分子开关,对水溶液中金属离子检测和其它化合物的传感具有十分重大的意义。
2.3 生物成像
当今,凭借着荧光检测的高灵敏度和可被生物化学和生物学家广泛设计的荧光探针,荧光显微几乎成为生物成像的同名词。虽然被广泛使用,但荧光成像仍然面临着一些限制。荧光成像的分辨率不仅受到可见光的衍射极限限制,还通常受到样品自发荧光的背景干扰。而且当同时使用多种荧光探针时,会发生输出或输入信号的串扰。这些问题驱使人们发展新的能够增加成像分辨率的方法。一种可行的方法是开发一个具有多于一个光学状态的荧光分子系统。通过提供外部刺激触发荧光探针在亮态和暗态之间相互转换,能够有效提升图像的对比度和分辨率[31]。
得益于成像技术的快速发展,基于荧光技术的细胞检测被广泛应用于细胞生命活动的研究[60]。传统的荧光成像探针,例如罗丹明和花菁类染料[61]在细胞学研究中非常实用,但它们仅仅能够对一个事件或刺激产生不可逆的响应[62]。与之相反,能够可逆响应的染料提供了一种简单而强大的区域功能标记技术,对细胞荧光标记具有更重要使用价值[63]。虽然许多光活化荧光蛋白已经发展到能够提供对目标蛋白精确地光学标记和示踪[64],但是由于荧光蛋白的尺寸较大,容易扰乱目标蛋白质的分布和功能[65]。因此,发展一种新型的低相对分子质量的荧光分子开关探针将会为研究细胞中的蛋白质动力学提供一种强大的工具。朱明强等[66]曾使用一种含有螺吡喃荧光分子开关的聚合物纳米粒子作为荧光探针,实现了HeLa细胞的开关成像,并首次使用双光子吸收替代紫外光作为辐射光源。但因为螺吡喃的有色态(荧光态)缺乏热稳定性,限制了其在生物成像中的应用。二芳基乙烯是一种以优异的抗疲劳性和良好的热稳定性著称的荧光分子开关体系,同时对生物具有良好的相容性,被认为在生物应用领域具有潜在的应用价值。
早期的相关研究大都集中在油溶性体系,例如Irie等[67]将荧光素与二芳基乙烯通过酰胺键连接在一起构建成荧光分子开关15o(图 16),同时二芳基乙烯的另一端连接有能够与氨基反应的琥珀酰胺酯基团,该基团能够与蛋白质的氨基反应成键,从而将二芳基乙烯荧光分子开关与目标蛋白质绑定在一起,构建了一种能够荧光开关的蛋白质分子16c。该工作为标记生物大分子提供了一种重要的途径,但是油溶性反应体系并不适合生物应用。
易涛课题组[16]利用两亲性的二芳基乙烯荧光分子开关2o(图 2)在水溶液中自组装形成稳定的囊泡。由于2o在单分子分散的极性溶剂中并无荧光,仅在聚集态时获得荧光发射能力,因此2o的自组装囊泡具有荧光发射性质,并在可见光和紫外光的交替照射下实现可逆的开关调控。作为一种荧光开关探针,2o能够染色KB细胞并进行可逆光开关的细胞成像(图 17)。二芳基乙荧光分子开关拥有双稳态特征和优良的抗疲劳性,在生物成像领域具有潜在的应用价值[68-69],其可开关的荧光有助于细胞的定位与示踪,并有效降低背景的干扰。近年来,荧光开关生物成像逐渐朝着传感和细胞器靶向方向发展,王胜课题组[70]报道了一种二芳基乙烯型Hg2+荧光探针,尽管其亲水性有限,但它能够进入活细胞,并对Hg2+发生荧光响应,且荧光能够被光控开关。
Branda[71]等使用含有双吡啶鎓盐取代的二芳基乙烯17o的缓冲溶液(含体积比10%DMSO)培育线虫活体,该染料被线虫摄取后,在体内仍然保持着良好的光致变色性能,同时还随之产生了光控的“麻痹”生理作用,如图 18所示。由于闭环态二芳基乙烯17c结构中的吡啶鎓盐基团的还原电位较低,能够干扰线虫新陈代谢所需要的能量产生过程,进而使得线虫发生麻痹作用;而开环态二芳基乙烯17o的吡啶鎓盐因还原电位较高则无此生理调节功能。使用紫外光和大于490 nm的可见光交替照射,17o与17c发生可逆地相互转化的同时,能够开关控制对线虫的“麻痹”效果。此工作指出该荧光开关具有荧光,有利于通过荧光显微镜监测染料被摄取的动态过程,但该工作仅强调了颜色的变化, 并未研究其荧光随光致变色反应的变化。由于荧光检测相对于吸收检测具有更高的灵敏度和更低的检测限制优势,因此设计出具有生理活性调控功能的荧光分子开关具有更广阔的先进生物学技术应用前景,比如光动力治疗和非侵入性手术治疗。
朱明强课题组[29]针对溶酶体靶向设计了一种真正意义上的水溶性聚合物荧光开关探针,该探针能够高度选择性的标记活细胞的溶酶体(图 19),在紫外光和可见光的交替照射下能够实现荧光开关成像,获得100:1的高荧光对比度,为后续的超分辨成像实验奠定了实验基础(见后文)。
 图19
使用溶酶体靶向荧光开关聚合物PNIPAM-DTE(50 mg/L)和溶酶体商业探针LysoTracker red(75 nmol/L)培养的HeLa活细胞的共聚焦显微成像。(a)溶酶体靶向荧光开关聚合物PNIPAM-DTE的荧光分布(λex=405 nm), (b)LysoTracker red(λex=561 nm)的荧光分布. (c)明场中(a)和(b)的重叠. (d)和(e)分别是(a)和(b)中虚线方框区域的放大图,表明聚合物荧光探针PNIPAM-DTE和商业荧光探针LysoTracker red具有几乎完全相同的分布图案[29]
Figure19.
Confocal laser scanning microscope(CLSM) images of living HeLa cells incubated with lysosomal targeting photoswitchable fluorescent polymer PNIPAM-DTE(50 mg/L) and LysoTracker red (75 nmol/L). (a)The fluorescent distribution of lysosomal targeting photoswitchable fluorescent PNIPAM-DTE(λex=405 nm), (b)The fluorescent distributionof LysoTracker red(λex=561 nm). (c)The images (a) and (b) are merged with the bright-field image. (d) and (e):Zoomed-in views identified by the boxes in (a) and (b) reveal that PNIPAM-DTE and commercial LysoTracker have essentially the same patterns[29]
图19
使用溶酶体靶向荧光开关聚合物PNIPAM-DTE(50 mg/L)和溶酶体商业探针LysoTracker red(75 nmol/L)培养的HeLa活细胞的共聚焦显微成像。(a)溶酶体靶向荧光开关聚合物PNIPAM-DTE的荧光分布(λex=405 nm), (b)LysoTracker red(λex=561 nm)的荧光分布. (c)明场中(a)和(b)的重叠. (d)和(e)分别是(a)和(b)中虚线方框区域的放大图,表明聚合物荧光探针PNIPAM-DTE和商业荧光探针LysoTracker red具有几乎完全相同的分布图案[29]
Figure19.
Confocal laser scanning microscope(CLSM) images of living HeLa cells incubated with lysosomal targeting photoswitchable fluorescent polymer PNIPAM-DTE(50 mg/L) and LysoTracker red (75 nmol/L). (a)The fluorescent distribution of lysosomal targeting photoswitchable fluorescent PNIPAM-DTE(λex=405 nm), (b)The fluorescent distributionof LysoTracker red(λex=561 nm). (c)The images (a) and (b) are merged with the bright-field image. (d) and (e):Zoomed-in views identified by the boxes in (a) and (b) reveal that PNIPAM-DTE and commercial LysoTracker have essentially the same patterns[29]
二噻吩基乙烯应用于生物成像或生物应用,首要问题是将二噻吩基乙烯由疏水性改造成具有一定亲水性。克服荧光分子在水溶液因聚集而发生荧光猝灭,寻找新型的水溶性荧光基团以及提高荧光探针的生物适应性,将会是一项十分重要的工作[15]。二噻吩基乙烯用于生物成像的关键难点在于发展快响应、高开关对比度、生物相容性良好以及具有靶向功能的全面型的二噻吩基乙烯荧光探针[15]。
2.4 超分辨荧光成像
超分辨成像已成为在纳米尺度对生物分子结构和功能进行研究的重要手段[72],荧光开关一直以来被认为是超分辨成像的关键[73],但有机荧光分子开关成功应用于超分辨成像的报道相对甚少[74-75]。朱明强教授课题组率先提出使用有机荧光分子开关作为探针[15, 21-22, 29, 76-82],使用基于单分子定位的超分辨成像技术如光敏定位显微术(PALM)[83]、光学重建显微术(STORM)[84]等,通过光照控制荧光分子随机地处于亮态和暗态且被纳米级精度定位(图 20),最终重构出突破衍射极限的高分辨率图像[85]。朱明强教授课题组[15, 21-22, 29, 76-79, 81-82, 86-87]基于其丰富的有机荧光分子开关的研究经验,率先将有机荧光分子开关与超分辨成像技术有机结合在一起,发展了一种基于有机荧光分子开关的超分辨成像技术。他们敏锐地发现有机荧光分子开关探针的使用具有超越现有超分辨技术的巨大潜力,并且能够将超分辨成像从生物体系拓展到更广泛的材料学体系。
朱明强等[29]发现水溶性聚合物PNIPAM-DTE能够选择性地标记活细胞的溶酶体(见前文),甚至与溶酶体商业探针Lysotracker® Red的效果相媲美。PNIPAM-DTE有望发展成为新一代的溶酶体指示剂。由于溶酶体内部为酸性微环境,PNIPAM-DTE在溶酶体中拥有良好的荧光和荧光开关对比度,满足超分辨荧光成像的要求,通过活细胞超分辨荧光成像实验,获得的空间分辨率高达40 nm,打破了常规荧光显微镜因光学衍射极限产生的>200 nm的分辨率限制(图 21)。该工作为设计复杂的多功能性荧光分子开关提供了一种新的思路,也是二芳基乙烯荧光分子开关首次在活细胞超分辨成像领域的应用,具有重要而深远的理论和应用价值。
 图21
二芳基乙烯聚合物荧光分子开关PNIPAM-DTE用于溶酶体的超分辨光学成像。(a)明场图。(b)荧光图。(c)是(b)图中紫色方框区域放大的荧光图。(d)是(c)图中相同区域的超分辨成像图。(e) (c)中黄色方框区域的放大图。(f)与(e)相同的区域的超分辨成像图。(g)对(f)图中蓝色实线剖面的高斯拟合[29]
Figure21.
The application of photoswitchable fluorescent polymer PNIPAM-DTE as a liposome highlighter for super-resolution imaging (a)Bright field image; (b)Conventional fluorescence image displaying the distribution of PNIPAM-DTE; (c)Expanded view of the conventional fluorescence image marked by the purple box in (b); (d)Super-resolution image of the same purple box marked in (b); Images (e) and (f) are enlarged view of the yellow boxes marked in (c) and (d), respectively, revealing the dramatic enhancement of the super-resolution technique; (g)Fluorescence cross-sectional profiles of a pair of vicinal fluorescent points along the dashed lines in (f), indicating that structures of 40 nm apart have been resolved[29]
图21
二芳基乙烯聚合物荧光分子开关PNIPAM-DTE用于溶酶体的超分辨光学成像。(a)明场图。(b)荧光图。(c)是(b)图中紫色方框区域放大的荧光图。(d)是(c)图中相同区域的超分辨成像图。(e) (c)中黄色方框区域的放大图。(f)与(e)相同的区域的超分辨成像图。(g)对(f)图中蓝色实线剖面的高斯拟合[29]
Figure21.
The application of photoswitchable fluorescent polymer PNIPAM-DTE as a liposome highlighter for super-resolution imaging (a)Bright field image; (b)Conventional fluorescence image displaying the distribution of PNIPAM-DTE; (c)Expanded view of the conventional fluorescence image marked by the purple box in (b); (d)Super-resolution image of the same purple box marked in (b); Images (e) and (f) are enlarged view of the yellow boxes marked in (c) and (d), respectively, revealing the dramatic enhancement of the super-resolution technique; (g)Fluorescence cross-sectional profiles of a pair of vicinal fluorescent points along the dashed lines in (f), indicating that structures of 40 nm apart have been resolved[29]
Hell联合Irie课题组[[88]制备了一种含有八个羧基的水溶性二苯并噻砜基乙烯荧光分子开关18o(图 22)。这种二芳基乙烯是一种“turn on”模式的荧光分子开关[37],即与常规二芳基乙烯荧光分子开关在紫外光照射下生成闭环态后荧光猝灭的现象不同,该类二芳基乙烯结构的闭环态具有较强的荧光,而开环态没有荧光,这种性质有利于获得较好的“暗态”,从而能够实现超分辨荧光成像[89-90]。该水溶性荧光分子开关与不同二抗连接后在缓冲溶液中保持良好的低聚集状态,并保留了二芳基乙烯优异的光开关性能和抗体的专一性。该二芳基乙烯抗体复合物能够特异性地免疫标记相应的一级抗体免疫标记过的微管蛋白、波形蛋白、核孔复合体。事先使用紫外光激活荧光后,在宽场STORM显微镜下,单独使用488 nm进行超分辨成像,获得图像的分辨率为(90±10) nm。但是因为这类荧光开关的开环量子产率很低,荧光分子闪烁频率较低,使得成像所需要的帧数较高,成像时间较长,并且必须依赖于事先的紫外光照射,对活体成像不利。
 图22
水溶性“turn-on”模式荧光分子开关与抗体结合后特异性标记细胞微管并实现超分辨光学成像[88]
Figure22.
Water soluble "turn-on" mode of fluorescent photoswitchable diarylethenes for targetedly biolabeling and super-resolution imaging of microscopies[[88]
图22
水溶性“turn-on”模式荧光分子开关与抗体结合后特异性标记细胞微管并实现超分辨光学成像[88]
Figure22.
Water soluble "turn-on" mode of fluorescent photoswitchable diarylethenes for targetedly biolabeling and super-resolution imaging of microscopies[[88]
现代生物学和材料科学希望从分子水平上揭示生命过程和材料性能,对研究的微观结构提出了越来越高的分辨率需求。脂质体纳米结构的表征对于大多数人来说是一种挑战,因为常用的电子显微镜表征手段需要在高真空和高电压条件下,不可避免会引起其形貌的变化,虽然借助冷冻切片显微镜能够高分辨率地观测,但是该方法过于繁琐、耗时并依赖于特殊设备,且无法进行原位动态的观测,限制了其在生物领域的应用。在这方面,因为光学显微镜具有非侵入性、成像时间短、灵活多变等优点,在脂质体成像中具有广泛的应用。然而,受光学衍射极限的限制,普通光学显微镜的横向分辨率一般只能达到200 nm、纵向分辨率约为500 nm,这已经无法研究亚细胞器和分子结构了,对脂质体的光学成像也是不利的。近年发展起来的超分辨成像技术不仅能够打破光学衍射极限,还能很好地应用于脂质体的显微成像领域。但是它们也存在一定的问题,如脂质体探针在细胞质水环境中的应用有待研究,或者需要利用较为复杂的STED成像系统,目前能够成像的脂质体也大都是结构简单的(巨)大单室结构的脂质体。因此,发展基于二芳基乙烯的脂质体超分辨成像探针具有非常重要的实用价值。
朱明强课题组[21]利用PEG-PMI-2DTE作为超分辨探针对脂质体进行染色,302 nm的紫外光能够使PEG-PMI-2DTE的二噻吩基乙烯结构从开环态转变为闭环态,从而使脂质体的荧光猝灭,获得“暗(OFF)态”;而473 nm的激光不仅能够激发PEG-PMI-2DTE发出红色荧光,还能使二噻吩基乙烯从闭环态转变为开环态,此时荧光处于“亮(ON)态”;如此反复的ON与OFF,多次定位重构,最后实现脂质体的超分辨成像。如图 23所示,常规的荧光显微成像只能看到一个个实心的模糊的球,不能清楚地观测到脂质体的尺寸和微观结构。而超分辨成像重构出来的图中,亮的部位是脂质体中的荧光开关探针经过反复的开关定位出来的,更清晰地展示出脂质体的双磷脂层膜结构形貌。在超分辨显微镜下,能够准确测量脂质体的尺寸,并能明显地区分大小单室以及多室的脂质体结构,定位精度高达(29.17±1.01) nm。利用二噻吩基乙烯聚合物荧光开关实现了脂质体的超分辨成像,不仅拓展了两亲性二噻吩基乙烯荧光分子开关的应用范围,同时率先打开了基于光致变色单元荧光分子开关探针对脂质体超分辨成像研究新的一页,为以后脂质体或生物膜的研究提供了一种有效的策略,具有重要的科学研究和实际应用价值。
 图23
二芳基乙烯荧光分子开关PEG-PMI-2DTE染色脂质体的超分辨荧光成像。(a)常规荧光成像。(b)重构的超分辨图。(c)和(d)分别是(a)和(b)中紫色方框区域放大的图像。(e)和(f)分别是(a)和(b)中绿色方框区域放大的图像。(g)和(h)分别是(a)和(b)中蓝色方框区域放大的图像。(f)与(e)相同的区域的超分辨成像图。(i)是对(d)、(f)、(h)图中蓝色实线剖面虚线区域剖面的高斯拟合。(i)根据(a)和(b)计算的傅里叶环相关曲线。比例尺为300 nm [21]
Figure23.
Optical nanoimaging of liposomes stained by photoswichable fluorescent daylethene PEG-PMI-2DTE. (a)Conventional fluorescence imaging. (b)Reconstructed super-resolution images. Scale bar:1 μm. (c) and (d) are the expansion of the blue boxes in (a) and (b) respectively. (e) and (f) are the expansion of the green boxes in (a) and (b) respectively. (g) and (h) are the expansion of the purple boxes in (a) and (b) respectively. (i)Cross-sectional profiles of along the dashed lines in super-resolution image (d), (f) and (h). (g)fourier ring correlation curve calculated from (a) and (b). Scale bar of c~h:300 nm[21]
图23
二芳基乙烯荧光分子开关PEG-PMI-2DTE染色脂质体的超分辨荧光成像。(a)常规荧光成像。(b)重构的超分辨图。(c)和(d)分别是(a)和(b)中紫色方框区域放大的图像。(e)和(f)分别是(a)和(b)中绿色方框区域放大的图像。(g)和(h)分别是(a)和(b)中蓝色方框区域放大的图像。(f)与(e)相同的区域的超分辨成像图。(i)是对(d)、(f)、(h)图中蓝色实线剖面虚线区域剖面的高斯拟合。(i)根据(a)和(b)计算的傅里叶环相关曲线。比例尺为300 nm [21]
Figure23.
Optical nanoimaging of liposomes stained by photoswichable fluorescent daylethene PEG-PMI-2DTE. (a)Conventional fluorescence imaging. (b)Reconstructed super-resolution images. Scale bar:1 μm. (c) and (d) are the expansion of the blue boxes in (a) and (b) respectively. (e) and (f) are the expansion of the green boxes in (a) and (b) respectively. (g) and (h) are the expansion of the purple boxes in (a) and (b) respectively. (i)Cross-sectional profiles of along the dashed lines in super-resolution image (d), (f) and (h). (g)fourier ring correlation curve calculated from (a) and (b). Scale bar of c~h:300 nm[21]
超分辨光学显微技术打破了光学衍射极限分辨率的限制,实现了纳米级分辨率成像,但因受到其荧光探针的种类和工作机理的限制,当前的二噻吩基乙烯类荧光分子开关探针,大都依赖于紫外光源才能获得有效的荧光猝灭,但超分辨成像系统往往难以并入紫外光源系统,同时高能量的紫外光会对观测对象如细胞造成不可避免的损伤,因此,开发可见光敏感的二噻吩基乙烯是解决其超分辨成像应用瓶颈的关键突破点之一[5]。二噻吩基乙烯具有优异的抗疲劳性,光开关过程仅需要光的调控,不需添加任何的辅助试剂,因此,二噻吩基乙烯荧光分子开关在活细胞长时或实时检测的超分辨成像领域具有广泛的应用前景,但需要突破的两个挑战分别是:1)获得高亮荧光开关对比[69];2)实现对可见光敏感的光致变色能力。基于有机荧光分子开关的超分辨成像拥有操作十分简便有效、成本低、对观察对象无侵害等优点,并能做到实时观测研究,将十分有利于推动相关领域的发展,并有望成为一种替代电子显微镜的高分辨率表征方法。
3 结论和展望
二芳基乙烯荧光分子开关的合成、性质和应用发展十分迅速,但亲水性二芳基乙烯荧光分子开关的研究才刚刚崭露头角。作为一种典型的有机荧光分子开关,二芳基乙烯母核本身具有较强的疏水性,如何通过化学修饰和物理方法实现一定的亲水性或水溶性,并对目标分子或细胞结构进行靶向,同时赋予良好的生物或环境相容性,是一件具有挑战性的工作。制备小分子水溶性荧光分子开关是最容易被人们想到的,但是由于二芳基乙烯母核本身具有强烈的疏水性,在有限的分子设计空间内,难以在保证其性能并附加其他功能的情况下实现水溶性或者亲水性,未来需要设计并发展更精简、更方便的分子结构同时兼顾荧光开关性能和分子的尺寸。荧光分子开关自身或与两亲性分子(或聚合物)自组装形成脂质体,以及与亲水性的聚合物共混或化学枝接的方式包覆在量子点表面形成核壳结构的复合纳米粒子(包括上转换粒子),均能形成稳定的水溶性荧光开关探针,但该探针存在具有一定尺寸的限制,并不能实现分子级别的开关调控与应用。朱明强课题组发展的将二芳基乙烯荧光分子开关单体化与其他功能单体进行聚合,即可简便的实现水溶性、生物相容性的多功能聚合物荧光开关探针,是一种非常灵活的构造满足实际应用要求的荧光分子开关的策略。由于聚合物的功能单体和聚合方法均多种多样,利用二噻吩基乙烯荧光开关单体与其他功能单体共聚,能够综合并充分发挥二噻吩基乙烯荧光分子开关和功能单体各自的性能,设计、合成出更多具有特殊用途的聚合物荧光开关。同时,为了更明确聚合物的结构,应该寻求开发出更多的构造二噻吩基乙烯聚合物荧光开关的方法。然而,当前对聚合物型水溶性荧光分子开关的研究相对匮乏,聚合物型水溶性荧光分子开关将会是未来发展的一个重要方向。
二芳基乙烯作为一种最为经典的有机光致变色体系之一,具有优良的热稳定性和抗疲劳性,拥有广泛的应用前景。本综述也介绍了亲水性二芳基乙烯荧光分子开关在化学传感、生物检测、生物荧光成像、超分辨成像等主要领域的一些进展。光开关与化学传感的结合,能够提高传感的选择性,并有助于发展新的检测方法和传感应用。生物分子作为一客体,选择性地稳定或者“锁住”二芳基乙烯的某一个异构体,这种与荧光开关性质形成的复杂逻辑关系,能够有效提高对生物大分子的选择性与灵敏度,基于此,有望在未来开发出新型的化学、生物传感器,为活体的生理过程例如细胞分裂和增殖、细胞内物理运动、疾病诊断和治疗等方面提供新的思考方向。同时荧光开关探针在荧光显微成像表现出良好的实用性,它们能够被调节的荧光强度和光谱,为生物成像提供了一种简单而强大的区域功能标记技术和示踪技术,对细胞荧光标记具有重要的应用价值。最为引人瞩目的是,二芳基乙烯荧光分子开关作为超分辨探针能够实现活细胞亚细胞结构或生物大分子的纳米级定位精度的荧光成像,并凭借着二芳基乙烯优异的抗疲劳性,有潜力发展一种实现在线实时监测的光学纳米成像技术。当前的亲水性荧光分子开关受到分子结构与种类的限制,并不能较好地满足实际应用的需求。主要表现在亲水性荧光分子开关的结构比较复杂;荧光开关比对比度有限;当前的二芳基乙烯分子体系抗疲劳性不够优异;并且依赖于具有伤害性的紫外光源作为闭环反应工作波长;同时对于某些需要双稳态的应用体系,当前的亲水二芳基乙烯荧光分子开关普遍存在荧光有损读出的情况;与环境的兼容性有待进一步提高等。亲水性只是二芳基乙烯迈向各种生物传感、光开关探针、生物成像、超分辨光学成像等应用的第一步,未来需要开展进一步的研究,以获得亲水性的同时兼顾光开关的性能以及探针的功能,此方向的研究显得十分的重要与迫切。
-
-
[1]
Irie M, Mohri M. Thermally Irreversible Photochromic Systems. Reversible Photocyclization of Diarylethene Derivatives[J]. J Org Chem, 1988, 53(4): 803-808. doi: 10.1021/jo00239a022
-
[2]
李冲. 二芳基乙烯类荧光分子开关的合成、性质及应用[D]. 武汉: 华中科技大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10487-1015597086.htmLI Chong. The Synthesis, Properties and Applications of Photoswitchable Fluorescent Diarylethene[D]. Wuhan:Huazhong University of Science & Technology, 2016(in Chinese). http://cdmd.cnki.com.cn/Article/CDMD-10487-1015597086.htm
-
[3]
Wigglesworth T J, Sud D, Norsten T B. Chiral Discrimination in Photochromic Helicenes[J]. J Am Chem Soc, 2005, 127(20): 7272-7273. doi: 10.1021/ja050190j
-
[4]
Irie M. Photochromism of Diarylethene Single Molecules and Single Crystals[J]. Photochem Photobiol Sci, 2010, 9(12): 1535-1542. doi: 10.1039/c0pp00251h
-
[5]
Toriumi A, Kawata S, Gu M. Reflection Confocal Microscope Readout System for Three-Dimensional Photochromic Optical Data Storage[J]. Opt Lett, 1998, 23(24): 1924-1926. doi: 10.1364/OL.23.001924
-
[6]
Uchida K, Saito M, Murakami A. Non-Destructive Readout of the Photochromic Reactions of Diarylethene Derivatives Using Infrared Light[J]. Adv Mater, 2003, 15(2): 121-125. doi: 10.1002/(ISSN)1521-4095
-
[7]
Stellacci F, Bertarelli C, Toscano F. Diarylethene-Based Photochromic Rewritable Optical Memories:On the Possibility of Reading in the Mid-infrared[J]. Chem Phys Lett, 1999, 302(5/6): 563-570.
-
[8]
Matsuda K. Photochromic Diarylethene as an Information Processing Unit:Magnetic and Electric Switching[J]. Pure Appl Chem, 2008, 80(3): 555-561.
-
[9]
Barone V, Cacelli I, Ferretti A. Electron Transport Properties of Diarylethene Photoswitches by a Simplified NEGF-DFT Approach[J]. J Phys Chem B, 2014, 118(18): 4976-4981. doi: 10.1021/jp502065c
-
[10]
Kawai T, Koshido T, Yoshino K. Optical and Dielectric Properties of Photochromic Dye in Amorphous State and Its Application[J]. Appl Phys Lett, 1995, 67(6): 795-797. doi: 10.1063/1.115470
-
[11]
Irie M, Ishida H, Tsujioka T. Rewritable Near-Field Optical Recording on Photochromic Perinaphthothioindigo Thin Films:Readout by Fluorescence[J]. Jpn J Appl Phys, 1999, 38(10R): 6114.
-
[12]
Tong Z, Pu S, Xiao Q. Synthesis and Photochromism of a Novel Water-Soluble Diarylethene with Glucosyltriazolyl Groups[J]. Tetrahedron Lett, 2013, 54(6): 474-477. doi: 10.1016/j.tetlet.2012.11.056
-
[13]
Zhang J, Zou Q, Tian H. Photochromic Materials:More Than Meets the Eye[J]. Adv Mater, 2013, 25(3): 378-399. doi: 10.1002/adma.201201521
-
[14]
Fukaminato T. Single-Molecule Fluorescence Photoswitching:Design and Synthesis of Photoswitchable Fluorescent Molecules[J]. J Photochem Photobiol, C, 2011, 12(3): 177-208. doi: 10.1016/j.jphotochemrev.2011.08.006
-
[15]
李冲, 刘俊霞, 谢诺华. 二噻吩基乙烯荧光分子开关的研究进展[J]. 高分子通报, 2015(9): 142-162. LI Chong, LIU Junxia, XIE Nuohua. Research Progress on Photoswitchable Fluorescent Dithienylethenes[J]. Polym Bull, 2015, (9): 142-162.
-
[16]
Zou Y, Yi T, Xiao S. Amphiphilic Diarylethene as a Photoswitchable Probe for Imaging Living Cells[J]. J Am Chem Soc, 2008, 130(47): 15750-15751. doi: 10.1021/ja8043163
-
[17]
Matsuda K, Shinkai Y, Yamaguchi T. Very High Cyclization Quantum Yields of Diarylethene Having Two N-Methylpyridinium Ions[J]. Chem Lett, 2003, 32(12): 1178-1179. doi: 10.1246/cl.2003.1178
-
[18]
Hirose T, Irie M, Matsuda K. Temperature-Light Dual Control of Clouding Behavior of an Oligo(ethylene glycol)-Diarylethene Hybrid System[J]. Adv Mater, 2008, 20(11): 2137-2141. doi: 10.1002/(ISSN)1521-4095
-
[19]
Saitoh M, Fukaminato T, Irie M. Photochromism of a Diarylethene Derivative in Aqueous Solution Capping with a Water-Soluble Nano-Cavitand[J]. J Photochem Photobiol A:Chem, 2009, 207(1): 28-31. doi: 10.1016/j.jphotochem.2009.03.010
-
[20]
Xiao S, Zou Y, Yu M. A photochromic Fluorescent Switch in an Organogel System with Non-destructive Readout Ability[J]. Chem Commun, 2007, (45): 4758-4760. doi: 10.1039/b709409d
-
[21]
Liu J X, Xin B, Li C. PEGylated Perylenemonoimide-Dithienylethene for Super-Resolution Imaging of Liposomes[J]. ACS Appl Mater Interfaces, 2017, 9(12): 10338-10343. doi: 10.1021/acsami.6b15076
-
[22]
Li C, Yan H, Zhao L X. A Trident Dithienylethene-Perylenemonoimide Dyad with Super Fluorescence Switching Speed and Ratio[J]. Nat Commun, 2014, 5: 5709. doi: 10.1038/ncomms6709
-
[23]
Cheng H, Ma P, Wang Y. Photoswitchable and Water-Soluble Fluorescent Nano-Aggregates Based on a Diarylethene Dansyl Dyad and Liposome[J]. Chem-Asian J, 2017, 12(2): 248-253. doi: 10.1002/asia.v12.2
-
[24]
Feng G, Ding D, Li K. Reversible Photoswitching Conjugated Polymer Nanoparticles for Cell and ex Vivo Tumor Imaging[J]. Nanoscale, 2014, 6(8): 4141-4147. doi: 10.1039/C3NR06663K
-
[25]
Balter M, Li S, Morimoto M. Emission Color Tuning and White-Light Generation Based on Photochromic Control of Energy Transfer Reactions in Polymer Micelles[J]. Chem Sci, 2016, 7(9): 5867-5871. doi: 10.1039/C6SC01623E
-
[26]
Min Y K, Ji G C, Ahn K H. Superparamagnetic Iron Oxide Nanoparticles with Photoswitchable Fluorescence[J]. Chem Commun, 2008, (38): 4622-4624. doi: 10.1039/b807462c
-
[27]
Wu T, Wilson D, Branda N R. Fluorescent Quenching of Lanthanide-Doped Upconverting Nanoparticles by Photoresponsive Polymer Shells[J]. Chem Mater, 2014, 26(14): 4313-4320. doi: 10.1021/cm5021405
-
[28]
Díaz S A, Gillanders F, Susumu K. Water-Soluble, Thermostable, Photomodulated Color-Switching Quantum Dots[J]. Chem-Eur J, 2017, 23(2): 263-267. doi: 10.1002/chem.v23.2
-
[29]
Li C, Hu Z, Aldred M P. Water-Soluble Polymeric Photoswitching Dyads Impart Super-Resolution Lysosome Highlighters[J]. Macromolecules, 2014, 47(24): 8594-8601. doi: 10.1021/ma501505w
-
[30]
Liu J X, Xin B, Li C. Photoswitchable Polyfluorophores Based on Perylenemonoimide-Dithienylethene Conjugates as Super-Resolution MitoTrackers[J]. J Mater Chem C, 2017, 5(36): 9339-9344. doi: 10.1039/C7TC02526B
-
[31]
Wu T, Boyer J C, Barker M. A "Plug-and-Play" Method to Prepare Water-Soluble Photoresponsive Encapsulated Upconverting Nanoparticles Containing Hydrophobic Molecular Switches[J]. Chem Mater, 2013, 25(12): 2495-2502. doi: 10.1021/cm400802d
-
[32]
Massaad J, Coppel Y, Sliwa M. Photocontrol of Luminescent Inorganic Nanocrystals via an Organic Molecular Switch[J]. Phys Chem Chem Phys, 2014, 16(41): 22775-22783. doi: 10.1039/C4CP03537B
-
[33]
Díaz S A, Giordano L, Azc rate J C. Quantum Dots as Templates for Self-Assembly of Photoswitchable Polymers:Small, Dual-Color Nanoparticles Capable of Facile Photomodulation[J]. J Am Chem Soc, 2013, 135(8): 3208-3217. doi: 10.1021/ja3117813
-
[34]
Díaz S A, Men ndez G O, Etchehon M H. Photoswitchable Water-Soluble Quantum Dots:pcFRET Based on Amphiphilic Photochromic Polymer Coating[J]. ACS Nano, 2011, 5(4): 2795-2805. doi: 10.1021/nn103243c
-
[35]
Díaz S A, Giordano L, Jovin T M. Modulation of a Photoswitchable Dual-Color Quantum Dot Containing a Photochromic FRET Acceptor and an Internal Standard[J]. Nano Lett, 2012, 12(7): 3537-3544. doi: 10.1021/nl301093s
-
[36]
Takagi Y, Kunishi T, Katayama T. Photoswitchable Fluorescent Diarylethene Derivatives with Short Alkyl Chain Substituents[J]. Photochem Photobiol Sci, 2012, 11(11): 1661-1665. doi: 10.1039/c2pp25078k
-
[37]
Uno K, Niikura H, Morimoto M. In Situ Preparation of Highly Fluorescent Dyes upon Photoirradiation[J]. J Am Chem Soc, 2011, 133(34): 13558-13564. doi: 10.1021/ja204583e
-
[38]
Mao Y, Yi T. Fluorescent Switchable Diarylethene Derivatives and Their Application to the Imaging of Living Cells. In Photon-Working Switches[M]. Yokoyama Y, Nakatani K, Eds. Japan:Tokyo:Springer, 2017:133-152.
-
[39]
Lv G, Cui B, Lan H. Diarylethene Based Fluorescent Switchable Probes for the Detection of Amyloid-β Pathology in Alzheimer's Disease[J]. Chem Commun, 2015, 51(1): 125-128. doi: 10.1039/C4CC07656G
-
[40]
Cao K, Farahi M, Dakanali M. Aminonaphthalene 2-Cyanoacrylate(ANCA) Probes Fluorescently Discriminate Between Amyloid-β and Prion Plaques in Brain[J]. J Am Chem Soc, 2012, 134(42): 17338-17341. doi: 10.1021/ja3063698
-
[41]
Liu K, Wen Y, Shi T. DNA Gated Photochromism and Fluorescent Switch in a Thiazole Orange Modified Diarylethene[J]. Chem Commun, 2014, 50(65): 9141-9144. doi: 10.1039/C4CC02783C
-
[42]
Biancardi A, Biver T, Marini A. Thiazole Orange(TO) as a Light-Switch Probe:A Combined Quantum-Mechanical and Spectroscopic Study[J]. Phys Chem Chem Phys, 2011, 13(27): 12595-12602. doi: 10.1039/c1cp20812h
-
[43]
Irie M, Miyatake O, Uchida K. Blocked Photochromism of Diarylethenes[J]. J Am Chem Soc, 1992, 114(22): 8715-8716. doi: 10.1021/ja00048a063
-
[44]
Mohanty J, Thakur N, Dutta Choudhury S. Recognition-Mediated Light-Up of Thiazole Orange with Cucurbit[J]. J Phys Chem B, 2012, 116(1): 130-135. doi: 10.1021/jp210432t
-
[45]
Xu Y, Guo M, Li X. Formation of Linear Supramolecular Polymers that is Based on Host-Guest Assembly in Water[J]. Chem Commun, 2011, 47(31): 8883-8885. doi: 10.1039/c1cc12599k
-
[46]
Mao Y, Liu K, Lv G. CB[8] Gated Photochromism of a Diarylethene Derivative Containing Thiazole Orange Groups[J]. Chem Commun, 2015, 51(30): 6667-6670. doi: 10.1039/C5CC01390A
-
[47]
Hu H, Zhu M, Meng X. Optical Switching and Fluorescence Modulation Properties of Photochromic Dithienylethene Derivatives[J]. J Photochem Photobiol A:Chem, 2007, 189(2): 307-313.
-
[48]
Jing S, Zheng C, Pu S. A Highly Selective Ratiometric Fluorescent Chemosensor for Hg2+ Based on a New Diarylethene with a Stilbene-Linked Terpyridine Unit[J]. Dyes Pigm, 2014, 107: 38-44. doi: 10.1016/j.dyepig.2014.03.023
-
[49]
Yokel R A. Aluminum Chelation Principles and Recent Advances[J]. Coord Chem Rev, 2002, 228(2): 97-113. doi: 10.1016/S0010-8545(02)00078-4
-
[50]
Altschuler E. Aluminum-Containing Antacids as a Cause of Idiopathic Parkinson's Disease[J]. Med Hypotheses, 1999, 53(1): 22-23. doi: 10.1054/mehy.1997.0701
-
[51]
Li S Y, Zhang D B, Wang J Y. A Novel Diarylethene-Hydrazinopyridine-Based Probe for Fluorescent Detection of Aluminum Ion and Naked-Eye Detection of Hydroxide Ion[J]. Sens Actuators B:Chem, 2017, 245: 263-272. doi: 10.1016/j.snb.2017.01.149
-
[52]
Wu J, Sheng R, Liu W. Fluorescent Sensors Based on Controllable Conformational Change for Discrimination of Zn2+ over Cd2+[J]. Tetrahedron, 2012, 68(27/28): 5458-5463.
-
[53]
Pu S, Zhang C, Fan C. Multi-Controllable Properties of an Antipyrine-Based Diarylethene and Its High Selectivity for Recognition of Al3+[J]. Dyes Pigm, 2016, 129: 24-33. doi: 10.1016/j.dyepig.2016.02.001
-
[54]
Zhang C, Pu S, Sun Z. Highly Sensitive and Selective Fluorescent Sensor for Zinc Ion Based on a New Diarylethene with a Thiocarbamide Unit[J]. J Phys Chem B, 2015, 119(13): 4673-4682. doi: 10.1021/acs.jpcb.5b01390
-
[55]
Zhang X, Wang R, Fan C. A highly Selective Fluorescent Sensor for Cd2+ Based on a New Diarylethene with a 1, 8-Naphthyridine Unit[J]. Dyes Pigm, 2017, 139: 208-217. doi: 10.1016/j.dyepig.2016.12.023
-
[56]
Dong X, Wang R, Liu G. A Novel Sensitive Sensor for Cu2+ and Multi-Switch Based on a Diarylethene with a 2-(2'-Hydroxyphenyl)benzothiazole Unit[J]. Tetrahedron, 2016, 72(22): 2935-2942. doi: 10.1016/j.tet.2016.04.007
-
[57]
Li G, Ma L, Liu G. A Diarylethene-Based "On-Off-On" Fluorescence Sensor for the Sequential Recognition of Mercury and Cysteine[J]. RSC Adv, 2017, 7(33): 20591-20596. doi: 10.1039/C6RA27773J
-
[58]
Qu S, Zheng C, Liao G. A Fluorescent Chemosensor for Sn2+ and Cu2+ Based on a Carbazole-Containing Diarylethene[J]. RSC Adv, 2017, 7(16): 9833-9839. doi: 10.1039/C6RA27339D
-
[59]
Xue D, Zheng C, Fan C. A Colorimetric Fluorescent Sensor for Cr3+ Based on a Novel Diarylethene with a Naphthalimide-Rhodamine B Group[J]. J Photochem Photobiol A:Chem, 2015, 303: 59-66.
-
[60]
Stephens D J, Allan V J. Light Microscopy Techniques for Live Cell Imaging[J]. Science, 2003, 300(5616): 82-86. doi: 10.1126/science.1082160
-
[61]
Carreon J R, Stewart K M, Mahon K P. Cyanine Dye Conjugates as Probes for Live Cell Imaging[J]. Biorg Med Chem Lett, 2007, 17(18): 5182-5185. doi: 10.1016/j.bmcl.2007.06.097
-
[62]
Negre-Salvayre A, Aug N, Duval C. [5] Detection of Intracellular Reactive Oxygen Species in Cultured Cells Using Fluorescent Probes[J]. Methods Enzymol, 2002, 352: 62-71. doi: 10.1016/S0076-6879(02)52007-3
-
[63]
Zhu M Q, Zhu L, Han J J. Spiropyran-Based Photochromic Polymer Nanoparticles with Optically Switchable Luminescence[J]. J Am Chem Soc, 2006, 128(13): 4303-4309. doi: 10.1021/ja0567642
-
[64]
Wiedenmann J, Ivanchenko S, Oswald F. EosFP, a Fluorescent Marker Protein with UV-Inducible Green-to-Red Fluorescence Conversion[J]. Proc Natl Acad Sci USA, 2004, 101(45): 15905-15910. doi: 10.1073/pnas.0403668101
-
[65]
Zhang J, Campbell R E, Ting A Y. Creating New Fluorescent Probes for Cell Biology[J]. Nat Rev Mol Cell Biol, 2002, 3(12): 906-918. doi: 10.1038/nrm976
-
[66]
Zhu M-Q, Zhang G-F, Li C. Reversible Two-Photon Photoswitching and Two-Photon Imaging of Immunofunctionalized Nanoparticles Targeted to Cancer Cells[J]. J Am Chem Soc, 2011, 133(2): 365-372. doi: 10.1021/ja106895k
-
[67]
Soh N, Yoshida K, Nakajima H. A Fluorescent Photochromic Compound for Labeling Biomolecules[J]. Chem Commun, 2007, (48): 5206-5208. doi: 10.1039/b713663c
-
[68]
Piao X, Zou Y, Wu J. Multiresponsive Switchable Diarylethene and Its Application in Bioimaging[J]. Org Lett, 2009, 11(17): 3818-3821. doi: 10.1021/ol9014267
-
[69]
Jae Lee M, Ho Kang S. Photoswitchable Fluorescent Diarylethene in a Turn-On Mode for Live Cell Imaging[J]. Chem Commun, 2012, 48(31): 3745-3747. doi: 10.1039/c2cc30738c
-
[70]
Wang S, Li C P, Xu L. A Photochromic Fluorescent Probe for Hg2+ Based on Dithienylethene-Rhodamine B Dyad and Its Application in Live Cells Imaging[J]. Sci Adv Mater, 2017, 9(3/4): 533-540.
-
[71]
Al-Atar U, Fernandes R, Johnsen B. A Photocontrolled Molecular Switch Regulates Paralysis in a Living Organism[J]. J Am Chem Soc, 2009, 131(44): 15966-15967. doi: 10.1021/ja903070u
-
[72]
Huang B, Wang W, Bates M. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy[J]. Science, 2008, 319](5864): 810-813.
-
[73]
Heilemann M, Dedecker P, Hofkens J. Photoswitches:Key Molecules for Subdiffraction-Resolution Fluorescence Imaging and Molecular Quantification[J]. Laser Photonics Rev, 2009, 3(1/2): 180-202.
-
[74]
Tian Z, Wu W, Li A D Q. Photoswitchable Fluorescent Nanoparticles:Preparation, Properties and Applications[J]. Chemphyschem, 2009, 10(15): 2577-2591. doi: 10.1002/cphc.v10:15
-
[75]
Tian Z, Li A D Q, Hu D. Super-resolution Fluorescence Nanoscopy Applied to Imaging Core-Shell Photoswitching Nanoparticles and Their Self-Assemblies[J]. Chem Commun, 2011, 47(4): 1258-1260. doi: 10.1039/C0CC03217D
-
[76]
Hua Q X, Xin B, Xiong Z. Super-Resolution Imaging of Self-Assembly of Amphiphilic Photoswitchable Macrocycles[J]. Chem Commun, 2017, 53(18): 2669-2672. doi: 10.1039/C7CC00044H
-
[77]
Gong W L, Xiong Z J, Xin B. Twofold Photoswitching of NIR Fluorescence and EPR Based on the PMI-N-HABI for Optical Nanoimaging of Electrospun Polymer Nanowires[J]. J Mater Chem C, 2016, 4(13): 2498-2505. doi: 10.1039/C6TC00542J
-
[78]
Yan J, Zhao L X, Li C. Optical Nanoimaging for Block Copolymer Self-Assembly[J]. J Am Chem Soc, 2015, 137(7): 2436-2439. doi: 10.1021/ja512189a
-
[79]
Zhu M Q, Zhang G F, Hu Z. Reversible Fluorescence Switching of Spiropyran-Conjugated Biodegradable Nanoparticles for Super-Resolution Fluorescence Imaging[J]. Macromolecules, 2014, 47(5): 1543-1552. doi: 10.1021/ma5001157
-
[80]
Gong W, Xiong Z, Zhu M. Current Progress in Molecular Photoswitches Based on Hexaarylbiimidazole:Molecular Design and Synthesis, Properties and Application[J]. Imaging Sci Photochem, 2014, 32(1): 43-59.
-
[81]
Zhang G, Chen T, Li C. Spiropyran-Based Molecular Photoswitches[J]. Chinese J Org Chem, 2013, 33(5): 927-942. doi: 10.6023/cjoc201210006
-
[82]
Li C, Gong W L, Hu Z. Photoswitchable Aggregation-Induced Emission of a Dithienylethene-Tetraphenylethene Conjugate for Optical Memory and Super-Resolution Imaging[J]. RSC Adv, 2013, 3(23): 8967-8972. doi: 10.1039/c3ra40674a
-
[83]
Betzig E, Patterson G H, Sougrat R. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution[J]. Science, 2006, 313(5793): 1642-1645. doi: 10.1126/science.1127344
-
[84]
Rust M J, Bates M, Zhuang X. Sub-Diffraction-Limit Imaging by Stochastic Optical Reconstruction Microscopy (STORM)[J]. Nat Methods, 2006, 3(10): 793-796. doi: 10.1038/nmeth929
-
[85]
Yan J, Zhao L X, Li C. Optical Nanoimaging for Block Copolymer Self-Assembly[J]. J Am Chem Soc, 2015, 137(7): 2436-2439. doi: 10.1021/ja512189a
-
[86]
Gong W L, Yan J, Zhao L X. Single-Wavelength-Controlled in Situ Dynamic Super-Resolution Fluorescence Imaging for Block Copolymer Nanostructures via Blue-Light-Switchable FRAP[J]. Photochem Photobiol Sci, 2016, 15(11): 1433-1441. doi: 10.1039/C6PP00293E
-
[87]
Gong W L, Hu Z, Li C. Condensed State Fluorescence Switching of Hexaarylbiimidazole-Tetraphenylethene Conjugate for Super-Resolution Fluorescence Nanolocalization[J]. Front Optoelectron, 2013, 6(4): 458-467. doi: 10.1007/s12200-013-0330-1
-
[88]
Roubinet B, Weber M, Shojaei H. Fluorescent Photoswitchable Diarylethenes for Biolabeling and Single-Molecule Localization Microscopies with Optical Superresolution[J]. J Am Chem Soc, 2017, 139(19): 6611-6620. doi: 10.1021/jacs.7b00274
-
[89]
Arai Y, Ito S, Fujita H. One-Colour Control of Activation, Excitation and Deactivation of a Fluorescent Diarylethene Derivative in Super-Resolution Microscopy[J]. Chem Commun, 2017, 53(29): 4066-4069. doi: 10.1039/C6CC10073B
-
[90]
Nevskyi O, Sysoiev D, Oppermann A. Nanoscopic Visualization of Soft Matter Using Fluorescent Diarylethene Photoswitches[J]. Angew Chem Int Ed, 2016, 55(41): 12698-12702. doi: 10.1002/anie.201606791
-
[1]
-
图 19 使用溶酶体靶向荧光开关聚合物PNIPAM-DTE(50 mg/L)和溶酶体商业探针LysoTracker red(75 nmol/L)培养的HeLa活细胞的共聚焦显微成像。(a)溶酶体靶向荧光开关聚合物PNIPAM-DTE的荧光分布(λex=405 nm), (b)LysoTracker red(λex=561 nm)的荧光分布. (c)明场中(a)和(b)的重叠. (d)和(e)分别是(a)和(b)中虚线方框区域的放大图,表明聚合物荧光探针PNIPAM-DTE和商业荧光探针LysoTracker red具有几乎完全相同的分布图案[29]
Figure 19 Confocal laser scanning microscope(CLSM) images of living HeLa cells incubated with lysosomal targeting photoswitchable fluorescent polymer PNIPAM-DTE(50 mg/L) and LysoTracker red (75 nmol/L). (a)The fluorescent distribution of lysosomal targeting photoswitchable fluorescent PNIPAM-DTE(λex=405 nm), (b)The fluorescent distributionof LysoTracker red(λex=561 nm). (c)The images (a) and (b) are merged with the bright-field image. (d) and (e):Zoomed-in views identified by the boxes in (a) and (b) reveal that PNIPAM-DTE and commercial LysoTracker have essentially the same patterns[29]
图 21 二芳基乙烯聚合物荧光分子开关PNIPAM-DTE用于溶酶体的超分辨光学成像。(a)明场图。(b)荧光图。(c)是(b)图中紫色方框区域放大的荧光图。(d)是(c)图中相同区域的超分辨成像图。(e) (c)中黄色方框区域的放大图。(f)与(e)相同的区域的超分辨成像图。(g)对(f)图中蓝色实线剖面的高斯拟合[29]
Figure 21 The application of photoswitchable fluorescent polymer PNIPAM-DTE as a liposome highlighter for super-resolution imaging (a)Bright field image; (b)Conventional fluorescence image displaying the distribution of PNIPAM-DTE; (c)Expanded view of the conventional fluorescence image marked by the purple box in (b); (d)Super-resolution image of the same purple box marked in (b); Images (e) and (f) are enlarged view of the yellow boxes marked in (c) and (d), respectively, revealing the dramatic enhancement of the super-resolution technique; (g)Fluorescence cross-sectional profiles of a pair of vicinal fluorescent points along the dashed lines in (f), indicating that structures of 40 nm apart have been resolved[29]
图 22 水溶性“turn-on”模式荧光分子开关与抗体结合后特异性标记细胞微管并实现超分辨光学成像[88]
Figure 22 Water soluble "turn-on" mode of fluorescent photoswitchable diarylethenes for targetedly biolabeling and super-resolution imaging of microscopies[[88]
图 23 二芳基乙烯荧光分子开关PEG-PMI-2DTE染色脂质体的超分辨荧光成像。(a)常规荧光成像。(b)重构的超分辨图。(c)和(d)分别是(a)和(b)中紫色方框区域放大的图像。(e)和(f)分别是(a)和(b)中绿色方框区域放大的图像。(g)和(h)分别是(a)和(b)中蓝色方框区域放大的图像。(f)与(e)相同的区域的超分辨成像图。(i)是对(d)、(f)、(h)图中蓝色实线剖面虚线区域剖面的高斯拟合。(i)根据(a)和(b)计算的傅里叶环相关曲线。比例尺为300 nm [21]
Figure 23 Optical nanoimaging of liposomes stained by photoswichable fluorescent daylethene PEG-PMI-2DTE. (a)Conventional fluorescence imaging. (b)Reconstructed super-resolution images. Scale bar:1 μm. (c) and (d) are the expansion of the blue boxes in (a) and (b) respectively. (e) and (f) are the expansion of the green boxes in (a) and (b) respectively. (g) and (h) are the expansion of the purple boxes in (a) and (b) respectively. (i)Cross-sectional profiles of along the dashed lines in super-resolution image (d), (f) and (h). (g)fourier ring correlation curve calculated from (a) and (b). Scale bar of c~h:300 nm[21]
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 50
- 文章访问数: 10230
- HTML全文浏览量: 1737




















 下载:
下载:






















 下载:
下载:

