 Figure Scheme 1.
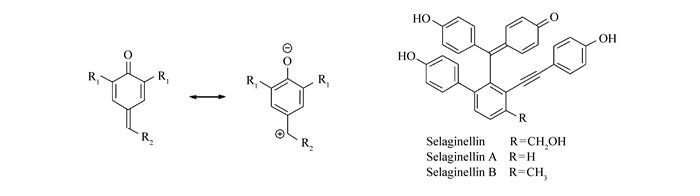
Structure of p-quinone methide(p-QM) and representative natural products contain p-QM core
Figure Scheme 1.
Structure of p-quinone methide(p-QM) and representative natural products contain p-QM core

Citation: TANG Pingsheng, WANG Bo. 1, 6-Addition of Terminal Alkynes to p-Quinone Methides[J]. Chinese Journal of Applied Chemistry, 2017, 34(6): 664-670. doi: 10.11944/j.issn.1000-0518.2017.06.160379

端炔与对亚甲基苯醌的1, 6-加成
English
1, 6-Addition of Terminal Alkynes to p-Quinone Methides
-
Key words:
- p-quinone methide
- / terminal alkyne
- / 1, 6-addition
-
对亚甲基苯醌结构单元(p-QM)广泛存在于真菌代谢物和植物色素等具有生物活性的天然产物分子中,同时也是许多生物化学过程,如木质素的生化合成的关键活性中间体[1]。p-QM具有独特的分子结构,即连续共轭的环己二烯酮和环外双键(Scheme 1);羰基的极化和恢复芳香性的趋势赋予其良好的亲电性,因而自其被发现的百余年来,引起了广泛的研究。其典型的反应模式有1, 6-共轭加成反应[2-8]、[4+2]环化反应[9-11]和[3+2]环化反应[12-13]。
 Figure Scheme 1.
Structure of p-quinone methide(p-QM) and representative natural products contain p-QM core
Figure Scheme 1.
Structure of p-quinone methide(p-QM) and representative natural products contain p-QM core
Selaginellin系列天然产物是从卷柏Selaginella tamariscina(Beauv.) Spring[14]和中华卷柏Selaginella sinensis(Desv.) Spring[15]中分离到的一类新型骨架结构天然炔酚化合物(Scheme 1),是卷柏的特征活性成分之一,具有抗衰老、抗肿瘤、抗氧化和抗炎等生物活性[16-17]。在对Selaginellin系列天然产物的全合成研究中,我们需要用到端炔对p-QM的1, 6-共轭加成反应来构筑二芳基对亚甲基苯醌结构单元。虽然关于p-QM的1, 6-共轭加成已有大量的研究[2-8],但是端炔对p-QM的1, 6-共轭加成反应未见文献报道。
1 实验部分
1.1 仪器和试剂
AVANCE Ⅲ 300 MHz型核磁共振谱仪(德国Bruker公司);micrOTOF-Q Ⅱ型高分辨率质谱仪(德国Bruker公司)。
所用溶剂经Pure Solv溶剂处理系统(美国Innovative Technology公司)除氧干燥后使用;试剂均为分析纯,端炔经蒸馏或减压蒸馏,再用4Å分子筛干燥后使用;柱层析硅胶(38~62 μm,加拿大Silicycle公司)。
1.2 对亚甲基苯醌的合成
对亚甲基苯醌1a~1i按文献[2]报道方法合成。
1.3 实验方法
在Ar气保护下,将端炔(0.85 mmol)和1.0 mL THF加入5 mL烧瓶,冷却到0 ℃;滴加2.5 mol/L正丁基锂正己烷溶液(0.30 mL,0.75 mmol),加完反应5 min。将p-QM(0.50 mmol)和1.0 mL THF加入到10 mL烧瓶中,于0 ℃搅拌溶解。用双头针头将上述炔锂溶液转移到10 mL烧瓶,再用THF润洗烧瓶(0.5 mL×2) 并转移到10 mL烧瓶中。保持0 ℃反应直至p-QM消失(TLC监测),加饱和NH4Cl溶液淬灭,用CH2Cl2萃取,有机相用饱和NaCl溶液洗涤,无水MgSO4干燥,过滤,浓缩,硅胶柱层析得到化合物3。
化合物3a:白色固体,1H NMR(300 MHz, CDCl3), δ:7.46~7.18(m, 5H), 7.23(s, 2H), 5.12(s, 1H), 4.93(s, 1H), 2.32(td, J=6.7, 2.0 Hz, 2H), 1.69~1.50(m, 4H), 1.44(s, 18H), 0.96(t, J=7.1 Hz, 3H); 13C NMR(75 MHz, CDCl3), δ:152.6, 143.2, 135.7, 133.0, 128.5, 127.9, 126.5, 124.6, 84.6, 81.6, 43.3, 34.5, 31.3, 30.4, 22.2, 18.8, 13.8;HRMS(ESI)计算值C27H37O [M+H]+:377.2839, 实测值:377.2843。
化合物3b:白色固体,1H NMR(300 MHz, CDCl3), δ:7.59(d, J=8.3 Hz, 2H), 7.48(d, J=8.3 Hz, 2H), 7.14(s, 2H), 5.16(s, 1H), 4.92(s, 1H), 2.29(td, J=6.8, 2.1 Hz, 2H), 1.68~1.43(m, 4H), 1.41(s, 18H), 0.93(t, J=7.1 Hz, 3H); 13C NMR(75 MHz, CDCl3), δ:152.9, 148.5, 136.1, 132.3, 131.5, 128.5, 124.4, 119.0, 110.3, 85.7, 80.1, 43.3, 34.4, 31.0, 30.3, 30.2, 22.0, 18.6, 13.7;HRMS(ESI)计算值C28H36NO [M+H]+:402.2791, 实测值:402.2794。
化合物3c:白色固体,1H NMR(300 MHz, CDCl3), δ:8.19(d, J=8.7 Hz, 2H), 7.58(d, J=8.7 Hz, 2H), 7.21(s, 2H), 5.22(s, 1H), 5.02(s, 1H), 2.34(td, J=6.7, 2.0 Hz, 2H), 1.68~1.50(m, 4H), 1.50(s, 18H), 0.97(t, J=7.1 Hz, 3H); 13C NMR(75 MHz, CDCl3), δ:153.0, 150.7, 146.7, 136.2, 131.4, 128.7, 124.5, 123.8, 86.1, 80.0, 43.2, 34.5, 31.1, 30.3, 22.1, 18.7, 13.8;HRMS(ESI)计算值C27H36NO3 [M+H]+:422.2690, 实测值:422.2695。
化合物3d:白色固体,1H NMR(300 MHz, CDCl3), δ:7.67(td, J=7.5, 2.1 Hz, 1H), 7.39(s, 2H), 7.32~7.14(m, 2H), 7.09(m, 1H), 5.40(t, J=2.4 Hz, 1H), 5.21(s, 1H), 2.40(dt, J=6.8, 3.4 Hz, 2H), 1.80~1.58(m, 4H), 1.54(s, 18H), 1.05(t, J=7.0 Hz, 3H); 13C NMR(75 MHz, CDCl3), δ:159.9(d, J=244.5 Hz), 152.7, 135.8, 132.0, 130.5(d, J=14.2 Hz), 129.5(d, J=3.9 Hz), 128.2(d, J=8.1 Hz), 124.5(d, J=1.1 Hz), 124.4(d, J=3.5 Hz), 115.4(d, J=22.1 Hz), 84.2, 80.6, 36.0(d, J=3.5 Hz), 34.5, 31.2, 30.4, 22.2, 18.7, 13.8;HRMS(ESI)计算值C27H36FO [M+H]+:395.2745, 实测值:395.2749。
化合物3e:白色固体,1H NMR(300 MHz, CDCl3), δ:7.33(d, J=8.6 Hz, 2H), 7.27(d, J=8.6 Hz, 2H), 7.18(s, 2H), 5.14(s, 1H), 4.88(s, 1H), 2.31(td, J=6.7, 2.1 Hz, 2H), 1.61~1.47(m, 4H), 1.44(s, 18H), 0.95(t, J=7.1 Hz, 3H); 13C NMR(75 MHz, CDCl3), δ:152.7, 141.8, 135.9, 132.5, 132.3, 129.2, 128.6, 124.5, 85.1, 81.1, 42.7, 34.5, 31.2, 30.4, 22.1, 18.8, 13.8;HRMS(ESI)计算值C27H36ClO [M+H]+:411.2449, 实测值:411.2455。
化合物3f:白色固体,1H NMR(300 MHz, CDCl3), δ:7.29(d, J=8.0 Hz, 2H), 7.23(s, 2H), 7.13(d, J=8.0 Hz, 2H), 5.10(s, 1H), 4.88(s, 1H), 2.34(s, 3H), 2.30(td, J=6.8, 2.2 Hz, 2H), 1.47~1.61(m, 4H), 1.44(s, 18H), 0.95(t, J=7.1 Hz, 3H); 13C NMR(75 MHz, CDCl3), δ:152.5, 140.4, 136.0, 135.7, 133.1, 129.2, 127.7, 124.5, 84.3, 81.7, 43.0, 34.5, 31.3, 30.4, 22.2, 21.1, 18.8, 13.8;HRMS(ESI)计算值C28H39O [M+H]+:391.2995, 实测值:391.3001。
化合物3g:白色固体,1H NMR(300 MHz, CDCl3), δ:7.24(d, J=8.7 Hz, 2H), 7.21(s, 2H), 6.70(d, J=8.7 Hz, 2H), 5.07(s, 1H), 4.82(s, 1H), 2.92(s, 6H), 2.28(dt, J=6.8, 3.3 Hz, 2H), 1.63~1.46(m, 4H), 1.42(s, 18H), 0.93(s, 3H); 13C NMR(75 MHz, CDCl3), δ:152.4, 149.5, 135.6, 133.6, 131.6, 128.4, 124.5, 112.9, 100.1, 84.0, 82.2, 42.4, 41.0, 34.5, 31.4, 30.4, 22.2, 18.9, 13.8;HRMS(ESI)计算值C29H42NO [M+H]+:420.3261, 实测值:420.3158。
化合物3h:白色固体,1H NMR(300 MHz, CDCl3), δ:7.45~7.22(m, 5H), 7.04(s, 2H), 5.69(d, J=3.0 Hz, 1H), 2.59(d, J=3.0 Hz, 1H), 2.54(t, J=6.8 Hz, 2H), 2.43(s, 6H), 1.61(m, 4H), 1.01(t, J=7.2 Hz, 3H); 13C NMR(75 MHz, CDCl3), δ:201.0, 143.8, 142.4, 140.3, 128.5, 127.5, 126.6, 124.8, 123.2, 99.1, 78.1, 76.1, 31.2, 22.1, 21.3, 19.5, 13.7;HRMS(ESI)计算值C21H25O [M+H]+:293.1900, 实测值:293.1902。
化合物3i:白色固体,1H NMR(300 MHz, CDCl3), δ:7.87(d, J=8.1 Hz, 2H), 7.53(d, J=2.3 Hz, 1H), 7.47(d, J=8.2 Hz, 2H), 7.18(s, 1H), 7.01(d, J=2.4 Hz, 1H), 2.99(s, 1H), 2.30(t, J=7.0 Hz, 4H), 1.62~1.47(m, 4H), 1.47~1.35(m, 4H), 1.33(s, 9H), 1.30(s, 9H), 0.91(t, J=7.2 Hz, 6H); 13C NMR(75 MHz, CDCl3), δ:186.6, 149.5, 147.9, 143.8, 142.1, 135.9, 135.2, 132.2, 130.5, 127.8, 126.4, 100.1, 86.3, 80.9, 65.0, 35.6, 35.1, 30.5, 29.7, 29.6, 22.1, 18.6, 13.7;HRMS(ESI)计算值C34H44O2 [M+H]+:485.3414, 实测值:485.3415。
化合物3j:白色固体,1H NMR(300 MHz, CDCl3), δ:7.66~7.56(m, 4H), 7.50~7.31(m, 8H), 5.29(s, 1H), 5.27(s, 1H), 1.57(s, 18H); 13C NMR(75 MHz, CDCl3), δ:152.8, 142.5, 135.9, 132.3, 131.7, 128.6, 128.3, 127.9, 126.8, 124.7, 123.9, 91.3, 84.5, 43.8, 34.5, 30.4;HRMS(ESI)计算值C29H33O [M+H]+:397.2526, 实测值:397.2524。
化合物3k:白色固体,1H NMR(300 MHz, CDCl3), δ:7.52~7.24(m, 5H), 7.32(s, 2H), 5.19(s, 1H), 5.03(s, 1H), 1.50(s, 18H), 0.30(s, 9H); 13C NMR(75 MHz, CDCl3), δ:152.7, 142.3, 135.8, 131.9, 128.6, 127.9, 126.7, 124.6, 107.8, 88.6, 44.1, 34.6, 30.4, 0.3;HRMS(ESI)计算值C26H37OSi [M+H]+:393.2608, 实测值:393.2611。
化合物3l:白色固体,1H NMR(300 MHz, CDCl3), δ:7.43~7.22(m, 5H), 7.18(s, 2H), 5.14(s, 1H), 4.99(s, 1H), 4.27(d, J=2.0 Hz, 2H), 3.57(t, J=6.6 Hz, 2H), 1.66~1.53(m, 2H), 1.42(s, 18H), 1.44~1.34(m, 2H), 0.93(t, J=7.3 Hz, 3H); 13C NMR(75 MHz, CDCl3), δ:152.7, 142.2, 135.8, 132.1, 128.5, 127.8, 126.7, 124.5, 87.6, 80.4, 69.7, 58.7, 43.2, 34.4, 31.7, 30.3, 19.4, 14.0;HRMS(ESI)计算值C28H39O2 [M+H]+:407.2945, 实测值:407.2941。
化合物3m:白色固体,1H NMR(300 MHz, CDCl3), δ:7.50~7.20(m, 5H), 7.18(s, 2H), 5.11(s, 1H), 4.90(s, 1H), 3.79(t, J=7.4 Hz, 2H), 2.52(td, J=7.4, 2.3 Hz, 2H), 1.42(s, 18H), 0.91(s, 9H), 0.07(s, 6H); 13C NMR(75 MHz, CDCl3), δ:152.6, 142.8, 135.8, 132.7, 128.5, 127.9, 126.6, 124.6, 82.8, 81.2, 62.5, 43.3, 34.5, 30.4, 26.1, 23.6, 18.5, -5.1;HRMS(ESI)计算值C31H46O2Si [M+H]+:479.3340, 实测值:479.3337。
化合物3n:白色固体,1H NMR(300 MHz, CDCl3), δ:7.46~7.20(m, 6H), 7.16(s, 2H), 5.12(s, 1H), 4.95(d, J=2.2 Hz, 1H), 3.75(t, J=4.7 Hz, 5H), 3.41(d, J=2.2 Hz, 2H), 2.70~2.57(m, 4H), 1.40(s, 19H); 13C NMR(75 MHz, CDCl3), δ: 152.6, 142.3, 135.8, 132.2, 128.5, 127.8, 126.6, 124.4, 87.1, 78.4, 66.8, 52.3, 47.8, 43.2, 34.4, 30.3;HRMS(ESI)计算值C28H38NO2 [M+H]+:420.2897, 实测值:420.2895。
2 结果与讨论
2.1 反应条件的确立
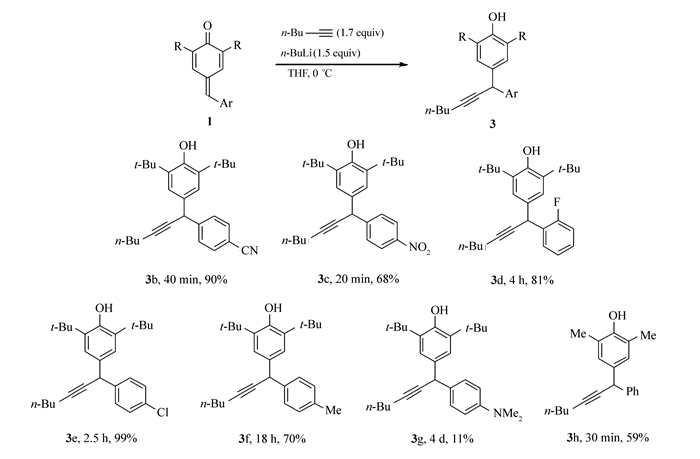
我们用p-QM化合物1a和正己炔作为模型底物来优化1, 6-共轭加成反应条件(表 1)。在有机碱和一价铜盐存在的条件下,未得到希望的加成产物3a(Entry 1~3)。此外,使用烷基格氏试剂对端炔拔氢,再与化合物1a混合,也未见反应产物(Entry 4, 5)。最后,使用1.5化学计量的正丁基锂将端炔完全转化为炔锂,可以与化合物1a发生预期的1, 6-共轭加成反应,并以95%产率得到产物3a(Entry 6)。降低炔锂的量导致产率降低(Entry 7)。因此,确立Entry 6作为考察底物适用性的反应条件。
2.2 底物适用性及局限性
确定了反应条件之后,我们考察了此反应的底物适用范围及其局限。首先研究了p-QM苯环上的取代基对反应的影响(Scheme 2)。当苯醌环上有吸电子基团存在时,考察的反应均可在40 min之内完成,产率可达90% (Scheme 2, 化合物3b, 3c);而取代基为卤素时,也可以得到高产率的相应产物,但是反应需要延长到数小时才能完成(Scheme 2, 化合物3d, 3e);当取代基为给电子基团时,反应时间延长至18 h,甚至4 d,TLC监测反应发现原料仍然有剩余,表明反应进行不完全(Scheme 2, 化合物3f, 3g)。此反应表现出可逆性,其产率由反应的热力学平衡常数决定。类似的p-QM的1, 6-加成反应的可逆性早有文献报道[1, 18]。因此,p-QM苯醌环上取代基对此反应的速率和产率具有显著的影响,表现出明显的电子效应。
对于羰基邻位为二甲基的稳定p-QM 1h,也可得到1, 6-加成产物3h,产率为59%。由于羰基位阻变小,有1, 2-加成产物生成,因而只得到中等产率的1, 6-加成产物3h。
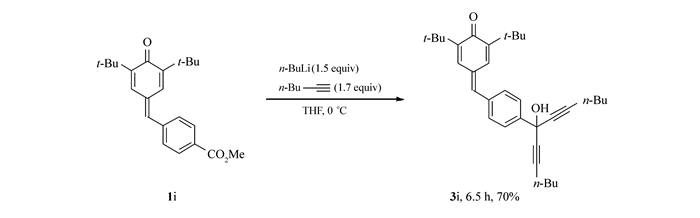
此外,当p-QM苯环上有较强亲电性的基团,如酯基存在时,没有期望的产物生成,而是生成了叔醇3i,p-QM的取代亚甲基没有发生反应(Scheme 3)。可见p-QM环外亚甲基的亲电性弱于酯。由此可推测,此反应对分子中含有羰基的p-QM也不适用。
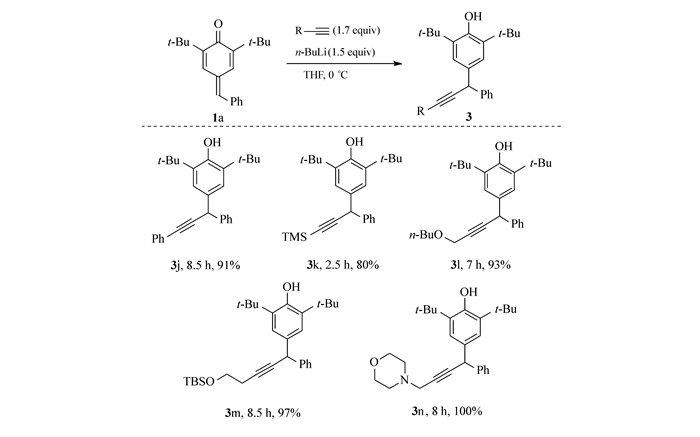
最后,对端炔的适用范围进行了研究。如Scheme 4所示,端炔对此反应的影响很小。苯乙炔(3j)、三甲硅基乙炔(3k)、正丁基炔丙醚(3l)、TBS保护的3-丁炔醇(3m)和N-炔丙基吗啉(3n)均可以反应,得到高产率的相应产物。我们尝试直接用3-丁炔醇发生加成反应,但是在羟基未被保护的情况下,3-丁炔醇被n-BuLi拔氢形成的双负离子在THF中溶解性差,反应很慢且转化率低;而用TBS保护的3-丁炔醇则可以得到97%产率的产物3m。
3 结论
端炔与对亚甲基苯醌的1, 6-共轭加成反应可得到产率范围为11%~100%的二芳甲基炔。对亚甲基苯醌苯环上的取代基对此反应的速率和产率有显著影响:与给电子取代基相比,吸电子取代基加速反应,并且可以较高的产率得到相应的二芳甲基炔;而端炔的取代基对反应的影响很小。此合成方法将应用于Selaginellin系列天然产物的全合成。
辅助材料(Supporting Information)[产物的1H NMR和13C NMR谱图]可以免费从本刊网站(http://yyhx.ciac.jl.cn/)下载。
-
-
[1]
Turner A B. Quinone Methides[J]. Q Rev, Chem Soc, 1964, 18(4): 347-360. doi: 10.1039/qr9641800347
-
[2]
Chu W D, Zhang L F, Bao X. Asymmetric Catalytic 1, 6-Conjugate Addition/Aromatization of para-Quinone Methides:Enantioselective Introduction of Functionalized Diarylmethine Stereogenic Centers[J]. Angew Chem Int Ed, 2013, 52(35): 9229-9233. doi: 10.1002/anie.201303928
-
[3]
Caruana L, Kniep F, Johansen T K. A New Organocatalytic Concept for Asymmetric α-Alkylation of Aldehydes[J]. J Am Chem Soc, 2014, 136(45): 15929-15932. doi: 10.1021/ja510475n
-
[4]
Wang Z, Wong Y F, Sun J. Catalytic Asymmetric 1, 6-Conjugate Addition of para-Quinone Methides:Formation of All-Carbon Quaternary Stereocenters[J]. Angew Chem Int Ed, 2015, 54(46): 13711-13714. doi: 10.1002/anie.201506701
-
[5]
Lou Y, Cao P, Jia T. Copper-Catalyzed Enantioselective 1, 6-Boration of para-Quinone Methides and Efficient Transformation of gem-Diarylmethine Boronates to Triarylmethanes[J]. Angew Chem Int Ed, 2015, 54(41): 12134-12138. doi: 10.1002/anie.201505926
-
[6]
Dong N, Zhang Z P, Xue X S. Phosphoric Acid Catalyzed Asymmetric 1, 6-Conjugate Addition of Thioacetic Acid to para-Quinone Methides[J]. Angew Chem Int Ed, 2016, 55(4): 1460-1464. doi: 10.1002/anie.201509110
-
[7]
Lopez A, Parra A, Jarava-Barrera C. Copper-catalyzed Silylation of p-Quinone Methides:New Entry to Dibenzylic Silanes[J]. Chem Commun, 2015, 51(100): 17684-17687. doi: 10.1039/C5CC06653K
-
[8]
Jarava-Barrera C, Parra A, López A. Copper-Catalyzed Borylative Aromatization of p-Quinone Methides:Enantioselective Synthesis of Dibenzylic Boronates[J]. ACS Catal, 2016, 6(1): 442-446. doi: 10.1021/acscatal.5b02742
-
[9]
Hatchard W R. Syntheses by Free-radical Reactions.Ⅶ.The Reaction of 2, 6-Di-t-butyl-4-methylphenol and 2, 6-Di-t-butyl-4-isopropylphenol with Chloroprene[J]. J Am Chem Soc, 1958, 80(14): 3640-3642. doi: 10.1021/ja01547a042
-
[10]
McClure J D. Synthesis of Spiroundecatrienones from 2, 6-Di-t-butylquinone Methide and Butadienes[J]. J Org Chem, 1962, 27(7): 2365-2368. doi: 10.1021/jo01054a018
-
[11]
Roper J M, Everly C R. Direct Synthesis of Spiro[5.5] undeca-1, 4, 7-trienones from Phenols via a Quinone Methide Intermediate[J]. J Org Chem, 1988, 53(11): 2639-2642. doi: 10.1021/jo00246a050
-
[12]
Angle S R, Arnaiz D. Formal[3+2] Cycloaddition of Benzylic Cations with Alkenes[J]. J Org Chem, 1992, 57(22): 5937-5947. doi: 10.1021/jo00048a029
-
[13]
Kim S, Kitano Y, Tada M. Alkylindan Synthesis via an Intermolecular[3+2] Cycloaddition Between Unactivated Alkenes and in situ Generated p-Quinomethanes[J]. Tetrahedron Lett, 2000, 41(36): 7079-7083. doi: 10.1016/S0040-4039(00)01216-8
-
[14]
Zhang L P, Liang Y M, Wei X C. A New Unusual Natural Pigment from Selaginella sinensis and Its Noticeable Physicochemical Properties[J]. J Org Chem, 2007, 72(10): 3921-3924. doi: 10.1021/jo0701177
-
[15]
Cheng X L, Ma S C, Yu J D. Selaginellin A and B, Two Novel Natural Pigments Isolated from Selaginella tamariscina[J]. Chem Pharm Bull, 2008, 56(7): 982-984. doi: 10.1248/cpb.56.982
-
[16]
谭桂山. 垫状卷柏化学成分及Selaginellin抗衰老作用于机制研究[D]. 长沙: 中南大学, 2007.TAN Guishan. Studies on Chemical Constituent from Selaginella Pulvinata Maxim and Effect of Selaginellin on Senescence of Endothelial Cells[D]. Changsha:Central South University, 2007(in Chinese).
-
[17]
曾庆海, 涂超, 范凡. 中药卷柏抗肿瘤作用及新型炔酚类化合物Selaginellin的研究进展[J]. 肿瘤药学, 2012,2,(6): 402-406. ZENG Qinghai, TU Chao, FAN Fan. Research Progress of Selaginellin and the Antitumor Activity of Selaginella[J]. Anti-tumor Pharm, 2012, 2(6): 402-406.
-
[18]
Zanarotti A. Synthesis and Reactivity of Vinyl Quinone Methides[J]. J Org Chem, 1985, 50(7): 941-945. doi: 10.1021/jo00207a006
-
[1]
-
表 1 反应条件的优化
Table 1. Optimization of reaction conditions

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 617
- HTML全文浏览量: 142


 下载:
下载:



 下载:
下载:

