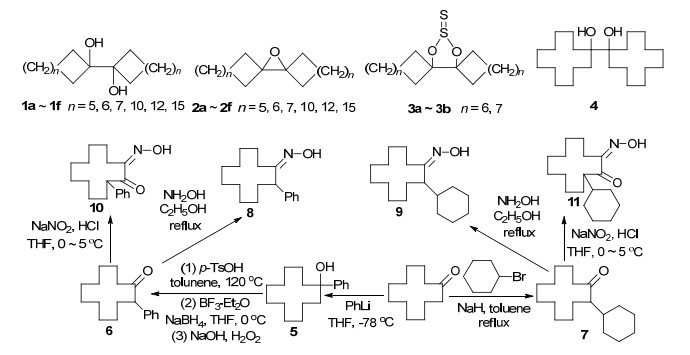
 图 图式1
标题化合物的合成路线
Figure 图式1.
Synthetic route of title compounds
图 图式1
标题化合物的合成路线
Figure 图式1.
Synthetic route of title compounds

Citation: Yang Mingyan, Zhang Xiaoteng, Wang Daoquan, Wang Mingan. Synthesis and Crystal Structure of 2-Phenyl/cyclohexyl Cyclododecane Oxime Derivatives[J]. Chinese Journal of Organic Chemistry, 2015, 36(2): 399-405. doi: 10.6023/cjoc201509025

2-苯基/环己基取代环十二酮肟衍生物的合成及晶体结构
-
关键词:
- 环十二酮肟
- / 1, 2-环十二二酮单肟
- / [3333]构象
- / [3333]-2-酮
- / [4233]-3, 4-二酮
English
Synthesis and Crystal Structure of 2-Phenyl/cyclohexyl Cyclododecane Oxime Derivatives
-
近年来在环十二烷或环十二酮衍生物的相关化学研究中出现了一些引人关注的新成果, 如Hamama等[1]系统总结了环十二酮的反应特征及其在复杂结构包括天然产物合成中的应用, O'Hagan等[2]研究了在环十二烷分子中CF2取代对十二元环构象的影响, Sathiyanarayanan等[3, 4]在超分子螺旋设计中引入环十二酮羟醛缩合衍生物和大环Mannich衍生物以及Khorasani等[5]关于环十二烷衍生物固态优势构象唯一性的深入分析.本课题组[6]对取代环十二烷或环十二酮的衍生物立体化学特别是构象分析进行了深入的研究, 发现在多取代环十二酮衍生物中p-π, π-π相互作用和体积效应是改变十二元环构象的主要因素, 前文[7]分别对2-取代环十二酮肟和3-取代-1, 2-环十二二酮单肟的构象进行了分析, 发现部分化合物由于取代基的性质差异已经改变了母体环十二酮的骨架构象, 但是并未涉及电子效应更明显的2-苯基(环己基)环十二酮肟和3-苯基(环己基)-1, 2-环十二二酮单肟的构象是否发生改变.在对2-苯基(环己基)环十二酮进行的还原反应中, 已经观察到苯基和环己基电子效应差异对羰基还原反应选择性的影响[8], 为此本文作者希望观察苯基和环己基的差异对羰基成肟反应以及亚硝酸钠-盐酸体系的亚硝化成肟反应产物构象的影响.
1, 1'-二羟基-1, 1'-联环烷(1)和1, 1'-环氧-1, 1'-联环烷(2)已有文献报道[9, 10], 但是没有报道它们的晶体结构, 迄今只报道了其中两个硫羰基亚硫酸酯衍生物3的晶体结构, 发现六元环和七元环的优势构象没有改变, 两个羟基在同一个方向形成硫羰基亚硫酸酯但具有一个45°的O—C—C—O二面角以维持亚硫酸酯五元环的优势构象[11, 12], 至于在1分子中这些环烷将采取哪种优势构象以及两个羟基在空间的取向如何尚没有明确的实验证据.作者曾制备了两个1, 1'-联环十二烷衍生物并获得了它们的晶体结构[13], 在此基础上系统总结了1, 1'-联环十二烷及其衍生物化学的研究进展[14], 但没有关于1, 1'-联环十二烷衍生物详细结构的研究报道.作者在进一步探索取代环十二酮衍生物的立体化学中, 通过环十二酮和溴代环己烷在氢化钠作碱的条件下反应合成2-环己基环十二酮, 除得到主要产物外还意外得到了1, 1'-二羟基-1, 1'-联环十二烷4, 获得了它的单晶.本文旨在通过X射线衍射方法阐明该化合物分子中两个十二元环将采取何种优势构象、两个羟基在空间的取向, 以及在晶体结构中的分子自组装特性.化合物的合成路线见Scheme 1.
1 结果与讨论
1.1 化合物的合成
化合物8和10的收率比化合物9和11的收率高29%~30%, 这可能与苯基的电子效应有关, 与文献[8]观察到因苯基的电子效应导致对2-取代环十二酮羰基还原反应具有更好的选择性相一致.化合物4是合成中间体7时意外得到的化合物, Alex等[15]首先在1981年报道环十二酮在吡啶和四氢呋喃中经金属钛还原生成了16%的4和31%的1, 1'-联环十二-1(1')-烯, 而Ji等[16]在1999年则报道环十二酮的醇或水溶液在高压汞灯辐照下以85%收率制得4, 但并没有它的详细结构表征.在文献[15, 16]中化合物4是通过金属钛或光照下的自由基偶联生成的, 初步推测在本文条件下少量环十二酮也会被诱导产生自由基而发生偶联生成1, 1'-二羟基-1, 1'-联环十二烷(4).
1.2 化合物的晶体结构和构象分析
化合物4, 5, 9, 10的晶体结构图见图 1, 结构参数见表 1, 二面角见表 2.
Parameter 4 5 9 10 CCDC numbers 921345 1424717 1424718 1424719 Crystal size/mm3 0.80×0.15×0.15 0.35×0.35×0.35 0.70×0.40×0.30 0.50×0.25×0.15 Empirical formula C24H46O2 C18H28O C18H33NO C18H25NO2 Formula weight 366.61 260.40 279.45 287.39 Temperature/K 101.7 102.9 103.6 100.2 Crystal system Triclinic Trigonal Triclinic Triclinic Space group P-1 R-3 P-1 P-1 a/nm 0.52862(4) 2.62927(13) 0.61733(10) 0.56782(11) b/nm 0.77468(8) 2.62927(13) 1.15835(18) 1.1973(2) c/nm 1.36129(9) 1.17390(4) 1.24643(19) 1.2148(2) α/(°) 81.952(7) 90.00 76.118(13) 99.556(15) β/(°) 81.606(6) 90.00 86.959(13) 99.960(15) γ/(°) 77.327(8) 120.00 83.791(13) 99.350(16) V/nm3 0.53468(8) 7.0280(6) 0.8599(2) 0.7865(3) Z 1 18 2 2 ρcalc/(mg·mm-3) 1.139 1.107 1.079 1.214 μ/mm-1 0.069 0.066 0.065 0.078 F(000) 206 2592 312 312 2q range/(°) 7.70~52 7.82~51.98 6.64~52 6.96~52 Index ranges -6≤h≤6 -15≤h≤31 -7≤h≤7 -7≤h≤7 -9≤k≤9 -32≤k19 -14≤k≤14 -14≤k≤14 -16≤l≤16 -14≤l≤8 -14≤l≤15 -14≤l≤14 Reflections collected 3417 5202 5667 9912 Independent reflections R(int) 3417 (0.0000) 3068 (0.0201) 3384 (0.0297) 3074 (0.0497) Data/restraints/parameters 3417/0/120 3068/0/173 3384/0/182 3074/16/195 R1, wR2 [I>2σ(I)] 0.0453, 0.1100 0.0434, 0.0864 0.0467, 0.1146 0.2001, 0.5677 R1, wR2 [all data] 0.0635, 0.1161 0.0613, 0.0946 0.0552, 0.1220 0.2149, 0.5795 Largest diff. peak/hole/(e·nm-3) 253/-232 270/-193 337/-223 651/-734 Completeness 0.996 0.996 0.999 0.999 表 1 化合物4, 5, 9和10的晶体结构参数
Table 1. The parameters of 4, 5, 9and 10 in their crystal structures 表 2
环十二烷, 环十二酮, 4, 5, 9和10在晶体结构中的二面角(°)
Table 2.
The torsional angles (°) in the crystal structures of cyclododecane, cyclododecanone, 4, 5, 9and 10
表 2
环十二烷, 环十二酮, 4, 5, 9和10在晶体结构中的二面角(°)
Table 2.
The torsional angles (°) in the crystal structures of cyclododecane, cyclododecanone, 4, 5, 9and 10
Angle [3333][21] 4 5 [3333]-2-one[22] 9 10 C(1)—C(2)—C(3)—C(4) 160.0 166.04 156.72 148.0 148.22 161.71 C(2)—C(3)—C(4)—C(5) -71.0 -75.49 -69.38 -60.0 -69.76 -136.77 C(3)—C(4)—C(5)—C(6) -71.0 -74.01 -71.20 -70.0 -67.78 54.05 C(4)—C(5)—C(6)—C(7) 159.0 154.87 164.53 176.0 174.59 65.20 C(5)—C(6)—C(7)—C(8) -66.0 -62.88 -67.51 -67.0 -68.89 -171.46 C(6)—C(7)—C(8)—C(9) -66.0 -62.06 -65.29 -69.0 -68.75 57.75 C(7)—C(8)—C(9)—C(10) 160.0 166.80 157.07 146.0 147.74 56.92 C(8)—C(9)—C(10)—C(11) -71.0 -70.88 -69.36 -69.0 -66.19 -168.66 C(9)—C(10)—C(11)—C(12) -71.0 -74.07 -69.35 -69.0 -71.07 89.75 C(10)—C(11)—C(12)—C(1) 159.0 155.34 166.08 172.0 171.11 78.60 C(11)—C(12)—C(1)—C(2) -66.0 -66.17 -54.13 -65.0 -66.94 -69.14 C(12)—C(1)—C(2)—C(3) -66.0 -62.74 -65.71 -76.0 -72.28 -67.01 表 2 环十二烷, 环十二酮, 4, 5, 9和10在晶体结构中的二面角(°)
Table 2. The torsional angles (°) in the crystal structures of cyclododecane, cyclododecanone, 4, 5, 9and 10在图 1所示化合物4和5的晶体结构和表 2所示的环十二烷骨架的二面角与环十二烷相应的特征二面角比较, 发现1-苯基环十二醇以及1, 1'-二羟基-1, 1'-联环十二烷的十二元环均采取与环十二烷及其衍生物相同的[3333]优势构象[8, 13, 18~20], 与文献[6e]合成的环十二烷衍生物以及两个1, 1'-联环十二烷衍生物的晶体结构中十二元环采取的[3333]优势构象也完全一致, 这说明十二元环并没有因为两个羟基或苯基相对较大的体积效应而改变其[3333]优势构象.在4的晶体结构中两个羟基间的O—C—C—O二面角为180°, 最大程度地保持分离而维持了母环的优势构象, 同样在前文中的两个1, 1'-联环十二烷衍生物中两个1, 1'位质子或一个1位质子与1'羟基间的二面角也为180°, 说明这类1, 1'-联环十二烷衍生物的两个1, 1'位基团总是处在对位交叉式的构象是其局部优势构象, 同时也不影响母环的[3333]优势构象, 这与硫羰基亚硫酸酯衍生物3的晶体结构中两个含氧基团取向完全不同.在硫羰基亚硫酸酯衍生物3中, 两个含氧基团处于邻位交叉式构象, 因此推断在原来的化合物1中两个羟基处于对位交叉式构象, 两个羟基在反应生成硫羰基亚硫酸酯衍生物3的过程中发生C—C单键旋转成为邻位交叉式构象.
在图 1所示化合物9和10的晶体结构和表 2所示的环十二酮骨架的二面角与环十二酮相应的特征二面角比较, 发现化合物9的十二元环保持了良好的[3333]-2-酮优势构象, 与文献[7b]观察到的大多数2-取代环十二酮肟的十二元环骨架构象一致, 而化合物10的十二元环则改变为[4233]-3, 4-二酮优势构象, 与文献[7a]观察到的大多数3-取代-1, 2-环十二二酮单肟的十二元环骨架仍保持[3333]-2, 3-二酮构象并不相同, 与3-苯磺酰基-1, 2-环十二二酮单肟的十二元环骨架的[4233]-3, 4-二酮构象一致.按照角位羰基参与反应的原理, 苯基和环己基不能与羰基以及羟胺形成氢键, 生成肟时应得到取代基在羰基角碳反向位的肟, 这与化合物9的晶体结构中环己基位于边碳外向位不吻合.由于未能获得化合物8和11的晶体, 本文通过量子力学计算的方法[7a, 8]获得了化合物8~11的理论预测构象. 表 3结果显示, 化合物8和9的低能构象十二元环骨架均保持了良好的[3333]-2-酮优势构象, 苯基和环己基位于边碳外向位的构象比位于角碳反向位的构象能量低, 由此说明苯基和环己基位于边碳外向位的[3333]-2-酮构象是其优势构象, 与化合物9的晶体结构中观察到的结果吻合, 但是化合物9的晶体结构显示C=N双键构型为E式, 而2-乙基环十二酮肟的晶体结构显示C=N双键构型为Z式[7b], 因此推断2-苯基(环己基)环十二酮与羟胺反应先生成苯基(环己基)位于羰基角碳反向位的肟, 由于C=N双键构型的改变使得十二元环骨架经历类似环十二酮的Cs假旋得到边碳外向位取代的[3333]-2-酮构象; 而化合物10和11的十二元环骨架均改变为[4233]-3, 4-二酮且苯基和环己基均位于边碳外向位的低能构象比保持了[3333]-2, 3-二酮且苯基和环己基位于角碳反向位的构象能量低, 由此说明苯基和环己基位于边碳外向位的[4233]-3, 4-二酮构象是其优势构象[7a], 其C=N双键构型均为E式, 与化合物10的晶体结构中观察到的结果相吻合.
 表 3
化合物8~11量子力学优化低能构象的相对能量(kJ/mol)
Table 3.
The relative energy (kJ/mol) of optimized conformation for compounds 8~11by
表 3
化合物8~11量子力学优化低能构象的相对能量(kJ/mol)
Table 3.
The relative energy (kJ/mol) of optimized conformation for compounds 8~11byquantum mechanics Compd. corner-anti-[3333]-2-one side-exo-[3333]-2-one corner-anti-[3333]-2, 3-dione side-exo-[4233]-3, 4-dione 8 6.19 0.00 - - 9 2.64 0.00 - - 10 - - 10.51 0.00 11 - - 1.03 0.00 表 3 化合物8~11量子力学优化低能构象的相对能量(kJ/mol)
Table 3. The relative energy (kJ/mol) of optimized conformation for compounds 8~11byquantum mechanics 1.3 化合物4的分子自组装特性
在图 2所示化合物4的晶体结构中, 图 2(a)显示平视所有分子均依靠范德华作用力采取完全平行的排列方式, 沿b轴方向两分子间的质子-质子最小距离为0.2499 nm, 侧视所有分子也依靠范德华作用力采取完全平行的排列方式, 沿c轴方向两分子间的质子-质子最小距离为0.2395 nm, 这与其它取代环十二烷或环十二酮衍生物的晶体结构中分子间采取的平行或反平行的排列方式非常相似, 但是图 2(b)从俯视角度观察所有分子沿a轴方向采用分子间氢键(表 4)呈现类似摞光盘一样完全重叠的自组装排列方式, 沿a轴方向两分子间的氧原子-氧原子最小距离为0.3132 nm, 碳环质子-碳环质子最小距离为0.2574 nm, 这在其它取代环十二烷或环十二酮衍生物的晶体结构中尚未观察到这种自组装特性, 而在其它一些大环化合物中已经观察到这种重要的自组装行为并在生物体内的离子传输过程中具有重要的应用[23].
D—H D—H/nm H…A/nm DHA/(°) D…A/nm A O(1)—H(1) 0.0840 0.2297 173.21 0.3132 O(1) [-x+1, -y+1, -z] 表 4 在4晶体结构中的氢键
Table 4. Hydrogen bond in the crystal structure of 42 结论
2-苯基(环己基)环十二酮肟的十二元环保持了[3333]-2-酮优势构象, 取代基位于边碳外向位; 3-苯基(环己基)-1, 2-环十二二酮单肟的十二元环则改变为[4233]-3, 4-二酮优势构象, 取代基也位于边碳外向位.苯基和环己基的不同对2-取代环十二酮的羰基成肟反应以及亚硝酸钠-盐酸体系的亚硝化成肟反应产物间的构象没有产生明显差异, 但与2-硝基和2-乙氧羰基相比使1, 2-环十二二酮单肟的十二元环构象从[3333]-2, 3-二酮改变为[4233]-3, 4-二酮优势构象, 取代基也从角碳反向位改变为边碳外向位.
3 实验部分
3.1 仪器与试剂
Yanagimoto显微熔点仪(温度计未校正); Bruker DPX 300 MHz核磁共振仪, TMS为内标, CDCl3为溶剂; Thermo Fisher ESCALAB 250型X射线衍射仪; Agilent 1100 HPLC-MSD-Trap液相色谱-质谱联用仪.所有试剂均为国产分析纯试剂, 甲苯和四氢呋喃使用前经无水处理后重蒸.
3.2 目标化合物的合成
3.3 目标化合物的晶体衍射
将20~30 mg高纯度的1, 1'-二羟基-1, 1'-联环十二烷(4)、1-苯基环十二醇(5)、2-环己基环十二酮肟(9)和3-苯基-1, 2-环十二酮单肟(10)分别置于50 mL三角瓶中, 分别用氯仿-无水乙醇(V:V=1:1)、正己烷、乙醇和乙醇溶解制备成一定浓度的稀溶液, 用保鲜膜将瓶口封好, 并扎3~5个针孔, 置于阴凉处, 让溶剂自然挥发, 大约5~10 d后析出晶莹透明符合单晶衍射所需的晶体.选取一定大小的晶体置于四圆衍射仪中, 以Mo Ka射线为辐射源, 石墨单色器, 在低温条件下用Xscan程序收集数据, 采用ω-2θ扫描方式, 在6.6°<2θ<52.0°范围内收集衍射点.强度数据经半经验吸收校正, 在微机上使用SHELXTL-97程序[17], 由直接法解出结构, 采用全矩阵最小二乘法进行结构精修, 分别得到四个化合物的晶体结构和结构参数.化合物的晶体结构数据已提交剑桥晶体结构数据库保存.
3.4 化合物的量子力学计算
本文参照文献[7a, 8]采用Gaussian 03软件中的密度泛函理论(density functional theory, DFT)方法在B3LYP/6-31G(d, p)基组水平对化合物8、9、10和11进行量子力学计算优化, 没有考虑色散矫正对构象相对能量的影响, 计算所得的能量为势能, 计算的温度采用默认值298.15 K.在表 3所示的结果采用相对能量大小的方式.
辅助材料(Supporting Information) 化合物的1H NMR和13C NMR谱以及高分辨质谱和分子轨道能级图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
3.2.1 中间体2-苯基环十二酮(6)和2-环己基环十二酮(7)的合成
2-苯基环十二酮(6)参照前文[8]方法通过环十二酮与苯基锂反应制备1-苯基环十二醇(5), 经脱水生成1-苯基环十二烯, 再经硼氢化还原和氧化共四步反应合成, 中间体1-苯基环十二醇为无色透明晶体, 收率93%. m.p. 99~101 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.49 (d, J=7.5 Hz, 2H, ArH), 7.49 (t, J=7.5 Hz, 2H, ArH), 7.49 (t, J=7.5 Hz, 1H, ArH), 1.90~1.84 (m, 4H, 2×CH2), 1.63 (brs, 1H, OH), 1.39~1.22 (brs, 18H, 9×CH2).其m.p., 1H NMR数据与文献[8]一致.
2-环己基环十二酮(7)参照文献[8]方法合成, 反应液除去溶剂后的残余物经硅胶柱层析, 石油醚/乙酸乙酯梯度洗脱得主要产物白色固体2-环己基环十二酮, 继续洗脱得到白色固体1, 1'-二羟基-1, 1'-联环十二烷(4), 无水乙醇重结晶得无色透明晶体, 收率2.8%. m.p. 158~160 ℃; 1H NMR (300 MHz, CDCl3) δ: 1.74 (brs, 2H, OH), 1.65~1.60 (m, 8H), 1.43~1.20 (brs, 36H); 13C NMR (75 MHz, CDCl3) δ: 79.89, 31.78, 27.24, 26.15, 23.04, 22.79, 20.76; HR-MS (ESI) calcd for C24H46O2Na [M+Na]+ 389.3395, found 389.3389.其m.p., 1H NMR和13C NMR数据与文献[15, 16]一致.
2-苯基环十二酮6和2-环己基环十二酮(7)的熔点、1H NMR, 13C NMR数据与文献[8]一致.
3.2.3 3-苯基-1, 2-环十二酮单肟(10)和3-环己基-1, 2-环十二酮单肟(11)的合成
3-苯基(环己基)-1, 2-环十二酮单肟参照文献[7a]方法合成.以3-苯基-1, 2-环十二二酮单肟(10)为例:向50 mL单口瓶中依次加入0.26 g (1.0 mmol) 2-苯基环十二酮、69 mg (1 mmol)亚硝酸钠、5 mL四氢呋喃和2 mL盐酸, 在0~5 ℃条件下搅拌, 至TLC检测反应物反应完全, 停止反应, 用15 mL水后以乙酸乙酯(25 mL×3)萃取, 有机相用饱和碳酸氢稀释钠溶液洗涤至中性后用无水硫酸钠干燥, 浓缩后以无水乙醇进行重结晶得到200 mg白色固体, 收率69%. m.p. 125~127 ℃; 1H NMR (300 MHz, CDCl3) δ: 7.95~7.91 (brs, 1H, OH), 7.37~7.16 (m, 5H, ArH), 4.88 (dd, J=11.8, 3.6 Hz, 1H, ArCH), 2.78~2.71, 2.64~2.55 (m, 2H, CH2), 2.37~2.31 (m, 1H, CH), 1.77~1.26 (m, 15H, 7×CH2+CH); 13C NMR (75 MHz, CDCl3) δ: 199.87, 161.39, 140.35, 128.37, 128.26, 126.68, 50.16, 34.26, 27.01, 26.07, 25.68, 25.36, 24.61, 23.46, 23.00, 22.25; IR (KBr) ν: 3306 (OH), 3236 (OH), 3061 (ArH), 3035 (ArH), 2923 (CH2), 2861 (CH2), 1688 (C=O, C=N), 1600 (Ar), 1496 (Ar), 1463 (CH2), 1454 (CH2), 1073 cm-1. HR-MS (ESI) calcd for C18H26NO2 [M+H]+ 288.1964, found 288.1961; C18H25NO2Na [M+Na]+ 310.1778; found 310.1781.
同样方法制得3-环己基-1, 2-环十二二酮单肟(11), 收率49%. m.p. 92~94 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.06~8.04 (brs, 1H, OH), 3.37~3.30 (m, 1H, CH), 2.84~2.75, 2.65~2.57 (m, 2H, CH2), 1.82~0.84 (m, 27H, 13×CH2+CH); 13C NMR (75 MHz, CDCl3) δ: 203.61, 161.18, 50.67, 38.21, 32.03, 30.05, 27.50, 26.52, 26.35, 26.26, 26.15, 25.93, 25.76, 24.37, 22.98, 22.79, 22.46, 21.92; IR (KBr) ν: 3297 (OH), 2930 (CH2), 2848 (CH2), 1689 (C=O), 1663 (C=N), 1469 (CH2), 1449 (CH2), 1243, 1134, 1039 cm-1. HR-MS (ESI) calcd for C18H32NO2 [M+H]+ 294.2433, found 294.2430; C18H31NO2Na [M+Na]+ 316.2252, found 316.2247.
3.2.2 2-苯基环十二酮肟(8)和2-环己基环十二酮肟(9)的合成
2-苯基(环己基)-环十二酮肟参照文献[6d, 7b]方法合成.以2-苯基环十二酮肟(8)为例:向50 mL三口瓶中依次加入0.26 g (1.0 mmol) 2-环己基环十二酮、0.21 g (3.0 mmol)盐酸羟胺、0.25 g (3.0 mmol)醋酸钠和10 mL无水乙醇, 加热回流至TLC检测反应物反应完全, 停止反应, 用15 mL水稀释后以乙酸乙酯(25 mL×3)萃取, 有机相用饱和食盐水洗涤, 无水硫酸钠干燥, 浓缩后用乙醇进行重结晶得到白色固体207 mg, 收率77%. m.p. 132~134 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.49 (brs, 1H, OH), 7.30~7.18 (m, 5H, ArH), 3.72 (dd, J=12.2, 3.6 Hz, 1H, ArCH), 3.01~2.92, 2.36~2.24 (m, 2H, CH2), 1.72~1.22 (m, 18H, 9×CH2); 13C NMR (75 MHz, CDCl3) δ: 160.95, 142.72, 128.49, 127.98, 126.64, 46.36, 33.30, 26.61, 26.46, 25.98, 24.24, 23.72, 23.59, 22.44, 22.37; IR (KBr) ν: 3257 (OH), 3164, 3065 (ArH), 3027 (ArH), 2980 (CH2), 2860 (CH2), 1667 (C=N), 1603 (Ar), 1493 (Ar), 1462 (CH2), 1452 (CH2), 1030 cm-1; HR-MS (ESI) calcd for C18H28NO [M+H]+ 274.2165, found 274.2167.
同样方法制得2-环己基环十二酮肟(9), 收率48%. m.p. 94~96 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.09~7.98 (brs, 1H, OH), 2.81~2.77 (m, 1H, CH), 2.27~2.21, 2.04~2.02 (m, 2H, CH2), 1.79~0.94 (m, 29H, 9×CH2+CH); 13C NMR (75 MHz, CDCl3) δ: 161.98, 46.95, 41.38, 31.94, 29.46, 27.00, 26.92, 26.78, 26.59, 26.55, 26.28, 24.87, 24.73, 23.97, 23.90, 22.61, 22.56; IR (KBr) ν: 3265 (OH), 2940 (CH2), 2857 (CH2), 1662 (C=N), 1468 (CH2), 1454 (CH2), 1251, 1031 cm-1. HR-MS (ESI) calcd for C18H34NO [M+H]+ calcd for 280.2635, found 280.2638.
-
-
[1]
Zoorob, H. H.; Elsherbini, M. S.; Hamama, W. S. ARKIVOC 2011, 429.
(b) Zoorob, H. H.; Elsherbini, M. S.; Hamama, W. S. Am. J. Org. Chem. 2012, 2, 63. -
[2]
Skibinski, M.; Wang, Y.; Slawin, A. M. Z.; Lebl, T.; Kirsch, P.; O'Hagan, D. Angew. Chem., Int. Ed. 2011, 50, 10581.
(b) O'Hagan, D.; Wang Y.; Skibinski M.; Slawin, A. M. Z. Pure Appl. Chem. 2012, 84, 1587.
(c) Wang, Y.; Kirsch, P.; Lebl, T.; Slawin, A. M. Z.; O'Hagan, D. Beilstein J. Org. Chem. 2012, 8, 1271. -
[3]
Sathesh, V.; Umamahesh, B.; Ramachandran, G.; Ravindaranath, S. R.; Sathiyanarayanan, K. I. New J. Chem., 2012, 36, 2292.
(b) Sathesh, V.; Natesan, S. K.; Ravindaranath, S. R.; Periyasamy, G.; Sathiyanarayanan, K. I. Med. Chem. Res. 2014, 23, 5086. -
[4]
Karthikeyan, N. S.; Gunasekar, R.; Sathiyanarayanan, K. I.; Ravindaranath, R. Synth. Commun. 2012, 42, 3429. doi: 10.1080/00397911.2011.584023
-
[5]
Khorasani, S.; Fernandes, M. A.; Perry, C. B. Cryst. Growth Des. 2012, 12, 5908. doi: 10.1021/cg300765b
-
[6]
Wang, D. Q.; Yang, X. L.; Wang, M. A.; Liang, X. M.; You, T. B. Acta Chim. Sinica 2002, 60, 475 (in Chinese).
(王道全, 杨晓亮, 王明安, 梁晓梅, 尤田耙, 化学学报, 2002, 60, 475.)
(b) Wang, M. A.; Ma, Z. C.; Lu, H. Z.; Wang, D. Q. Acta Chim. Sinica 2003, 61, 445 (in Chinese).
(王明安, 马祖超, 路慧哲, 王道全, 化学学报, 2003, 61, 445.)
(c) Wang, M. A.; Ma, Z. C.; Wang D. Q. Acta Chim. Sinica 2003, 61, 399 (in Chinese).
(王明安, 马祖超, 王道全, 化学学报, 2003, 61, 399.)
(d) Wang, M. A.; Yan, X. J.; Liu, J. P.; Jin, S. H.; Li, T. G.; Yang, X.; Ma, Z. C.; Wang, D. Q. Acta Chim. Sinica 2007, 65, 1657 (in Chinese).
(王明安, 闫晓静, 刘建平, 金淑慧, 李太公, 杨旭, 王道全, 化学学报, 2007, 65, 1657.)
(e) Wang, M. A.; Zhang, N.; Lu, H. Z.; Wang, D. Q. Chin. J. Chem. 2007, 25, 1196. -
[7]
Chen, S. C.; Zhang, C. Y.; Zhang, L.; Wang, D. Q.; Wang, M. A. Acta Chim. Sinica 2011, 69, 1354 (in Chinese).
(陈守聪, 张春艳, 张莉, 王道全, 王明安, 化学学报, 2011, 69, 1354.)
(b) Zhang, C. Y.; Chen, S. C.; Wang, D. Q.; Wang, M. A. Acta Chim. Sinica 2010, 68, 989 (in Chinese).
(张春艳, 陈守聪, 王道全, 王明安, 化学学报, 2010, 68, 989.) -
[8]
杨明艳, 张莉, 王道全, 王明安, 高等学校化学学报, 2015, 36, 489.Yang, M. Y.; Zhang, L.; Wang, D. Q.; Wang, M. A. Chem. J. Chin. Univ. 2015, 36, 489 (in Chinese).
-
[9]
McMurry, J. E.; Fleming, M. P. J. Am. Chem. Soc. 1974, 96, 4708.
(b) Imamoto, T.; Kusumoto, T.; Hatanaka, Y.; Yokoyama, M. Tetrahedron Lett. 1982, 23, 1353.
(c) Mukaiyama, T.; Kagayama, A.; Shiina, I. Chem. Lett. 1998, 11, 1107.
(d) Lannou, M.; Helion, F.; Namy, J. Tetrahedron 2003, 59, 10551. -
[10]
Marshall, J. A.; Black, T. H.; Shone, R. L. Tetrahedron Lett. 1979, 20, 4737.
(b) Alex, N.; Pamela, St. J. Z. Tetrahedron Lett. 1980, 21, 3527. -
[11]
Harpp, D. N.; Steliou, K.; Cheer, C. J. J. Chem. Soc., Chem. Commun. 1980, 825.
-
[12]
Zysman-Colman, E.; Abrams, C. B.; Harpp, D. N. J. Org. Chem. 2003, 68, 7059. doi: 10.1021/jo0346306
-
[13]
Wang, M. A.; Tu, G. Z.; Ma, Z. C.; Zhang, N.; Wang, D. Q. Chin. J. Chem. 2006, 24, 205. doi: 10.1002/(ISSN)1614-7065
-
[14]
李太公, 刘建平, 王明安, 山东师范大学学报, 2009, 24, 72. http://www.cqvip.com/QK/94155X/200902/1000762010.htmlLi, T. G.; Liu, J. P.; Wang, M. A., J. Shandong Normal Univ. 2009, 24, 72 (in Chinese). http://www.cqvip.com/QK/94155X/200902/1000762010.html
-
[15]
Alex, N.; Pamela, St. J. Z. J. Org. Chem. 1981, 46, 4685. doi: 10.1021/jo00336a012
-
[16]
Ji, S.; Matsushita, M.; Takahashi, T. T.; Horiuchi, C. A. Tetrahedron Lett. 1999, 40, 6791. doi: 10.1016/S0040-4039(99)01357-X
-
[17]
Sheldrick, G. M. Acta Crystallogr. 2008, A64, 112. doi: 10.1107/S0108767390000277/abstract
-
[18]
Han, X. Y.; Wang, M. A.; Li, T. G.; Liang, X. M.; Dong, Y. H.; Chen, F. H.; Wang, D. Q. Chin. J. Struct. Chem., 2007, 26, 625.
-
[19]
Weinberg, N.; Wolfe, S. J. Am. Chem. Soc. 1994, 116, 9860.
(b) Yates, P. C.; Richardson, C. M. THEMOCHEM 1996, 363, 17.
(c) Kolossvary, I.; Guida, W. C. J. Am. Chem. Soc. 1993, 115, 2107.
(d) Kolossvary, I.; Guida, W. C. J. Am. Chem. Soc. 1996, 118, 5011.
(e) Christensen, I. T.; Jorgensen, F. S. J. Comput.-Aided Mol. Des. 1997, 11, 385. -
[20]
Kolochkov, V. V.; Chernov, P. P.; Polozov, A. M.; Antonovskii, V. L.; Koshel, G. N.; Antonova, T. N.; Aganov, A. V. Zh. Org. Khim. 1990, 26, 387.
(b) Ballini, R.; Palestini, C. Tetrahedron Lett. 1994, 35, 5731.
(c) Potekhin, K. A.; Maleev, A. V.; Struchkov, Y. T.; Magerramov, A. M.; Kozmin, A. S.; Zefirov, N. S. Dokl. Akad. Nauk 1995, 340, 345.
(d) Terent'ev, A. O.; Kutkin, A. V.; Starikova, Z. A. Synthesis 2004, 2356. -
[21]
Dunitz, J. D.; Shearer, H. M. M. Helv. Chim. Acta 1960, 43, 18. doi: 10.1002/(ISSN)1522-2675
-
[22]
Rawdah, T. N. Tetrahedron 1991, 47, 8579. doi: 10.1016/S0040-4020(01)82401-7
-
[23]
Zhang, Y. F.; Yamato, K.; Zhong, K.; Zhu, J.; Deng, J. G.; Gong, B. Org. Lett. 2008, 10, 4339.
(b) Helsel, A. J.; Brown, A. L.; Yamato, K.; Wen, F.; Yuan, L. H.; Clements, A. J.; Harding, S. V.; Szabo, G.; Shao, Z. F.; Gong, B. J. Am. Chem. Soc. 2008, 130, 15784.
-
[1]
-
表 1 化合物4, 5, 9和10的晶体结构参数
Table 1. The parameters of 4, 5, 9and 10 in their crystal structures
Parameter 4 5 9 10 CCDC numbers 921345 1424717 1424718 1424719 Crystal size/mm3 0.80×0.15×0.15 0.35×0.35×0.35 0.70×0.40×0.30 0.50×0.25×0.15 Empirical formula C24H46O2 C18H28O C18H33NO C18H25NO2 Formula weight 366.61 260.40 279.45 287.39 Temperature/K 101.7 102.9 103.6 100.2 Crystal system Triclinic Trigonal Triclinic Triclinic Space group P-1 R-3 P-1 P-1 a/nm 0.52862(4) 2.62927(13) 0.61733(10) 0.56782(11) b/nm 0.77468(8) 2.62927(13) 1.15835(18) 1.1973(2) c/nm 1.36129(9) 1.17390(4) 1.24643(19) 1.2148(2) α/(°) 81.952(7) 90.00 76.118(13) 99.556(15) β/(°) 81.606(6) 90.00 86.959(13) 99.960(15) γ/(°) 77.327(8) 120.00 83.791(13) 99.350(16) V/nm3 0.53468(8) 7.0280(6) 0.8599(2) 0.7865(3) Z 1 18 2 2 ρcalc/(mg·mm-3) 1.139 1.107 1.079 1.214 μ/mm-1 0.069 0.066 0.065 0.078 F(000) 206 2592 312 312 2q range/(°) 7.70~52 7.82~51.98 6.64~52 6.96~52 Index ranges -6≤h≤6 -15≤h≤31 -7≤h≤7 -7≤h≤7 -9≤k≤9 -32≤k19 -14≤k≤14 -14≤k≤14 -16≤l≤16 -14≤l≤8 -14≤l≤15 -14≤l≤14 Reflections collected 3417 5202 5667 9912 Independent reflections R(int) 3417 (0.0000) 3068 (0.0201) 3384 (0.0297) 3074 (0.0497) Data/restraints/parameters 3417/0/120 3068/0/173 3384/0/182 3074/16/195 R1, wR2 [I>2σ(I)] 0.0453, 0.1100 0.0434, 0.0864 0.0467, 0.1146 0.2001, 0.5677 R1, wR2 [all data] 0.0635, 0.1161 0.0613, 0.0946 0.0552, 0.1220 0.2149, 0.5795 Largest diff. peak/hole/(e·nm-3) 253/-232 270/-193 337/-223 651/-734 Completeness 0.996 0.996 0.999 0.999 表 2 环十二烷, 环十二酮, 4, 5, 9和10在晶体结构中的二面角(°)
Table 2. The torsional angles (°) in the crystal structures of cyclododecane, cyclododecanone, 4, 5, 9and 10
Angle [3333][21] 4 5 [3333]-2-one[22] 9 10 C(1)—C(2)—C(3)—C(4) 160.0 166.04 156.72 148.0 148.22 161.71 C(2)—C(3)—C(4)—C(5) -71.0 -75.49 -69.38 -60.0 -69.76 -136.77 C(3)—C(4)—C(5)—C(6) -71.0 -74.01 -71.20 -70.0 -67.78 54.05 C(4)—C(5)—C(6)—C(7) 159.0 154.87 164.53 176.0 174.59 65.20 C(5)—C(6)—C(7)—C(8) -66.0 -62.88 -67.51 -67.0 -68.89 -171.46 C(6)—C(7)—C(8)—C(9) -66.0 -62.06 -65.29 -69.0 -68.75 57.75 C(7)—C(8)—C(9)—C(10) 160.0 166.80 157.07 146.0 147.74 56.92 C(8)—C(9)—C(10)—C(11) -71.0 -70.88 -69.36 -69.0 -66.19 -168.66 C(9)—C(10)—C(11)—C(12) -71.0 -74.07 -69.35 -69.0 -71.07 89.75 C(10)—C(11)—C(12)—C(1) 159.0 155.34 166.08 172.0 171.11 78.60 C(11)—C(12)—C(1)—C(2) -66.0 -66.17 -54.13 -65.0 -66.94 -69.14 C(12)—C(1)—C(2)—C(3) -66.0 -62.74 -65.71 -76.0 -72.28 -67.01 表 3 化合物8~11量子力学优化低能构象的相对能量(kJ/mol)
Table 3. The relative energy (kJ/mol) of optimized conformation for compounds 8~11by
quantum mechanics Compd. corner-anti-[3333]-2-one side-exo-[3333]-2-one corner-anti-[3333]-2, 3-dione side-exo-[4233]-3, 4-dione 8 6.19 0.00 - - 9 2.64 0.00 - - 10 - - 10.51 0.00 11 - - 1.03 0.00 表 4 在4晶体结构中的氢键
Table 4. Hydrogen bond in the crystal structure of 4
D—H D—H/nm H…A/nm DHA/(°) D…A/nm A O(1)—H(1) 0.0840 0.2297 173.21 0.3132 O(1) [-x+1, -y+1, -z] -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 206
- HTML全文浏览量: 50




 下载:
下载:


 下载:
下载:

