 图 1
代表性有生物活性的芳基硫醚
Figure 1.
Representative bioactive aryl sulfides
图 1
代表性有生物活性的芳基硫醚
Figure 1.
Representative bioactive aryl sulfides

Citation: Zhang Bianxiang, Yang Lihua, Shi Ruixue, Kang Yongqiang. Synthesis of Heterocyclic Aromatic Sulfides under Microwave Irradiation[J]. Chinese Journal of Organic Chemistry, 2015, 36(2): 352-357. doi: 10.6023/cjoc201509026

微波促进下含苯并杂环芳硫醚的合成
English
Synthesis of Heterocyclic Aromatic Sulfides under Microwave Irradiation
-
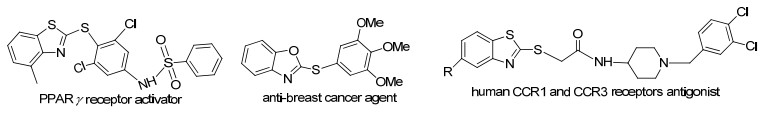
苯并杂环芳硫醚是硫醚类化合物中研究最多、应用最广泛的一类重要有机化合物, 在医药领域中具有重要的药物活性和生理活性, 在新药合成中作为基本单元或中间体被广泛研究[1~4].近年来, 随着生物学的发展, 越来越多的官能化杂环芳基硫醚被不断合成[5], 例如: PPAR γ受体激活剂(PPAR γ receptor activator, 图 1)、抗癌试剂(anti-breastn cancer Agent, 图 1)、人类CCR1和CCR3受体(human CCR1 and CCR3 Receptors antigonist, 图 1).
目前合成杂环芳硫醚的方法[6~21]主要可以分为两类, 一类是利用过渡金属(Cu, Pd等金属化合物)催化, 以卤代芳烃与巯基苯并五元杂环化合物发生C—S偶联反应, 得到相应的芳基硫醚化合物[22](Eq. 1);另一类是铜催化下, 苯并五元杂环化合物和硫酚或二苯二硫醚的反应, 生成芳硫醚化合物[23](Eq. 2).在这些制备方法中有的使用了高价配体, 有的反应时间长达20 h, 且副产物多, 后处理繁杂.在我们准备论文的同时, Ivelina课题组[24]报道了一种用芳基锌试剂合成芳基硫醚的方法, 其后处理需在高温下进行且所用时间较长; Natividad课题组[25]报道了一种在光照和微波条件下的硫芳基化反应, 但其底物比较单一, 主要讨论了苯并噻唑类硫醚的合成.近年开发的微波技术可对反应混合物中的各个组分进行选择性加热, 由于极性分子的介电常数较大, 能与微波产生较强的偶合作用, 其吸收微波后, 温度升高, 可实现分子水平上的搅拌, 且物料受热均匀, 加快反应速度.因此, 利用微波具有的特点, 本实验在微波辐射下, 进行了巯基唑类化合物与芳基碘化物的反应, 得到了系列芳基硫醚化合物(Eq. 3).并且通过高效液相色谱分析法分别对微波辐射和传统油浴加热条件下的反应结果进行了讨论.实验表明微波辐射条件下, 反应选择性高、时间短、副产物少.有望解决现有含杂原子芳硫醚合成中操作繁杂、耗时长、能耗大、副产物多等技术缺陷.
1 结果与讨论
1.1 合成条件的讨论
以2-巯基苯并咪唑与碘苯的反应为模板反应, 讨论了催化剂用量、碱的种类、反应时间及溶剂对反应的影响, 并确定了最佳反应条件, 结果如表 1所示.

Entry CuI/mol% Base Time/min Solvent Yield/% 1 — KOH 10 DMF Trace 2 5 KOH 10 DMF 65 3 8 KOH 10 DMF 69 4 10 KOH 10 DMF 72 5 12 KOH 10 DMF 68 6 10 KOH 12 DMF 73 7 10 KOH 15 DMF 81 8 10 KOH 18 DMF 70 9 10 K2CO3 15 DMF 5 10 10 NEt3 15 DMF 3 11 10 NaOH 15 DMF 55.3 12 10 KOH 15 DMSO 55.2 13 10 KOH 15 DME 0 14 10 KOH 15 DMP 39.4 aReaction conditions: 1a (2 mmol), 2a (2 mmol), solvent (5 mL), CuI, base (5 mol%), and irradiation at 30 W. bIsolated yield. 表 1 反应条件的优化a
Table 1. Optimization of reaction conditions从表 1可以看出, 当微波输出功率为30 W, 所用碱为KOH, 反应时间为10 min, 所用溶剂为DMF时, 在反应体系中加入不同催化量的CuI, 产率有所不同.当不加CuI时, 反应产率很低, 反应几乎不能够进行; 当CuI的量从1 mol%增加到10 mol%时, 产率明显提高, 当加至12 mol%时, 产率又有所下降, 这可能是由于Cu表面杂质堆积, 引起催化活性降低.另外, 在同等条件下, 使用FeCl3, Cu(OAc)2作催化剂时, 生成物的产率有所降低.其次, 在使用KOH, K2CO3, NEt3, NaOH作碱的讨论中发现, 用KOH作碱时产率最高.随着反应时间的增加, 产率也逐渐增加, 但当反应时间超过15 min后, 产率提高不明显.在使用DMF, DMSO, DME, NMP作溶剂的讨论中发现, 用DMF作溶剂时产率最高.当微波输出功率从10 W升到40 W时, 产率先升高后降低, 其中微波输出功率为30 W时产率最佳.因此, 在2-巯基苯并咪唑与碘苯的反应体系中, 最佳的反应条件是:微波输出功率为30 W, CuI用量为10 mol%, 所用碱为KOH, 时间15 min, 溶剂为DMF, 产率达到81%.
为了扩大反应的适用范围, 在上述优化反应条件下, 进行了系列杂环芳基硫醚与芳基碘化物的反应, 结果如表 2所示.从表 2可以得知, 2-巯基苯并咪唑(1a)、2-巯基苯并噻唑(1b)、2-巯基苯并噁唑(1c)与芳基碘化物的反应性都比较好, 均得到了相应产率较高的芳基硫醚产物3b~3l.当芳基碘化物在碘取代基的对位带有不同取代基时, 产物的产率略有不同, 实验数据表明:带有供电性越强的基团反应产率越高, 以I, H, CH3, OCH3的顺序递增.
 表 2 杂环芳基硫醚的合成a
表 2 杂环芳基硫醚的合成a
Table 2. Synthesis of heterocyclic aromatic sulfides有趣的是, 当2-巯基苯并噻唑(1b)、2-巯基苯并噁唑(1c)与1, 4-二碘苯(2b)反应时, 分别得到单偶联3f1, 3j1和双偶联3f2, 3j2两个目标产物, 并由高效液相色谱分析得知二者的产率比均为3:2(图 2); 而2-巯基苯并咪唑与1, 4-二碘苯在相同的反应体系中只得到一个单偶联产物3b; 当在反应体系中加大2-巯基苯并唑类的物质的量之比到2:1时, 2-巯基苯并噻唑、2-巯基苯并噁唑与1, 4-二碘苯反应时, 仍分别得到单偶联和双偶联两个产物, 且两个产物的比例接近1:1, 而2-巯基苯并咪唑与1, 4-二碘苯反应仍得到一个单偶联产物; 当继续加大2-巯基苯并唑类的比例为2.5:1时, 1b和1c仍得到两个目标产物, 且两个产物的比例接近1:1.2, 1a仍得到一个目标产物.其原因可能是氧原子和硫原子的电负性略大于氮原子, 使得巯基中S—H键在微波作用下更容易被极化, 进一步与生成的碘化物进行反应.为了探明反应机理, 对此我们用高效液相色谱分析法进行了追踪.
1.2 微波反应与传统加热方法对比
以2-巯基苯并咪唑与1, 4-二碘苯为例, 在以上优化的条件下分别进行微波反应和传统油浴加热反应, 利用高效液相色谱监测了不同反应时间的反应混合物, 结果如图 3和4所示.
在检测条件完全相同的情况下, 从高效液相色谱图中可以看出, 微波反应15 min后的混合液中几乎没有杂质且反应较为完全(图 3), 并可以清晰地看出2-巯基苯并咪唑与1, 4-二碘苯的反应体系中只得到一个目的产物.而传统加热回流方法进行的反应, 24 h后反应液中原料所占比例较大, 反应不能完全进行, 而且副产物较多(图 4).因此, 微波反应相对于传统加热回流反应具有十分明显的优势, 该方法反应条件温和、反应时间短、产品纯度高、成本低, 有望成为一种高效、温和、对环境友好的合成芳基硫醚的方法.
2 结论
本实验在微波辐射下进行了巯基唑类化合物与芳基碘化物的反应, 得到了系列芳基硫醚化合物, 通过对不同反应条件的探讨, 确定了最佳反应条件.当微波输出功率30 W、微波辐射15 min, CuI (10% mol)为催化剂、DMF为溶剂, 生成物产率可达79%~88%.同时, 利用高效液相色谱分析法直观地体现了微波辐射反应的优点, 与通常合成C—S键的方法相比, 微波辐射条件下缩短了反应时间, 提高了反应选择性和产率, 为芳基硫醚类化合物的合成及新药的开发提供了理论依据.
3 实验部分
3.1 仪器与试剂
ZF-C型三用紫外仪, 85-3型恒温磁力搅拌器, X-4数字显示显微熔点测定仪, TU-1901型紫外吸收光谱仪, BS223S型分析天平, SHZ-D(Ⅲ)循环水式真空泵, RE-52C旋转蒸发器, 可调功率微波反应器(WBFY-201型), 300 MHz超导核磁共振仪(Bruker DLX 300), R2030高效液相色谱仪(SunriseC18, 5 um), 所用试剂均为分析纯.
3.2 实验方法
在100 mL烧瓶中加入化合物1 (2 mmol)和化合物2 (2 mmol), 加入5 mL N, N-二甲基甲酰胺(DMF)将其溶解后, 加入10 mol%碘化亚铜和5 mol%氢氧化钾.将其转入微波反应器中, 设置功率为30 W, 反应时间为15 min.反应结束后, 待烧瓶冷却至室温, 将混合物转入分液漏斗中, 加10 mL水充分振荡分出有机层后, 水层每次用10 mL乙酸乙酯萃取两次.合并有机层和乙酸乙酯萃取液, 用无水硫酸钠干燥后旋干溶剂, 进行柱层析分离得到目标产物3, 洗脱剂为乙酸乙酯与石油醚[V(乙酸乙酯):V(石油醚)=1:15];当1b, 1c分别与2b反应生成两个目标产物时, 洗脱剂为乙酸乙酯与石油醚[V(乙酸乙酯):V(石油醚)=1:20].并用1H NMR, 13C NMR和质谱对目标化合物进行了表征.
2-苯硫基苯并咪唑(3a):白色固体, m.p. 200~202 ℃ (lit.[26] 198~200 ℃); 1H NMR (DMSO-d6) δ: 7.16~7.48 (m, ArH, 9H), 12.79 (s, NH, 1H); 13C NMR (CDCl3) δ: 110.28, 118.37, 121.90, 121.96, 127.53, 127.62, 130.90, 131.71, 135.71, 140.09, 144.97.
2-[(4-碘苯)硫基]苯并咪唑(3b):白色固体, m.p. 236~238 ℃; 1H NMR (DMSO-d6, 300 MHz) δ: 7.16~7.25 (m, ArH, 2H), 7.25~7.28 (m, ArH, 2H), 7.40~7.55 (m, ArH, 2H), 7.74~7.77 (m, ArH, 2H), 12.77 (s, NH, 1H); 13C NMR (CDCl3) δ: 93.65, 114.39, 114.40, 122.07, 131.37, 132.90, 138.01, 138.41, 139.07, 139.27, 141.85; HRMS (ESI) clacd for C13H9N2SI 352.9603, found 352.9612.
2-[(4-甲氧基苯)硫基]苯并咪唑(3c):白色固体, m.p. 203~206 ℃ (lit.[27] 206.0~207.5 ℃); 1H NMR (CDCl3)δ: 3.77 (s, CH3, 3H), 6.99~7.12 (m, ArH, 4H), 7.42~7.54 (m, ArH, 4H), 12.59 (s, NH, 1H); 13C NMR (CDCl3) δ: 54.90, 106.49, 106.55, 109.66, 114.05, 114.75, 119.66, 121.53, 135.00, 139.04, 149.31, 159.90.
2-[(4-甲基苯)硫基]苯并咪唑(3d):白色固体, m.p. 195~197 ℃ (lit.[27] 194~195 ℃); 1H NMR (DMSO-d6)δ: 2.31 (s, CH3, 3H), 7.15~7.25 (m, ArH, 4H), 7.41~7.44 (m, ArH, 4H), 12.60 (s, NH, 1H); 13C NMR (CDCl3) δ: 20.10, 115.32, 115.54, 121.32, 126.38, 129.58, 131.58, 137.63, 138.05, 139.43, 139.58, 141.66.
2-苯硫基苯并噻唑(3e)[28]:淡黄色液体, 1H NMR (CDCl3) δ: 7.24~7.29 (m, ArH, 1H), 7.38~7.43 (m, ArH, 1H), 7.48~7.53 (m, ArH, 3H), 7.63~7.66 (m, ArH, 1H), 7.74~7.76 (m, ArH, 2H), 7.87~7.90 (m, ArH, 1H); 13C NMR (CDCl3) δ: 121.57, 121.59, 122.76, 125.13, 126.97, 130.73, 131.28, 135.98, 136.11, 154.72, 170.50.
2-[(4-碘苯)硫基]苯并噻唑(3f1):白色固体, m.p. 45~47 ℃; 1H NMR (CDCl3) δ: 7.29~7.35 (m, ArH, 1H), 7.43~7.49 (m, ArH, 3H), 7.70~7.73 (m, ArH, 1H), 7.82~7.85 (m, ArH, 2H), 7.91~7.94 (m, ArH, 1H); 13C NMR (CDCl3) δ: 97.32, 121.18, 122.40, 124.89, 126.60, 130.15, 135.56, 135.86, 136.81, 139.36, 154.05. HRMS (ESI) clacd for C13H8NS2I 369.9215, found 369.9224.
2, 2'-[(4, 4'-二苯)-二硫基]苯并噻唑(3f2):白色固体, m.p. 191~193 ℃; 1H NMR (CDCl3) δ: 7.23~7.40 (m, ArH, 4H), 7.58~7.63 (m, ArH, 5H), 7.91~8.11 (m, ArH, 3H); 13C NMR (CDCl3) δ: 121.59, 122.06, 125.03, 126.17, 130.24, 131.99, 136.14, 154.02, 165.12; HRMS (ESI) clacd for C20H12N2S4 408.9956, found 408.9964.
2-[(4-甲氧基苯)硫基]苯并噻唑(3g):白色固体, m.p. 54~57 ℃ (lit.[29] 58~59 ℃); 1H NMR (CDCl3)δ: 3.83 (s, OCH3, 3H), 6.94~6.97 (m, ArH, 2H), 7.20~7.21 (m, ArH, 1H), 7.32~7.37 (m, ArH, 1H), 7.57~7.64 (m, ArH, 3H), 7.80~7.83 (m, ArH, 1H); 13C NMR (CDCl3) δ: 55.87, 115.89, 120.54, 121.13, 122.13, 124.45, 126.48, 135.77, 137.99, 154.56, 162.08, 172.36.
2-[(4-甲基苯)硫基]苯并噻唑(3h):白色固体, m.p. 58~60 ℃ (lit.[30] 71~72 ℃); 1H NMR (CDCl3)δ: 2.95 (s, CH3, 3H), 7.25~7.33 (m, ArH, 3H), 7.39~7.45 (m, ArH, 1H), 7.64~7.66 (m, ArH, 3H), 7.88~7.91 (m, ArH, 1H); 13C NMR (CDCl3) δ: 22.64, 117.91, 118.24, 121.94, 123.01, 125.36, 127.31, 131.95, 136.77, 142.35, 155.22, 172.02.
2-苯硫基苯并噁唑(3i)[31]:无色液体. 1H NMR (CDCl3) δ: 7.24~7.25 (m, ArH, 3H), 7.39~7.46 (m, ArH, 4H), 7.59~7.61 (m, ArH, 1H), 7.69~7.70 (m, ArH, 1H); 13C NMR (CDCl3) δ: 120.62, 121.68, 124.14, 125.98, 129.64, 129.76, 132.16, 135.12, 135.27, 153.62, 169.26.
2-[(4-碘苯)硫基]苯并噁唑(3j1):淡黄色液体. 1H NMR (CDCl3)δ: 7.27~7.31 (m, ArH, 2H), 7.42~7.46 (m, ArH, 2H), 7.60~7.65 (m, ArH, 2H), 7.75~7.78 (m, ArH, 2H); 13C NMR (CDCl3) δ: 94.71, 110.84, 125.24, 127.79, 131.02, 132.08, 133.98, 134.94, 135.64, 139.53, 163.19; HRMS (ESI) clacd for C13H8NSOI: 353.9444, found 353.9454.
2, 2'-[(4, 4'-二苯)-二硫基]苯并噁唑(3j2):白色固体. m.p. 125~128 ℃; 1H NMR (CDCl3) δ: 7.25~7.46 (m, ArH, 9H), 7.72~7.84 (m, ArH, 3H); 13C NMR (CDCl3) δ: 109.67, 119.73, 120.30, 123.62, 128.17, 134.68, 139.14, 149.31, 153.53; HRMS (ESI) clacd for C20H12N2S2O2: 377.0413, found 377.0423.
2-[(4-甲氧基苯)硫基]苯并噁唑(3k)[31]:无色液体. 1H NMR (CDCl3)δ: 3.83 (s, OCH3, 3H), 6.94~6.95 (m, ArH, 2H), 7.16~7.26 (m, ArH, 3H), 7.41~7.45 (m, ArH, 1H), 7.55~7.56 (m, ArH, 2H); 13C NMR (CDCl3) δ: 56.28, 110.82, 116.16, 117.85, 119.81, 124.91, 125.14, 137.64, 142.92, 152.75, 162.05, 165.30.
2-[(4-甲基苯)硫基]苯并噁唑(3l)[31]:无色液体, 1H NMR (CDCl3) δ: 2.38 (s, CH3, 3H), 7.22~7.25 (m, ArH, 4H), 7.40~7.59 (m, ArH, 4H); 13C NMR (CDCl3) δ: 21.63, 110.22, 119.23, 123.51, 124.38, 124.55, 130.73, 134.93, 140.60, 142.24, 152.10, 164.19.
辅助材料(Supporting Information) 产物3a~3l的1H NMR, 13C NMR和MS谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Xiao, F.; Chen, H.; Xie, H.; Chen, S.; Yang, L.; Deng, G. Org. Lett. 2014, 16, 50. doi: 10.1021/ol402987u
-
[2]
Inomata, H.; Toh, A.; Mitsui, T.; Fukuzawa, S. Tetrahedron Lett. 2013, 54, 4729. doi: 10.1016/j.tetlet.2013.06.104
-
[3]
Varun, B.; Prabhu, K. J. Org. Chem. 2014, 79, 9655. doi: 10.1021/jo501793q
-
[4]
Alves, D.; Lara, R.; Contreira, M.; Radatz, C.; Duarte, L.; Perin, G. Tetrahedron Lett. 2012, 53, 3364. doi: 10.1016/j.tetlet.2012.04.094
-
[5]
Azam, M.; Suresh, B. Sci. Pharm. 2012, 80, 789.
(b) Pejin, B.; Iodice, C.; Tommonaro, G. J. Nat. Prod. 2008, 71, 1850.
(c) Wei, H.; Yang, G. Bioorg. Med. Chem. 2006, 14, 8280.
(d) Gangjee, A.; Zeng, Y.; Talreja, T. J. Med. Chem. 2007, 50, 3046. -
[6]
肖尚友, 朱俊, 穆小静, 有机化学, 2013, 33, 1668. doi: 10.6023/cjoc201210023Xiao, S.; Zhu, J.; Mu, X. Chin. J. Org. Chem. 2013, 33, 1668 (in Chinese). doi: 10.6023/cjoc201210023
-
[7]
Qiao, Z. J.; Liu, H.; Xiao, X.; Fu, X. Org. Lett. 2013, 15, 2594. doi: 10.1021/ol400618k
-
[8]
Wang, B.; Graskemper, J. W.; Qin, L.; DiMagno, S. Angew. Chem., Int. Engl. 2010, 49, 4079. doi: 10.1002/anie.201000695
-
[9]
Liu, K.; Ou, H.; Shi, X. J. Org. Chem. 2014, 4, 681.
-
[10]
Kumat, S.; Engman, L. J. Org. Chem. 2006, 71, 5400. doi: 10.1021/jo060690a
-
[11]
Wang, D.; Yu, X.; Zhao, K.; Li, L.; Ding, Y. Tetrahedron Lett. 2014, 55, 5739. doi: 10.1016/j.tetlet.2014.08.088
-
[12]
Taniguchi, N. J. Org. Chem. 2006, 71, 7874. doi: 10.1021/jo060834l
-
[13]
Ge, W.; Wei, Y. Green Chem. 2012, 14, 2066. doi: 10.1039/c2gc35337g
-
[14]
Luo, P.; Yu, M.; Tang, R.; Zhong, P.; Li, J. Tetrahedron Lett. 2009, 50, 1066. doi: 10.1016/j.tetlet.2008.12.066
-
[15]
Sekar, R.; Srinivasan, M.; Marcelis, A.; Sambandam, A. Tetrahedron Lett. 2011, 52, 3347. doi: 10.1016/j.tetlet.2011.04.078
-
[16]
He, Z.; Luo, F.; Li, Y.; Zhu, G. Tetrahedron Lett. 2013, 54, 5907. doi: 10.1016/j.tetlet.2013.08.097
-
[17]
Mondal, J.; Borah, P.; Modak, A.; Zhao, Y. L.; Bhaumik, A. Org. Process Res. Dev. 2014, 18, 257. doi: 10.1021/op4000994
-
[18]
Zhang, X.; Zeng, W.; Yang, Y.; Huang, H.; Liang, Y. Org. Lett. 2014, 16, 876. doi: 10.1021/ol403638d
-
[19]
Song, H.; Leninger, M.; Lee, N.; Liu, P. H. Org. Lett. 2013, 15, 4854. doi: 10.1021/ol402275t
-
[20]
Varala, R.; Ramu, E.; Alam, M.; Adapa, S. Chem. Lett. 2004, 33, 1614. doi: 10.1246/cl.2004.1614
-
[21]
Jalalian, N.; Petersen, T.; Olofssn, B. Chem. Eur. J. 2012, 18, 14140. doi: 10.1002/chem.v18.44
-
[22]
He, G.; Huang, Y.; Tong, Y.; Zhang, J.; Zhao, D.; Zhou, S.; Han, S. Tetrahedron Lett. 2013, 54, 5318. doi: 10.1016/j.tetlet.2013.07.096
-
[23]
张变香, 陈凯, 杨丽花, 有机化学, 2015, 35, 905. doi: 10.6023/cjoc201410009Zhang, B.; Chen, K.; Yang, L. Chin. J. Org. Chem. 2015, 35, 905 (in Chinese). doi: 10.6023/cjoc201410009
-
[24]
Ivelina, M.; Charlotte, A.; Naomi, S. J. Org. Chem. 2014, 79, 1947. doi: 10.1021/jo402586v
-
[25]
Natividad, H.; Maria, S.; Ana, N. J. Agric. Food Chem. 2015, 63, 3681. doi: 10.1021/acs.jafc.5b00150
-
[26]
Prilezhaeva, E. N.; Shmonina, L. I. Khimicheskaya 1969, 670.
-
[27]
Michitada, S.; Teruya, A.; Watanabe, Y. Yakugaku Zassh 1965, 85, 962.
-
[28]
Murru, S.; Ghosh, H.; Sahoo, K. S.; Patel, K. B. Org. Lett. 2009, 11, 4254. doi: 10.1021/ol9017535
-
[29]
Prasad, D.; Naidu, A.; Sekar, G. Tetrahedron Lett. 2009, 50, 1411. doi: 10.1016/j.tetlet.2009.01.022
-
[30]
Illuminati, G.; Gilman, H. J. Am. Chem. Soc. 1949, 71, 3349. doi: 10.1021/ja01178a021
-
[31]
Fukuzawa, S.; Shimizu, E.; Atsuumi, Y.; Haga, M.; Ogata, K.; Tetrahedron Lett. 2009, 50, 2374. doi: 10.1016/j.tetlet.2009.02.214
-
[1]
-
表 1 反应条件的优化a
Table 1. Optimization of reaction conditions

Entry CuI/mol% Base Time/min Solvent Yield/% 1 — KOH 10 DMF Trace 2 5 KOH 10 DMF 65 3 8 KOH 10 DMF 69 4 10 KOH 10 DMF 72 5 12 KOH 10 DMF 68 6 10 KOH 12 DMF 73 7 10 KOH 15 DMF 81 8 10 KOH 18 DMF 70 9 10 K2CO3 15 DMF 5 10 10 NEt3 15 DMF 3 11 10 NaOH 15 DMF 55.3 12 10 KOH 15 DMSO 55.2 13 10 KOH 15 DME 0 14 10 KOH 15 DMP 39.4 aReaction conditions: 1a (2 mmol), 2a (2 mmol), solvent (5 mL), CuI, base (5 mol%), and irradiation at 30 W. bIsolated yield. 表 2 杂环芳基硫醚的合成a
Table 2. Synthesis of heterocyclic aromatic sulfides

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 63
- HTML全文浏览量: 2





 下载:
下载:



 下载:
下载:

