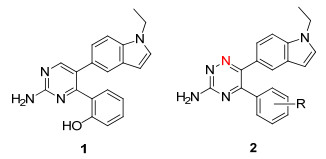
 图 1
化合物1和1, 2, 4-三嗪衍生物2的结构
Figure 1.
Structure of compound 1 and general structure of 1, 2, 4-triazine derivatives 2
图 1
化合物1和1, 2, 4-三嗪衍生物2的结构
Figure 1.
Structure of compound 1 and general structure of 1, 2, 4-triazine derivatives 2

Citation: Liu Jiangong, Li Xiaolong, Cheng Xu, Hao Wenmei, Hai Li, Wu Yong. Condensation of 1-(1-Ethyl-1H-indol-5-yl)-2-phenylethane-1, 2-dione to 1, 2, 4-Triazines[J]. Chinese Journal of Organic Chemistry, 2015, 36(2): 370-376. doi: 10.6023/cjoc201509010

1-(1-乙基-1H-5-吲哚基)-2-苯基-1, 2-二酮缩合成1, 2, 4-三嗪类化合物反应
-
关键词:
- 缩合
- / 不对称1, 2-二酮
- / 同分异构体
- / 1, 2, 4-三嗪
English
Condensation of 1-(1-Ethyl-1H-indol-5-yl)-2-phenylethane-1, 2-dione to 1, 2, 4-Triazines
-
Key words:
- condensation
- / unsymmetrical 1, 2-diketone
- / isomer
- / 1, 2, 4-triazine
-
在化学领域中, 1, 2, 4-三嗪是一类在有机合成中应用最为广泛的中间体之一[1~3], 且广泛存在于多种生物活性物质的基本骨架中, 并表现出多种不同的生物活性[4~7].例如, Congreve等[8]研究了一类1, 2, 4-三嗪衍生物, 作为腺苷A2A受体拮抗剂.最近, 胡有洪等[9]报道了一类微管蛋白聚合抑制剂, 其母核结构为2, 4, 5-三取代嘧啶.其中, 化合物1(图 1)具有较佳的体外微管蛋白聚合抑制作用, IC50达到0.79 μmol·L-1.定量构效关系揭示, 该结构中的1-乙基-吲哚基对其抑制活性有重要作用.借助于计算机辅助药物设计, 设计了一系列的1-乙基-吲哚基取代的1, 2, 4-三嗪衍生物(化合物2, 图 1), 以期获得比化合物1活性更好的微管蛋白聚合抑制剂.
 图 1
化合物1和1, 2, 4-三嗪衍生物2的结构
Figure 1.
Structure of compound 1 and general structure of 1, 2, 4-triazine derivatives 2
图 1
化合物1和1, 2, 4-三嗪衍生物2的结构
Figure 1.
Structure of compound 1 and general structure of 1, 2, 4-triazine derivatives 2
1, 2, 4-三嗪最简便易得的合成方法就是1, 2-二酮与氨基胍盐一步缩合得到, 但绝大部分文献研究底物为对称二酮化合物.查阅文献, 发现唯有Mallikarjuna等[10]报道了非对称情况下的反应产物依然为单一化合物, 且取代基的电性效应对缩合方向无影响; 但是, 据分析, 对于本工作中不对称二酮的底物而言, 其反应可能会产生两个不同的缩合产物化合物2和4 (Eq. 1).因此, 我们对1-(1-乙基-1H-5-吲哚基)-2-苯基-1, 2-二酮与氨基胍盐的缩合反应进行了进一步的探索, 研究其在不同的电性效应影响下, 两个同分异构体组成比例, 以及其缩合的规律.
1 结果与讨论
以苯环上无取代的1-(1-乙基-1H-5-吲哚基)-2-苯基-1, 2-二酮(3a)与氨基胍碳酸氢盐为模型反应, 摸索了该反应的缩合条件(表 1).首先尝试了反应溶剂的选择, 用环己醇作为溶剂时, 在160 ℃下回流并未得到产品(表 1, Entry 3);而改用乙醇或正丁醇作溶剂时, 在各自回流条件下, 得到明显的产品, 但乙醇收率更高(表 1, Entries 1, 2), 故选定乙醇作为溶剂.由于两个异构体的结构非常接近, 故其极性相差极小, 柱层析色谱法并未将其分离.但从1H NMR谱图可明显看出3a缩合后产物分别在δ 7.871与7.768处(吲哚环4位Ar-H峰)以及5.629与5.578处(游离NH2-H峰, 重水交换后消失)出现两组峰.经判断, 两组峰面积大致比例为60:40, 且质谱显示单一分子量, 由此也验证了我们推测——对于不对称二酮的缩合, 其反应可能会产生两个不同的缩合产物.同时, 参考文献[8]的方法, 定向合成了2a (Scheme 1), 确定了δ 7.768所对应的结构为2a, 由此确定混合物中n(2a):n(4a)=40:60 (表 1, Entry 1).
 表 1
合成1, 2, 4-三嗪化合物条件的筛选a
Table 1.
Study of reaction conditions for the synthesis of 1, 2, 4-triazines
表 1
合成1, 2, 4-三嗪化合物条件的筛选a
Table 1.
Study of reaction conditions for the synthesis of 1, 2, 4-triazines

Entry Solvent Temp./℃ Time/h Yieldb/% n(2a):n(4a)c 1 EtOH 78 5 71 40:60 2 n-Butanol 117 5 25 41:59 3 Cyclohexanol 160 5 Trace — 4 EtOH 20 24 Trace — 5 EtOH 50 10 27 24:76 6d EtOH 120 5 39 42:58 a 3a (2 mmol), aminoguanidine (2.5 mmol), solvent (3 mL). b The whole yield of 2a and 4a after column chromatography. c 1H NMR analysis. d The reaction was performed in a sealed tube. 表 1 合成1, 2, 4-三嗪化合物条件的筛选a
Table 1. Study of reaction conditions for the synthesis of 1, 2, 4-triazines进而, 对不同的反应温度进行了筛选.结果表明, 与回流温度(78 ℃)相比, 温度降低或升高均会使反应收率降低, 且温度对产品的组成比例也有一定的影响, 但在温度较高时, 这种影响较小; 温度越高, 产品中2a的比例越大(表 1, Entries 4~6), 但综合反应收率问题, 我们最终选用乙醇回流的条件作为最佳反应条件.
最后, 比较了不同电子云密度的不对称二酮在乙醇回流条件中缩合产物的情况(表 2).研究发现, 当苯环为吸电子硝基取代时, 反应总收率达到81%, 缩合产品n(2b):n(4b)=63:37(表 2, Entry 1).令人意外的是, 当苯环为供电子基团取代时, 缩合产物大部分是系列2的产品(表 2, Entries 2~7).非常幸运的是, 在目标化合物设计初期的构效关系研究及相关报道中提到, 苯环上为供电子基团时化合物活性最佳[9].由此, 本路线可作为目标衍生物的合成路线.
 表 2
不同取代的不对称二酮3与氨基胍的缩合反应研究a
Table 2.
Condensation of various 1, 2-diketones 3 with aminoguanidine under the optimized conditions
表 2
不同取代的不对称二酮3与氨基胍的缩合反应研究a
Table 2.
Condensation of various 1, 2-diketones 3 with aminoguanidine under the optimized conditions

Entry Substrate Time/h Product Yieldb/% n(2):n(4)c 1 
3 
81 63:37 2 
4 
55 100:0 3 
5 
43 93:7 4 
8 
40 94:6 5 
5 
49 100:0 6 
5 
51 100:0 7 
4.5 
46 100:0 a Reaction condition: 2 mmol of 1, 2-diketones and 2.5 mmol of aminoguanidine in ethanol at 78 ℃. b The whole yield of 2 and 4 after column chromatography. c 1H NMR analysis. 表 2 不同取代的不对称二酮3与氨基胍的缩合反应研究a
Table 2. Condensation of various 1, 2-diketones 3 with aminoguanidine under the optimized conditions该反应可能的机理如Scheme 2.当反应底物为3a时, 氨基胍可进攻C(1), C(2)位羰基, 脱去一分子的H2O, 按路线1和路线2, 形成了如图所示的中间体A和B, 再环合并脱去一分子的H2O, 形成两个同分异构体的混合物.由前文中目标定向合成的方法, 我们合成了其中一个产品, 并确定了缩合反应中, 两个同分异构体的比例n(2a):n(4a)=40:60.
随后, 运用Schodinger 2013-1软件包的Jaguar多功能量化并行计算软件, 采用B3LYP/6-311G+(d, p)的计算方法, 得到底物羰基碳的Mulliken Charge(电荷分布情况), 如图 2.
从计算结果可以看出, 当底物为3a时, C(2)的电正性比C(1)大, 有+0.026e的电荷差, 故氨基的亲核取代易发生在C(2)位的羰基, 生成以Route 1的产品4a为主的混合物[n(4a):n(2a)=60:40].当底物为吸电子硝基苯取代的3b时, 由于硝基的吸电子作用, 使得C(2)的正电性增大, 比苯环取代时C(2)的正电性有0.004e的增大, 与C(1)有+0.031e的电荷差, 故仍旧以Route 1的产品4b为主, 且其比例也略有提高[n(4b):n(2b)=63:37], 电荷差的增大可能与产品比例变化呈正相关.但底物为邻甲氧基苯基取代的3c时, 由于甲氧基的给电子作用, 使得C(2)的正电性大大降低到0.144e, 而此时计算出C(1)的正电性升高到0.158e, 此时C(2)低于C(1)的正电性, 故此时氨基的亲核取代易发生在C(1)位, 生成以Route 2的产品2c为主; 实验结果亦显示, 缩合仅生成较单一的2c, 而C(2)与C(1)的电荷差为-0.014e, 这种电荷差的翻转, 可能是导致生成较单一的2系列化合物的原因.故由此推测, 当苯环上的取代为供电子基时, 生成以2系列产物为主的产品, 甚至是仅生成2系列的产品.
2 结论
报道了一种简单实用的以1-(1-乙基-1H-5-吲哚基)-2-苯基-1, 2-二酮为底物合成1, 2, 4-三嗪的方法.结果显示, 不同的电子云密度对该反应缩合产物的影响规律为:当苯环无取代或被硝基取代时所得产品为两种缩合产物的混合物(2和4), 推测可能是由于苯环本身具有弱吸电性, 而硝基为强吸电子基团; 当苯环被供电子基团取代时, 所得到的产品大部分为系列2的缩合产物.该类1, 2, 4-三嗪化合物生物活性试验还正在进行中, 相关活性数据会跟进报道.
3 实验部分
3.1 仪器与试剂
核磁共振用Varian INOVA-400型核磁共振仪测定, 以氘代氯仿或氘代二甲基亚砜作为溶剂, 四甲基硅烷(TMS)为内标; 高分辨质谱用Agilent 1946B质谱仪测定; 熔点用YRT-3型熔点测定仪测定, 温度未校正; 所用试剂均为分析纯.化合物3按照文献[11]方法制备.
3.2 实验方法
3.2.2 6-(1-乙基-1H-5-吲哚基)-5-苯基-3-氨基-1, 2, 4-三嗪(2a)的定向合成
5-苯基-3-氨基-6-溴-1, 2, 4-三嗪(9)的合成参考文献[8, 12]操作, 黄色油状物, 收率13%(从原料硫代氨基脲开始计算). 1H NMR (400 MHz, DMSO-d6)δ: 7.73~7.75 (m, 2H), 7.47~7.56 (m, 5H).
(1-乙基-1H-5-吲哚基)硼酸(10)的合成参考文献[9]操作, 黄色油状物, 收率69%. 1H NMR (400 MHz, DMSO-d6) δ: 8.05 (s, 1H), 7.77 (s, 2H), 7.59 (d, J=8.0 Hz, 1H), 7.41 (d, J=8.0 Hz, 1H), 7.35 (d, J=2.8 Hz, 1H), 6.43 (d, J=2.4 Hz, 1H), 4.20 (q, J=6.8 Hz, 2H), 1.36 (t, J=7.2 Hz, 3H).
于封管中将9 (20 mg, 0.08 mmol)溶于1, 4-二氧六环(2.0 mL)中, 依次加入10 (18.1 mg, 0.096 mmol), K2CO3 (33.12 mg, 0.24 mmol), H2O (1.0 mL)及Pd(PPh3)4 (4.6 mg, 0.004 mmol), 避氧密封, 于150 ℃搅拌18 h后, 将反应液冷却至室温, 加入10 mL水稀释, 乙酸乙酯萃取, 合并有机层, 无水硫酸钠干燥后, 浓缩得粗品, 柱层析纯化[V(二氯甲烷):V(甲醇)=100:1], 得淡黄色固体21.6 mg, 收率86%. m.p. 176~178 ℃; 1H NMR (400 MHz, CDCl3) δ: 7.77 (s, 1H), 7.50 (d, J=7.2 Hz, 2H), 7.35~7.39 (m, 1H), 7.27 (dd, J=8.4, 6.4 Hz, 3H), 7.17 (d, J=8.0 Hz, 1H), 7.13 (d, J=3.2 Hz, 1H), 6.46 (d, J=2.8 Hz, 1H), 4.16 (dd, J=7.2, 7.2 Hz, 2H), 1.46 (t, J=7.2 Hz, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 161.8, 155.5, 152.4, 148.8, 139.2, 136.3, 132.7, 131.5, 129.6, 128.1, 127.1, 122.6, 121.5, 109.5, 101.9, 40.7, 15.7; IR (KBr) ν: 3307.38, 3184.45, 2977.18, 2933.05, 1619.08, 1519.93, 1461.73, 1384.85, 1340.36, 1220.34, 1109.43, 1045.34, 768.28, 725.96, 699.98 cm-1; HRMS calcd for C19H17N5[M+H]+ 316.1557, found 316.1549.
辅助材料(Supporting Information)部分中间体及所有终产物的图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
3.2.1 1, 2, 4-三嗪的合成
将1, 2-二酮(0.256 mmol)溶于2 mL乙醇, 加入氨基胍碳酸氢盐(43 mg, 0.32 mmol)形成混悬液, 反应混合物加热回流. TLC检测原料反应完全后, 冷却至室温, 25%的氨水溶液调节混合液pH至8, 再用乙酸乙酯提取, 合并有机层, 无水硫酸钠干燥, 浓缩, 柱层析得1, 2, 4-三嗪.
6-(1-乙基-1H-5-吲哚基)-5-(2-甲氧基苯基)-3-氨基-1, 2, 4-三嗪(2c):黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.83 (s, 1H), 7.58 (d, J=7.2 Hz, 1H), 7.37~7.42 (m, 2H), 7.21 (d, J=8.4 Hz, 1H), 7.11~7.14 (m, 2H), 6.73 (d, J=8.4 Hz, 1H), 6.42 (d, J=2.8 Hz, 1H), 6.18 (brs, 1H), 4.14 (dd, J=7.6, 6.8 Hz, 2H), 3.19 (s, 3H), 1.44 (t, J=7.6 Hz, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 161.8, 157.8, 155.5, 148.8, 137.6, 136.3, 135.2, 132.7, 131.5, 129.6, 128.4, 128.0, 127.2, 122.6, 121.5, 109.7, 101.9, 60.4, 40.7, 15.7; IR (KBr) ν: 3308.43, 3185.32, 2976.87, 2934.15, 1618.56, 1518.73, 1462.52, 1384.67, 1340.58, 1219.89, 1109.36, 1042.54, 803.14, 763.68 cm-1; HRMS calcd for C20H19N5O[M+H]+ 346.1662, found 346.1669.
6-(1-乙基-1H-5-吲哚基)-5-(3, 4-二甲氧基苯基)-3-氨基-1, 2, 4-三嗪(2d):黄色油状物. 1H NMR (400 MHz, DMSO-d6)δ: 7.59 (s, 1H), 7.41~7.46 (m, 2H), 7.18 (s, 2H), 7.06 (dd, J=8.4, 1.6 Hz, 2H), 6.97 (d, J=2.0 Hz, 1H), 6.87 (d, J=8.2 Hz, 1H), 6.42 (d, J=3.2 Hz, 1H), 4.21 (q, J=7.6 Hz, 2H), 3.72 (s, 3H), 3.36 (s, 3H), 2.50 (s, 3H), 1.33 (t, J=7.6 Hz, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 161.8, 157.8, 152.4, 139.2, 136.3, 132.7, 131.5, 129.6, 128.4, 128.0, 127.2, 122.7, 122.6, 121.5, 109.7, 107.5, 101.3, 60.4, 55.7, 40.7, 15.7; IR (KBr) ν: 3308.27, 3185.56, 2977.09, 2933.85, 1617.72, 1517.37, 1462.64, 1384.64, 1340.46, 1220.21, 1109.33, 1042.62, 887.93, 837.52 cm-1; HRMS calcd for C21H21N5O2[M+H]+ 376.1768, found 376.1764.
6-(1-乙基-1H-5-吲哚基)-5-(3, 4, 5-三甲氧基苯基)-3-氨基-1, 2, 4-三嗪(2e):黄色油状物. 1H NMR (400 MHz, CDCl3) δ: 7.77 (s, 1H), 7.25~7.31 (m, 3H), 7.13~7.19 (m, 2H), 6.70 (s, 1H), 7.47~7.49 (m, 1H), 5.51 (s, 1H), 4.18 (q, J=7.6 Hz, 2H), 3.86 (s, 3H), 3.52 (s, 6H), 1.44 (t, J=7.6 Hz, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 161.8, 157.8, 152.7, 148.8, 137.6, 136.3, 132.7, 131.5, 129.1, 128.4, 127.1, 122.6, 121.5, 109.7, 101.9, 60.4, 55.9, 55.7, 40.7, 15.7; IR (KBr) ν: 3308.71, 3183.97, 2977.58, 2933.49, 1619.61, 1519.26, 1461.53, 1384.75, 1340.57, 1220.43, 1109.22, 1040.89, 846.42 cm-1; HRMS calcd for C22H23N5O3[M+H]+ 406.1874, found 406.1865.
N-{3-[3-氨基-6-(1-乙基-1H-5-吲哚基)-1, 2, 4-三嗪-5-基]苯基}乙酰胺(2f):黄色油状物. 1H NMR (400 MHz, DMSO-d6) δ: 10.0 (s, 1H), 7.88 (s, 1H), 7.58~7.59 (m, 1H), 7.38~7.40 (m, 1H), 7.26 (s, 1H), 7.12 (d, J=7.6 Hz, 1H), 7.04 (dd, J=1.6, 8.2 Hz, 1H), 6.83 (d, J=3.6 Hz, 1H), 6.40 (d, J=3.2 Hz, 1H), 4.18 (q, J=7.6 Hz, 2H), 2.01 (s, 3H), 1.35 (t, J=7.6 Hz, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 168.7, 161.6, 148.9, 139.6, 138.1, 136.5, 135.3, 129.5, 128.6, 127.9, 126.8, 124.1, 122.8, 122.7, 120.3, 119.2, 109.5, 101.9, 40.5, 24.2, 15.7; IR (KBr) ν: 3378.15, 3310.31, 3185.45, 2978.42, 2933.87, 1618.53, 1518.37, 1460.56, 1384.94, 1342.62, 1220.21, 1109.51, 1043.76, 775.81, 694.96 cm-1; HRMS calcd for C21H20N6-O[M+H]+ 373.1771, found 373.1773.
N-{3-[3-氨基-6-(1-乙基-1H-5-吲哚基)-1, 2, 4-三嗪-5-基]苯基}-4-甲基苯磺酰胺(2g):黄色固体, m.p. 170~172 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 10.26 (s, 1H), 7.57~7.65 (m, 3H), 7.44 (d, J=3.2 Hz, 1H), 7.29~7.34 (m, 5H), 7.00~7.08 (m, 3H), 6.81~6.82 (m, 1H), 6.38 (d, J=3.2 Hz, 1H), 4.19 (t, J=7.6 Hz, 2H), 2.32 (s, 3H), 1.34 (t, J=7.6 Hz, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 161.9, 157.3, 148.6, 143.5, 138.7, 138.7, 136.7, 136.4, 129.9, 129.5, 129.1, 127.9, 127.0, 126.7, 124.9, 122.8, 122.6, 120.4, 119.3, 109.5, 101.9, 40.7, 21.2, 15.7; IR (KBr) ν: 3370.18, 3309.88, 3187.65, 2977.58, 2934.78, 1620.15, 1520.76, 1461.28, 1384.55, 1340.81, 1220.78, 1109.57, 1042.09, 768.64, 712.32 cm-1; HRMS calcd for C26H24N6O2S[M+H]+ 485.1754, found 485.1760.
N-{4-[3-氨基-6-(1-乙基-1H-5-吲哚基)-1, 2, 4-三嗪-5-基]苯基}-4-甲基苯磺酰胺(2h):黄色固体, m.p. 210~212 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 10.28 (s, 1H), 7.61~7.64 (m, 3H), 7.45 (d, J=2.8 Hz, 1H), 7.33~7.36 (m, 3H), 7.10 (dd, J=1.6, 8.4 Hz, 1H), 7.01 (d, J=2.8 Hz, 2H), 6.36 (d, J=3.2 Hz, 1H), 4.19 (q, J=7.2 Hz, 2H), 2.35 (s, 3H), 1.35 (t, J=7.6 Hz, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 161.8, 157.1, 148.5, 143.6, 137.6, 136.7, 136.3, 133.2, 130.0, 129.9, 129.4, 127.8, 126.9, 126.8, 122.8, 122.7, 119.7, 109.4, 101.8, 40.6, 21.2, 15.6; IR (KBr) ν: 3369.64, 3310.31, 3188.57, 2977.64, 2934.51, 1619.72, 1519.42, 1461.63, 1384.34, 1341.12, 1219.83, 1108.96, 1041.46, 825.77 cm-1; HRMS calcd for C26H24N6O2S[M+H]+ 485.1754, found 485.1751.
-
-
[1]
陆忠娥, 万军, 陈克潜, 有机化学, 1992, 12, 605. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract331568.shtmlLu, Z.-E.; Wan, J.; Chen, K. Q. Chin. J. Org. Chem. 1992, 12, 605 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract331568.shtml
-
[2]
李英俊, 邵昕, 高立信, 靳焜, 盛丽, 罗潼川, 于洋, 李佳, 有机化学, 2013, 33, 2178. doi: 10.6023/cjoc201304011Li, Y. J.; Shao, X.; Gao, L. X.; Jin, K.; Sheng, L.; Luo, T. C.; Yu, Y.; Li, J. Chin. J. Org. Chem. 2013, 33, 2178 (in Chinese). doi: 10.6023/cjoc201304011
-
[3]
李英俊, 史相玲, 高立信, 靳焜, 盛丽, 吴疆红, 彭立娜, 李佳, 有机化学, 2015, 35, 191. doi: 10.6023/cjoc201405032Li, Y. J.; Shi, X. L.; Gao, L. X.; Jin, K.; Sheng, L.; Wu, J. H.; Peng, L. N.; Li, J. Chin. J. Org. Chem. 2015, 35, 191 (in Chinese). doi: 10.6023/cjoc201405032
-
[4]
Eid, M. M.; Mansour, A. K. J. Heterocycl. Chem. 1988, 25, 1139. doi: 10.1002/jhet.v25:4
-
[5]
Rees, R. W. A.; Russell, P. B.; Foell, T. J.; Bright, R. E. J. Med. Chem. 1972, 15, 859. doi: 10.1021/jm00278a024
-
[6]
March, L. C.; Bajwa, G. S.; Lee, J.; Wasti, K.; Joullie, M. M. J. Med. Chem. 1976, 19, 845. doi: 10.1021/jm00228a024
-
[7]
Kim, J. W.; Lee, D. Y.; Park, C. M. ACS Med. Chem. Lett. 2012, 3, 678. doi: 10.1021/ml300146q
-
[8]
Congreve, M.; Andrews, S. P.; Dore, A. S.; Hollenstein, K. J. Med. Chem. 2012, 55, 1898. doi: 10.1021/jm201376w
-
[9]
Xie, F. C.; Zhao, H. B.; Li, D. W.; Chen, H.; Quan, H. T.; Shi, X. J.; Lou, L. G.; Hu, Y. H. J. Med. Chem. 2011, 54, 3200. doi: 10.1021/jm101388d
-
[10]
Mallikarjuna, B. P.; Suresh, K. G. V.; Sastry, B. S.; Nagaraj; Manohara, K. P. J. Zhejiang Univ., Sci. B 2007, 8, 526. doi: 10.1631/jzus.2007.B0526
-
[11]
Cheng, X.; Li, X. L.; Wan, W. L.; Hao, W. M.; Hai, L.; Wu, Y. Chem. Res. Chin. Univ. 2015, 31, 53. doi: 10.1007/s40242-015-4373-2
-
[12]
Congreve, M.; Andrews, S. P.; Mason, J. S.; Richardson, C. M.; Brown, G. A. WO 2011095625, 2011 [Chem. Abstr. 2011, 155, 271296].
-
[1]
-
图式1 6-(1-乙基-1H-5-吲哚基)-5-苯基-3-氨基-1, 2, 4-三嗪(2a)的合成
Scheme 1 Synthesis of 6-(1-ethyl-1H-indol-5-yl)-5-phenyl-1, 2, 4-triazin-3-amine (2a)
Reagents and conditions: (a) CH3I, EtOH, reflux, 81%; (b) K2CO3, AcOH, THF/H2O (V:V=1:1), r.t., 52%; (c) m-CPBA, CH2Cl2, r.t., 72%; (d) NH3·H2O, r.t., 65%; (e) NBS, DMF, -20 oC, 64%; (f) n-BuLi, triisopropyl borate, THF, -78 oC, 69%; (g) Pd(PPh3)4, K2CO3, 1, 4-dioxane/H2O, 150 oC, 86%.
表 1 合成1, 2, 4-三嗪化合物条件的筛选a
Table 1. Study of reaction conditions for the synthesis of 1, 2, 4-triazines

Entry Solvent Temp./℃ Time/h Yieldb/% n(2a):n(4a)c 1 EtOH 78 5 71 40:60 2 n-Butanol 117 5 25 41:59 3 Cyclohexanol 160 5 Trace — 4 EtOH 20 24 Trace — 5 EtOH 50 10 27 24:76 6d EtOH 120 5 39 42:58 a 3a (2 mmol), aminoguanidine (2.5 mmol), solvent (3 mL). b The whole yield of 2a and 4a after column chromatography. c 1H NMR analysis. d The reaction was performed in a sealed tube. 表 2 不同取代的不对称二酮3与氨基胍的缩合反应研究a
Table 2. Condensation of various 1, 2-diketones 3 with aminoguanidine under the optimized conditions

Entry Substrate Time/h Product Yieldb/% n(2):n(4)c 1 
3 
81 63:37 2 
4 
55 100:0 3 
5 
43 93:7 4 
8 
40 94:6 5 
5 
49 100:0 6 
5 
51 100:0 7 
4.5 
46 100:0 a Reaction condition: 2 mmol of 1, 2-diketones and 2.5 mmol of aminoguanidine in ethanol at 78 ℃. b The whole yield of 2 and 4 after column chromatography. c 1H NMR analysis. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 63
- HTML全文浏览量: 3





 下载:
下载:



 下载:
下载:

