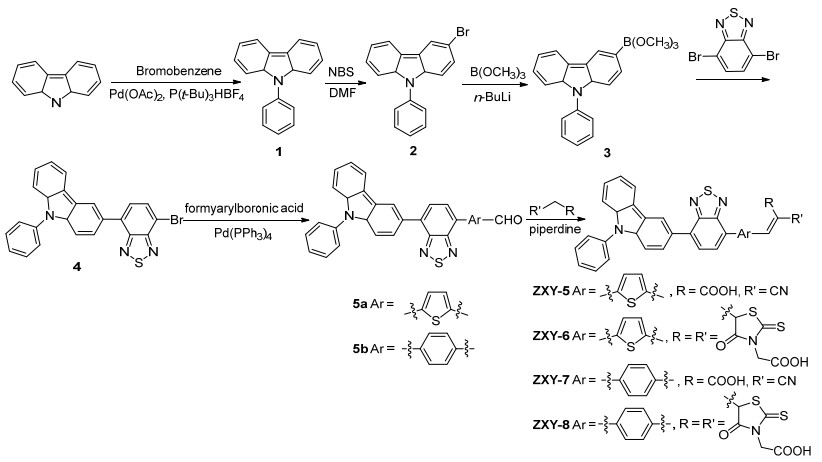
 图式 1
N-苯基咔唑类染料的合成
Scheme1.
Syntheses of N-phenylcarbazole dyes
图式 1
N-苯基咔唑类染料的合成
Scheme1.
Syntheses of N-phenylcarbazole dyes

Citation: Han Liang, Wu Liang, Tong Yongzheng, Zu Xiaoyan, Jiang Shaoli-ang. Syntheses and Photovoltaic Performance of N-Phenylcarbazole Sensitizers with Benzothiadiazole Auxiliary Acceptor[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2940-2947. doi: 10.6023/cjoc201704045

以苯并噻二唑为辅助受体的N-苯基咔唑类染料敏化剂的合成及光伏性能
English
Syntheses and Photovoltaic Performance of N-Phenylcarbazole Sensitizers with Benzothiadiazole Auxiliary Acceptor
-
染料敏化太阳能电池(Dye sensitized solar cell, DSSC)凭借其低成本、高光电转化效率和稳定性良好等优点, 作为半导体硅电池的可能替代物, 受到了广泛关注[1~8].染料敏化剂是DSSC的核心部件, 其吸收太阳光, 产生光电子, 聚集能量, 是DSSC光电转化效率的决定性因素.国内外敏化色素的研究主要分两类, 一类为有机金属配合物, 如联吡啶钌类和卟啉类化合物, 其在可见光区吸收较强, 氧化还原性能可逆, 氧化稳定性高, 但此类配合物难提纯, 成本较高[9]; 而另一类为纯有机非金属敏化染料由于分子结构多样, 且制作生产成本低, 光电转换效率高, 具有良好的发展前景[10~12].
目前“D-π-A”结构的染料敏化剂研究得比较成熟, 已设计和开发了多种染料敏化剂如咔唑型[13, 14]、吲哚型[15, 16]、三芳胺型[17~19]等. 2009年吲哚啉类染料获得当时报道的最高光电转换效率9.5%[20], 但吲哚啉类染料稳定性较差.在此基础上, 染料敏化剂的设计开发由延长π桥转向增加分子的给体或受体, 来实现吸收光谱的红移及光电效率的提高[21].在“D-π-A”结构的染料分子中引入一个额外受体, 构成新型的“D-A-π-A”结构的染料分子, 不仅可以增大染料分子的共轭体系, 增强光生电子的传输动力; 而且能够有效降低分子内最高已占轨道(HOMO)-最低未占分子轨道(LUMO)间的能级差, 促使染料分子吸收光谱红移, 增强染料分子对可见光的吸收, 提高光能利用率.而且相对于延长π桥键的体系, “D-A-π-A”型染料分子更加稳定[22].例如朱为宏等[23]设计并合成了以吲哚为电子给体, 烷氧基取代的喹喔啉为额外受体, 噻吩为桥键, 氰基乙酸为受体的“D-A-π-A”型染料分子, 其中分子中带有辛氧基长链的染料由于具有较强的光吸收能力和抗分子聚集能力, 电池效率达到8.5%;李振等[24]以三芳胺为给体, 苯并噻二唑为额外受体, 设计合成了11种“D-A-π-A”型染料分子, 发现分子中含己基取代噻吩的染料敏化剂光电转换效率达到8.54%.
咔唑及其衍生物由于其良好的光激发和吸收性能、强空穴传输能力以及宽带隙等特点, 现多作为供电基团被引入染料敏化剂中[25].早前的染料分子多采用烯键(C=C)作为π桥键, 但是在光照条件下, 染料分子易发生光学异构化, 造成能量损失.为了增强染料分子的稳定性, 提高电子的传输效率, 现多采用结构稳定的芳香基团(如噻吩基或苯基)作为π桥键.另外, 苯并噻二唑是一个强的拉电子基团, 具有较高氧化电位和良好的稳定性, 分子结构小, 易修饰, 将其引入到染料分子中可以降低分子内HOMO-LUMO间的能级差[22], 从而可以有效改善DSSC的性能.因此我们以N-苯基咔唑为电子给体, 苯并噻二唑为电子受体, 苯基或噻吩基为桥键, 氰基乙酸或罗丹宁乙酸为键合受体, 设计合成了四个N-苯基咔唑染料敏化剂, 对其光谱性能和光电转换性能进行了研究.
1 结果与讨论
1.1 合成
选择以N-苯基咔唑为电子给体, 苯并噻二唑为额外引入的受体, 苯基或噻吩基为桥键, 氰基乙酸或罗丹宁乙酸为键合受体, 合成了四种“D-A-π-A”结构的咔唑染料敏化剂(ZXY-5~ZXY-8).于咔唑N原子上引入苯基, 得到N-苯基咔唑1, 再在N-溴代琥珀酰亚胺(NBS)作用下发生溴代得到3-溴-N-苯基咔唑2.化合物2在正丁基锂催化下与硼酸三甲酯进行反应转变为相应的硼酸酯后, 不经分离直接与4, 7-二溴-苯并噻二唑发生Suzuki偶联反应得到化合物4.化合物4分别与5-甲酰基噻吩-2-硼酸、4-甲酰基苯基硼酸进行Suzuki偶联反应得到中间体醛5, 最后与氰基乙酸或罗丹宁乙酸经Knoevenagel缩合反应得到最终化合物ZXY-5~ZXY-8 (Scheme 1).
1.2 光谱性质
图 1a是N-苯基咔唑类染料敏化剂在甲醇-氯仿混合溶液中的紫外-可见吸收光谱, 表 1列出了其光学性质参数. N-苯基咔唑染料敏化剂的液体紫外吸收主要有两个吸收峰, 短波长处的吸收峰为π→π*吸收峰, 长波长处的吸收峰为分子内电荷转移跃迁吸收峰(ICT).其中以罗丹宁乙酸为受体的ZXY-6只在471 nm处表现出一个吸收峰, 可能原因是短波长处π→π*吸收峰与ICT引发的吸收峰重叠.类似的情况在同样以罗丹宁乙酸为受体的ZXY-8的吸收图谱中也可以观察到, 其在397和441 nm处的吸收峰有一部分重叠, 因而吸收峰变宽.与以氰乙酸为受体的ZXY-5和ZXY-7相比, 以罗丹宁乙酸作为受体的染料敏化剂ZXY-6和ZXY-8由于共轭体系增大, ICT吸收峰发生略微红移, 但摩尔吸光系数显著增加.与以苯基为π桥的ZXY-7和ZXY-8相比, 以噻吩为π桥的ZXY-5和ZXY-6最大波长发生了30~40 nm的红移, 分别由434 (ZXY-7)和441 nm (ZXY-8)移至469 (ZXY-5)和471 nm (ZXY-6), 且摩尔吸光系数更高. ZXY-5和ZXY-6的光谱响应范围也较ZXY-7和ZXY-8拓宽, 红移了约100 nm.由此可见, 噻吩π桥较苯基π桥有利于更大的吸收波长和更宽的吸收光谱, 因而使得ZXY-5和ZXY-6的光吸收能力更强.
Compd. λmaxa/nm εa/(L·mol-1·cm-1) λmaxb/nm λemc/nm ZXY-5 469 26233 458 585 ZXY-6 471 42767 462 594 ZXY-7 434 20300 429 560 ZXY-8 441 38300 437 568 a Maximum absorption wavelength of dyes measured in CH3OH/CHCl3 solution [V(CH3OH): V(CHCl3)=1: 10] (3×10-5 mol·L-1).bMaximum absorption wavelength of dyes on sensitized TiO2 electrodes. cMaximum emission wavelength measured in CH3OH/CHCl3 solution [V(CH3OH): V(CHCl3)=1: 10] (3×10-6 mol·L-1). 图 1b是N-苯基咔唑染料敏化剂负载在TiO2电极上的紫外-可见吸收光谱.当染料吸附在TiO2薄膜上后, 染料通过键合受体中的羧酸基团脱质子与TiO2结合, 同时在TiO2上进行聚集.羧酸基团脱质子后, 吸电子能力下降, 削弱了分子内电荷转移, 导致吸收峰蓝移, 另外, 当染料在TiO2上进行面对面的聚集(H-聚集)时, 也导致吸收峰蓝移.由图 1可知, 与液体紫外吸收相比, N-苯基咔唑染料敏化剂在TiO2薄膜上的吸收峰均发生了蓝移, 可能为羧基脱质子或染料分子间形成H-聚集导致.此外, 在TiO2薄膜上具有不同桥键的染料敏化剂紫外吸收蓝移程度不同.以噻吩基为π桥的染料敏化剂ZXY-5和ZXY-6蓝移比较明显(大约10 nm), 而以苯基为π桥的染料敏化剂ZXY-7和ZXY-8蓝移了约4 nm.可能是五元环的噻吩体积比六元环的苯基体积小, 因而ZXY-5和ZXY-6比ZXY-7和ZXY-8平面性好, 易发生面对面的聚集, 从而使吸收峰蓝移幅度增加.与溶液中类似, 以苯基为π桥的ZXY-7和ZXY-8在TiO2上的吸收范围最大为550 nm, 明显比以噻吩基为π桥的ZXY-5和ZXY-6窄, 蓝移了约100 nm, 再次说明了噻吩π桥有利于提高染料敏化剂的光吸收能力.
1.3 密度泛函理论研究
为了进一步分析N-苯基咔唑染料敏化剂的吸收光谱特征, 利用密度泛函理论(DFT)在B3LYP/6-31G(d)水平上对分子的空间结构进行了优化, 并对其电子云分布进行了模拟, 计算了HOMO和LUMO能级.
图 2为N-苯基咔唑染料敏化剂的空间结构模型.从图中可以看到, N-苯基咔唑部分由于苯基的引入, 使得N-苯基咔唑给体部分发生扭曲, 平面性较差.在ZXY-5和ZXY-6分子中, 苯并噻二唑额外受体、噻吩π桥和氰基丙酸受体处于同一平面, 但在ZXY-7和ZXY-8分子中, 由于苯基π桥体积较大, 与额外受体苯并噻二唑之间具有较大二面角, 分子整体平面性较差, 削弱了分子内电荷转移.因此以苯基为π桥的ZXY-7和ZXY-8 ICT吸收峰较以噻吩为π桥的ZXY-5和ZXY-6蓝移.
在DSSC中, 染料激发态电子快速注入到纳米半导体后, 再接受电解质传递的电子而还原再生.为了实现电池循环反应, 就要求染料分子的最低空轨道(LUMO)的能量高于TiO2的导带能级, 且具有良好的轨道重叠, 而最高占有轨道(HOMO)要低于电解质的氧化还原能级. N-苯基咔唑染料敏化剂前线分子轨道电子云分布如图 3所示, HOMO与LUMO能级轨道具有较好的重叠, 可以有效地保证电子由给体部分传递到受体部分.四种染料分子的LUMO能级电子云离域在苯并噻二唑、π桥和受体上.但以罗丹宁乙酸为受体的ZXY-6和ZXY-8由于受体部分N原子与羧基之间亚甲基的存在, 导致羧基没有与分子其他部分共轭, 因而LUMO能级电子云未覆盖羧基, 这将削弱其染料激发态电子注入到TiO2导带的能力. ZXY-5和ZXY-6分子的HOMO能级主要分布于整个分子.在ZXY-7和ZXY-8分子中, 可能由于苯并噻二唑受体与苯基π桥之间二面角比较大, 导致其HOMO能级主要分布在N-苯基给体和苯并噻二唑受体上.
表 2列出了用B3LYP/6-31G(d)计算的N-苯基咔唑染料分子的前线分子轨道能级值, 并与循环伏安测得实验值进行比较, 理论计算值与实验值基本相符.由表中可以看出, N-苯基咔唑染料分子的HOMO能级位于-5.44~-5.33 eV, 低于电解质I-/I3-的氧化还原电位(-4.9 eV); 而LUMO能级位于-2.99~-2.80 eV, 高于TiO2的导带能级(-4.0 eV).因此染料的激发态电子可以有效注入到光阳极, 并且可以从还原态电解质得到电子而重生.此外, 以噻吩作为桥键的ZXY-5和ZXY-6不仅具有较高的HOMO能级, 而且LUMO能级较低, 因而能级差较ZXY-7和ZXY-8小, 电子跃迁更易, 紫外吸收波长红移.
Compd. Experimental/eV Calculatedd/eV HOMOa E0-0b LUMOc HOMO E0-0 LUMO ZXY-5 -5.12 2.31 -2.81 -5.41 2.42 -2.99 ZXY-6 -5.13 2.39 -2.74 -5.33 2.39 -2.94 ZXY-7 -5.14 2.47 -2.67 -5.44 2.64 -2.80 ZXY-8 -5.15 2.44 -2.71 -5.40 2.56 -2.84 a The oxidation potential in DMF was determined from cyclic voltammograms and used to describe the ground-state energy HOMO. bE0-0 was calculated from E0-0=1240/λint and λint was the intersection of the normalized absorption and emission spectra. cELUMO was calculated from ELUMO=EHOMO+E0-0. dCalculated at the B3LYP/6-31G(d) level in vaccum. 1.4 光电转换性能
测量不同波长单色光照射下N-苯基咔唑染料敏化剂太阳能电池产生的短路电流, 得到入射单色光子-电子转化效率(IPCE)曲线如图 4a所示. IPCE为太阳能电池的电荷载流子数目与照射在其表面一定能量的光子数目的比率, 与染料敏化剂的光吸收能力和电子注入效率有关.从图 4中可以看出, N-苯基咔唑染料敏化剂太阳能电池IPCE曲线响应范围主要分布在300~650 nm之间.以氰基乙酸为受体的染料ZXY-5和ZXY-7的IPCE曲线响应值较大, 最大值分别为31%和50%;而以罗丹宁乙酸作为受体的染料ZXY-6和ZXY-8的IPCE响应较弱, 最大值仅为7%和36%.究其原因, 可能是以罗丹宁乙酸为受体的染料中亚甲基的存在, 导致与TiO2键合的羧基不能与分子其他部分形成共轭, 因而导致其电子注入能力较差, 从而降低了IPCE值.另外值得注意的是, 以苯基为π桥的染料敏化剂ZXY-7和ZXY-8的IPCE最大值分别为50%和36%, 明显高于以噻吩基为π桥的染料敏化剂ZXY-5和ZXY-6.由前面光谱性质结果可知, ZXY-5和ZXY-6的光吸收能力优于ZXY-7和ZXY-8, 而后者却表现出更优的入射单色光子-电子转化效率, 表明ZXY-7和ZXY-8具有较优的电子注入效率, 弥补了其光吸收能力弱的缺点.
N-苯基咔唑染料敏化剂太阳能电池的电流-电压(I-V)曲线如图 4b所示, 光电性能参数列于表 3.可以看出, 以苯基为π桥的染料敏化剂由于光电子注入效率高, 表现出比噻吩为π桥的染料敏化剂更高的光电流密度.四种N-苯基咔唑染料中, 以苯基为π桥、氰基乙酸为受体的ZXY-7具有最高的IPCE值和最宽的IPCE响应范围, 对应其最高的光电流密度9.14 mA/cm2.尽管ZXY-8的IPCE值比ZXY-5高, 其在长波530~630 nm处IPCE值低于ZXY-5.可能长波长处略低的ICPE值抵消了ZXY-8短波长处较高的IPCE值, 使得ZXY-8 (5.97 mA/cm2)的光电流密度较ZXY-5 (6.83 mA/cm2)低. ZXY-6由于其IPCE值明显偏低, 光电流密度最小.除了光电流密度外, 光电压也是决定染料光电转换效率的重要因素, 取决于染料敏化剂的电子注入能力和电荷重组速率.以苯基为π桥的ZXY-7和ZXY-8由于电子注入效率较高, 因而开路电压明显高于以噻吩基为π桥的ZXY-5和ZXY-6.而以罗丹宁乙酸为受体的ZXY-6和ZXY-8由于羧基无法与分子其他部分形成共轭, 削弱了电子注入能力, 导致开路电压明显降低.四种染料敏化剂中, 以苯基为π桥、氰基乙酸为受体的染料敏化剂ZXY-7由于具有最高的光电流密度和光电压, 从而获得最高光电转化效率5.28%.值得一提的是, ZXY-5尽管具有较好的光电流密度和光电压, 但由于填充因子过低, 使得光电转换效率偏低, 相关原因仍在探索中.
Compd. Voc/V Jsc/(mA·cm-2) FF η/% ZXY-5 0.62±0.01 6.83±0.03 0.33±0.03 1.40±0.06 ZXY-6 0.50±0.01 2.29±0.01 0.71±0.02 0.82±0.02 ZXY-7 0.74±0.01 9.14±0.02 0.78±0.01 5.28±0.03 ZXY-8 0.61±0.01 5.97±0.02 0.76±0.03 2.77±0.01 1.5 电化学性质
电化学阻抗(EIS)是一种利用等效电路模拟DSSC各部分电阻, 进而研究电池中电子的转移以及在光阳极和电解质界面的电子转移和电荷复合情况的方法.在黑暗中, 对N-苯基咔唑染料敏化剂的电化学阻抗图谱进行了测定, 相关Bode图见图 5.一般, 0.1~1 Hz的低频区代表I3-在电解液中的传递过程, 对应低频的电解液的Nernst扩散阻抗(Z1); 1~1000 Hz的中频区代表光生激发态电子从TiO2表面经电解质到对电极的传递过程(Z2), 对应中频的半导体氧化物/染料/电解液界面电子传输的阻抗; 大于1 kHz的高频区则代表着I3-在电解液及铂对电极上的还原过程, 对应高频的对电极的氧化还原反应阻抗(Z3).由图 5可知, 染料ZXY-5和ZXY-6只出现一个峰, 其对应于电子在半导体氧化物/染料/电解液界面电子传输的阻抗(Z2), 由于电解液I3-离子的扩散阻抗(Z1)和氧化还原反应阻抗(Z3)相对比较小, 因而被Z2阻抗的半圆弧所掩盖.而染料ZXY-7和ZXY-8则有两个峰, 分别对应的是电解液I3-离子的氧化还原反应阻抗(Z3)和电子在半导体氧化物/染料/电解液界面电子传输的阻抗(Z2). Bode图中Z2峰对应的频率越小, 表明电池中电荷重组的速率越小, 电子寿命增长.四种N-苯基咔唑染料敏化剂的Z2峰对应的频率排序为: ZXY-5 (564 Hz)>ZXY-6 (333 Hz)>ZXY-7 (27 Hz)>ZXY-8 (20 Hz), 表明以苯基为π桥的ZXY-7和ZXY-8电荷重组速率小, 电子寿命较长, 有利于提高其开路电压.如前所述, 分子平面性好的ZXY-5和ZXY-6易在TiO2形成聚集, 使得电荷重组几率增大.而ZXY-7和ZXY-8中由于苯基与苯并噻二唑受体之间夹角较大, 削弱了分子平面性, 也减少了分子聚集程度, 降低了电荷重组几率.由此可见, 在N-苯基咔唑染料中, 苯基π桥的引入, 不仅有利于电荷注入效率的提高, 而且减少了电荷重组几率, 有利于提高光电转换效率.
2 结论
以N-苯基咔唑为电子给体, 苯并噻二唑为额外受体, 噻吩或苯环为π桥, 氰基乙酸或罗丹宁乙酸为键合受体, 合成了四种N-苯基咔唑染料敏化剂.通过π桥和键合受体的变化对染料敏化剂的光谱性质和光电转换性质的影响进行了分析.发现以罗丹宁乙酸为受体的染料敏化剂由于共轭体系较大, 吸光强度显著增长; 以噻吩为π桥的染料敏化剂由于平面性较好, ICT吸收显著红移, 紫外吸收光谱加宽.在光电性能转换方面, 以罗丹宁乙酸为受体的染料敏化剂, 由于羧基与分子其他部分未形成共轭, 导致电子注入能力变差; 而以苯基为π桥的染料敏化剂, 尽管光谱吸收相对较窄, 但电子注入效率高, 且电荷重组几率小, 导致光电流密度和光电压较高.在四种N-苯基咔唑类染料敏化剂中, 以苯基作桥键和氰基乙酸作为受体的染料敏化剂ZXY-7光电转化效率最高, 达到5.28%.
3 实验部分
3.1 仪器与试剂
咔唑、正丁基锂、硼酸三甲酯、四三苯基膦钯、碳酸钾、氰乙酸、罗丹宁乙酸及其他常用试剂均为化学纯试剂. X-4数字显示显微熔点测定仪; Bruker Avance Ⅲ 500 MHz型核磁共振仪; Shimadzu UV-2550紫外-可见光谱仪; Hitachi FL-2500 spectrofluorometer三维荧光光谱仪; Thermo Finnigan LCQ Series, Agilent 6210 Series Time-of-Flight质谱仪(ESI/APCI).
3.2 咔唑类染料敏化剂的合成
3.2.1 9-苯基-9H-咔唑(1)的合成
化合物1按照文献[26]进行制备, 表征数据与文献一致.
3.2.2 3-溴-9-苯基-9H-咔唑(2)的合成
化合物2按照参考文献[27]进行制备, 表征数据与文献一致.
3.2.3 4-溴-7-(9-苯基-9H-咔唑-3-基)苯并噻二唑(4)的合成
将干燥过的化合物2 (3.16 g, 9.8 mmol)溶于无水四氢呋喃(60 mL)中, 降温至-78 ℃, 在氮气保护下, 用注射器注入正丁基锂的正己烷溶液(4.6 mL, 11.8 mmol), 低温下反应1 h, 然后注入硼酸三甲酯试剂(3.5 mL, 14.7 mmol), 将反应体系缓慢移至室温, 在室温下继续反应24 h, 从而得到白色透明溶液, 直接进行下一步的Suzuki偶联.
在250 mL的三口烧瓶中, 依次加入4, 7-二溴-苯并噻二唑(2.95 g, 9.8 mmol), 真空换氮, 在氮气保护下, 加入四三苯基膦钯(288 mg, 0.25 mmol), 四氢呋喃(50 mL)和2 mol/L的碳酸钾水溶液(2.70 g, 19.6 mmol), 以及上一步的透明溶液, 加热回流24 h, 反应结束后, 冷却, 加入200 mL的水, 用乙酸乙酯(30 mL×3)萃取, 有机层用大量饱和食盐水洗涤, 无水硫酸镁干燥, 过滤, 干燥后得到的粗产品过柱[V(石油醚):V(乙酸乙酯)=50:1]分离, 得到2.85 g黄色固体4, 收率64%. m.p. 105 ℃; 1H NMR (500 MHz, CDCl3) δ: 8.66 (d, J=1.4 Hz, 1H, ArH), 8.23 (d, J=7.7 Hz, 1H, ArH), 7.97~7.95 (m, 2H, ArH), 7.69~7.61 (m, 5H, ArH), 7.56~7.51 (m, 2H, ArH), 7.47~7.42 (m, 2H, ArH), 7.36~7.33 (m, 1H, ArH).
3.2.4 5-(7-(9-苯基-9H-咔唑-3-基)-苯并噻二唑-4-基)噻吩-2-甲醛(5a)的合成
依次将化合物4 (1.70 g, 3.74 mmol)、5-甲酰基噻吩-2-硼酸(0.64 g, 4.11 mmol)、碳酸钾(1.03 g, 7.48 mmol)加入到100 mL三口烧瓶中, 真空换氮, 在氮气保护下, 加入四三苯基膦钯(430 mg, 0.38 mmol)、四氢呋喃(40 mL)和水(3.7 mL), 加热回流24 h, 反应结束后, 冷却, 加入100 mL的水, 用乙酸乙酯(30 mL×3)萃取, 有机层用大量饱和食盐水洗涤, 无水硫酸镁干燥, 过滤, 干燥后得到的粗产品过柱[V(石油醚):V(乙酸乙酯)=10:1]分离, 得到186 mg红色固体5a[28], 收率10.2%. m.p. 125~129 ℃; 1H NMR (500 MHz, CDCl3) δ: 10.00 (s, 1H, CHO), 8.78 (d, J=1.6 Hz, 1H, ArH), 8.25~8.24 (m, 2H, ArH), 8.12 (d, J=7.5 Hz, 1H, ArH), 8.05 (dd, J=7.5, 1.5 Hz, 2H, ArH), 7.90~7.87 (m, 2H, ArH), 7.65 (d, J=7 Hz, 2H, ArH), 7.63 (d, J=1.6 Hz, 1H, ArH), 7.57 (d, J=8.5 Hz, 1H, ArH), 7.55~7.51 (m, 2H, ArH), 7.46 (d, J=2 Hz, 1H, ArH), 7.37~7.34 (m, 1H, ArH).
3.2.5 4-(7-(9-苯基-9H-咔唑-3-基)-苯并噻二唑-4-基)苯甲醛(5b)的合成
依次将化合物4 (1.85 g, 4.06 mmol)、4-甲酰基苯基硼酸(0.73 g, 4.87 mmol)、碳酸钾(1.12 g, 8.12 mmol)加入到100 mL三口烧瓶中, 然后真空换氮, 在氮气保护下, 加入四三苯基膦钯(235 mg, 0.23 mmol)、四氢呋喃(50 mL)和水(4 mL), 加热回流24 h, 反应结束后, 冷却, 加入50 mL的水, 用乙酸乙酯(20 mL×3)萃取, 有机层用大量饱和食盐水洗涤, 无水硫酸镁干燥, 过滤, 干燥后得到的粗产品过柱分离[V(石油醚):V(乙酸乙酯)=10:1], 得431 mg黄色固体5b[28], 收率22.1%. m.p. 119~121 ℃; 1H NMR (500 MHz, CDCl3) δ: 10.14 (s, 1H, CHO), 8.78 (s, 1H, ArH), 8.26 (d, J=7.8 Hz, 1H, ArH), 8.22 (d, J=8.1 Hz, 2H, ArH), 8.09 (d, J=8.3 Hz, 2H, ArH), 8.02 (d, J=8.2 Hz, 1H, ArH), 7.97~7.92 (m, 2H, ArH), 7.82 (d, J=8.1 Hz, 1H, ArH), 7.68~7.63 (m, 4H, ArH), 7.61~7.58 (m, 1H, ArH), 7.57~7.52 (m, 1H, ArH), 7.47 (d, J=3.3 Hz, 1H, ArH), 7.38~7.34 (m, 1H, ArH).
3.2.6 2-氰基-3-(5-(7-(9-苯基-9H-咔唑-3)-苯并[c][1,2,5]噻二唑-4) -噻吩-2)-丙烯酸(ZXY-5)的合成
在氮气保护下, 将化合物5a (110 mg, 0.23 mmol)、氰基乙酸(39 mg, 0.46 mmol)投于施莱克管中, 注入乙腈(4 mL)和氯仿(2 mL), 滴加5滴哌啶, 加热回流4 h, 反应过程中有固体析出.冷却, 抽滤, 用乙腈(5 mL×3)洗涤.干燥, 用CH2Cl2/MeOH (V:V=10:1)重结晶, 得到70 mg暗红色固体ZXY-5, 收率56.4%. m.p. 254~256 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.99 (d, J=1.4 Hz, 1H, ArH), 8.55 (s, 1H, CH=CCN), 8.45 (d, J=7.6 Hz, 1H, ArH), 8.37 (d, J=7.8 Hz, 1H, ArH), 8.35 (d, J=4.1 Hz, 1H, ArH), 8.18 (dd, J=8.6, 1.7 Hz, 1H, ArH), 8.13 (d, J=5.3 Hz, 2H, ArH), 7.76~7.71 (m, 4H, ArH), 7.60 (t, J=7.0 Hz, 1H, ArH), 7.54 (d, J=8.4 Hz, 1H, ArH), 7.51 (t, J=8.1 Hz, 1H, ArH), 7.44 (d, J=8.2 Hz, 1H, ArH), 7.37 (t, J=7.4 Hz, 1H, ArH); HR-ESI-MS calcd for C32H17N4O2S2 [M-H]- 553.0793, found 553.0795.
3.2.7 2-(4-氧代-5-((5-(7-(9-苯基-9H-咔唑-3)-苯并[c][1,2,5]噻二唑-4)-噻吩-2)-亚甲基)-2-硫氧代噻唑啉-3)-乙酸(ZXY-6)的合成
在氮气保护下, 将化合物5a (120 mg, 0.24 mmol)、罗丹宁乙酸(74 mg, 0.39 mmol)投于施莱克管中, 注入乙腈(4 mL)和氯仿(2 mL), 滴加5滴哌啶, 加热回流4 h, 反应过程中有固体析出.冷却, 抽滤, 用乙腈(5 mL×3)洗涤.干燥, 用CH2Cl2/MeOH (V:V=10:1)重结晶, 得到68 mg暗红色固体ZXY-6, 收率44.2%. m.p. 257~258 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.99 (s, 1H, ArH), 8.48 (d, J=7.7 Hz, 1H, ArH), 8.38 (d, J=7.2 Hz, 2H, ArH), 8.26 (s, 1H, CH=C), 8.19 (d, J=8.7 Hz, 1H, ArH), 8.11 (d, J=7.4 Hz, 1H, ArH), 7.98 (d, J=4.3 Hz, 1H, ArH), 7.76~7.70 (m, 4H, ArH), 7.59 (t, J=7.0 Hz, 1H, ArH), 7.55 (d, J=8.6 Hz, 1H, ArH), 7.49 (t, J=7.5 Hz, 1H, ArH), 7.44 (d, J=7.7 Hz, 1H, ArH), 7.37 (t, J=7.1 Hz, 1H, ArH), 4.75 (s, 2H, CH2COOH); HR-ESI-MS calcd for C34H21N4O3S4 [M+H]+ 661.0496, found 661.0496.
3.2.8 2-氰基-3-(4-(7-(9-苯基-9H-咔唑-3)-苯并[c][1,2,5]噻二唑-4)-苯基)丙烯酸(ZXY-7)的合成
在氮气保护下, 将化合物5b (120 mg, 0.25 mmol)、氰基乙酸(42.5 mg, 0.50 mmol)投于施莱克管中, 注入乙腈(4 mL)和氯仿(2 mL), 滴加5滴哌啶, 加热回流4 h, 反应过程中有固体析出.冷却, 抽滤, 用乙腈(5 mL×3)洗涤.干燥, 用CH2Cl2/MeOH (V:V=10:1)重结晶, 得到89 mg红色固体ZXY-7, 收率67.2%. m.p. 226~228 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 14.09 (s, 1H, COOH), 8.94 (s, 1H, ArH), 8.43 (s, 1H, CH=CCN), 8.36 (d, J=7.7 Hz, 1H, ArH), 8.29 (d, J=8.4 Hz, 2H, ArH), 8.23 (d, J=8.5 Hz, 2H, ArH), 8.16 (d, J=7.0 Hz, 2H, ArH), 8.10 (d, J=7.4 Hz, 1H, ArH), 7.76~7.68 (m, 4H, ArH), 7.59 (t, J=7.0 Hz, 1H, ArH), 7.54 (d, J=8.6 Hz, 1H, ArH), 7.49 (t, J=7.5 Hz, 1H, ArH), 7.43 (d, J=8.2 Hz, 1H, ArH), 7.36 (t, J=7.3 Hz, 1H, ArH); HR-ESI-MS calcd for C34H19N4O2S [M-H]- 547.1229, found 547.1229.
3.2.9 2-(4-氧代-5-(4-(7-(9-苯基-9H-咔唑-3)-苯并[c][1,2,5]噻二唑-4)-苯亚甲基)-2-硫氧代噻唑啉-3)-乙酸(ZXY-8)的合成
在氮气保护下, 将化合物5b (130 mg, 0.22 mmol)、罗丹宁乙酸(67 mg, 0.35 mmol)投于施莱克管中, 注入乙腈(4 mL)和氯仿(2 mL), 滴加5滴哌啶, 加热回流4 h, 反应过程中有固体析出.冷却, 抽滤, 用乙腈(5 mL×3)洗涤.干燥, 用CH2Cl2/MeOH (V:V=10:1)重结晶, 得到91 mg红色固体ZXY-8, 收率60.5%. m.p.>300 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 8.95 (s, 1H, ArH), 8.36 (d, J=7.7 Hz, 1H, ArH), 8.29 (d, J=8.4 Hz, 2H, ArH), 8.18~8.14 (m, 2H, ArH), 8.10 (d, J=7.4 Hz, 1H, ArH), 8.00 (s, 1H, CH=C), 7.88 (d, J=8.4 Hz, 2H, ArH), 7.76~7.68 (m, 4H, ArH), 7.59 (t, J=7.0 Hz, 1H, ArH), 7.55 (d, J=8.6 Hz, 1H, ArH), 7.49 (t, J=7.5 Hz, 1H, ArH), 7.43 (d, J=8.2 Hz, 1H, ArH), 7.36 (t, J=7.3 Hz, 1H, ArH), 4.77 (s, 2H, CH2COOH); HR-ESI-MS calcd for C36H21N4O3S3 [M-H]- 653.0778, found 653.0776.
3.3 染料敏化剂电化学性能测试
染料溶液的循环伏安曲线通过IviumStat电化学工作站(IviumStat, Holland)进行测定, 采用三电极体系, 玻碳电极为工作电极, 铂片电极为辅助电极, Ag/AgNO3电极为参比电极; 电解液为0.1 mol/L 4-丁基高氯酸铵(TBAP)的乙腈溶液.
3.4 染料敏化纳米电极的制备及电池器件的组装
利用丝网印刷制备的双层TiO2纳米粒子膜作为光电极:首先在导电玻璃FTO上印一层12 μm厚的20 nm的TiO2粒子(OPV-TiO2, 营口奥匹维特新能源科技有限公司), 450 ℃下马弗炉内煅烧30 min.在浸染料之前将烧好的膜浸入40 mmol·L-1的TiCl4水溶液70 ℃预处理30 min, 然后分别用水和乙醇冲洗, 电吹风吹干.经马弗炉450 ℃下再次煅烧30 min后, 冷却至80 ℃后浸入3×10-4 mol·L-1染料的N, N-二甲基甲酰胺(DMF)溶液室温24 h敏化.对电极的制备:采用丝网印刷方法, 将一定浓度的H2PtCl6溶液印刷在FTO导电玻璃上, 然后400 ℃马弗炉烧结20 min.吸附染料的TiO2电极和铂对电极组装成三明治结构开放电池, 所用电解液为OPV-AN-I型(营口奥匹维特新能源科技有限公司), 1-甲基-3-丙基碘化咪唑(0.3 mol·L-1), I2 (0.03 mol·L-1), LiI (0.07 mol·L-1), 异硫氰酸胍(0.1 mol·L-1)和4-叔丁基吡啶(0.4 mol·L-1)的乙腈溶液.
3.5 电池器件光电性能的测试
单色光光电转换效率IPCE使用PEC-S20 IPCE测试系统(Peccell, Japan)测定.光电压-电流特性曲线的测试是利用Keithley数字源表(Keithley 2601, USA)采集数据, 白光光源为AM 1.5G太阳模拟器(Peccell-L15, Peccell, Japan), 电池的有效面积为0.16 cm2.电池性能数据由两块电池得到.
辅助材料(Supporting Information) 化合物4, 5和化合物ZXY-5~ZXY-8的1H NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Al-Alwani, M. A. M.; Mohamad, A. B.; Ludin, N. A.; Kadhum, A. A. H.; Sopian, K. Renewable Sustainable Energy Rev. 2016, 65, 183. doi: 10.1016/j.rser.2016.06.045
-
[2]
顾承志, 孟舒献, 冯亚青, 有机化学, 2015, 35, 1229. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344832.shtmlGu, C.-Z.; Meng, S.-X.; Feng, Y.-Q. Chin. J. Org. Chem. 2015, 35, 1229(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344832.shtml
-
[3]
Hafeldt, A.; Boschloo, G.; Sun, L. C.; Kloo, L.; Pettersson, H. Chem. Rev. 2010, 110, 6595. doi: 10.1021/cr900356p
-
[4]
马英壮, 郑灵灵, 张立培, 陈志坚, 王树峰, 曲波, 肖立新, 龚旗煌, 化学学报, 2015, 73, 257. doi: 10.3969/j.issn.0253-2409.2015.03.001Ma, Y.-Z.; Zheng, L.-L.; Zhang, L.-P.; Chen, Z.-J.; Wang, S.-F.; Qu, B.; Xiao, L.-X.; Gong, Q.-H. Acta Chim. Sinica 2015, 73, 257(in Chinese). doi: 10.3969/j.issn.0253-2409.2015.03.001
-
[5]
Chaurasia, S.; Lin, J. T. Chem. Rec. 2016, 16, 1311. doi: 10.1002/tcr.201500288
-
[6]
荣耀光, 梅安意, 刘林峰, 李雄, 韩宏伟, 化学学报, 2015, 73, 237. doi: 10.3866/PKU.WHXB201411242Rong, Y.-G.; Mei, A.-Y.; Liu, L.-F.; Li, X.; Han, H.-W. Acta Chim. Sinica 2015, 73, 237(in Chinese). doi: 10.3866/PKU.WHXB201411242
-
[7]
Ye, T.-L.; Wang, J.-H.; Dong, G.-H.; Jiang, Y.-X.; Feng, C.; Yang, Y.-L. Chin. J. Chem. 2016, 34, 747. doi: 10.1002/cjoc.v34.8
-
[8]
韩若冰, 芦姗, 王艳杰, 张雪华, 吴强, 贺涛, 化学学报, 2015, 73, 1061. doi: 10.3969/j.issn.0253-2409.2015.09.006Han, R.-B.; Lu, S.; Wang, Y.-J.; Zhang, X.-H.; Wu, Q.; He, T. Acta Chim. Sinica 2015, 73, 1061(in Chinese). doi: 10.3969/j.issn.0253-2409.2015.09.006
-
[9]
(a) Xie, Y.; Tang, Y.; Wu, W.; Wang, Y.; Liu, J.; Li, X.; Tian, H.; Zhu, W. J. Am. Chem. Soc. 2015, 137, 14055.
(b) Tang, Y.; Wang, Y.; Li, X.; Ågren, H.; Zhu, W.; Xie, Y. ACS Appl. Mater. Interfaces 2015, 7, 27976.
(c) Wei, T.; Sun, X.; Li, X.; Ågren, H.; Xie, Y. ACS Appl. Mater. Interfaces 2015, 7, 21956.
(d) Wang, Y.; Chen, B.; Wu, W.; Li, X.; Zhu, W.; Tian, H.; Xie, Y. Angew. Chem., Int. Ed. 2014, 53, 10779.
(e) Wang, Y.; Li, X.; Liu, B.; Wu, W.; Zhu, W.; Xie, Y. RSC Adv. 2013, 3, 14780. -
[10]
Chaurasia, S.; Liang, C. J.; Yen, Y. S.; Lin, J. T. J. Mater. Chem. C 2015, 3, 9765. doi: 10.1039/C5TC02356D
-
[11]
Kim, B.; Chung, K.; Kim, J. Chem. Eur. J. 2013, 19, 5220 doi: 10.1002/chem.201204343
-
[12]
Lee, C. P.; Lin, R. Y. Y.; Lin, L. Y.; Li, C. T.; Chu, T. C.; Sun, S. S.; Lin, J. T.; Ho, K. C. RSC Adv. 2015, 5, 23810. doi: 10.1039/C4RA16493H
-
[13]
Liu, Y.; He, J.; Han, L.; Gao, J. R. J. Photochem. Photobiol. A 2017, 332, 283. doi: 10.1016/j.jphotochem.2016.08.033
-
[14]
Li, T.; Gao, J. R.; Cui, Y. H.; Zhong, C. J.; Ye, Q; Han, L. J. Photochem. Photobiol. A 2015, 303, 91. http://www.sciencedirect.com/science/article/pii/S0378775314015821
-
[15]
Wang, Y.; Zheng, Z.; Li, T.; Robertson, N.; Xiang, H.; Wu, W.; Hua, J.; Zhu, W. H.; Tian, H. ACS Appl. Mater. Interfaces 2016, 8, 31016. doi: 10.1021/acsami.6b11152
-
[16]
Han, L.; Zhao, J.; Wang, B.; Jiang, S. L. J. Photochem. Photo-biol. A 2016, 326, 1. doi: 10.1016/j.jphotochem.2016.04.011
-
[17]
Eom, Y. K.; Hong, J. Y.; Kim, J.; Kim, H. K. Dyes Pigm. 2017, 136, 496. doi: 10.1016/j.dyepig.2016.09.007
-
[18]
Huang, H. L.; Chen, H. J.; Long, J.; Wang, G.; Tan, S. T. J. Power Sources 2016, 326, 438. doi: 10.1016/j.jpowsour.2016.06.099
-
[19]
Wu, F.; Liu, H.-T.; Lee, L. T. L.; Chen, T.; Wang, M.; Zhu, L.-N. Chin. J. Chem. 2015, 33, 925. doi: 10.1002/cjoc.v33.8
-
[20]
Mishra, A.; Fischer, M. K. R.; Bäuerle P. Angew. Chem., Int. Ed. 2009, 48, 2474. doi: 10.1002/anie.v48:14
-
[21]
Wu, Y. Z.; Zhu, W. H. Chem. Soc. Rev. 2013, 42, 2039. doi: 10.1039/C2CS35346F
-
[22]
Wu, Y.; Zhu, W.; Zakeeruddin, S. M.; Grätzel, M. ACS Appl. Mater. Interfaces 2015, 7, 9307. doi: 10.1021/acsami.5b02475
-
[23]
Pei, K.; Wu, Y.; Wu, W.; Zhang, Q.; Chen, B.; Tian, H.; Zhu, W. Chem. Eur. J. 2012, 18, 8190. doi: 10.1002/chem.v18.26
-
[24]
Chai, Z.; Wan, S.; Zhong, C.; Xu, T.; Fang, M.; Wang, J.; Xie, Y.; Zhang, Y.; Mei, A.; Han, H.; Peng, Q.; Li, Q.; Li, Z. ACS Appl. Mater. Interfaces 2016, 8, 28652. doi: 10.1021/acsami.6b10030
-
[25]
Soman, S.; Rahim, M. A.; Lingamoorthy, S.; Suresh, C. H.; Das, S. Phys. Chem. Chem. Phys. 2015, 17, 23095. doi: 10.1039/C5CP03371C
-
[26]
Watanabe, M.; Nishiyama, M.; Yamamoto, T.; Koie, Y. Tetra-hedron Lett. 2000, 41, 481. doi: 10.1016/S0040-4039(99)02096-1
-
[27]
Liu, Y.; Wang, H.-Y.; Chen, G.; Xu, X.-P.; Ji, S.-J. Aust. J. Chem. 2009, 62, 934
Keerthi, A.; Sriramulu, D.; Liu, Y.; Timothy C. T. Y.; Wang, Q.; Valiyaveettil S. Dyes Pigm. 2013, 99, 787.
-
[1]
-
表 1 N-苯基咔唑染料的光学性质
Table 1. Optical properties of N-phenylcarbazole dyes
Compd. λmaxa/nm εa/(L·mol-1·cm-1) λmaxb/nm λemc/nm ZXY-5 469 26233 458 585 ZXY-6 471 42767 462 594 ZXY-7 434 20300 429 560 ZXY-8 441 38300 437 568 a Maximum absorption wavelength of dyes measured in CH3OH/CHCl3 solution [V(CH3OH): V(CHCl3)=1: 10] (3×10-5 mol·L-1).bMaximum absorption wavelength of dyes on sensitized TiO2 electrodes. cMaximum emission wavelength measured in CH3OH/CHCl3 solution [V(CH3OH): V(CHCl3)=1: 10] (3×10-6 mol·L-1). 表 2 N-苯基咔唑染料的能级水平
Table 2. Energy level of N-phenylcarbazole dyes
Compd. Experimental/eV Calculatedd/eV HOMOa E0-0b LUMOc HOMO E0-0 LUMO ZXY-5 -5.12 2.31 -2.81 -5.41 2.42 -2.99 ZXY-6 -5.13 2.39 -2.74 -5.33 2.39 -2.94 ZXY-7 -5.14 2.47 -2.67 -5.44 2.64 -2.80 ZXY-8 -5.15 2.44 -2.71 -5.40 2.56 -2.84 a The oxidation potential in DMF was determined from cyclic voltammograms and used to describe the ground-state energy HOMO. bE0-0 was calculated from E0-0=1240/λint and λint was the intersection of the normalized absorption and emission spectra. cELUMO was calculated from ELUMO=EHOMO+E0-0. dCalculated at the B3LYP/6-31G(d) level in vaccum. 表 3 N-苯基咔唑染料的DSSC性能参数
Table 3. Parameters for DSSCs based on N-phenylcarbazole dyes
Compd. Voc/V Jsc/(mA·cm-2) FF η/% ZXY-5 0.62±0.01 6.83±0.03 0.33±0.03 1.40±0.06 ZXY-6 0.50±0.01 2.29±0.01 0.71±0.02 0.82±0.02 ZXY-7 0.74±0.01 9.14±0.02 0.78±0.01 5.28±0.03 ZXY-8 0.61±0.01 5.97±0.02 0.76±0.03 2.77±0.01 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 2825
- HTML全文浏览量: 355







 下载:
下载:





 下载:
下载:

