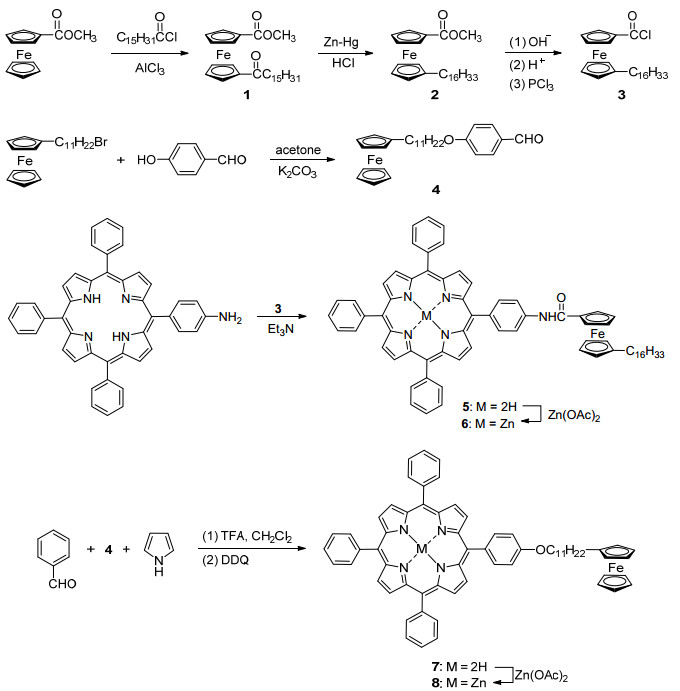
 图 图式1
卟啉5~8的合成
Figure 图式1.
Synthesis of porphyrins 5~8
图 图式1
卟啉5~8的合成
Figure 图式1.
Synthesis of porphyrins 5~8

Citation: Chen Dong, Tuo Qiaoyan, Liu Wenxin, Yin Qin, Tong Xuguang, Zhao Haiying, Li Baoguo, Bian Zhanxi. Synthesis and Properties of Porphyrin Containing Long Chain Alkylferrocene[J]. Chinese Journal of Organic Chemistry, 2015, 36(2): 346-351. doi: 10.6023/cjoc201509007

长链烷基二茂铁取代卟啉的合成与性质
English
Synthesis and Properties of Porphyrin Containing Long Chain Alkylferrocene
-
Key words:
- ferrocene
- / porphyrin
- / UV-Vis absorption spectrum
- / fluorescence spectrum
- / electrochemistry
-
卟啉及其金属络合物是一类重要的功能分子材料, 在自然界中, 光合反应中心的叶绿素以及人类与动物体内储存和运输氧的血红素就分别是镁卟啉和铁卟啉.卟啉这些重要功能激发科学工作者从仿生的角度合成各种卟啉衍生物.其中, 金属锌卟啉由于易于制备且性能优良是应用频率较高的金属卟啉之一[1~3], 如利用锌卟啉中心金属易于配位的特点, 通过与受体分子的配位作用可以构筑具有特定功能的组装体[4, 5].另一方面, 二茂铁取代卟啉化合物的合成及应用近年来引起人们的极大兴趣[6~8].二茂铁主要通过直连, meso位取代和β位取代对卟啉进行修饰.将二茂铁通过共轭方式与卟啉连接, 由于二茂铁具有低的氧化电势, 作为电子给体可以将电子传递给卟啉, 从而降低卟啉的氧化电势, 使卟啉更易于氧化; 同时二茂铁的引入还能减小π电子的HOMO和LUMO能级差, 从而改善卟啉类化合物的光吸收及发光性能[9].因此二茂铁修饰卟啉后赋予了卟啉分子新的功能, 常用作性能优良的光敏剂, 在光电功能材料及器件——如通过给受体之间的光诱导电子转移模拟光合反应中心[10]、基于多氧化还原中心的光电化学传感及电子器件[11, 12]、基于多电子氧化还原催化剂[13, 14]、分子水平的信息存贮[15]及主客体化学[16]等多领域得到广泛应用.二茂铁取代卟啉化合物的应用目前仍是人们研究的热点[17, 18].为了开发新型的卟啉类功能分子, 本文合成了两类二茂铁修饰卟啉及其金属锌卟啉(Scheme 1), 通过紫外-可见吸收光谱(UV-Vis)、荧光光谱以及循环伏安法(CV)研究两类化合物的光谱与电化学特征.
1 结果与讨论
1.1 合成与表征
不对称的1, 1'-双取代二茂铁由于容易产生多种异构体, 一般难于合成.如Scheme 1所示, 本文将二茂铁甲酸甲酯与十六酰氯进行富氏酰基化反应, 得到1'-十六酰基二茂铁甲酸甲酯, 随后经锌汞齐还原、皂化、酸化制得1'-十六酰基二茂铁甲酸[19].将1'-十六酰基二茂铁甲酸用三氯化磷处理, 得到酰氯3, 将酰氯3与5-(4-氨基苯基)-10, 15, 20-三苯基卟啉在室温下反应, 得到卟啉5; 将1分子4-(11-二茂铁基十一烷氧基)苯甲醛(4)[20]与3分子苯甲醛和吡咯反应, 制得卟啉7; 将卟啉5与7与醋酸锌反应, 制得相应的金属锌卟啉6与8.在卟啉5与7的核磁共振氢谱中(1H NMR), 由于卟啉环的强屏蔽作用, 中心氮原子上质子的化学位移出现在δ -2.76处, 与金属锌配位后, 该信号消失.此外, 不同的取代方式, 对卟啉中苯环氢的化学位移产生一定的影响, 在卟啉5与6中, 与酰胺基相连苯环邻位质子的化学位移出现在δ 7.90~8.00处, 而在卟啉7与8中, 与氧相连苯环邻位质子的化学位移出现在δ 7.27~7.28处, 这可能由于酰胺基及茂环的进一步去屏蔽作用所致.卟啉中酰胺上质子的化学位移出现在δ 7.63~7.69处, 与氧相连的亚甲基质子化学位移出现在δ 4.24处.在13C NMR中, 卟啉5与6羰基碳的化学位移出现在δ 168.74~168.88处, 而在红外光谱中, 羰基的伸缩振动出现在1640 cm-1附近.高分辨质谱中均出现了卟啉5~8的正离子信号.这些表征确证了新合成卟啉的结构.
1.2 紫外-可见吸收光谱
UV-Vis光谱可反映出二茂铁与卟啉在基态电子相互作用的情况. 图 1给出了卟啉5~8在N, N-二甲基甲酰胺(DMF)中的UV-Vis光谱对照.在DMF中, 两种卟啉配体5与7的最大吸均出现在419 nm附近, 两种金属锌卟啉6与8的最大吸均出现在426 nm附近.与卟啉配体相比, 金属锌卟啉的最大吸收发生了7 nm的红移, 且摩尔吸光系数增加, Q带吸收峰的数量由4个减少到2个.金属锌卟啉的UV-Vis光谱的变化说明锌离子已与卟啉配体发生配位作用.从上述数据还可以看出, 卟啉与二茂铁单元不同的连接方式与距离对卟啉的吸收几乎未产生影响, 说明基态下二茂铁与卟啉几乎未发生作用.
1.3 荧光光谱
为了研究两种不同连接方式的二茂铁修饰卟啉在激发态电子相互作用情况, 分别测试了卟啉5~8的荧光光谱. 图 2是卟啉5~8以及5, 10, 15, 20-四苯基卟啉(TPP)在激发波长420 nm处具有相同吸收时的荧光光谱对照.从图 2可以看出, 两种卟啉配体的较强荧光均出现在651与717 nm处, 与TPP的位置几乎相同, 而金属锌配合物的荧光发生了较大幅度的蓝移, 这是由于Zn2+具有空4s轨道, 激发态时有部分电子从配体的π轨道跃迁到Zn2+的空4s轨道上, 当从4s轨道再发射时比单纯的π*-π跃迁蓝移[21].此外, 卟啉配体及锌配合物的荧光相对于TPP均发生了猝灭, 与卟啉7与锌卟啉8相比, 含有酰胺键的卟啉5与6荧光猝灭程度更大.为了定量计算卟啉的的荧光猝灭程度, 以TPP (Φf=0.11, CHCl3溶液)为标准, 通过比较的方法计算了卟啉5~8在DMF溶液中的荧光量子产率[7].通过长链相连的二茂铁修饰卟啉7与锌卟啉8的荧光量子产率Φf分别为0.061与0.030, 而通过酰胺键相连的卟啉5与6的Φf大大降低, 分别为0.029与0.013.这些结果说明酰胺键的共轭连接方式更有助于二茂铁与卟啉在激发态相互作用.
1.4 电化学性质
为了研究二茂铁不同取代对卟啉电化学性质的影响, 用CV法测试了卟啉5~8的氧化还原电势, CV曲线见图 3, 氧化还原电势数据列于表 1.从图 3与表 1可知, 化合物5~8均出现了5对氧化还原电势, 其中卟啉的第一、第二氧化电势分别出现在0.383~0.567和0.682~0.896 V附近, 卟啉的第一、第二还原电势分别出现在-1.637~-2.004和-1.957~-2.189 V附近, 而二茂铁的氧化还原电势出现在-0.012~0.184 V附近, 比卟啉的第一氧化电势低, 说明二茂铁作为电子给体能够将电子转移给卟啉.此外, 当卟啉配体与金属锌离子配位后, 卟啉环及二茂铁的氧化还原半波电位均发生负移, 这是因为卟啉配体与金属离子配位后对称性增大, 环共轭效应增强, 卟啉大环的电子密度降低, 使得配合物比配体更难于还原.这一点与紫外可见光谱的变化是相对应的.此外, 通过对卟啉的第一氧化电势数据进行对比, 发现二茂铁距卟啉核较远的7与8比近距离连接的相应的卟啉配体及配合物5与6的第一氧化电势略有降低(13~18 mV), 而二茂铁的第一氧化电势降低幅度较大, 降低182~194 mV左右.说明二茂铁与卟啉连接方式的不同对卟啉的氧化还原电势影响不大, 但是在通过长链烷基相连的二茂铁修饰的卟啉中, 卟啉单元对二茂铁的氧化还原电势影响不大(都接近自由二茂铁的电势0 V), 而通过酰胺键桥连的二茂铁修饰的卟啉中, 由于卟啉与二茂铁单元的电子能量作用较强, 卟啉单元对二茂铁的氧化还原电势有较大的影响, 使二茂铁单元更不易失去电子而被氧化.
Compd. Potential/V vs Fc/Fc+ P-/2- P0/- Fc0/+ P0/+ P+/2+ 5 -1.998 -1.670 0.184 0.567 0.896 6 -2.189 -2.001 0.182 0.401 0.715 7 -1.957 -1.637 0.002 0.554 0.858 8 -2.181 -2.004 -0.012 0.383 0.682 aHalf-wave potential: E1/2=1/2(Epa+Epc), where Epa is the anodic peak potential, Epc is the cathodic peak potential. P: E1/2 of porphyrin; Fc: E1/2 of ferrocene 表 1 卟啉5~8在CH2Cl2溶液中的氧化还原电势a
Table 1. Electrochemical redox potentials of porphyrins 5~8 in CH2Cl22 结论
合成了两类二茂铁修饰的卟啉及其金属锌卟啉, 其中一类将长链烷氧基二茂铁通过酰胺键与卟啉相连, 另一类将二茂铁通过长链与卟啉相连.二茂铁与卟啉的不同连接方式对卟啉的吸收位置未产生影响, 但是却使卟啉的荧光光谱发生较大变化, 表现为酰胺键桥连的二茂铁修饰卟啉及金属卟啉的荧光猝灭程度增大, 量子产率降低.说明在激发态, 在近距离共轭相连的二茂铁修饰卟啉中, 卟啉和二茂铁之间发生了较强的电子和能量的传递.电化学研究表明, 由于卟啉配体与金属锌离子配位后, 环共轭效应增强, 卟啉大环的电子密度降低, 使得配合物比配体更难于还原; 二茂铁与卟啉的不同连接方式对卟啉的第一氧化电势影响不大, 但是在通过长链烷基相连的二茂铁修饰的卟啉中, 卟啉单元对二茂铁的氧化还原电势影响不大, 而通过酰胺键桥连的二茂铁修饰的卟啉中, 由于卟啉与二茂铁作用较强, 卟啉单元对二茂铁的氧化还原电势有较大的影响, 使二茂铁单元更不易失去电子而被氧化.
3 实验部分
3.1 仪器与试剂
NEXUS-670傅里叶变换红外光谱仪, KBr压片; Avance 500 Bruker (500 MHz)核磁共振仪, 以TMS为内标; 岛津UV2600 UV-Vis光谱仪; Bruker ultrafleXtreme MALDI-TOF/TOF高分辨质谱仪; Edinburgh Instruments FLS920荧光光谱仪; AUTOLAB PGSTAT302电化学分析仪, 在298 K下, 样品溶于干燥的CH2Cl2溶液, 加入0.1 mol·L-1四丁基六氟磷酸氨(TBAPF6)作为支持电解质, 用三电极方法, 玻碳电极为工作电极, Pt为对电极, Ag/AgCl为参比电极, Fc/Fc+作为外标, 扫描速率100 mV/s.所用试剂均为市售分析纯试剂, 溶剂的干燥按常规方法进行.
3.2 5-[4-(1'-十六烷基二茂铁甲酰胺基)苯基]-10, 15, 20-三苯基卟啉及其锌配合物的合成
3.3 5-(4-(11-二茂铁基十一烷氧基)苯基)-10, 15, 20-三苯基卟啉及其锌配合物的合成
3.2.2 1'-十六烷基二茂铁甲酸甲酯(2)的合成
在250 mL三口瓶中加入15 g锌粉, 用4%的盐酸溶液100 mL分5次洗涤锌粉, 剧烈搅拌下, 加入1.2 g氯化汞溶于1 mL浓盐酸和25 mL水的溶液, 使其充分搅拌30 min, 倾出上层清液, 此时锌汞齐制作完成.将1 (4.82 g, 10 mmol)用22 mL苯与5 mL无水甲醇溶解, 加入到上述锌汞齐中, 加热至回流, 加入7 mL浓盐酸, 继)续回流反应3 h.用二氯甲烷萃取, 有机相经水洗涤至中性, 用无水硫酸镁干燥, 硅胶柱层析(100~200目) [V(石油醚):V(乙酸乙酯)=10:1洗脱], 除去溶剂得棕红色液体, 产率81%.1H NMR (CDCl3, 500 MHz) δ: 4.72 (t, J=2.0 Hz, 2H, FcH), 4.33 (t, J=2.0 Hz, 2H, FcH), 4.07 (s, 4H, FcH), 3.79 (s, 3H, OCH3), 2.23 (t, J=7.5 Hz, 2H, CH2), 1.46~1.42 (m, 2H, CH2), 1.25 (b, 26H, CH2), 0.88 (t, J=6.0 Hz, 3H, CH3). Anal. calcd for C28H44FeO2: C 71.78, H 9.47; found C 71.43, H 9.69.
3.2.4 5-[4-(1'-十六烷基二茂铁甲酰胺基)苯基]-10, 15, 20-三苯基锌(Ⅱ)卟啉(6)的合成
卟啉1b (20 mg, 18.8 mmol)溶于15 mL氯仿中, 加入0.5 mL饱和醋酸锌的甲醇溶液, 室温反应3 h, 水洗四次, 无水Na2SO4干燥, 减压蒸除溶剂, 硅胶柱层析[V(石油醚):V(乙酸乙酯)=10:1洗脱], 得到19.5 mg紫色粉末2b, 产率92%. m.p. 230 ℃; UV-Vis (DMF) λmax [lg ε/(L·mol-1·cm-1)]: 426 (5.81), 560 (4.37), 600 (4.13) nm; Fluorescence (DMF, λex=420 nm) λem: 606, 654 nm; 1H NMR (CDCl3, 500 MHz) δ: 9.02~8.94 (m, 8H, β-pyrrole-H), 8.23~8.18 (m, 8H, phenyl-H), 7.90 (d, J=8.5 Hz, 2H, phenyl-H), 7.74 (d, J=7.5 Hz, 9H, phenyl-H), 7.63 (s, 1H, CONH), 4.74 (s, 2H, FcH), 4.42 (s, 2H, FcH), 4.22 (s, 4H, FcH), 2.37 (t, J=7.5 Hz, 2H, CH2), 1.43~1.13 (m, 28H, CH2), 0.83 (t, J=7.0 Hz, 3H, CH3); 13C NMR (CDCl3, 125 MHz) δ:168.74, 142.85, 138.37, 137.66, 135.09, 134.44, 132.03, 127.50, 126.56, 121.17, 117.77, 91.50, 71.77, 70.03, 69.25, 68.89, 31.87, 31.27, 29.70, 29.67, 29.63, 29.58, 29.29, 28.87, 22.65, 14.08; IR (KBr) ν: 3413, 3101, 2921, 2851, 1639, 1513, 1450, 1397, 1260, 1190, 1069, 994, 801 cm-1; HRMS calcd for C67H61FeN5OZn 1071.3517, found 1071.3523.
3.2.1 1'-十六酰基二茂铁甲酸甲酯(1)的合成
在250 mL三口瓶中加入三氯化铝(3.5 g, 26.22 mmol), 30 mL二氯甲烷, 在冰水浴下(0~5 ℃)经15 min滴加十六酰氯(4.06 g, 14.8 mmol)溶于10 mL二氯甲烷的溶液.滴加完毕, 将20 mL溶有二茂铁甲酸甲酯(3.0 g, 12.29 mmol)的二氯甲烷溶液30 min内滴入上述溶液中, 此时溶液变为红色, 滴加完毕, 在冰水浴下继续反应2 h.反应完毕, 将反应液倒入冰水中, 分出有机相, 依次用水和5%碳酸氢钠溶液洗涤, 无水硫酸镁干燥, 经硅胶柱层析(100~200目)[V(石油醚):V(乙酸乙酯)=10:1洗脱], 蒸干溶剂得棕红色固体, 产率87%. m.p. 71~74 ℃; 1H NMR (CDCl3, 500 MHz) δ: 4.81~4.78 (m, 4H, FcH), 4.49 (t, J=2.0 Hz, 2H, FcH), 4.40 (t, J=2.0 Hz, 2H, FcH), 3.82 (s, 3H, OCH3), 2.68 (t, J=7.0 Hz, 2H, CH2), 1.70~1.66 (m, 2H, CH2), 1.37~1.26 (m, 24H, CH2), 0.88 (t, J=7.0 Hz, 3H, CH3). Anal. calcd for C28H42FeO3: C 69.70, H 8.77; found C 69.58, H 8.83.
3.2.3 5-[4-(1'-十六烷基二茂铁甲酰胺基)苯基]-10, 15, 20-三苯基卟啉(5)的合成
在50 mL三口瓶中加入1.2 g氢氧化钠, 4.5 mL水, 搅拌至溶解, 加入4.5 mL溶有2 (3.51 g, 7.5 mmol)的乙醇溶液, 回流反应4 h.加入20 mL水稀释, 用乙醚萃取, 水相用稀盐酸调至pH为1, 析出沉淀, 沉淀物用乙醚溶解, 水洗后经无水硫酸镁干燥, 减压蒸除溶剂得到红褐色固体1'-十六烷基二茂铁甲酸粗产物, 产率87%.
将上述制得的1'-十六烷基二茂铁甲酸粗产物(2.27 g, 5.0 mmol)溶于25 mL无水苯中, 加入1 mL三氯化磷, 50 ℃反应3 h, 蒸除溶剂, 用石油醚提取, 过滤, 减压蒸除溶剂得红色油状1'-十六烷基二茂铁甲酰氯(3), 待用.
在100 mL圆底烧瓶中加入5-(4-氨基苯基)-10, 15, 20-三苯基卟啉(50 mg, 0.079 mmol), 35 mL二氯甲烷, 1 mL三乙胺, 搅拌下滴加上述新制的3 (0.158 mmol, 74 mg)溶于2 mL二氯甲烷的溶液.滴毕, 回流8 h, 冷却至室温后, 蒸干溶剂, 过硅胶柱[V(二氯甲烷):V(石油醚)=1:2洗脱], 蒸除溶剂, 二氯甲烷/甲醇重结晶, 得紫红色固体5 35.3 mg, 产率为42%. m.p. 184 ℃; UV-Vis (DMF) λmax [lg ε/(L·mol-1·cm-1)]: 419 (5.66), 515 (4.35), 551 (4.10), 592 (3.86), 647 (3.86) nm; Fluorescence (DMF, λex=420 nm) λem: 651, 717 nm; 1H NMR (CDCl3, 500 MHz) δ: 8.93 (d, J=4.0 Hz, 2H, β-pyrrole-H), 8.85 (s, 6H, β-pyrrole-H), 8.22 (d, J=6.0 Hz, 8H, phenyl-H), 8.00 (d, J=8.0 Hz, 2H, phenyl-H), 7.77~7.74 (m, 9H, phenyl-H), 7.69 (s, 1H, CONH), 4.83 (s, 2H, FcH), 4.44 (s, 2H, FcH), 4.25 (s, 4H, FcH), 2.40 (t, J=7.5 Hz, 2H, CH2), 1.31~1.15 (m, 28H, CH2), 0.85 (t, J=6.5 Hz, 3H, CH3), -2.76 (s, 2H, pyrrole-NH); 13C NMR (CDCl3, 125 MHz)δ:168.88, 142.17, 137.89, 137.72, 135.25, 134.55, 127.69, 126.67, 120.14, 120.09, 119.64, 117.90, 91.46, 71.72, 69.91, 69.17, 68.83, 31.87, 31.30, 29.68, 29.64, 29.62, 29.57, 29.29, 28.86, 22.65, 14.10; IR (KBr) ν: 3426, 3312, 3101, 2920, 2850, 1641, 1586, 1508, 1399, 1311, 1177, 1072, 965, 800 cm-1; HRMS calcd for C67H63FeN5O 1065.5008, found 1065.5005.
3.3.1 4-(11-二茂铁基十一烷氧基)苯甲醛(4)的合成
参照文献[20]方法合成, 产率75%. m.p. 60~61 ℃ (文献值m.p. 54~56 ℃); 1H NMR (CDCl3, 500 MHz) δ: 9.88 (s, 1H, CHO), 7.82 (d, J=8.5 Hz, 2H, phenyl-H), 6.99 (d, J=8.5 Hz, 2H, phenyl-H), 4.09~4.02 (m, 11H, FcH, OCH2), 2.31 (t, J=7.5 Hz, 2H, CH2), 1.82~1.79 (m, 2H, CH2), 1.50~1.45 (m, 4H, CH2), 1.35~1.29 (m, 12H, CH2).
3.3.3 5-(4-(11-二茂铁基十一烷氧基)苯基)-10, 15, 20-三苯基锌(Ⅱ)卟啉(8)的合成
称取7 (20 mg, 21 mmol)溶于氯仿中, 加入0.5 mL饱和醋酸锌的甲醇溶液, 室温反应5 h, 水洗四次, 无水Na2SO4干燥, 减压蒸除溶剂, 硅胶柱层析[V(石油醚):V(乙酸乙酯)=5:1洗脱]得到紫色金属配合物8, 产率92%. m.p. 149 ℃; UV-Vis (DMF) λmax [lg ε/(L·mol-1·cm-1)]: 426 (5.81), 560 (4.36), 600 (4.10) nm; Fluorescence (DMF, λex=420 nm) λem: 606, 657 nm; 1H NMR (CDCl3, 500 MHz) δ: 8.99~8.93 (m, 8H, β-pyrrole-H), 8.22 (d, J=6.5 Hz, 6H, phenyl-H), 8.11 (d, J=7.5 Hz, 2H, phenyl-H), 7.74 (d, J=7.0 Hz, 9H, phenyl-H), 7.27 (d, J=7.5 Hz, 2H, phenyl-H), 4.24 (t, J=6.5 Hz, 2H, OCH2), 4.19 (s, 9H, FcH), 2.23 (s, 2H, CH2), 2.00~1.95 (m, 2H, CH2), 1.67~1.48 (m, 2H, CH2), 1.42~1.29 (m, 14H, CH2); 13C NMR (CDCl3, 125 MHz) δ:150.23, 142.89, 135.43, 134.44, 132.10, 131.96, 131.88, 127.48, 126.55, 112.64, 68.37, 29.68, 29.55, 26.27; IR (KBr) ν: 3092, 2924, 2851, 1606, 1505, 1466, 1243, 1174, 998, 798, 484; HRMS calcd for C65H58FeN4OZn 1030.3252, found 1030.3244.
3.3.2 5-[4-(11-二茂铁基十一烷氧基)苯基]-10, 15, 20-三苯基卟啉(7)的合成
在250 mL三口瓶中加入4 (0.46 g, 1 mmol)、新蒸苯甲醛(0.318 g, 3 mmol)、新蒸吡咯(0.268 g, 4 mmol)、250 mL新蒸的二氯甲烷.氮气保护下, 避光室温搅拌15 min后, 将三氟乙酸(0.66 g, 5.7 mmol)用2 mL二氯甲烷溶解滴入上述体系, 搅拌1 h.称取二氯二氰基苯醌(0.91 g, 4 mmol)用5 mL四氢呋喃溶解滴加.室温继续搅拌3 h, 加几滴三乙胺, 减压蒸除溶剂, 氧化铝柱层析, 二氯甲烷为洗脱剂, 收集第一带深紫色色带, 接着硅胶(200~300目)柱层析[V(石油醚):V(二氯甲烷)=5:2洗脱], 接收第二带, 蒸除溶剂得紫色固体7, 产率为18%. m.p. 123~125 ℃; UV-Vis (DMF) λmax [lg ε/(L·mol-1·cm-1)]: 419 (5.66), 515 (4.34), 550 (4.11), 591 (3.92), 648 (3.96) nm; Fluorescence (DMF, λex=420 nm) λem: 651, 717 nm; 1H NMR (CDCl3, 500 MHz) δ: 8.89 (d, J=4.5 Hz, 2H, β-pyrrole-H), 8.84 (s, 6H, β-pyrrole-H), 8.21 (d, J=7.0 Hz, 6H, phenyl-H), 8.11 (d, J=8.5 Hz, 2H, phenyl-H), 7.78~7.73 (m, 9H, phenyl-H), 7.28 (d, J=8.5 Hz, 2H, phenyl-H), 4.24 (t, J=6.5 Hz, 2H, OCH2), 4.09~4.03 (m, 9H, FcH), 2.32 (t, J=7.0 Hz, 2H, CH2), 2.0~1.95 (m, 2H, CH2), 1.63~1.60 (m, 2H, CH2), 1.52~1.34 (m, 14H, CH2), -2.77 (s, 2H, pyrrole-NH); 13C NMR (CDCl3, 125 MHz) δ:159.02, 142.25, 142.21, 135.64, 134.58, 134.32, 127.70, 126.69, 120.23, 120.07, 119.94, 112.74, 89.64, 68.47, 68.35, 68.07, 66.99, 31.18, 29.73, 29.70, 29.62, 29.57, 29.54, 26.27; IR (KBr) ν: 3314, 3125, 2922, 2849, 1606, 1468, 1400, 1244, 1176, 965, 800, 700 cm-1; HRMS calcd for C65H60FeN4O 968.4117, found 968.4125.
-
-
[1]
Fungo, F.; Milanesio, M. E.; Durantini, E. N.; Otero, L.; Dittrich, T. J. Mater. Chem. 2007, 17, 2107. doi: 10.1039/B617944D
-
[2]
Vecchi, A.; Erickson, N. R.; Sabin, J. R.; Floris, B.; Conte, V.; Venanzi, M.; Galloni, P.; Nemykin, V. N. Chem. Eur. J. 2015, 21, 269. doi: 10.1002/chem.201404457
-
[3]
Fukuzumi, S.; Kojima, T. J. Mater. Chem. 2008, 18, 1427. doi: 10.1039/b717958h
-
[4]
Villegas, C.; Wolf, M.; Joly, D.; Delgado, J. L.; Guldi, D. M.; Martín, N. Org. Lett. 2015, 17(20), 5056. doi: 10.1021/acs.orglett.5b02542
-
[5]
Rousseaux, S. A. L.; Gong, J. Q.; Haver, R.; Odell, B.; Claridge, T. D. W.; Herz, L. M.; Anderson, H. L. J. Am. Chem. Soc. 2015, 137, 12713. doi: 10.1021/jacs.5b07956
-
[6]
Tagliatesta, P.; Pizzoferrato, R. J. Organomet. Chem. 2015, 787, 27. doi: 10.1016/j.jorganchem.2015.04.006
-
[7]
赵海英, 顾雪松, 鄢小卿, 刘智波, 陈强, 边占喜, 有机化学, 2014, 34, 371. doi: 10.6023/cjoc201308036Zhao, H.; Gu, X.; Yan, X.; Liu, Z.; Chen, Q.; Bian, Z. Chin. J. Org. Chem. 2014, 34, 371 (in Chinese). doi: 10.6023/cjoc201308036
-
[8]
Bucher, C.; Devillers, C. H.; Moutet, J.-C.; Saint-Aman, E. Coord. Chem. Rev. 2009, 253, 21. doi: 10.1016/j.ccr.2007.11.025
-
[9]
Gokulnath, S.; Achary, B. S.; Kumar C. K.; Trivedi, R.; Sridhar, B.; Giribabu, L. Photochem. Photobiol. 2015, 91, 33. doi: 10.1111/php.12372
-
[10]
Wijesinghe, C. A.; El-Khouly, M. E.; Fukuzumi, S.; D'Souza, F. Chem. Eur. J. 2013, 19, 9629. doi: 10.1002/chem.201300877
-
[11]
Lvova, L.; Galloni, P.; Floris, B.; Lundström, I.; Paolesse, R.; Natale, C. D. Sensors 2013, 13, 5841. doi: 10.3390/s130505841
-
[12]
Sirbu, D.; Turta, C.; Benniston, A. C.; Abou-Chahine, F.; Lemmetyinen, H.; Tkachenko, N. V.; Wood, C.; Gibson, E. RSC Adv. 2014, 4, 22733. doi: 10.1039/c4ra03105a
-
[13]
Mittra, K; Chatterjee, S.; Samanta, S.; Dey, A. Inorg. Chem. 2013, 52, 14317. doi: 10.1021/ic402297f
-
[14]
Sirbu, D.; Turta, C.; Gibson, E. A.; Benniston, A. C. Dalton Trans. 2015, 44, 14646. doi: 10.1039/C5DT02191J
-
[15]
Vecchi, A.; Galloni, P.; Floris, B.; Nemykin, V. N. J. Porphyrins Phthalocyanines 2013, 17, 165. doi: 10.1142/S1088424613300012
-
[16]
Brahma, S.; Ikbal, S. A.; Dhamija, A.; Rath, S. P. Inorg. Chem, 2014, 53, 2381. doi: 10.1021/ic401395d
-
[17]
Sun, B.; Ou, Z.; Meng, D.; Fang, Y.; Song, Y.; Zhu, W.; Solntsev, P. V.; Nemykin, V. N.; Kadish, K. M. Inorg. Chem. 2014, 53, 8600. doi: 10.1021/ic501210t
-
[18]
Zhu, P.; Kan, L.; Han, X.; Feng, J.; Jia, J.; Zhang, X. Dyes Pigm. 2015, 113, 55. doi: 10.1016/j.dyepig.2014.07.009
-
[19]
王丽英, 李保国, 石艳菊, 有机化学, 2006, 26, 120. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract337147.shtmlWang, L.; Li, B.; Shi, Y. Chin. J. Org. Chem. 2006, 26, 120 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract337147.shtml
-
[20]
Majumdar, K. C.; Chakravorty, S.; Pal, N.; Sinha, R. K. Tetrahedron 2009, 65, 7998. doi: 10.1016/j.tet.2009.07.042
-
[21]
喻龙, 王蕊欣, 高保娇, 耿天奇, 陈玫君, 雷彩萍, 刘少伟, 黄小利, 雷鸣, 发光学报, 2012, 33, 1373. doi: 10.3788/fgxbYu, L.; Wang, R.; Gao, B.; Geng, T.; Chen, M.; Lei, C.; Liu, S.; Huang, X.; Lei, M. Chin. J. Lumin. 2012, 33, 1373 (in Chinese). doi: 10.3788/fgxb
-
[1]
-
表 1 卟啉5~8在CH2Cl2溶液中的氧化还原电势a
Table 1. Electrochemical redox potentials of porphyrins 5~8 in CH2Cl2
Compd. Potential/V vs Fc/Fc+ P-/2- P0/- Fc0/+ P0/+ P+/2+ 5 -1.998 -1.670 0.184 0.567 0.896 6 -2.189 -2.001 0.182 0.401 0.715 7 -1.957 -1.637 0.002 0.554 0.858 8 -2.181 -2.004 -0.012 0.383 0.682 aHalf-wave potential: E1/2=1/2(Epa+Epc), where Epa is the anodic peak potential, Epc is the cathodic peak potential. P: E1/2 of porphyrin; Fc: E1/2 of ferrocene -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 330
- HTML全文浏览量: 94





 下载:
下载:



 下载:
下载:

