 图 图式1
系列GA-他克林杂合体化合物的设计合成
Figure 图式1.
Design and synthesis of GA-tacrine hybrids
图 图式1
系列GA-他克林杂合体化合物的设计合成
Figure 图式1.
Design and synthesis of GA-tacrine hybrids

Citation: Zhang Xinyi, Yuan Sheng, Zhao Jiaqiang, Zhang Lei, Zhang Chao, Wang Rikang, Chen Heru. Design Synthesis of Gardenamide A/Tacrine Hybrids and Their Protection against 6-Hydroxydopamine-Induced Insults in PC12 Cells[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 873-880. doi: 10.6023/cjoc201611026

栀子酰胺A-他克林杂合体的设计合成及其对6-羟多巴胺诱导的PC12细胞损伤的保护作用
English
Design Synthesis of Gardenamide A/Tacrine Hybrids and Their Protection against 6-Hydroxydopamine-Induced Insults in PC12 Cells
-
Key words:
- drug design
- / drug synthesis
- / gardenamide A
- / tacrine
- / alzheimer disease
-
阿茨海默症 (Alzheimer’s Disease, AD) 是一组异质性多病理机制的疾病, 其成因涉及到多个方面, 主要与脑内胆碱水平的降低、β-淀粉样蛋白 (Aβ) 的聚集或沉淀、氧化应激、钙离子水平失调和金属离子水平异常增高以及中枢神经炎症等多种因素相关.针对多因性疾病, 越来越多的药物学家认可多靶标导向的药物设计策略 (multi-targeted-single-ligand approach, MTSL), 即将多个不同靶向作用的配体集成于一个分子上形成一个杂合物, 使其能够产生多种药理活性[1].这一策略目前已在许多重大疾病的药物治疗中得到应用.例如, 美国礼来公司研制生产的多靶点抗叶酸制剂培美曲塞二钠 (ALIMTA), 它能抑制多个与叶酸系统有关的酶的活性, 已进入临床研究[2]; 另一个例子是双重抑制剂Omapatrilat, 它能够同时靶向血管紧张素转化酶和神经内肽酶, 已进入高血压治疗的Ⅲ期临床研究以及心力衰竭治疗的Ⅱ期临床研究[3]; 再如Netoglitazone, 它能够同时靶向过氧化物酶体增殖激活受体α和β, 是一种双重激动剂, 目前正在进行用于Ⅱ型糖尿病治疗的Ⅱ期临床研究[4].
在神经退行性疾病的药物研究方面, 多靶标导向的药物设计策略也有了许多尝试[5].作为第一个被批准用于治疗AD的临床药物, 他克林 (tacrine) 常被用于MTSL设计的一个药物分子. 1996年, Pang等[6]设计并合成出了一系列由不同长度烷基桥联的双他克林复合物, 在随后的药理活性实验中发现所有设计合成的双他克林复合物对AChE的抑制活性均比单独使用他克林有所提高, 而毒性也比他克林小; 2007年, Bolognesi等[7]设计并合成了三个中间链接基团不同的双他克林杂合物.在随后的活性测试中发现, 这些杂合物不仅具有胆碱酯酶和Aβ的抑制活性, 同时也具有金属螯合的功能; Rodríguez等[8]将他克林与褪黑素相连, 先后设计合成了一系列衍生物, 并证实该系列杂合物不但具有他克林较强的胆碱酯酶抑制活性, 而且具有褪黑素的抗氧化功能及神经细胞保护作用.其中当中间碳链的碳原子数目为6时, 杂合物对AChE的IC50值达到8 pmol•L-1, 是目前已知的最强的AChE抑制剂之一.
本课题组在对天然产物栀子酰胺A (gardenamide A, GA) 的系统研究中发现, GA对血清剥除或6-羟基多巴胺胺 (6-OHDA) 诱导的PC12细胞损伤具有很好的神经保护作用, 其作用机制是通过同时激活神经元型一氧化氮合成酶 (nNOS) 和内皮质型一氧化氮合成酶 (eNOS) 的活性, 调控P13K/AKT和ERK1/2信号通路降低细胞凋亡水平, 且具有较强的抗氧化能力, 可以在神经退行性疾病中发挥作用[9~11].因此, 利用GA从结构上改造他克林, 使其成为有效的多靶标导向药物, 将有可能发现对包括AD在内的神经退行性疾病具有更佳治疗效果的先导化合物.本文报道了这方面的初步探索工作.具体报道了GA-他克林系列杂合体化合物的合成及对6-OHDA损伤的PC12细胞保护作用的初步研究结果.
1 结果与讨论
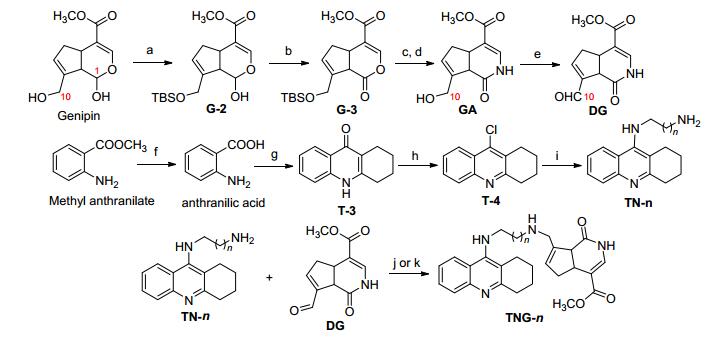
系列GA-他克林杂合体化合物TNG-n的合成路线如Scheme 1所示.
首先是10-栀子酰胺A-醛 (DG) 的合成.其前体化合物GA的合成参照文献[9].该路线首先利用京尼平C-1和C-10羟基反应活泼性的差异, 在弱碱咪唑的作用下, 实现C-10羟基的选择性保护, 收率89%;从化合物G-3至GA, 文献采用先内酰胺化再脱保护基二甲基叔丁基硅基 (TBS) 的两步法, 两步收率分别为30%和86%, 总收率为25.8%;本实验对此做了改进, 即内酰胺化后不分离直接脱TBS, 两步合并收率提高到33.8%;将GA中C-10羟基用戴斯-马丁试剂 (Dess-Martin periodine, DMP)[12, 13]直接氧化, 以85%的收率得到DG. C-10羟基的氧化活泼性没有C-1位的半缩醛羟基大, 同样的氧化剂DMP, C-10羟基的氧化时间需要6 h才能反应完全, 而C-1位羟基只需要2 h.
系列化合物N-末端氨基烷基他克林 (TN-n) 的合成参照文献[14]进行.考虑到起始原料邻氨基苯甲酸为易制毒试剂, 不能自由采购, 本实验采用邻氨基苯甲酸甲酯作为替代的起始原料, 经NaOH溶液皂化水解而得.按照文献[14], 9-氯代-1, 2, 3, 4-四氢吖啶, 即氯代他克林 (T-4) 与相应过量的二胺在1-戊醇中反应, 需回流40 h, 最后以66%~89%的收率获得系列双吖啶化合物; 本实验尝试加入催化量KI (10 mol%), 可以将反应时间缩短至8 h, 以大致相当的收率获得N-单吖啶二胺化合物TN-n(表 1).作者认为, 催化量KI的加入可以将氯代他克林转换为更加活泼的碘代他克林, 从而缩短反应时间.实验发现, 包含3~5个碳的二胺, 反应收率比较高.其中, 以1, 3-丙二胺的反应收率最高, 为85%(表 1).
系列目标化合物的合成通过DG与TN-n的还原胺化反应来获得.按照文献[15], 在进行还原胺化时, 使用的还原剂是硼氢化钠, 且对所有的底物都适用, 都能够成功还原中间体Schiff碱从而得到目标化合物.本实验中我们发现, TN-n的中间碳链长度不同, 即n值不同时, 在还原胺化时需要采用不同的还原剂.当n=1~4时, 使用硼氢化钠或氰基硼氢化钠可以使反应顺利进行.但使用氰基硼氢化钠还原后的产物杂质较少且较易分离纯化, 反应条件没有使用硼氢化钠时那样苛刻; 但在合成n=5~7的目标化合物时, 采用硼氢化钠或氰基硼氢化钠作为还原剂, DG与TN-n基本不反应或者反应收率很低, 且后期的分离纯化也比较困难.在多次尝试之后, 作者将还原剂换成了三乙酰氧基硼氢化钠, 同时将反应溶剂换成1, 2-二氯乙烷, 在常温条件下即可进行还原胺化反应, 顺利得到目标化合物, 且反应所需的时间也大大缩短, 一般在6 h内即可反应完全, 反应副产物较少, 易分离纯化.由于三乙酰氧基硼氢化钠的还原能力相比硼氢化钠或氰基硼氢化钠低, 因此只能选择性地还原活泼型较高的席夫碱类化合物.值得注意的是, 三乙酰氧基硼氢化钠易变质, 在保存及称量过程中需要注意.系列TNG-n合成反应的收率列于表 1.
Compd. n Yield/% TN-1 1 72 TN-2 2 85 TN-3 3 81 TN-4 4 79 TN-5 5 67 TN-6 6 71 TN-7 7 65 TNG-1 1 45 TNG-2 2 42 TNG-3 3 38 TNG-4 4 43 TNG-5 5 37 TNG-6 6 54 TNG-7 7 52 表 1 化合物TN-n和TNG-n的反应收率
Table 1. Yields of compounds TN-n and TNG-n本工作利用六羟多巴胺 (6-OHDA) 诱导损伤的嗜铬细胞瘤株PC12细胞模型来评价系列化合物对神经细胞损伤的保护作用.采用噻唑蓝 (MTT) 法测定细胞存活率.对照组为不加6-OHDA处理的正常PC12细胞, 其细胞存活率设定为100%;模型细胞组为经终浓度为200 μmol•L-1的6-OHDA预处理2 h, 再孵育24 h的PC12细胞, 其细胞存活率经MTT法测定为 (38.99±1.70)%; 用药组则是经终浓度为200 μmol•L-1的6-OHDA预处理2 h后, 分别加入终浓度为3, 10, 30 μmol•L-1的待试药物, 再孵育24 h, 检测其细胞存活率, 结果见表 2和图 1.
 表 2
TNG-n系列化合物对6-OHDA诱导的PC12细胞损伤保护作用 (细胞存活率/%)a
Table 2.
Neuroprotective effect of TNG-n on the cell viability of PC12 cells induced by 6-OHDA (cell viability/%)
表 2
TNG-n系列化合物对6-OHDA诱导的PC12细胞损伤保护作用 (细胞存活率/%)a
Table 2.
Neuroprotective effect of TNG-n on the cell viability of PC12 cells induced by 6-OHDA (cell viability/%)
Compd. cTNG-n/(μmol•L-1) 3 10 30 他克林 44.42±1.90 47.35±3.87 50.82±2.91 GA 44.31±7.83 52.56±5.06 64.11±1.23 TNG-1 47.56±1.56 59.23±2.03* 71.17±1.76** TNG-2 37.93±2.63 53.41±0.99 37.64±6.48 TNG-3 39.20±3.98 44.71±2.54 49.31±5.68 TNG-4 42.72±7.91 54.23±7.61* 65.22±2.72** TNG-5 49.61±3.76 54.70±0.88 72.78±1.06 TNG-6 36.02±6.25 31.59±6.81 36.92±3.68 TNG-7 35.45±3.19 34.09±1.66 44.17±9.65 a The percentage of cell viability was presented as mean±SD for six replicates. *p<0.05, **p<0.01 vs. 6-OHDA group (n=6). 表 2 TNG-n系列化合物对6-OHDA诱导的PC12细胞损伤保护作用 (细胞存活率/%)a
Table 2. Neuroprotective effect of TNG-n on the cell viability of PC12 cells induced by 6-OHDA (cell viability/%)可以看到, 单体药他克林显示出弱的神经保护作用, 当浓度为30 µmol•L-1时, 细胞存活率为 (50.82± 2.91)%, 比模型组细胞存活率增加30.3%;单体药GA则显示出比他克林更强的保护作用, 在同样浓度下, 其细胞存活率为 (64.11±1.23)%, 比模型组细胞存活率增加64.4%.相比之下, GA-他克林杂合物TNG-1和TNG-5在30 µmol•L-1呈现最佳的神经保护作用, 其细胞存活率分别为 (71.17±1.76)%和 (72.78±1.06)%, 比模型组细胞存活率分别增加82.5%和86.7%, 且呈剂量依赖性, 其保护作用要比单体药物他克林和GA强; 另一杂合物TNG-4显示与GA相近的保护作用, 而杂合物TNG-2在10 µmol•L-1显示保护作用, 在其它浓度则不显示神经保护作用; 有趣的是, 杂合物TNG-3, TNG-6和TNG-7在所检测的浓度范围内均未显示出神经保护作用.
可见, TNG-n的他克林和GA结构模块之间的碳链长度会影响杂合物的生物活性.适当长度, 在本实验中为n=1和5, 即当中间连接子为2和6个碳的碳链时, 将使杂合物有更为适当的活性构象, 从而显示出比单体化合物更好的神经保护活性.但其清晰的作用机制, 还需要更细致的实验加以证实.
更进一步地, 本实验比较了TNG-1和TNG-5与两个单体药物以及其1:1联合药物的神经保护作用活性 (图 2).物质的量的比为1:1的他克林/GA联合药物并没有显示出比单体药物叠加的活性, 其活性与GA相近; 而TNG-1和TNG-5分别显示出显著的叠加活性, 说明他克林和GA通过适当方式链接的杂合物能够带来协同作用, 可能是类药性更好的候选化合物.
2 结论
设计合成了7个GA-他克林杂合物.首先以京尼平为原料, 经5步反应合成10-栀子酰胺A醛 (DG), 总收率20.4%;再以邻氨基苯甲酸甲酯为原料, 经4步反应合成N-末端氨基烷基他克林 (TN-n), 总收率50.0%~ 65.4%;然后, DG与TN-n在合适的还原剂作用下经还原胺化获得目标化合物, 收率37%~54%.同时建立六羟多巴 (6-OHDA) 诱导损伤的PC12细胞模型对系列杂合物进行生物活性评价, 发现TNG-1和TNG-5具有比他克林、GA及其1:1联合药物更好的神经保护作用, 推测杂合物可能具有比单体药物更好的类药性.
3 实验部分
3.1 仪器与试剂
NMR谱在Bruker-AV300 MHz型核磁共振仪 (瑞士Bruker公司) 上测定; 低分辨质谱在Finnigan LCQ Advantage MAX上测定; 高分辨质谱在Applied Biosystems Q-STAR Elite ESI-LC-MS/MS质谱仪上测定. DHG-9140A型恒温干燥箱 (上海浦东荣丰科学仪器有限公司); CLJBQ-3型恒温磁力搅拌器 (郑州长城科工贸有限公司); EYELA型旋转蒸发仪 (东京理化器械独资工厂); LGJ-12冷冻干燥机 (巩义市英峪予华仪器有限公司); FA2104型电子天平 (上海恒平科学仪器有限公司); TU-1810S紫外分光光度计 (北京普析通仪器有限公司); LC-UV100液相色谱仪 (上海伍丰科学仪器有限公司); Cosmosil 5C18-MS-Ⅱ色谱柱 (Nacalai Tesque Inc., 日本); DZF-150型小型真空干燥箱 (郑州长城科工贸有限公司); KQ3200E型超声波清洗器 (昆山市超声仪器有限公司); HERAcell CO2培养箱X (美国热电公司); 多功能酶标仪 (德国Sartorius公司); 京尼平购于成都康邦生物科技有限公司; 咪唑、戴斯-马丁试剂购自上海晶纯生物科技有限公司; 他克林购自西格玛-奥瑞里奇公司; PC12细胞购自上海中国科学与细胞库; 杜尔伯科改良伊格尔培养基 (DMEM) 购自美国Invitrogen公司; FBS和PBS购自美国Hyclone公司.
二氯甲烷 (DCM) 加P2O5回流3~4 h, 蒸馏备用; 四氢呋喃 (THF) 加钠丝回流3~4 h, 蒸馏备用.化合物G-2, G-3和GA的合成及其结构鉴定数据同文献[9].
3.2 实验方法
3.2.7 生物活性检测方法
PC12细胞的培养及传代:将水浴锅调至37~ 37.5 ℃, 待水浴温度稳定后, 取出液氮中冻存的细胞迅速放入水浴锅, 将细胞液面浸至水面以下轻轻摇动至完全融化.然后用转速1000 r/min离心3 min, 弃上清, 加入适量的完全培养基重悬细胞, 吹打均匀后移入细胞培养瓶中, 以10%小牛胎血清 (FBS)、5%小马血清 (HS) 和0.2%纯化对苯二甲酸 (PTA) 的DMEM高糖培养液置于CO2培养箱内培养复苏的细胞.每2~3 d更换培养液一次.待细胞融合率达80%以上时, 即可进行传代及后续的细胞处理实验.
噻唑蓝 (MTT) 法检测细胞存活率: PC12细胞按每孔1×104个细胞的密度接种于96孔板.每孔的培养基体积为100 μL, 于37 ℃, 5% CO2及饱和湿度条件下培养24 h后, 换液为不含血清的DMEM培养基, 用200 μmol•L-1 6-OHDA预先处理2 h后分别加入终浓度为3, 10, 30 μmol•L-1的待试药物, 处理24 h, 加10 μL浓度为10 mg•mL-1的MTT试剂, 继续温浴4 h后去上清液, 每孔加入150 μL二甲亚砜 (DMSO), 微振荡后, 用全自动酶标仪在570 nm波长处读取吸光度 (A) 值.用如下公式计算细胞存活率:
其中, 对照组为不加药的正常细胞, 其存活率为100%;溶剂空白为DMSO.
辅助材料 (Supporting Information) 化合物TNG-n (n=1~7) 的1H NMR和13C NMR谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
3.2.3 9-氯代-1, 2, 3, 4-四氢吖啶 (T-4) 的合成
量取70 mL三氯氧磷加入500 mL圆底烧瓶中, 称取T-3 (13.9 g, 64.2 mmol) 分批加入到上述反应体系中.在120 ℃油浴中加热反应2 h, 此时反应液变橙红色.反应体系冷却至室温后, 将反应混合物缓慢倒入冰水中, 用饱和氢氧化钠水溶液调节pH值至11左右, 此时反应液由澄清的橙红色变为淡黄色浑浊液, 并有部分固体析出; 二氯甲烷萃取 (100 mL×3), 合并有机相, 饱和氯化钠溶液洗涤, 无水硫酸钠干燥, 旋蒸除溶剂后直接干燥, 得淡黄色片状固体13.8 g, 收率91%. m.p. 65~ 67 ℃(文献值[14] 66.5~67.7 ℃); 1H NMR (300 MHz, CDCl3) δ: 7.96~7.92 (m, 1H), 7.85~7.82 (m, 1H), 7.53~7.47 (m, 1H), 7.37~7.31 (m, 1H), 2.98 (d, J=12 Hz, 2H), 2.77 (t, J=12 Hz, 2H), 1.83~1.70 (m, 4H).
3.2.2 1, 2, 3, 4-四氢吖啶-9(10H)-酮 (T-3) 的合成
称取邻氨基苯甲酸 (10.0 g, 73.0 mmol) 和环己酮 (8.6 g, 87.6 mmol) 于250 mL圆底烧瓶中, 量取35 mL甲苯溶解, 接分水器, 在120 ℃油浴加热回流5 h, ,此时溶液呈深棕色.冷却至室温, 有少量针状结晶析出, 用冰浴使其冷却至0 ℃, 有大量棕黄色固体析出.抽滤, 滤饼分别用甲苯、乙醇洗涤, 真空干燥得黄色固体16.0 g, 收率89%.熔点142~144 ℃(文献值[14] 143~145 ℃).
3.2.5 化合物TNG-n (n=1~4) 的合成通法
称取化合物DG (55.3 mg, 0.25 mmol) 于25 mL圆底烧瓶中, 用10 mL干燥甲醇溶解, 加入化合物TN-n (0.25 mmol), 然后再加入少量的经活化分子筛, 室温搅拌4 h后, 移至0 ℃的恒温反应浴中, 搅拌平衡5 min, 称取氰基硼氢化钠 (50.0 mg, 0.75 mmol) 加入到反应体系中, 继续搅拌反应24 h.反应结束, 室温下旋蒸除去溶剂, 饱和氯化铵淬灭, 用乙酸乙酯萃取 (20 mL×3), 合并有机相, 用饱和氯化钠溶液洗涤, 无水硫酸钠干燥, 过滤, 滤液旋蒸除去溶剂, 残留物用适量甲醇溶解, 过ODS柱, 高效液相制备 (洗脱剂为甲醇/水, V:V=65: 35), 得到目标化合物.
N-[2-(10-去氧栀子酰胺A-基) 氨基乙基]他克林 (TNG-1):淡黄色油状液体48.4 mg, 收率45%. 1H NMR (300 MHz, CD3OD) δ: 8.10 (d, J=6 Hz, 1H), 7.77 (d, J= 6 Hz, 1H), 7.58~7.52 (m, 1H), 7.39~7.34 (m, 1H), 7.14 (s, 1H), 5.69 (s, 1H), 3.72 (s, 3H, OCH3), 3.70~3.60 (m, 2H), 3.58~3.44 (m, 2H), 3.31~3.29 (m, 2H) 2.96 (t, J= 12 Hz, 2H), 2.87~2.80 (m, 1H), 2.83~2.78 (m, 2H), 2.80~2.72 (m, 2H), 2.18~2.02 (m, 1H), 1.93~1.82 (m, 4H); 13C NMR (75 MHz, CD3OD) δ: 172.2, 168.8, 159.0, 153.1, 147.6, 141.7, 136.5, 134.8, 129.9, 129.1, 127.8, 124.4, 121.3, 117.3, 111.0, 52.0, 49.9, 49.6, 49.4, 48.5, 41.2, 38.3, 34.0, 26.1, 24.0, 23.6; ESI-MS m/z: 447.5 [M+ H]+, 446.0 [M-H]-; ESI-HRMS calcd for C26H31N4O3 [M+H]+ 447.2396, found 447.2394.
N-[3-(10-去氧栀子酰胺A-基) 氨基正丙基]他克林 (TNG-2):淡黄色油状液体46.6 mg, 收率42%. 1H NMR (300 MHz, CD3OD) δ: 8.12~8.09 (m, 1H), 7.76~7.73 (m, 1H), 7.58~7.52 (m, 1H), 7.39~7.34 (m, 1H), 7.15 (s, 1H), 5.68 (s, 1H), 3.72 (s, 3H, OCH3), 3.63 (t, J=12 Hz, 2H), 3.48~3.44 (m, 2H), 3.42~3.37 (m, 2H), 2.96 (t, J= 12 Hz, 2H), 2.84~2.78 (m, 1H), 2.73 (t, J=12 Hz, 2H), 2.64~2.60 (m, 2H), 2.14~2.06 (m, 1H), 1.94~1.78 (m, 6H); 13C NMR (75 MHz, CD3OD) δ: 170.9, 167.4, 157.6, 151.7, 146.3, 139.9, 133.4, 128.4, 127.8, 126.4, 123.4, 123.0, 119.7, 115.2, 109.6, 50.6, 48.5, 46.5, 46.1, 39.8, 37.0, 36.8, 32.7, 30.2, 22.7, 22.3; ESI-MS m/z: 461.5 [M+ H]+, 460.1 [M-H]-; ESI-HRMS calcd for C27H33N4O3 [M+H]+ 461.2553, found 461.2549.
N-[4-(10-去氧栀子酰胺A-基) 氨基正丁基]他克林 (TNG-3):淡黄色油状液体43.5 mg, 收率38%. 1H NMR (300 MHz, CD3OD) δ: 8.10~8.07 (m, 1H), 7.77~7.74 (m, 1H), 7.56~7.51 (m, 1H), 7.37~7.32 (m, 1H), 7.15 (s, 1H), 5.70 (s, 1H), 3.72 (s, 3H, OCH3), 3.54 (t, J=12 Hz, 2H), 3.47~3.38 (m, 3H), 2.96 (t, J=12 Hz, 2H), 2.86~ 2.78 (m, 1H), 2.74 (t, J=12 Hz, 2H), 2.56~2.51 (m, 2H), 2.17~2.09 (m, 1H), 1.94~1.85 (m, 5H), 1.71~1.50 (m, 4H); 13C NMR (75 MHz, CD3OD) δ: 172.3, 168.8, 159.2, 153.1, 147.9, 141.2, 134.8, 129.7, 129.3, 128.0, 124.7, 124.4, 121.3, 116.9, 110.0, 52.0, 50.0, 49.8, 49.5(2), 41.2, 38.4, 34.2, 30.0, 27.6, 26.2, 24.1, 23.7; ESI-MS m/z: 475.4 [M+H]+, 474.2 [M-H]-; ESI-HRMS calcd for C28H35-N4O3 [M+H]+ 475.2709, found 475.2706.
N-[5-(10-去氧栀子酰胺A-基) 氨基正戊基]他克林 (TNG-4):淡黄色油状液体50.8 mg, 收率43%. 1H NMR (300 MHz, CD3OD) δ: 8.10~8.08 (m, 1H), 7.77~7.74 (m, 1H), 7.57~7.51 (m, 1H), 7.38~7.32 (m, 1H), 7.16 (s, 1H), 5.74 (s, 1H), 3.72 (s, 3H, OCH3), 3.54 (t, J=12 Hz, 2H), 3.48~3.43 (m, 3H), 2.96 (t, J=12 Hz, 2H), 2.89~ 2.80 (m, 1H), 2.74 (t, J=12 Hz, 2H), 2.58~2.45 (m, 2H), 2.21~2.11 (m, 1H), 1.94~1.86 (m, 5H), 1.70~1.60 (m, 2H), 1.56~1.46 (m, 2H), 1.42~1.35 (m, 2H); 13C NMR (75 MHz, CD3OD) δ: 172.3, 168.8, 159.2, 153.2, 147.9, 141.1, 134.8, 129.7, 129.3, 128.0, 124.7, 124.4, 121.3, 116.8, 110.0, 52.0, 50.1, 49.9, 49.7, 41.3, 38.4, 38.3, 34.2, 32.1, 29.9, 26.2, 25.6, 24.1, 23.7; ESI-MS m/z: 475.4 [M+ H]+, 474.2 [M-H]-; ESI-HRMS calcd for C29H37N4O3 [M+H]+ 489.2866, found 489.2869.
3.2.4 化合物TN-n的合成通法
参照文献[14]合成.称取T-4 (0.25 g, 1.15 mmol)、相应的二胺 (8.65 mmol) 和10 mol%催化量的碘化钾加入到25 mL的圆底烧瓶中, 然后量取5 mL正戊醇加入反应体系, 在160 ℃油浴中加热回流8 h, 此时反应液呈棕黄色油状液.待反应体系降至室温, 用真空泵在油浴65~80 ℃条件下减压蒸除正戊醇, 然后加入20 mL的氢氧化钠溶液 (2 mol•L-1), 用氯仿萃取 (30 mL×3), 合并有机相, 用饱和氯化钠溶液洗涤, 无水硫酸钠干燥, 旋蒸除去溶剂, 残留物用柱层析 (氯仿/甲醇/氨水, V: V:V=25:1:0.005), 得黄色油状物.
N-(2-氨基乙基) 他克林 (TN-1):黄色油状物0.20 g, 收率72%. 1H NMR (300 MHz, CD3OD) δ: 8.11~8.08 (m, 1H), 7.79~7.76 (m, 1H), 7.58~7.52 (m, 1H), 7.40~7.34 (m, 1H), 3.73~3.68 (m, 2H), 3.63~3.59 (m, 2H), 2.98 (t, J=12 Hz, 2H), 2.79 (t, J=12 Hz, 2H), 1.93~1.89 (m, 4H).
N-(3-氨基正丙基) 他克林 (TN-2):黄色油状液体0.25 g, 收率85%. 1H NMR (300 MHz, CDCl3) δ: 8.15 (d, J=9 Hz, 1H), 7.86 (d, J=9 Hz, 1H), 7.64~7.59 (m, 1H), 7.44~7.38 (m, 1H), 4.1 (s, 2H, NH2), 2.66 (t, J=12 Hz, 2H), 2.39 (t, J=12Hz, 2H), 2.27~2.19 (m, 2H), 1.55~ 1.42 (m, 4H).
N-(4-氨基正丁基) 他克林 (TN-3):黄色油状液体0.25 g, 收率81%. 1H NMR (300 MHz, CDCl3) δ: 7.93 (d, J=6.0 Hz, 1H), 7.87 (d, J=6.0 Hz, 1H), 7.53~7.49 (m, 1H), 7.32~7.29 (m, 1H), 4.18 (s, 1H, NH), 3.47 (t, J= 12.0 Hz, 2H), 3.02~2.98 (m, 2H), 2.95~2.93 (m, 4H), 2.71~2.66 (m, 4H), 1.67~1.62 (m, 2H), 1.54~1.49 (m, 2H).
N-(5-氨基正戊基) 他克林 (TN-4):黄色油状液体0.24 g, 收率79%. 1H NMR (300 MHz, CDCl3) δ: 7.93 (d, J=6.0 Hz, 1H), 7.87 (d, J=6.0 Hz, 1H), 7.53~7.49 (m, 1H), 7.32~7.29 (m, 1H), 4.18 (s, 1H, NH), 3.47 (t, J= 12.0 Hz, 2H), 3.02~2.97 (m, 2H), 2.95~2.93 (m, 4H), 2.71~2.66 (m, 4H), 1.67~1.62 (m, 2H), 1.54~1.49 (m, 2H), 1.45~1.41 (m, 2H).
N-(6-氨基正己基) 他克林 (TN-5):黄色油状液体0.23 g, 收率67%. 1H NMR (300 MHz, CD3OD) δ: 8.07~ 8.03 (m, 1H), 7.78~7.74 (m, 1H), 7.54~7.49 (m, 1H), 7.35~7.29 (m, 1H), 3.47 (t, J=12 Hz, 2H), 2.95 (t, J=12 Hz, 2H), 2.69 (t, J=12 Hz, 2H), 2.54 (t, J=15 Hz, 2H), 1.90~1.85 (m, 4H), 1.64~1.55 (m, 2H), 1.43~1.23 (m, 6H); 13C NMR (75 MHz, CD3OD) δ: 159.3, 153.3, 148.2, 129.8, 128.3, 124.8, 124.5, 121.5, 116.9, 48.3, 42.5, 34.4, 33.8, 32.4, 28.0, 27.9, 26.3, 24.3, 23.9.
N-(7-氨基正庚基) 他克林 (TN-6):黄色油状液体0.26 g, 收率71%. 1H NMR (300 MHz, CD3OD) δ: 8.06 (d, J=9 Hz, 1H), 7.76 (d, J=9 Hz, 1H), 7.56~7.50 (m, 1H), 7.36~7.31 (m, 1H), 3.49 (t, J=15 Hz, 2H), 2.96 (t, J=12 Hz, 2H), 2.71 (t, J=12 Hz, 2H), 2.60 (t, J=12 Hz, 2H), 1.89~1.87 (m, 4H), 1.62~1.55 (m, 2H), 1.43~1.39 (m, 2H), 1.25 (m, 6H).
N-(8-氨基正辛基) 他克林 (TN-7):黄色油状液体0.24 g, 收率65%. 1H NMR (300 MHz, CD3OD) δ: 8.06 (d, J=9 Hz, 1H), 7.75 (d, J=9 Hz, 1H), 7.56~7.50 (m, 1H), 7.36~7.31 (m, 1H), 3.49 (t, J=15 Hz, 2H), 2.96 (t, J=12 Hz, 2H), 2.71 (t, J=12 Hz, 2H), 2.60 (t, J=12 Hz, 2H), 1.89~1.87 (m, 4H), 1.62~1.55 (m, 2H), 1.43~1.39 (m, 2H), 1.25 (m, 8H).
3.2.6 化合物TNG-n (n=5~7) 的合成通法
称取化合物DG (55.3 mg, 0.25 mmol) 于25 mL圆底烧瓶中, 用10 mL干燥甲醇溶解, 加入化合物TN-n (0.25 mmol), 然后再加入少量的经活化分子筛, 室温搅拌2 h后.保持室温, 称取三乙酰氧基硼氢化钠 (0.16 g, 0.75 mmol), 搅拌下分批加入到反应体系中, 继续搅拌反应4 h.反应结束, 蒸干溶剂, 用饱和碳酸氢钠溶液淬灭, 乙酸乙酯萃取 (20 mL×3), 合并有机相, 用饱和氯化钠溶液洗涤, 无水硫酸钠干燥, 旋蒸除去溶剂, 残留物用适量甲醇溶解, 过十八烷基硅胶 (ODS) 柱, 高效液相制备 (洗脱剂为甲醇/水, V:V=45:55), 得到目标化合物.
N-[6-(10-去氧栀子酰胺A-基) 氨基正己基]他克林 (TNG-5):淡黄色油状液体44.9 mg, 收率37%. 1H NMR (300 MHz, CD3OD) δ: 8.10~8.07 (m, 1H), 7.77~7.74 (m, 1H), 7.56~7.51 (m, 1H), 7.37~7.32 (m, 1H), 7.15 (s, 1H), 5.75 (s, 1H), 3.71 (s, 3H, OCH3), 3.52 (t, J=15 Hz, 2H), 3.48~3.41 (m, 3H), 2.96 (t, J=12 Hz, 2H), 2.89~ 2.80 (m, 1H), 2.73 (t, J=12 Hz, 2H), 2.57~2.44 (m, 2H), 2.19~2.10 (m, 1H), 1.94~1.85 (m, 4H), 1.68~1.58 (m, 2H), 1.53~1.43 (m, 2H), 1.40~1.26 (m, 4H); 13C NMR (75 MHz, CD3OD) δ: 172.3, 168.8, 159.1, 153.2, 147.9, 141.0, 134.8, 129.7, 129.4, 128.0, 124.7, 124.4, 121.3, 116.8, 110.0, 52.0, 50.1, 49.8, 49.6(2), 41.3, 38.4, 38.3, 34.2, 32.2, 30.1, 28.0, 27.8, 26.2, 24.1, 23.7; ESI-MS m/z: 503.5 [M+H]+, 502.9 [M-H]-; ESI-HRMS calcd for C30H39N4O3 [M+H]+ 503.3022, found 503.3021.
N-[7-(10-去氧栀子酰胺A-基) 氨基正庚基]他克林 (TNG-6):淡黄色油状液体67.5 mg, 收率54%. 1H NMR (300 MHz, CD3OD) δ: 8.11~8.08 (m, 1H), 7.78~7.75 (m, 1H), 7.58~7.53 (m, 1H), 7.39~7.34 (m, 1H), 7.17 (s, 1H), 5.79 (s, 1H), 3.73 (s, 3H, OCH3), 3.54 (t, J=15 Hz, 2H), 3.51~3.44 (m, 3H), 2.98 (t, J=12 Hz, 2H), 2.91~ 2.82 (m, 1H), 2.75 (t, J=12 Hz, 2H), 2.59~2.48 (m, 2H), 2.21~2.12 (m, 1H), 1.96~1.87 (m, 4H), 1.69~1.60 (m, 2H), 1.53~1.44 (m, 2H), 1.40~1.29 (m, 6H); 13C NMR (75 MHz, CD3OD) δ: 172.4, 168.8, 159.0, 153.4, 147.8, 140.8, 134.9, 129.8, 129.7, 127.8, 124.7, 124.5, 121.3, 116.7, 110.1, 52.0, 49.9, 49.7, 49.6, 41.3, 38.4, 38.3, 34.1, 32.2, 30.0, 28.2, 27.8, 26.2, 24.1, 23.7; ESI-MS m/z: 517.8 [M+H]+, 515.4 [M-H]-; ESI-HRMS calcd for C31H41-N4O3 [M+H]+ 517.3179, found 517.3173.
N-(8-(10-去氧栀子酰胺A-基) 氨基正辛基) 他克林 (TNG-7):淡黄色油状液体66.8 mg, 收率52%. 1H NMR (300 MHz, CD3OD) δ: 8.08~8.06 (m, 1H), 7.77~7.74 (m, 1H), 7.56~7.50 (m, 1H), 7.36~7.31 (m, 1H), 7.16 (s, 1H), 5.76 (s, 1H), 3.71 (s, 3H, OCH3), 3.55~3.42 (m, 5H), 2.96 (t, J=12 Hz, 2H), 2.89~2.80 (m, 1H), 2.71 (t, J=12 Hz, 2H), 2.56~2.46 (m, 2H), 2.20~2.11 (m, 1H), 1.94~ 1.86 (m, 5H), 1.65~1.56 (m, 2H), 1.51~1.42 (m, 2H), 1.34~1.18 (m, 8H); 13C NMR (75 MHz, CD3OD) δ: 172.3, 168.8, 159.1, 153.2, 147.9, 141.0, 134.8, 129.7, 129.4, 128.0, 124.7, 124.5, 121.3, 116.7, 110.0, 52.0, 49.9(2), 49.7, 41.3, 38.4, 38.3, 34.2, 32.3, 30.4, 30.3, 30.2, 28.2, 27.8, 26.2, 24.1, 23.7; ESI-MS m/z: 531.8 [M+H]+; ESI-HRMS calcd for C32H43N4O3 [M+H]+ 531.3335, found 531.3336.
3.2.1 (4aS, 7aS)-7-甲酰基-1-氧亚基-2, 4a, 5, 7a-四氢-1H-戊环骈[c]吡啶-4-甲酸甲酯 (DG) 的合成
称取GA (100.4 mg, 0.45 mmol) 于25 mL的圆底烧瓶中, 加入8 mL干燥的二氯甲烷溶液溶解, 然后再称取戴斯-马丁试剂 (384.5 mg, 0.90 mmol) 分批加入到上述反应体系中, 反应体系呈混悬液状态.室温下搅拌反应6 h, 随后在冰浴下放置0.5 h, 直接过滤, 并用二氯甲烷洗涤滤渣, 合并滤液, 旋蒸除去溶剂.残留液用柱层析 (石油醚/乙酸乙酯, V:V=1:1) 分离得到白色油状物84.5 mg, 收率85%. 1H NMR (300 MHz, CDCl3) δ: 9.84 (s, 1H), 8.59 (s, 1H), 7.28~7.24 (m, 1H), 6.97 (s, 1H), 3.94 (d, J=9.0 Hz, 1H), 3.73 (s, 3H), 3.54~3.52 (m, 1H), 3.13~3.10 (m, 1H), 2.41~2.38 (m, 1H); 13C NMR (75 MHz, CDCl3) δ: 188.2, 170.1, 166.7, 150.8, 144.9, 134.2, 109.0, 51.7, 44.7, 40.3, 37.5; ESI-MS m/z: 220.1 [M-H]-.
邻氨基苯甲酸合成过程参照皂化反应的常规方法.收率95%, 熔点146~148 ℃(同文献[16]值).
-
-
[1]
Zimmermann, G. R.; Lehar, J.; Keith, C. T. Drug Discovery Today 2007, 12, 34. doi: 10.1016/j.drudis.2006.11.008
-
[2]
Hanauske, A. R.; Chen, V.; Peoletti, P. Oncologist 2001, 6, 363. doi: 10.1634/theoncologist.6-4-363
-
[3]
Graul, A.; Leeson, P.; Castaner, J. Drugs Future 1999, 24, 269. doi: 10.1358/dof.1999.024.03.489142
-
[4]
Sorbera, L. A.; Castaner, J.; Fresno, M. Drugs Future 2002, 27, 132. doi: 10.1358/dof.2002.027.02.657482
-
[5]
Geldenhuys, W. J.; Youdim, M. B. H.; Carroll, R. T.; Van der Schyf, C. J. Prog. Neurobiol. 2011, 94, 347. doi: 10.1016/j.pneurobio.2011.04.010
-
[6]
Pang, Y. P.; Cusack, B.; Groshan, K.; Richelson, E. J. Biol. Chem. 1996, 271, 15060. doi: 10.1074/jbc.271.25.15060
-
[7]
Bolognesi, M. L.; Cavalli, A.; Valgimigli, L. J. Med. Chem. 2007, 50, 6446. doi: 10.1021/jm701225u
-
[8]
Fernandez, M. I.; Perez, C.; Campillo, N. E. ChemMedChem 2009, 4, 828. doi: 10.1002/cmdc.v4:5
-
[9]
Luo, J.; Wang, J.; Huang, Z.; Yang, J.; Yao, X.; Chen, H.; Zheng, W. ChemMedChem 2012, 7, 1661. doi: 10.1002/cmdc.v7.9
-
[10]
Wang, J.; Yang, J.; Peng, L.; Zhao, J.; Mu, N.; Huang, J.; Lazarovici, P.; Chen, H.; Zheng, W. Neuroscience 2015, 286, 242. doi: 10.1016/j.neuroscience.2014.11.056
-
[11]
Wang, J.; Peng, L.; Zhao, J.; Zhang, L.; Guo, C.; Zheng, W.; Chen, H. Int. J. Mol. Sci. 2015, 16, 22350. doi: 10.3390/ijms160922350
-
[12]
Dess, D. B.; Martin, J. C. J. Org. Chem. 1983, 48, 4155. doi: 10.1021/jo00170a070
-
[13]
Dess, D. B.; Martin, J. C. J. Am. Chem Soc.. 1991, 113, 7277. doi: 10.1021/ja00019a027
-
[14]
Carlier, P. R.; Han, Y. F.; Chow, E. S.-H.; Li, C. P.-L.; Wang, H.; Lieu, T. X.; Wong, H. S.; Pang, Y.-P. Bioorg. Med. Chem. 1999, 7, 351. doi: 10.1016/S0968-0896(98)00213-2
-
[15]
Zhou, J. J.; Huang, H.; Xie, S. Q. Chin. Chem. Lett. 2008, 19, 99. doi: 10.1016/j.cclet.2007.10.031
-
[16]
Sheibley, F. E. J. Chem. Educ. 1943, 20, 115. doi: 10.1021/ed020p115
-
[1]
-
图式1 系列GA-他克林杂合体化合物的设计合成
Scheme 1 Design and synthesis of GA-tacrine hybrids
Regents and conditions: (a) TBSCl/imidazol, THF, r.t., 89%; (b) DMP/DCM, r.t., 80%; (c) NH4Ac, Py, 110 ℃; (d) TFA/THF, 80 ℃, (c) and (d) two-step yield 33.8%; (e) DMP/DCM, r.t., 85%; (f) sat. NaOH, reflux, 95%; (g) cyclohexone/toluent, reflux, 89%; (h) POCl3, 120 ℃, 91%; (i) diamines, KI, 1-pentanol, 160 ℃, 65%~85%; (j) NaBH4/MeOH, 0 ℃, n=1~4, 38%~45%; (k) NaHB (OOCCH3)3, 1, 2-dicloroethane, r.t., n= 5~7, 37%~54%.
图 1 他克林 (Tacrine), GA, TNG-1~TNG-7对6-OHDA诱导的PC12细胞毒性的神经保护作用
Figure 1 Neuroprotection of tacrine, GA, TNG-1~TNG-7 against 6-OHDA-induced toxicity in PC12 cells
PC12 cells were pre-treated with 200 µmol•L-1 6-OHDA for 2 h, following the treatment of tacrine, GA, TNG-1~TNG-7 at a dose of 3, 10 and 30 µmol•L-1, respectively. And then the cells were incubated for another 24 h. Cells viability was determined by MTT assay. ## p < 0.01 vs. control group; *p < 0.05, **p < 0.01 vs. 6-OHDA group (n=6)
图 2 他克林 (T), GA (G), 1:1联合用药T+G (摩尔浓度比T:G=1:1) 以及TNG-1和TNG-5对6-OHDA诱导的PC12细胞毒性的神经保护作用的比较
Figure 2 Comparison of the neuroprotective effects of tacrine (T), GA (G), drug combination T+G (T:G=1:1 in concentration), TNG-1, and TNG-5 against 6-OHDA-induced impairments in PC12 cells
PC12 cells were pretreated with 200 µmol•L-1 6-OHDA for 2 h, and then tested samples at the dose of 30 µmol•L-1 were added, respectively. After that, cells were incubated for another 24 h. The cell viability was determined by MTT assay. ##p < 0.01 vs. control group (Ctrl); *p < 0.05, **p < 0.01 vs. Cort-treated group (n=6).
表 1 化合物TN-n和TNG-n的反应收率
Table 1. Yields of compounds TN-n and TNG-n
Compd. n Yield/% TN-1 1 72 TN-2 2 85 TN-3 3 81 TN-4 4 79 TN-5 5 67 TN-6 6 71 TN-7 7 65 TNG-1 1 45 TNG-2 2 42 TNG-3 3 38 TNG-4 4 43 TNG-5 5 37 TNG-6 6 54 TNG-7 7 52 表 2 TNG-n系列化合物对6-OHDA诱导的PC12细胞损伤保护作用 (细胞存活率/%)a
Table 2. Neuroprotective effect of TNG-n on the cell viability of PC12 cells induced by 6-OHDA (cell viability/%)
Compd. cTNG-n/(μmol•L-1) 3 10 30 他克林 44.42±1.90 47.35±3.87 50.82±2.91 GA 44.31±7.83 52.56±5.06 64.11±1.23 TNG-1 47.56±1.56 59.23±2.03* 71.17±1.76** TNG-2 37.93±2.63 53.41±0.99 37.64±6.48 TNG-3 39.20±3.98 44.71±2.54 49.31±5.68 TNG-4 42.72±7.91 54.23±7.61* 65.22±2.72** TNG-5 49.61±3.76 54.70±0.88 72.78±1.06 TNG-6 36.02±6.25 31.59±6.81 36.92±3.68 TNG-7 35.45±3.19 34.09±1.66 44.17±9.65 a The percentage of cell viability was presented as mean±SD for six replicates. *p<0.05, **p<0.01 vs. 6-OHDA group (n=6). -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 2141
- HTML全文浏览量: 170




 下载:
下载:


 下载:
下载:

