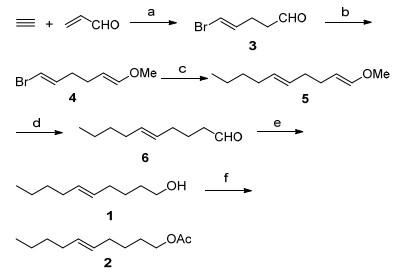
 图 图式1
目标化合物1和2的合成路线
Figure 图式1.
Synthetic route of the target compounds 1 and 2
图 图式1
目标化合物1和2的合成路线
Figure 图式1.
Synthetic route of the target compounds 1 and 2

Citation: Huang Fei, Yang Wanqiu, Zhang Yushun Yushun, Yao Yun, Tao Yunhai. Simple Synthesis of 5E-Decen-1-ol and 5E-Decenyl Acetate, the Sex Pheromone of Peach Twig Borer[J]. Chinese Journal of Organic Chemistry, 2017, 37(4): 1046-1050. doi: 10.6023/cjoc201608011

桃条麦蛾性信息素5E-癸烯-1-醇及乙酸5E-癸烯酯的简便合成
-
关键词:
- 桃条麦蛾
- / 5E-癸烯-1-醇
- / 乙酸5E-癸烯酯
- / 信息素合成
- / Kumada偶联反应
English
Simple Synthesis of 5E-Decen-1-ol and 5E-Decenyl Acetate, the Sex Pheromone of Peach Twig Borer
-
Key words:
- peach twig borer
- / 5E-decen-1-ol
- / 5E-decenyl acetate
- / pheromone synthesis
- / Kumada cross-coupling
-
桃条麦蛾 (拉丁学名Anarsia lineatella Zeller, 英文名Peach twig borer), 属鳞翅目麦蛾科条麦蛾属.桃条麦蛾主要为害桃、杏、苹果等, 第一代幼虫主要危害新梢和花, 而下一代幼虫主要取食果实.桃条麦蛾原产于地中海地区, 国外分布在苏联、中亚细亚、欧洲的中部及南部、地中海东部以及北美等地, 国内分布在华北及西北地区[1].
目前化学农药仍是农业上防治害虫的基本手段, 但是长期大量的使用导致很多副作用, 害虫抗药性导致用药量增加、防治成本提高、防治更加困难, 杀伤天敌, 破坏生态, 污染环境, 农药残留.因此, 目前国内外研究者一直在努力探索和研究害虫防治的新途径、新技术.应用昆虫信息素防治害虫作为一种生物防治技术, 具有活性高、选择性强、无毒、不污染环境、不杀伤天敌、不易产生抗药性等优点, 国内外对其研究日益关注, 并成功应用于多种农林害虫的防治中[2].大量研究表明, 以昆虫性信息素为基础的大量诱捕法和交配干扰法应用于桃条麦蛾的防治, 具有广泛的应用前景, 为我们提供了一条有效解决上述问题的新方法[3].
桃条麦蛾性信息素由Roelofs等[4]于1975年分离鉴定为5E-癸烯-1-醇 (1) 和乙酸5E-癸烯酯 (2).目前已有多种方法合成桃条麦蛾性信息素.多人报道了炔还原的方法, 他们通过不同的方法制备了相应的炔, 但是这些方法步骤繁琐、条件苛刻[5].还有报道改进的Horner-Wittig反应形成反式双键, 但是制备含膦中间产物有难度[6]. Vig等[7]报道了一条从1, 5-戊二醇出发的经Claisen重排的路线, 步骤繁琐, 且需要剧毒的乙酸汞. Miyano等[8]报道了从正己烯出发与氯碘甲烷在AIBN作用下得到1-氯-3-碘庚烷, 再与丙二酸作用得到4E-壬酸, 再经多步反应得到目标产物. Chattopadhyay等[9]报道了正丁基锂加成二氢吡喃得到4E-壬烯醇再经多步反应得到目标产物. Zakharkin等[10]报道了从E-l, 6-十一碳二烯出发经二溴代、高锰酸钾氧化和脱溴等步骤的路线, 但是合成E-l, 6-十一碳二烯需要多步反应. Chauret等[11]报道了环氧硅烷与有机金属化合物反应后消除形成反式双键的方法.有专利报道了烯烃复分解反应制备目标产物, 但是立体选择性较差[12].这些方法或步骤繁琐, 或原料昂贵, 或条件苛刻.
作为我们课题组昆虫信息素合成研究[13]的部分工作, 本文以廉价易得的丙烯醛为原料, 在钯催化下与乙炔偶联得到5-溴-4E-戊烯醛 (3), 与甲氧基甲基三苯基氯化膦进行Wittig反应得到1E, 5E/Z-1-溴6-甲氧基己二烯 (4), 再与丁基溴化镁进行Kumada偶联反应得到1E/Z, 5E-1-甲氧基癸二烯 (5), 水解得到5E-癸烯醛 (6), 再还原得到5E-癸烯-1-醇 (1), 最后酯化得到乙酸5E-癸烯酯 (2), 总产率为32.8% (Scheme 1).
1 结果与讨论
以丙烯醛为原料, 在钯催化下与乙炔偶联得到5-溴-4E-戊烯醛 (3), 再经Wittig反应、Kumada偶联反应、酸水解和还原得到目标产物5E-癸烯-1-醇 (1), 酯化得到另一目标产物乙酸5E-癸烯酯 (2), 总产率为32.8% (Scheme 1).
我们[13d]先前报道了丙烯醛与乙炔偶联反应同时产生5-溴-4E-戊烯醛 (3) 和7-溴-4Z, 6E-庚烯醛 (7) (Scheme 2), 在本文中我们优化了反应条件, 得到唯一产物3.比较表 1的Entries 1~3可以看出, 丙烯醛浓度增加即HOAc和H2O用量减少, 明显促进3生成; 比较Entries 3~5可以看出, 温度对反应有双重影响, 温度升高至室温促进3生成并抑制7生成, 温度进一步升高, 二者的产率均有所下降, 这可能是丙烯醛及两个产物在高温下不稳定所致; 比较Entries 4、6、7可以看出, 延长反应时间促进3生成; 比较Entries 7~9可以看出, 增加乙炔气压, 对3的产率影响很小, 但对反应选择性影响较大.本文报道的实验条件是反应时间不变而反应规模放大, 产率略有下降, 在情理之中. Lu等[14]在1998年首次报道化合物7并推测了机理, 即Scheme 2中的 (a) 路径, 首先溴化锂在钯催化下加成乙炔得到中间体8, 再加成一分子乙炔得到中间体9, 再加成丙烯醛得到中间体10, 最后质子化得到化合物7.我们据此推测了化合物3的反应机理, 即 (b) 路径, 中间体8加成丙烯醛得到中间体11, 最后质子化得到化合物3.决定中间体8反应路径的关键因素是乙炔气压和丙烯醛浓度, 在乙炔气压固定时, 提高丙烯醛浓度可以促使反应向路径 (b) 进行.实际反应中通过控制HOAc用量调节丙烯醛浓度, HOAc既是溶剂也提供质子, 因此至少要超过反应物且足以溶解反应物.化合物3的GC-MS出现几组m/z相差2的离子峰及比例, 表明含有溴原子, 其1H NMR中δ在6.12和6.15~6.22的信号峰, J=13.6 Hz, 表明具有反式双键结构.
 表 1
钯催化的丙烯醛、乙炔及溴化锂的偶联反应的优化
Table 1.
Optimization of Pd (Ⅱ)-catalyzed coupling reaction of halide, acetylene, and acrolein
表 1
钯催化的丙烯醛、乙炔及溴化锂的偶联反应的优化
Table 1.
Optimization of Pd (Ⅱ)-catalyzed coupling reaction of halide, acetylene, and acrolein
Entry n(HOAc)/n(H2O) Reaction time/h Temperature/℃ Acetylene pressure/kPa Yield/% 7 3 1 4.5/3 24 5 101 16 15 2 3/2 24 5 101 18 21 3 1.5/1 24 5 101 3.2 35 4 1.5/1 24 25 101 1.0 38 5 1.5/1 24 45 101 0.8 31 6 1.5/1 48 25 101 1.2 59 7 1.5/1 72 25 101 1.3 73 8 1.5/1 72 25 81 0.5 70 9 1.5/1 72 25 122 3.3 73 a Pd (OAc)2 (1 mmol), LiBr (1 mol) and acrolein (1.2 mol). 表 1 钯催化的丙烯醛、乙炔及溴化锂的偶联反应的优化
Table 1. Optimization of Pd (Ⅱ)-catalyzed coupling reaction of halide, acetylene, and acrolein常规合成路线是将化合物3的醛基保护后再进行Kumada偶联, 本文的创新设计是先通过Wittig反应增加一个碳得到烯醚4, 再进行Kumada偶联, 烯醚对于格氏试剂是稳定的.该Wittig反应按照一般操作给出满意产率. Kumada偶联相比我们以前的工作[13a, b]大为改进, 以NiCl2(dppp) 作为催化剂, 以满意产率得到烯醚5.烯醚5用乙酸水解得到烯醛6.烯醛6用NaBH4还原得到目标产物5E-癸烯醇 (1), 再用乙酸酐酯化得到另一个目标产物乙酸5E-癸烯酯 (2).
5E-癸烯醇 (1) 的1H NMR谱图中δ在5.35~5.43有两个氢的多重峰, 说明具有碳碳双键结构, 在3.63有两个氢的三重峰, 对应羟基邻位的亚甲基; 13C NMR谱图中δ在131.3、130.2和63.3的信号峰表明具有双键结构和羟基. 5E-癸烯醇 (1) 的立体选择性根据气相色谱确定.根据我们长期研究这类化合物的经验, 气相色谱图上, 顺式异构体在前, 反式异构体在后, 它们的保留时间相差小于0.2 min.目标产物符合这一规律, 如图 1所示, 在主峰前没有极近的明显小峰出现, 因此顺式异构体含量达到99%以上, 这也表明化合物3的顺反异构纯度非常好, 并且Kumada偶联反应不会改变化合物顺反异构.
本路线各步反应的中间产物和目标产物的结构经NMR和GC-MS确证, 目标化合物与参考文献[8]数据一致.本文的合成方法共计6步反应, 总产率为32.8%, 具有原料廉价易得、合成路线简单、反应条件温和、操作便利安全、产率高、成本低的优点, 是一条具有实用价值的合成路线.
2 实验部分
2.1 仪器与试剂
Bruker-Ascend 400核磁共振仪 (CDCl3为溶剂, TMS作为内标); Aglilent GC6890-MS5973气质联用仪; Aglilent 7820A气相色谱仪 (GC).柱层析硅胶 (200~300目) 及薄层硅胶板 (GF254) 购自青岛海洋化工厂.试剂购自阿拉丁试剂 (上海) 有限公司.溶剂未作特别说明外均未做前处理.
2.2 5-溴代-4E-戊烯醛 (3) 的制备
将丙烯醛 (168 g, 3 mol)、LiBr (261 g, 3 mol) 和Pd (OAc)2 (560 mg, 2.5 mmol) 溶于HOAc (270 g, 4.5 mol) 和H2O (54 g, 3 mol) 的混合溶剂中, 通入经硫酸洗气处理的乙炔, 在室温下搅拌反应72 h, 用饱和Na2CO3溶液中和至中性, 分离有机层, 水层用Et2O萃取 (200 mL×3), 合并有机层并用水洗涤, 经无水Na2SO4干燥并蒸除溶剂后得248 g桔黄色液体3, 产率61%, 无需分离即可用于下一步反应. 1H NMR (CDCl3, 400 MHz) δ: 9.77 (s, 1H, CHO), 6.12 (d, J=13.6 Hz, 1H, BrCH=CH), 6.15~6.22 (m, 1H, BrCH=CH), 2.60~2.56 (m, 2H), 2.40~2.35 (m, 2H); 13C NMR (CDCl3, 100 MHz) δ: 200.7, 135.8, 106.0, 42.5, 25.4; EI-MS m/z: 162/164 (M+), 133/135, 119/121, 106/108, 93/95, 83, 79/81, 65, 55.
2.3 1E, 5E/Z-1-溴-6-甲氧基己二烯 (4) 的制备
在氮气保护及冰浴中, 将甲氧基甲基三苯基氯化膦 (514 g, 1.5 mol) 和2 L无水THF混合, 分几次加入t-BuOK (168 g, 1.5 mol), 搅拌1 h得到红色溶液, 将化合物3 (163 g, 1 mol) 的1 L无水THF溶液滴加到反应混合物中, 搅拌反应12 h, 加入1 L饱和NaCl溶液, 分离水层, 有机层用饱和NaCl溶液洗涤, 经无水Na2SO4干燥并蒸除溶剂后得粗产物, 经柱层析 (洗脱剂为石油醚) 纯化得146 g淡黄色液体4, 产率87%.
1E, 5E-1-溴-6-甲氧基己二烯: 1H NMR (CDCl3, 400 MHz) δ: 6.30 (d, J=12.6 Hz, 1H, C=CHOCH3), 6.21~6.13 (m, 1H, BrCH=CH), 6.02 (d, J=14.2 Hz, 1H, Br-CH=CH), 4.67 (dt, J=12.6, 7.2 Hz, 1H, CH=CHOCH3), 2.00~2.20 (m, 2H, CH2CH2); 13C NMR (CDCl3, 100 MHz) δ: 147.9, 137.7, 104.9, 101.3, 55.9, 34.2, 22.2.
1E, 5Z-1-溴-6-甲氧基己二烯: 1H NMR (CDCl3, 400 MHz) δ: 6.21~6.13 (m, 1H, BrCH=CH), 6.02 (d, J=14.2 Hz, 1H, BrCH=CH), 5.89 (d, J=6.2 Hz, 1H, C=CHOCH3), 4.30 (dt, J=6.3, 7.0 Hz, 1H, CH=CHOCH3), 2.00~2.20 (m, 2H, CH2CH2); 13C NMR (CDCl3, 100 MHz) δ: 146.9, 137.4, 104.6, 104.4, 59.5, 33.0, 27.0; EI-MS m/z: 162/164 (M+), 133/135, 119/121, 106/108, 93/95, 83, 79/81, 65, 55.
2.4 1E/Z, 5E-1-甲氧基癸二烯 (5) 的制备
在氮气保护及冰浴中, 将NiCl2(dppp) (1084 mg, 2 mmol) 和化合物4 (153 g, 0.8 mol) 溶于800 mL无水THF, 将正丁基溴化镁 (1.2 mol, 1 mol•L-1) 的无水THF溶液滴加到反应混合物中, 搅拌反应12 h, 加入1 L饱和NaCl溶液, 分离水层, 有机层用饱和NaCl溶液洗涤, 经无水Na2SO4干燥并蒸除溶剂后得粗产物, 经柱层析 (洗脱剂为石油醚) 纯化得114 g淡黄色液体5, 产率85%.
1E, 5E-1-甲氧基癸二烯: 1H NMR (CDCl3, 400 MHz) δ: 6.29 (d, J=12.6 Hz, 1H, C=CHOCH3), 5.44~5.36 (m, 2H, CH=CH), 4.72 (dt, J=12.6, 7.1 Hz, 1H, CH=CHOCH3), 3.49 (s, OCH3), 1.96~2.18 (m, 6H, =CH-CH2), 1.24~1.34 (m, 4H), 0.89 (t, J=7.0 Hz, 3H, CH3); 13C NMR (CDCl3, 100 MHz) δ: 147.1, 131.0, 129.4, 102.6, 55.8, 33.9, 32.3, 31.8, 28.0, 22.2, 14.0.
1Z, 5E-1-甲氧基癸二烯: 1H NMR (CDCl3, 400 MHz) δ: 5.87 (d, J=6.3 Hz, 1H, C=CHOCH3), 5.44~5.36 (m, 2H, CH=CH), 4.34 (dt, J=6.3, 7.0 Hz, 1H, CH=CHOCH3), 3.57 (s, OCH3), 1.96~2.18 (m, 2H, =CHCH2), 1.24~1.34 (m, 4H), 0.89 (t, J=7.0 Hz, 3H, CH3); 13C NMR (CDCl3, 100 MHz) δ: 146.0, 130.7, 129.7, 106.4, 59.4, 32.7, 32.3, 31.8, 24.0, 22.2, 14.0.
2.5 5E-癸烯醛 (6) 的制备
将化合物5 (101 g, 0.6 mol) 溶于600 mL HOAc-THF-H2O (V:V:V=3:1:1) 混合溶剂中, 55 ℃下搅拌10 h, 用饱和Na2CO3溶液中和至中性, 用乙酸乙酯萃取 (200 mL×3), 有机层用饱和NaCl溶液洗涤, 经无水Na2SO4干燥并蒸除溶剂后得粗产物, 经柱层析 (洗脱剂为石油醚和乙酸乙酯) 纯化得87 g无色液体6, 产率94%. 1H NMR (CDCl3, 400 MHz) δ: 9.76 (s, 1H, CHO), 5.47~5.31 (m, 2H, CH=CH), 2.44~2.40 (m, 2H, CH2CHO), 2.06~2.02 (m, 2H), 1.99~1.96 (m, 2H), 1.74~1.65 (m, 2H), 1.32~1.30 (m, 4H), 0.89 (t, J=7.0 Hz, 3H); 13C NMR (CDCl3, 100 MHz) δ: 202.7, 131.9, 128.7, 43.1, 32.2, 31.7, 31.6, 22.2, 21.9, 13.9.
2.6 5E-癸烯醇 (1) 的制备
将化合物6 (77 g, 0.5 mol) 和NaBH4 (9.93 g, 0.2625 mol) 溶解在500 mL MeOH中, 并加入0.1 mL NaOH水溶液 (6 mol•L-1), 在冰浴中下搅拌反应4 h, 用稀HCl中和至中性, 蒸除MeOH, 用200 mL×3乙酸乙酯萃取, 有机层用水洗涤, 经无水Na2SO4干燥并蒸除溶剂后得粗产物, 经柱层析 (洗脱剂为石油醚和乙酸乙酯) 纯化得68 g无色液体1, 产率87%. 1H NMR (CDCl3, 400 MHz) δ: 5.35~5.45 (m, 2H, CH=CH), 3.63 (t, J=6.6 Hz, 2H, CH2OH), 1.97~2.04 (m, 4H, CH2), 1.53~1.60 (m, 2H, CH2), 1.38~1.45 (m, 2H, CH2), 1.27~1.34 (m, 4H, CH2), 0.89 (t, J=7.1 Hz, 3H, CH3); 13C NMR (CDC13, 100 MHz) δ: 130.8, 129.8, 62.8, 32.3(2C), 31.8(2C), 25.7, 22.2, 13.9; EI-MS m/z: 156, 138, 110, 95, 81, 67, 55.与文献[8]一致.
2.7 乙酸5E-癸烯酯 (2) 的制备
将化合物1 (59.4 g, 0.3 mol), Ac2O (36.7 g, 0.36 mol) 和Et3N (42.5 g, 0.42 mol) 溶于300 mL CH2Cl2中, 在冰浴中搅拌反应5 h, 用稀HCl酸化除去过量Et3N, 分离有机层, 水层用CH2Cl2萃取 (50 mL×2), 合并有机层并用水洗涤, 再经无水Na2SO4干燥并蒸除溶剂后得粗产物, 经柱层析 (洗脱剂为石油醚和乙酸乙酯) 纯化得53 g无色液体2, 产率89%. 1H NMR (CDC13, 400 MHz) δ: 5.35~5.43 (m, 2H, CH=CH), 4.06 (t, J=6.7 Hz, 2H, CH2O), 2.04 (s, 3H, CH3COO), 1.95~2.02 (m, 4H, CH2), 1.58~1.64 (m, 2H, CH2), 1.38~1.44 (m, 2H, CH2), 1.25~1.38 (m, 4H, CH2), 0.9 (t, J=6.6 Hz, 3H, CH3); 13C NMR (CDC13, 100 MHz) δ: 171.2, 131.0, 129.5, 65.9, 32.1, 31.8(2C), 28.0, 25.9, 22.2, 21.0, 13.9.与文献[8]一致.
辅助材料(Supporting Information)化合物的核磁共振谱图.这些材料可以免费从本刊网站 (http://sioc-journal.cn/) 上下载.
-
-
[1]
白九维, 赵剑霞, 马文梁, 林业科学, 1980, S1, 127.Bai, J.-W.; Zhao, J.-X.; Ma, W.-L. Sci. Silvae Sin. 1980, S1, 127 (in Chinese).
-
[2]
(a) Meng, X. -Z. Entomol. Knowl. 2000, 37, 75 (in Chinese).
(孟宪佐, 昆虫知识, 2000, 37, 75. )
(b) Meng, X. -Z. Chin. Bull. Entomol. 2007, 44, 477 (in Chinese).
(苏茂文, 张钟宁, 昆虫知识, 2007, 44, 477. ) -
[3]
倪长春, 世界农药, 2008, 30, 31. doi: 10.3969/j.issn.1009-6485.2008.01.005Ni, C.-C. World Pestic. 2008, 30, 31 (in Chinese). doi: 10.3969/j.issn.1009-6485.2008.01.005
-
[4]
Roelofs, W. L.; Kochansky, J.; Anthon, E.; Rice, R.; Carde, R. Environ. Entomol. 1975, 4, 580. doi: 10.1093/ee/4.4.580
-
[5]
(a) Ohloff, G.; Vial, C.; Näf, F.; Pawlak, M. Helv. Chim. Acta 1977, 60, 1161.
(b) Odinokov, V. N.; Balezina, G. G.; Ishmuratov, G. Y.; Vakhitov, R. S.; Tolstikov, G. A. Chem. Nat. Compd. 1985, 21, 369.
(c) Poleschner, H.; Heydenreich, M.; Martin, D. Synthesis 1991, 1231.
(d) Doolittle, R. E.; Patrick, D. G.; Heath, R. H. J. Org. Chem. 1993, 58, 5063. -
[6]
(a) Buss, A. D.; Greeves, N.; Mason, R.; Warren, S. J. Chem. Soc., Perkin Trans. 1 1987, 2569.
(b) Levin, D.; Warren, S. Tetrahedron Lett. 1985, 26, 505.
(c) Buss, A. D.; Greeves, N.; Levin, D.; Wallace, P.; Warren, S. Tetrahedron Lett. 1984, 25, 357. -
[7]
Vig, O. P.; Sharma, M. L.; Gakhar, M.; Malik, N. Indian J. Chem., Sect. B 1980, 19, 755.
-
[8]
Miyano, S.; Hokari, H.; Umeda, Y.; Hashimoto, H. Bull. Chem. Soc. Jpn. 1980, 53, 770. doi: 10.1246/bcsj.53.770
-
[9]
Chattopadhyay, A.; Mamdapur, V. R.; Chadha, M. S. Indian J. Chem., Sect. B 1983, 22, 1221.
-
[10]
Zakharkin, L. I.; Petrushkina, E. A. Bull. Acad. Sci. USSR, Div. Chem. Sci. 1985, 34, 193. doi: 10.1007/BF01157355
-
[11]
Chauret, D. C.; Chong, J. M. Tetrahedron Lett. 1993, 34, 3695. doi: 10.1016/S0040-4039(00)79203-3
-
[12]
Pederson, R. L.; Grubbs, R. H. US 20020022741, 2002[Chem. Abstr. 2002, 143315]
-
[13]
(a) Tao, Y. -H. ; Cheng, W. -X. ; Zhang, Y. -S. ; Gu, K. Chem. J. Chin. Univ. 2005, 26, 1072 (in Chinese).
(陶云海, 程伟贤, 张玉顺, 古昆, 高等学校化学学校, 2005, 26, 1072. )
(b) Tao, Y. -H. ; Cheng, W. -X. ; Huang, X. -Z. ; Zhang, Y. -S. ; Gu, K. Chin. J. Org. Chem. 2005, 25, 558 (in Chinese).
(陶云海, 程伟贤, 黄相中, 张玉顺, 古昆, 有机化学, 2005, 25, 558. )
(c) Ma, Z. ; Yang X. ; Zhang, Y. ; Huang, X. ; Tao, Y. Synlett 2012, 23, 581.
(d) Tao, Y. ; Yang, X. ; Jin, Y. ; Wang, Q. Synth. Commun. 2013, 43, 415.
(e) Yang, X. -M. ; Zhang, Y. -Z. ; Yao, Y. ; Tao, Y. -H. Chin. J. Org. Chem. 2014, 34, 1458 (in Chinese).
(杨晓梅, 张玉顺, 姚赟, 陶云海, 有机化学, 2014, 34, 1458. ) http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344374.shtml -
[14]
Wang, Z.; Lu, X.; Lei, A.; Zhang, Z. J. Org. Chem. 1998, 63, 3806. doi: 10.1021/jo980440x
-
[1]
-
图式1 目标化合物1和2的合成路线
Scheme 1 Synthetic route of the target compounds 1 and 2
Reagents and conditions: (a) LiBr, Pd (OAc)2, HOAc/H2O, r.t., 72 h, 61%. (b) MeOCH2P+Ph3•Cl-, t-BuOK, THF, 0 ℃, 12 h, 87%. (c) n-BuMgBr, NiCl2(dppp), THF, 0 ℃, 12 h, 85%. (d) HOAc-THF-H2O, 55 ℃, 10 h, 94%. (e) NaBH4, MeOH, 0 ℃, 4 h, 87%. (f) Ac2O, Et3N, CH2Cl2, 0 ℃, 5 h, 89%.
表 1 钯催化的丙烯醛、乙炔及溴化锂的偶联反应的优化
Table 1. Optimization of Pd (Ⅱ)-catalyzed coupling reaction of halide, acetylene, and acrolein
Entry n(HOAc)/n(H2O) Reaction time/h Temperature/℃ Acetylene pressure/kPa Yield/% 7 3 1 4.5/3 24 5 101 16 15 2 3/2 24 5 101 18 21 3 1.5/1 24 5 101 3.2 35 4 1.5/1 24 25 101 1.0 38 5 1.5/1 24 45 101 0.8 31 6 1.5/1 48 25 101 1.2 59 7 1.5/1 72 25 101 1.3 73 8 1.5/1 72 25 81 0.5 70 9 1.5/1 72 25 122 3.3 73 a Pd (OAc)2 (1 mmol), LiBr (1 mol) and acrolein (1.2 mol). -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1172
- HTML全文浏览量: 137




 下载:
下载:


 下载:
下载:

