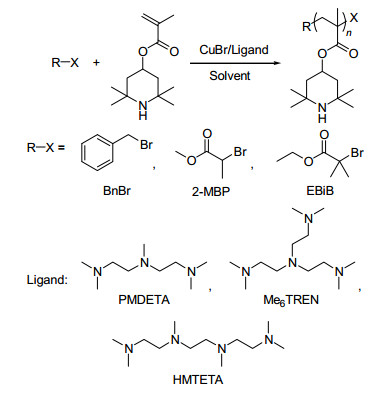
 图 图式1
通过原子转移自由基聚合合成PTMPM
Figure 图式1.
Synthesis of PTMPM via ATRP
图 图式1
通过原子转移自由基聚合合成PTMPM
Figure 图式1.
Synthesis of PTMPM via ATRP

Citation: Jian Zukai, Yang Yang, Lang Meidong, Li Yongjun. Atom Transfer Radical Polymerization of Secondary Amine Containing Methacrylate Monomer[J]. Chinese Journal of Organic Chemistry, 2015, 36(2): 412-416. doi: 10.6023/cjoc201509039

含有仲氨基团的甲基丙烯酸酯单体的原子转移自由基聚合研究
English
Atom Transfer Radical Polymerization of Secondary Amine Containing Methacrylate Monomer
-
Key words:
- methacrylate
- / secondary amine
- / atom transfer radical polymerization
-
近年来随着信息技术和新能源技术的发展, 作为高效储能的二次电池成为若干重大应用中的关键技术之一.无论是清洁能源、电动汽车, 以及各种便携式电子产品, 均需要高能量密度或高功率密度的二次电池作为技术支持[1, 2].目前大量研究的二次电池, 主要是以无机氧化物为电极材料的锂离子电池, 其充放电过程是通过电子和相应平衡离子在电极表面的迁移来实现的[3].但是, 离子的传递速率受制于离子在电极材料中较慢的嵌入和转移的动力学过程, 很难大幅度提高其功率密度.另外, 基于过渡金属氧化物的二次电池由于面临的资源与环境问题, 亟待寻求新型的替代品.
与无机电极材料相比, 具有氧化还原活性的有机聚合物材料在储能密度、原料和环境等方面的优势, 日益受到人们的关注[4].自由基聚合物是一种含有稳定自由基的聚合物电极材料, 其结构中的稳定自由基能够发生迅速、可逆的单电子氧化还原反应, 从而实现电荷的存储与释放.在充放电循环的过程中具有优异的倍率性能及循环稳定性[5].自从2002年Nakahara等[6]首次将聚(4-甲基丙烯酰氧基-2, 2, 6, 6-四甲基哌啶氮氧自由基) (PTMA)应用于二次电池的正极材料, 这种聚合物电极材料由于其优良的电化学稳定性、可逆性和快速充放电等特点, 有望成为新一代高容量兼高功率电极材料[7].
PTMA是通过单体2, 2, 6, 6-四甲基哌啶-4-甲基丙烯酸酯(TMPM)的自由基聚合以及进一步的氧化来制备[8, 9].为了方便合成具有不同分子量或拓扑结构的自由基聚合物, 以及制备含有自由基聚合物的复合材料, 可控自由基聚合是一种重要的合成手段[10~12].与常见的丙烯酸酯类单体相比, TMPM的可控自由基聚合的报道很少.由于其结构中含有仲氨基团, 在通过可逆加成-断裂链转移聚合(RAFT)聚合时, RAFT试剂的硫代酯结构会被氨解从而终止聚合反应, 因此TMPM的RAFT聚合需要事先将氨基转化为相应的盐酸盐[13].而通过原子转移自由基聚合(ATRP)时, 仲氨基团能够取代Cu(I)-配体络合物中的配体, 因此很难取得很好的可控性. Lee等[14]报道了表面引发ATRP制备PTMPM功能化的ITO, 但是没有对其ATRP聚合进行详细的研究. Gohy等[15]报道了TMPM的ATRP聚合, 以TsCl为引发剂, CuCl/dNbpy为催化体系, 得到了窄分散的聚(2, 2, 6, 6-四甲基哌啶-4-甲基丙烯酸酯) (PTMPM), 但是TsCl很难与Grafting-from策略相结合用于合成含有自由基聚合物的复合材料.因此, 在上述工作的基础上, 我们有必要通过对多种引发剂和催化体系的比较, 筛选TMPM合适的ATRP聚合体系.
在本文中, 我们以丙烯酸酯类单体常用的引发剂、催化体系引发TMPM的ATRP聚合(Scheme 1), 通过对反应时间、单体转化率、表观引发剂效率、聚合物的分子量以及分子量分布等比较, 找到了TMPM最佳的ATRP聚合体系, 即以EBiB为引发剂, CuBr/HMTETA为催化体系, 在丙酮中70 ℃聚合得到分子量可控、分子量分布窄的PTMPM.
1 结果与讨论
1.1 TMPM的ATRP聚合体系选择
TMPM的自由基聚合一般是在极性溶剂(如无水乙酸)中进行, 可能的原因是单体中的哌啶结构在聚合过程中有阻聚作用.当选择乙酸作为溶剂时, 由于羧基与哌啶的仲氨基团之间能够形成羧酸盐, 抑制了单体的阻聚作用, 所以TMPM能够顺利聚合[16].对于TMPM的可控自由基聚合的研究中, 多采用极性较弱的甲苯或苯甲醚作溶剂作为反应溶剂.考虑到TMPM是甲基丙烯酸酯类单体, 其常用的溶剂包括四氢呋喃、二氧六环、丙酮等, 我们选择对TMPM有很好溶解性的丙酮为溶剂, 以苄基卤化物或α-卤代酯为引发剂, CuBr为催化剂, 配体选择含氮的三齿配体或四齿配体, 反应温度为70 ℃, 反应时间为8 h, 所得聚合物的分子量、分子量分布, 单体的转化率和引发剂的表观引发效率见表 1, 聚合物的GPC曲线见附加材料.从聚合物PTMPM的核磁谱图上看出(图 1), δ 6.07和5.54处的双键氢在聚合后消失, 说明聚合反应的发生, 而与氧羰基相连的氢的信号依然在δ 5.11处, 哌啶环上的四个甲基氢信号出现在δ 1.24和1.14处.另外, 聚合后双键上的甲基氢的化学位移在δ 1.00处.
Initiator Ligand Mnb/(g·mol-1) Mw/Mn Conv.c/% I.E.d/% 1 BnBr HMTETA 8900 1.53 61.7 136.3 2 PMDETA 20900 1.49 69.8 56.9 3 Me6TREN 13860 1.47 66.7 77.0 4 2-MBP HMTETA 12000 1.18 95.7 133.6 5 PMDETA 11900 1.19 98.7 143.1 6 Me6TREN 11900 1.19 81.9 103.7 7 EBiB HMTETA 9800 1.04 98.7 172.7 8 PMDETA 10970 1.06 98.1 150.9 9 Me6TREN 12100 1.18 89.2 132.8 aFeed ratio: [TMPM]:[Initiator]:[CuBr]:[Ligand]=50:1:1:1, acetone as solvent, 70 ℃, 8 h. bDetermined by GPC (THF/TEA=97/3 as mobile phase,
PMMA as standard). cConversion determined by 1H NMR. dI.E., apparent initiator efficiency, was the percentage of the mass of PTMPM to the mass of initiator.表 1 单体TMPM在不同引发剂和催化体系下的ATRP聚合
Table 1. ATRP of TMPM using different initiators and catalyst systema与α-卤代酯引发剂相比, 苄基溴作为TMPM的ATRP引发剂时, 经过8 h聚合后, 单体转化率低于70%, 聚合物PTMPM的分子量分布较宽.当使用不同的催化体系时, 所得聚合物的分子量变化较大, 以CuBr/HMTETA为催化体系时, PTMPM的分子量为8900, 而以CuBr/ PMDETA为催化体系时, PTMPM的分子量为20900.当使用不同的催化体系时, 引发剂的表观引发剂效率也有很大的变化, 以CuBr/HMTETA为催化体系时, BnBr的表观引发剂效率为136.3%(表观引发剂效率大于100%, 是因为通过GPC测试所得到的分子量为相对分子量), 而以CuBr/PMDETA为催化体系时, BnBr的表观引发剂效率为56.9%.从单体转化率、PTMPM的分子量及分子量分布, 以及表观引发剂效率等方面可以看出, 苄基溴不能很好地引发TMPM的ATRP聚合.当使用与单体结构类似的α-卤代酯类引发剂时, 在相同的反应时间内, 单体转化率能够达到80%以上, 甚至接近100%, 而且所得聚合物的分子量分布小于1.2[17].从表观引发剂效率来看, α-卤代酯类引发剂能够很好地引发TMPM的ATRP聚合.与2-MBP相比, EBiB作为ATRP引发剂时, 能够更快地产生自由基, 因此能够更快地引发TMPM的ATRP聚合, 所以相应的单体转化率要高于用2-MBP作为引发剂的聚合反应, 而且PTMPM的分子量分布也很窄.因此, 从三类引发剂的比较来看, 当使用EBiB作为TMPM的ATRP引发剂时, 能够得到分子量和分子量分布可控的PTMPM.
在已经报道的TMPM的ATRP研究中, 所使用的催化体系多以4, 4'-二壬基-2, 2'-联吡啶(dNpby)为配体.在ATRP聚合中, 配体的N原子数目对催化剂的活性和聚合反应的速率有很大的影响, 体系的催化活性随N原子数目减少而降低.在本文中, 我们选择了一种三齿配体(PMDETA)和两种四齿配体(HMTETA、Me6TREN), 比较了这三种配体对TMPM的ATRP聚合的影响.从表 1中可以看出, 在相同的引发剂和催化剂条件下, 分别使用三类配体时, 单体的转化率和PTMPM的分子量分布比较接近, 但是引发剂的表观引发剂效率有明显的差异.与直链的配体(PMDETA、HMTETA)相比, 支链结构的Me6TREN作为配体时, 体系的表观引发剂效率较低, 同时单体的转化率也较低.这是因为Me6TREN与CuBr形成的催化络合物是以Cu原子为中心的双三角锥形结构, 而HMTETA和PMDETA与CuBr形成的催化络合物是更倾向于以Cu原子为顶点的四方锥形结构.相对于以Cu原子为中心的双三角锥形结构, 以Cu原子为顶点的四方锥形结构更有利于Cu—Br键的断裂, 利于聚合体系中休眠种与活性种之间平衡的建立, 从而得到更有效的聚合体系[18].因此, 通过对不同的引发剂和催化体系的对比, 我们最终选择EBiB/CuBr/HMTETA作为TMPM的ATRP聚合体系.
1.2 TMPM的ATRP聚合动力学研究
我们对单体TMPM的ATRP聚合进行了反应动力学研究, 采用的聚合体系为TMPM:EBiB:CuBr: HMTETA=50:1:1:1, 反应温度为70 ℃, 丙酮作溶剂, 考察了单体的转化率随时间的变化以及分子量与转化率之间的关系.以ln([M]0/[M])对反应时间作图(图 2a), 从图中可以看出ln([M]0/[M])与反应时间成线性关系, 说明表观聚合速率与单体浓度成动力学一级关系, 这表明体系中增长自由基的浓度在反应中基本保持恒定.聚合物的分子量与单体转化率成线性关系(图 2b), 并且在整个过程中, 分子量分布都保持较低(Mw/Mn≤1.20).从聚合物的GPC流出曲线(Figure 2c)也可以发现分子量随反应时间成增加趋势, 并且GPC曲线都是对称的单峰.从以上结果可以看出, TMPM的ATRP聚合是活性聚合.
 图 2
单体TMPM在EBiB/CuBr/HMTETA引发下ATRP聚合的动力学曲线(a)、分子量及分子量分布与单体转化率之间的关系(b)、聚合物PTMPM的GPC曲线(c)
Figure 2.
Kinetic plot (a) and dependence of molecular weight (Mn) and molecular weight distribution (Mw/Mn) on the conversion of monomer (b) for the ATRP of TMPM using EBiB/CuBr/HMTETA initiate system, and GPC trances (c) of PTMPM
图 2
单体TMPM在EBiB/CuBr/HMTETA引发下ATRP聚合的动力学曲线(a)、分子量及分子量分布与单体转化率之间的关系(b)、聚合物PTMPM的GPC曲线(c)
Figure 2.
Kinetic plot (a) and dependence of molecular weight (Mn) and molecular weight distribution (Mw/Mn) on the conversion of monomer (b) for the ATRP of TMPM using EBiB/CuBr/HMTETA initiate system, and GPC trances (c) of PTMPM
在此基础上, 我们通过使用不同的单体与引发剂的投料比(表 2), 合成了具有不同分子量的PTMPM, 从GPC曲线(图 3)可以看出所得聚合物的GPC曲线呈对称的单峰, 当增大单体的投料比, 聚合物的分子量也相应增加, 并且其分子量分布都小于1.2.说明以EBiB为引发剂、CuBr/HMDETA为催化体系的聚合条件是TMPM合适的ATRP聚合条件.
 表 2
以EBiB/CuBr/HMTETA为引发体系, 不同单体与引发剂投料比时TMPM的ATRP聚合
Table 2.
ATRP of TMPM using EBiB/CuBr/HMTETA initiate system in different mole ratio
表 2
以EBiB/CuBr/HMTETA为引发体系, 不同单体与引发剂投料比时TMPM的ATRP聚合
Table 2.
ATRP of TMPM using EBiB/CuBr/HMTETA initiate system in different mole ratio
[M]:[I]:[C]:[L]a Mnb/(g·mol-1) Mw/Mn Conv.c/% P1 50:1:1:1 7600 1.15 99.9 P2 100:1:1:1 11530 1.16 98.7 P3 150:1:1:1 13770 1.16 97.1 P4 200:1:1:1 17270 1.20 91.0 a[M]:[I]:[C]:[L] presented the feed ratio of [Monomer]:[Initiator]:
[Catalyst]:[Ligand]. bDetermined by GPC (THF/TEA=97/3 as mobile
phase, PMMA as standard). cConversion determined by 1H NMR.表 2 以EBiB/CuBr/HMTETA为引发体系, 不同单体与引发剂投料比时TMPM的ATRP聚合
Table 2. ATRP of TMPM using EBiB/CuBr/HMTETA initiate system in different mole ratio我们将所制备的PTMPM溶于甲醇, 使用EDTA和钨酸钠作为催化剂, 用H2O2氧化得到自由基聚合物PTMA[19].从氧化前后的红外谱图中可以看出(图 4a), PTMPM仲氨基团在3300 cm-1处的振动吸收峰在氧化后消失, 在PTMA的红外谱图中1360 cm-1处出现了氮氧自由基N—O•的特征吸收峰, 说明H2O2能够将PTMPM中的仲氨基团彻底氧化得到含有氮氧自由基的聚合物PTMA.随后, 我们又利用顺磁共振(ESR)对氧化后产物进行了表征(图 4b), 得到的g因子值为1.9996, 对应着自由基的g值区间(ge±0.5%), 说明PTMPM被成功氧化为PTMA.
2 结论
在本文中, 我们通过筛选具有不同结构的引发剂和配体, 成功得到了含有仲氨基团的甲基丙烯酸酯单体TMPM的最优化ATRP聚合条件, 所得聚合物的分子量可控, 并且具有很窄的分子量分布.从动力学研究结果来看, 以EBiB为引发剂, CuBr/HMTETA为催化体系引发的TMPM的ATRP聚合是可控自由基聚合.通过ATRP聚合与其他合成方法结合, 能够方便合成具有不同分子量或拓扑结构的自由基聚合物复合材料.
3 实验部分
3.1 仪器与试剂
凝胶渗透色谱(GPC, Waters 1515)选用THF/TEA(V/V=97/3)为流动相, 35 ℃下测定分子量和分子量分布, 溶剂流出速度1.0 mL/min.核磁共振:以氘代丙酮为溶剂, 四甲基硅为内标, 在Bruker AM-400上完成.
2, 2, 6, 6-四甲基哌啶醇-4-甲基丙烯酸酯(TMPM, TCI, 98%); 五甲基二乙烯三胺(PMDETA, 99%), 甲基三乙烯四胺(HMTETA, 99%), 2-溴代异丁酸乙酯(EBiB, 98%), 2-溴丙酸甲酯(2-MBP, 99%), 苄溴(Bn-Br, 98%)全部购于Aldrich; 乙二胺四乙酸二钠二水(99%), 钨酸钠二水(99.5%), 溴化亚铜(CuBr 98%)全部购自于阿拉丁; 过氧化氢, 三乙胺(TEA), 丙酮均购自于国药集团.丙酮经过干燥处理使用.溴化亚铜(CuBr)经乙酸搅拌过夜后, 再经乙醇, 丙酮, 乙醚等顺次洗涤数次至淡黄色, 真空烘箱40 ℃真空干燥24 h, 避光保存备用.
3.2 实验方法
以EBiB/CuBr/HMTETA催化体系在丙酮中70 ℃反应为例:将反应管经抽真空-烘烤-充氮气3次循环除水除氧之后, 在氮气保护下, 依次加次TMPM (3 g, 13.2 mmol), HMTETA (36.2 μL, 0.132 mmol), 丙酮(5 mL), 反应体系冻抽三次后, 在冷冻下加入CuBr (19.2 mg, 0.132 mmol), 解冻后加入EBiB (19.6 μL, 0.132 mmol), 将反应管置于油浴锅70 ℃开始反应, 8 h后用液氮淬灭反应体系.粗产物过中性氧化铝柱层析除去催化剂, 然后在甲醇中沉降三次, 所得到的白色固体真空干燥24 h, 得到聚(2, 2, 6, 6-四甲基哌啶醇-4-甲基丙烯酸酯). 1H NMR (300 MHz, CD3COCD3) δ: 5.11 (CHO), 3.0~2.45 (NH), 1.24~1.14 (CH3), 1.0 (CH2); FT-IR (KBr) ν: 3600~3300 (N—H) cm-1.
在反应瓶中加入前聚体PTMPM (2.5 g), 乙二胺四乙酸二钠二水(0.708 g, 1.9 mmol), 钨酸钠二水(0.0426 g, 0.13 mmol), 30 mL的甲醇溶剂和磁子.超声分散30 min后, 开始滴加H2O2 (20 mL), 4 h内滴完.体系常温搅拌反应48 h.过滤得到粗产物, 依次用水、甲醇洗三次, 所得黄色固体真空干燥24 h, 得到最终产物聚(4-甲基丙烯酰氧基-2, 2, 6, 6-四甲基哌啶氮氧自由基). FT-IR (KBr) ν: 1360 (N—O) cm-1.
-
-
[1]
Arico, A. S.; Bruce, P.; Scrosati, B.; Tarascon, J. M.; Van Schalkwijk, W. Nat. Mater. 2005, 4, 366. doi: 10.1038/nmat1368
-
[2]
Bruce, P. G.; Scrosati, B.; Tarascon, J. M. Angew. Chem., Int. Ed. 2008, 47, 2930. doi: 10.1002/(ISSN)1521-3773
-
[3]
Aricò, A. S.; Bruce, P.; Scrosati, B.; Tarascon, J. M.; Van Schalkwijk, W. Nat. Mater. 2005, 4, 366. doi: 10.1038/nmat1368
-
[4]
Poizot, P.; Dolhem, F. Energy Environ. Sci. 2011, 4, 2003. doi: 10.1039/c0ee00731e
-
[5]
Liang, Y.; Tao, Z.; Chen, J. Adv. Energy Mater. 2012, 2, 742. doi: 10.1002/aenm.201100795
-
[6]
Nakahara, K.; Iwasa, S.; Satoh, M.; Morika, Y.; Iriyama, J.; Suguro, M.; Hasegawa, E. Chem. Phys. Lett. 2002, 359, 351. doi: 10.1016/S0009-2614(02)00705-4
-
[7]
赵瑞瑞, 朱利敏, 杨汉西, 化学进展, 2011, 23, 302. http://www.cnki.com.cn/Article/CJFDTotal-HXJZ2011Z1006.htmZhao, R. R.; Zhu, L. M.; Yang, H. X. Prog. Chem. 2011, 23, 302 (in Chinese). http://www.cnki.com.cn/Article/CJFDTotal-HXJZ2011Z1006.htm
-
[8]
邓凌峰, 李新海, 肖立新, 张云河, 高分子学报, 2004, (1), 8. http://d.wanfangdata.com.cn/Periodical/gfzxb200401002Deng, L. F.; Li, X. H.; Xiao, L. X.; Zhang, Y. H. Acta Polym. Sin. 2004, (1), 8 (in Chinese). http://d.wanfangdata.com.cn/Periodical/gfzxb200401002
-
[9]
Guo, W.; Yin, Y. X.; Xin, S.; Guo, Y. G.; Wan, L. J. Energy Environ. Sci. 2012, 5, 5221. doi: 10.1039/C1EE02148F
-
[10]
Rostro, L.; Baradwaj, A. G..; MuLLer, A. R. MRS Commun. 2015, 5, 257. doi: 10.1557/mrc.2015.27
-
[11]
Bertrand, O.; Ernould, B.; Boujioui, F.; Vlad, A.; Gohy, J. F. Polym. Chem. 2015, 6, 6067. doi: 10.1039/C5PY00896D
-
[12]
Sukegawa, T.; Masuko, I.; Oyaizu, K.; Nishide, H. Macromolecules 2014, 47, 8611. doi: 10.1021/ma501632t
-
[13]
Janoschka, T.; Teichler, A.; Krieg, A.; Hager, M. D.; Schubert, U. S. J. Polym. Sci., Part A: Polym. Chem. 2012, 50, 1394. doi: 10.1002/pola.v50.7
-
[14]
Wang, Y. H.; Hung, M. K.; Lin, C. H.; Lin, H. C.; Lee, J. T. Chem. Commun. 2011, 47, 1249. doi: 10.1039/C0CC02442B
-
[15]
Hauffman, G.; Rolland, J.; Bourgeois, J. P.; Vlad, A.; Gohy, J. F. J. Polym. Sci., Part A: Polym. Chem. 2013, 51, 101. doi: 10.1002/pola.26279
-
[16]
Kurosaki, T.; Lee, K. W.; Okawara, M. J. Polym. Sci., Part A: Polym. Chem. 1972, 10, 3295. doi: 10.1002/pol.1972.170101116
-
[17]
Matyjaszewski, K.; Xia, J. Chem. Rev. 2001, 101, 2921. doi: 10.1021/cr940534g
-
[18]
Pintauer, T.; Matyjaszewski, K. Coord. Chem. Rev. 2005, 249, 1155. doi: 10.1016/j.ccr.2004.11.010
-
[19]
Zhang, X. H.; Li, H. Q.; Li, L. T.; Lu, G. L.; Zhang, S.; Gu. L. N.; Xia, Y. Y.; Huang, X. Y. Polymer 2008, 49, 3393. doi: 10.1016/j.polymer.2008.06.019
-
[1]
-
图 2 单体TMPM在EBiB/CuBr/HMTETA引发下ATRP聚合的动力学曲线(a)、分子量及分子量分布与单体转化率之间的关系(b)、聚合物PTMPM的GPC曲线(c)
Figure 2 Kinetic plot (a) and dependence of molecular weight (Mn) and molecular weight distribution (Mw/Mn) on the conversion of monomer (b) for the ATRP of TMPM using EBiB/CuBr/HMTETA initiate system, and GPC trances (c) of PTMPM
表 1 单体TMPM在不同引发剂和催化体系下的ATRP聚合
Table 1. ATRP of TMPM using different initiators and catalyst systema
Initiator Ligand Mnb/(g·mol-1) Mw/Mn Conv.c/% I.E.d/% 1 BnBr HMTETA 8900 1.53 61.7 136.3 2 PMDETA 20900 1.49 69.8 56.9 3 Me6TREN 13860 1.47 66.7 77.0 4 2-MBP HMTETA 12000 1.18 95.7 133.6 5 PMDETA 11900 1.19 98.7 143.1 6 Me6TREN 11900 1.19 81.9 103.7 7 EBiB HMTETA 9800 1.04 98.7 172.7 8 PMDETA 10970 1.06 98.1 150.9 9 Me6TREN 12100 1.18 89.2 132.8 aFeed ratio: [TMPM]:[Initiator]:[CuBr]:[Ligand]=50:1:1:1, acetone as solvent, 70 ℃, 8 h. bDetermined by GPC (THF/TEA=97/3 as mobile phase,
PMMA as standard). cConversion determined by 1H NMR. dI.E., apparent initiator efficiency, was the percentage of the mass of PTMPM to the mass of initiator.表 2 以EBiB/CuBr/HMTETA为引发体系, 不同单体与引发剂投料比时TMPM的ATRP聚合
Table 2. ATRP of TMPM using EBiB/CuBr/HMTETA initiate system in different mole ratio
[M]:[I]:[C]:[L]a Mnb/(g·mol-1) Mw/Mn Conv.c/% P1 50:1:1:1 7600 1.15 99.9 P2 100:1:1:1 11530 1.16 98.7 P3 150:1:1:1 13770 1.16 97.1 P4 200:1:1:1 17270 1.20 91.0 a[M]:[I]:[C]:[L] presented the feed ratio of [Monomer]:[Initiator]:
[Catalyst]:[Ligand]. bDetermined by GPC (THF/TEA=97/3 as mobile
phase, PMMA as standard). cConversion determined by 1H NMR. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 0
- 文章访问数: 340
- HTML全文浏览量: 51





 下载:
下载:




 下载:
下载:

