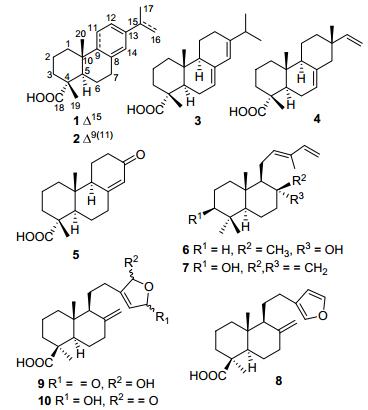
 图 1
化合物1~10的结构
Figure 1.
Chemical structures of compounds 1~10
图 1
化合物1~10的结构
Figure 1.
Chemical structures of compounds 1~10

Citation: Li Ming, Hu Changlin, Han Han, Xiong Juan, Hu Jinfeng. Diterpenoids from the Needles of the Endangered Plant Pinus dabeshanensis and Their Protein Tyrosine Phosphatase 1B Inhibitory Effects[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1860-1863. doi: 10.6023/cjoc201701002

大别山五针松松针中二萜成分及其蛋白酪氨酸磷酸酶1B抑制活性研究
-
关键词:
- 濒危植物
- / 大别山五针松
- / 二萜
- / dabeshanensin L
- / PTP1B抑制活性
English
Diterpenoids from the Needles of the Endangered Plant Pinus dabeshanensis and Their Protein Tyrosine Phosphatase 1B Inhibitory Effects
-
Key words:
- endangered plant
- / Pinus dabeshanensis
- / diterpenoids
- / dabeshanensin L
- / PTP1B inhibition
-
近来, 统计表明源于珍稀濒危植物中的天然产物的成药性远高于一般植物的平均水平[1, 2].松科(Pinaceae)是能产生药物的主要植物科属之一[2].该科全球共有10属230余种, 我国有10属113种29变种, 其中包括大别山五针松(Pinus dabeshanensis Cheng et Law)在内的39种作为濒危植物被《中国植物红皮书》收载[3~6].大别山五针松是我国特有常绿乔木, 属于国家二级保护植物[5], 主要分布于湖北和安徽交界的大别山地区.本课题组前期已从大别山五针松自然脱落的树皮(干重180 g)中分离得到39个不同类型的二萜化合物, 并发现部分化合物具有显著的蛋白酪氨酸磷酸酶1B (PTP1B)的抑制活性[6].为了进一步发现PTP1B天然小分子抑制剂, 我们对少量大别山五针松松针的90%甲醇提取物进行相同的生物活性测试, 发现该粗提物也具有一定的PTP1B抑制活性(IC50=37.9±4.49 µg/mL).通过运用多种现代色谱分离手段, 从该提取物中分离得到1个新的(1)和9个不同结构类型的已知二萜类化合物2~10(图 1).本文主要报道这些化合物的提取分离、结构鉴定以及PTP1B抑制活性测试结果.
1 结果与讨论
通过运用硅胶、Sephadex LH-20凝胶和半制备型HPLC等色谱分离纯化手段, 从大别山五针松(P. dabeshanensis)松针(干重30 g)的90%甲醇提取物中共分离得到10个二萜类化合物(图 1).通过对比文献以及分析其理化数据, 其中9个已知二萜化合物分别被鉴定为7-callitrisic acid (2)[7]、abieta-7, 13-diene-18-oic acid (3)[7~9]、isopimara-7-en-18-oic acid (4)[10, 11]、8(14)-podocarpen-13-on-18-oic acid (5)[12]、trans-abienol (6)[13]、3β-hydroxy-12, 13E-biformen (7)[14]、lambertianic acid (8)[15~17]、16ξ-hydroxpinusolidic acid (9)[15]、15ξ-hydroxpinusolidic acid (10)[15].
化合物1为无色油状物, 根据其HR-ESIMS(准分子离子峰质荷比为m/z 301.2164 [M+H]+, 计算值为301.2162) 推断它的分子式为C20H28O4, 并得到其13C NMR数据的佐证.该分子式表明化合物1的结构中有7个不饱和度.在其IR光谱中, 1722、1693和1633 cm-1处吸收带显示1的结构中存在羧基和双键等官能团.分析其1H NMR数据, 推断1的结构中有3个单峰甲基[δH 1.93 (s, Me-17), 1.27 (s, Me-19), 0.84 (s, Me-20)], 4个烯氢[δH 6.16 (s, H-14), 5.59 (br d, J=4.0 Hz, H-12), 5.04 (br s, H-16a), 4.92 (br s, H-16b)].其13C NMR谱中有20个碳信号, 可归属为3个甲基, 7个亚甲基(包含1个在δC 111.2的末端双键上的亚甲基碳), 4个次甲基(包2个含分别在δC 124.5和127.0的双键次甲基碳), 5个季碳(包含3个分别在δC 135.8、136.4和143.2的双键季碳)和1个羧基碳(δC 183.9).以上数据表明化合物1和从长苞冷杉Abies georgei中分离得到的松香烷型二萜化合物7-callitrisic acid (2)[7]的结构非常相似, 区别仅在于化合物1中的Me-17由双重峰变为一个宽单峰, 并且化学位移明显向低场移动, 说明化合物1与2相比多出一个Δ15末端双键, 而Δ9(11)双键消失.这可以从化合物1的1H-1H COSY谱中H(9)-H2(11)-H(12) 自旋偶合体系的存在得到确证.另外HMBC(图 2)谱中Me-17与C-15和C-16的相关以及Me-20/H-14与C-9的相关进一步证实了上述对于1的结构推断.化合物1的相对构型是通过分析相关质子的偶合常数以及NOESY谱得到确定的. H-5和H-9均具有大的偶合常数(JH-5, 6β=13.2 Hz, JH-9, 11β=14.8 Hz)表明这两个质子都处于直立键.在NOESY(图 3)谱中, Me-19/Me-20和H-5/H-9的NOE相关表明Me-19和Me-20都为β构型.因此, 化合物1被鉴定为abieta-8(14), 12, 15-trien-18-oic acid.
对所分离得到的10个二萜类化合物均进行了PTP1B抑制活性评价, 结果如表 1所示.在实验中, 以齐墩果酸(IC50=3.3 µmol/L)作为阳性对照[6, 18].其中, 异海松烷型二萜化合物isopimara-7-en-18-oic acid (4)和半日花烷型二萜trans-abienol (6)均为首次报道具有PTP1B抑制活性, 其IC50值分别为14.6和37.7 µmol/L.而半日花烷型二萜化合物lambertianic acid (8)的活性(IC50=22.2 µmol/L)与文献报导类似[19].其余化合物没活性(IC50>100 µmol/L).研究结果说明这些活性二萜化合物在治疗和预防II型糖尿病、肥胖症及其它由PTP1B介导的疾病中具有一定的潜在应用价值.
Compound IC50a/(µmol·L-1) 4 14.6±0.98 6 37.7±2.68 8 22.2±0.82 Oleanolic acid 3.3±0.24 aValues are expressed as mean±SD of three replicates. 2 实验部分
2.1 仪器与试剂
比旋光采用Rudolph Autopol Ⅵ旋光仪测定; 紫外和红外分别采用日立U-2900E双光束分光光度仪和Thermo Scientific Nicolet iS5傅里叶变换红外光谱仪测定; 核磁共振谱采用Bruker Avance Ⅲ 400 MHz核磁共振仪测定, 化学位移以残余溶剂峰作为参照; 低分辨质谱采用Agilent 1100 series质谱仪测定, 高分辨质谱采用Agilent Technologies 6224 TOF LC/MS质谱仪测定, 半制备型高效液相色谱仪为Waters e2695系列, 配备Waters 2998 PDA检测器和Waters 2424 ELSD检测器, 半制备型色谱柱为SunFire ODS column (5 μm, 250 mm×10 mm; 流速: 3.0 mL/min); 正相柱层析硅胶规格为200~300目(烟台牟平区康必诺化学试剂厂和青岛海洋化工厂分厂); 薄层层析板(TLC)规格为GF254/0.25 mm(烟台牟平区康必诺化学试剂厂); 凝胶色谱填料为Sephadex LH-20 (GE Healthcare Bio-Sciences AB, Uppsala, Sweden); 分析纯溶剂甲醇、乙酸乙酯、氯仿、石油醚等购自于上海化学试剂公司, 色谱级甲醇和乙腈等从北京百灵威科技有限公司采购, 氘代试剂由Sigma-Aldrich生产; 薄层层析显色剂为体积分数为10%的H2SO4乙醇溶液(120 ℃烘烤).
大别山五针松(P. dabeshanensis)松针于2012年12月由湖北省英山县桃花冲林场肖保同先生协助采集, 该植物经由湖北省英山县林业局徐练先生鉴定.标本存于复旦大学药学院天然药化教研室(标本编号: 20121215).
2.2 提取与分离
取大别山五针松松针30 g(干重), 粉碎后用体积分数为90%甲醇室温浸提5次, 合并提取液后减压浓缩, 得到7.0 g(半干)棕色浸膏.该浸膏经100~200目硅胶柱分离, 以V(石油醚):V(乙酸乙酯)=30:1~0:1进行梯度洗脱, 得到5个组分(Fr.A~Fr.E).组分Fr.A (160 mg)经半制备型HPLC进一步分离, 以91%(体积比)的甲醇/水(含0.05% TFA, 流速: 3 mL/min)进行等度洗脱, 得到化合物4((7.0 mg, tR=22.5 min)和8 (50.0 mg, tR=12.1 min).组分Fr.B (78 mg)经半制备型HPLC进一步分离, 以91%(体积比)的甲醇/水(含0.05% TFA, 流速: 3 mL/min)进行等度洗脱, 得到化合物1((4.0 mg, tR=21.6 min)和3 (3.0 mg, tR=23.8 min).化合物6 (5.2 mg, tR=26.6 min)和7 (5.8 mg, tR=31.2 min)由组分Fr.C (70 mg)通过半制备型HPLC进一步分离, 以87%(体积比)的乙腈/水(含0.05% TFA, 流速: mL/min)等度洗脱得到.组分Fr.D (250 mg)通过凝胶柱Sephadex LH-20柱层析(甲醇)得到化合物2 (5.6 mg)和10 (6.0 mg).化合物5 (2.6 mg, tR=12.0 min)和9 (3.4 mg, tR=30.0 min)则由组分Fr.E (85 mg)经半制备HPLC进一步分离, 以65%(体积比)的甲醇/水(含0.05% TFA, 流速: 3 mL/min)等度洗脱而分离得到.
Abieta-8(14), 12, 15-trien-18-oic acid (Dabeshanensin L, 1):无色油状物; [α]D20+15.0 (c 0.1, CHCl3); UV (MeOH) λmax [log ε/(L·mol-1·cm-1)]: 273 (1.21) nm; 1H NMR (CDCl3, 400 MHz) δ:1.92~1.96 (m, H-1a), 1.18~1.22 (m, H-1b), 1.60~1.64 (m, H2-2), 1.83~1.87 (m, H-3a), 1.70 (br. d, J=13.2 Hz, H-3b), 2.08 (br. d, J=13.2 Hz, H-5), 1.78~1.82 (m, H-6a), 1.22~1.26 (m, H-6b), 2.06 (br. d, J=13.2 Hz, H-7a), 1.94~1.98 (m, H-7b), 2.50 (br. d, J=14.8 Hz, H-9), 2.14~2.18 (m, H-11a), 1.87~1.91 (m, H-11b), 5.59 (br. d, J=4.0 Hz, H-12), 6.16 (s, H-14), 5.04 (s, H-16a), 4.92 (s, H-16b), 1.93 (s, Me-17), 1.27 (s, Me-19), 0.84 (s, Me-20); 13C NMR (CDCl3, 100 MHz) δ: 38.2 (C-1), 18.0 (C-2), 37.2 (C-3), 46.2 (C-4), 44.7 (C-5), 22.1 (C-6), 26.2 (C-7), 135.8 (C-8), 50.3 (C-9), 34.4 (C-10), 26.0 (C-11), 124.5 (C-12), 136.4 (C-13), 127.0 (C-14), 143.2 (C-15), 111.2 (C-16), 20.5 (C-17), 183.9 (C-18), 16.8 (C-19), 14.0 (C-20); IR (KBr) νmax: 2926, 2845, 1722, 1664, 1452, 1442, 1386, 1216, 1024, 876 cm-1; (+) ESIMS m/z: 301 [M+H]+; HR-ESI-MS calcd for C20H29O2 [M+H]+ 301.2162, found 301.2164.
2.3 蛋白酪氨酸磷酸酶1B (PTP1B)抑制活性测试
试验方法:简而言之[20], 利用分子生物学手段在大肠杆菌系统表达人源蛋白质酪氨酸磷酸酯酶1B (hPTP1B)催化结构域, 经纯化后的hPTP1B重组蛋白能水解底物para-Nitrophenyl Phosphate (p-NPP)的磷脂键, 生成的脱磷酸产物p-NP在波长405 nm处有很强的光吸收, 因此可通过直接检测405 nm处光吸收的变化来观测酶活性的变化以及化合物对酶活性的抑制情况.初筛选择化合物1~10浓度为100 µmol/L时对PTP1B酶活性的百分抑制率进行考察, 实验结果表明化合物4和8抑制率高于85%, 化合物6抑制率高于60%.进一步测定IC50值, 样品临用前溶于DMSO配成合适浓度, 3倍稀释, 7个稀释度, 三复孔, 取2 µL样品溶液加入到标准测活体系中[30 nmol/L GST-hPTP1B、2 mmol/L p-NPP、pH 6.5、50 mmol/L 3-吗啉丙磺酸(MOPS)、2 mmol/L DTT, 1 mmol/L EDTA, 2% DMSO].反应温度为30 ℃, 在VERSAmax上动态测量405 nm处光吸收, 时间为3 min, 其动力学曲线一级反应的斜率作为酶的活性指标.以相对活性对化合物浓度作图, 经公式ν/ν0=100/(1+b[I]/IC50], 拟合得到IC50值.实验重复三次, 结果取三次平均值, 阳性对照为齐墩果酸(oleanolic acid, 纯度≥98%), IC50值为3.3 µmol/L.
辅助材料(Supporting Information) (新化合物1的1D/2D NMR谱图、高分辨质谱谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Ibrahim, M. A.; Na, M.; Oh, J.; Schinazi, R. F.; McBrayer, T. R.; Whitaker, T.; Doerksen, R. J.; Newman, D. J.; Zachos, L. G.; Hamann, M. T. Proc. Natl. Acad. Sci. U. S. A. 2013, 110, 16832. doi: 10.1073/pnas.1311528110
-
[2]
Zhu, F.; Qin, C.; Tao, L.; Liu, X.; Shi, Z.; Ma, X.; Jia, J.; Tan, Y.; Cui, C.; Lin, J.; Tan, C.; Jiang, Y.; Chen, Y. Proc. Natl. Acad. Sci. U. S. A. 2011, 108, 12943. doi: 10.1073/pnas.1107336108
-
[3]
中国科学院中国植物志编辑委员会, 中国植物志, 第7卷, 科学出版社, 北京, 1978, pp. 32~211.Editorial Committee Flora of China, Science Press, Beijing, 1978, Vol. 7, pp. 32~211(in Chinese).
-
[4]
傅立国, 金鉴明, 中国植物红皮书-稀有濒危植物(第一册), 科学出版社, 北京, 1992.Fu, L.-K.; Jin, J.-M. China Plant Red Data Book. Rare and Endangered Plants I, Science Press, Beijing, 1992(in Chinese).
-
[5]
The State Forestry Administration and the Ministry of Agriculture List of Wild Plants of National Priority Protection I, 1999. http://www.gov.cn/gongbao/content/2000/content_60072.htm.
-
[6]
Hu, C.-L.; Xiong, J.; Gao, L.-X.; Li, J.; Zeng, H.-Q.; Zou, Y.; Hu, J.-F. RSC Adv. 2016, 6, 1832.
-
[7]
Yang, X.-W.; Feng, L.; Li, S. M.; Liu, X.-H.; Li, Y.-L.; Wu, L.; Shen, Y.-H.; Tian, J.-M.; Zhang, X.; Liu, X.-R.; Wang, N.; Liu, Y.-H.; Zhang, W.-D. Bioorg. Med. Chem. 2010, 18, 744. doi: 10.1016/j.bmc.2009.11.055
-
[8]
Wenkert, E.; Buckwalter, L. J. Am. Chem. Soc. 1972, 94, 4367. doi: 10.1021/ja00767a070
-
[9]
Wang, H.; Lin, B.; Liu, X.; Zhang, J.; Xia, M. Green Chem. 2008, 10, 1190. doi: 10.1039/b803295e
-
[10]
Palkin, S.; Harris, T. H. J. Am. Chem. Soc. 1934, 56, 1935. doi: 10.1021/ja01324a032
-
[11]
Zhao, Y.-X.; Zhou, L.; Guo, L.; Luo, X.-D.; Zhou, J. J. Asian Nat. Prod. Res. 2005, 7, 259. doi: 10.1080/10286020410001690163
-
[12]
Yang, X.-W.; Li, S.-M.; Feng, L.; Shen, Y.-H.; Tian, J.-M.; Liu, X.-H.; Zeng, H.-W.; Zhang, C.; Zhang, W.-D. Tetrahedron 2008, 64, 4354. doi: 10.1016/j.tet.2008.02.069
-
[13]
Mills, J. S. J. Chem. Soc. C 1967, 2514.
-
[14]
Bohlmann, F.; Czerson, H. Phyrochemistry 1979, 18, 115. doi: 10.1016/S0031-9422(00)90926-9
-
[15]
Asili, J.; Lambert, M.; Ziegler, H. L.; Stærk, D.; Sairafianpour, M.; Witt, M.; Asghari, G.; Ibrahimi, I. S.; Jaroszewski, J. W. J. Nat. Prod. 2004, 67, 631. doi: 10.1021/np034033e
-
[16]
Dauben, W. G.; German, V. F. Tetrahedron 1966, 22, 679. doi: 10.1016/0040-4020(66)80037-6
-
[17]
Fang, J.-M.; Lang, C.-I.; Chen W.-L.; Cheng Y.-S. Phytochemistry 1991, 30, 2793. doi: 10.1016/0031-9422(91)85148-S
-
[18]
Hu, C.-L.; Xiong, J.; Li, J.-Y.; Gao, L.-X.; Wang, W.-X.; Cheng, K.-J.; Yang, G.-X.; Li, J.; Hu, J.-F. Eur. J. Org. Chem. 2016, 1832.
-
[19]
Li, Y.; Wang, T.-T.; Zhao, J.; Shi, X.; Hu, S.-C.; Gao, K. Food Chem. 2012, 131, 972. doi: 10.1016/j.foodchem.2011.09.089
-
[20]
Liang, L.-F.; Kurtan, T.; Mandi, A.; Yao, L.-G.; Li, J.; Zhang, W.; Guo, Y.-W. Org. Lett. 2013, 15, 274. doi: 10.1021/ol303110d
-
[1]
-
表 1 PTP1B抑制活性的测试结果
Table 1. Inhibitory effects on PTP1B enzyme
Compound IC50a/(µmol·L-1) 4 14.6±0.98 6 37.7±2.68 8 22.2±0.82 Oleanolic acid 3.3±0.24 aValues are expressed as mean±SD of three replicates. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1465
- HTML全文浏览量: 145




 下载:
下载:


 下载:
下载:

