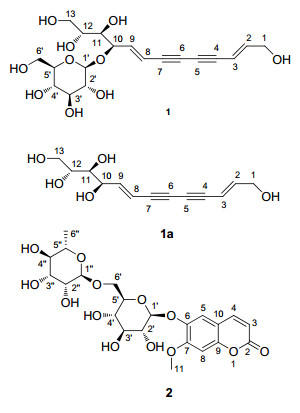
 图1
化合物1, 1a和2的结构
Figure1.
Structures of compounds 1, 1a, and 2
图1
化合物1, 1a和2的结构
Figure1.
Structures of compounds 1, 1a, and 2

Citation: Xu Kuo, Feng Ziming, Yang Ya'nan, Jiang Jianshuang, Zhang Peicheng. Two New Compounds from Rhizomes of Atractylodes lancea[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 3019-3023. doi: 10.6023/cjoc201706031

茅苍术根茎中的两个新化合物
English
Two New Compounds from Rhizomes of Atractylodes lancea
-
Key words:
- Atractylodes lancea
- / 4, 6-diyne
- / polyacetylene
- / coumarin
- / absolute configuration
-
苍术为菊科苍术属Atractylodes, 多年生草本植物, 包括7个植物种群, 主要分布于亚洲东部, 其中, 我国特有5个种群[1].苍术属植物的药用历史最早记载于2000多年前的《神农本草经》, 以苍术和白术最为常用.药用苍术为茅苍术(Atractylodes lancea)和关苍术(Atractylodes chinensis)的干燥根茎, 具有燥湿健脾, 除风散寒、明目之功效[2].现代药理学研究表明, 苍术具有促进胃肠蠕动、利尿、肝保护、抗炎、抗病毒、降血脂、降血糖等方面的药理作用[3, 4].其主要含有萜类、多烯炔类、甾体类、酰基蔗糖类以及其它类化学成分[5~10].本工作对茅苍术80%乙醇提取物的水溶性化学成分进行了研究, 从中分离得到2个新化合物(图 1).借助UV, IR, HR-ESIMS, 1D和2D NMR以及ECD等多种谱学技术, 鉴定其结构分别为(10R, 11R, 12R)-十三烷-2E, 8E-二烯-4, 6-二炔-1, 10, 11, 12, 13-五醇-10-O-β-D-吡喃葡萄糖苷(1)和isoscopoletin 6-O-α-L-吡喃鼠李糖基-(1→6)-β-D-吡喃葡萄糖苷(2).还评价了化合物1和2对α-葡萄糖苷酶以及蛋白酪氨酸磷酸酶1B (PTP1B)的体外抑制活性.
1 结果与讨论
1.1 化合物1的结构鉴定
化合物1为棕色无定型粉末, 易溶于水和甲醇; [α]D20-136.0 (c 0.12, MeOH); UV-Vis (MeOH) λmax [log ε/(L•mol-1•cm-1)]: 216 (4.46), 263 (3.95), 277 (4.19), 294 (4.35), 314 (4.27) nm; ECD (MeOH) λmax [Δε/(L•mol-1•cm-1)]: 233 (-5.43), 293 (-1.50), 312 (-1.03) nm; 其HR-ESIMS和13C NMR谱提示分子式为C19H26O10 (calcd for C19H25O10 [M-H]- 413.1448, found 413.1452), 不饱和度为7.该化合物的红外光谱提示结构中存在羟基(3352 cm−1)、炔键(2133, 2208 cm−1)和烯键(1369, 1417, 1628 cm−1).极具特征的紫外图谱提示其为烯炔类衍生物, 且具有丁二炔基与烯键共轭形成的发色团(CH=CHC≡CC≡CCH=CH)[11, 12].结合HSQC二维谱, 1H NMR谱(表 1)显示1组Δ2, 3烯键信号δH 5.86, 6.49, 其3J值(16.0 Hz)提示其为反式构型; 1组Δ8, 9烯键信号δH 6.20, 6.38, 其3J值(16.0 Hz)提示其为反式构型; 1组糖基氢信号, 其端基的3J值为7.5 Hz; 3组含氧次甲基的氢信号δH 3.29~3.34, 3.51~3.61, 4.52; 2组含氧亚甲基的氢信号δH 3.35~3.43 (1H), 3.51~3.61 (1H), 4.06 (2H). 13C NMR谱(表 1)中可推断出4个烯键碳信号δC 106.2, 109.3, 147.2, 149.4; 4个响应较低的炔碳信号δC 80.6, 73.5, 74.0, 80.6; 3个含氧次甲基碳信号δC 70.8, 73.1, 77.3; 2个含氧亚甲基碳信号δC 60.8, 63.1以及1组吡喃葡萄糖基信号δC 101.8, 73.5, 76.7, 70.6, 76.6, 61.5, 其相对构型由端基氢的3J值(7.5 Hz)确定为β构型(葡萄糖基的绝对构型通过气相色谱法确定为D). 1H-1HCOSY谱(图 2)中发现H2-1/H-2, H-2/H-3之间以及H-8/H-9, H-9/H-10, H-10/H-11, H-11/H-12, H-12/H2-13之间存在相关, 确定结构中存在C1(H2)OHC2(H)=C3(H)和C8(H)=C9(H)C10(H)ORC11(H)OHC12(H)OHC13(H2)OH的片段. HMBC谱(图 2)中发现H-1与C-3相关, H-8与C-6相关, H-9与C-7相关, 提示1为4, 6-二炔烯苷类, 进一步分析发现葡萄糖的端基氢H-1′与C-10存在相关.因此, 化合物1的平面结构被确定为十三烷-2E, 8E-二烯-4, 6-二炔-1, 10, 11, 12, 13-五醇-10-O-β-D-吡喃葡萄糖苷.
 表 1
化合物1和2的1H和13C NMR数据(DMSO-d6)
Table 1.
1H NMR spectroscopic data for compounds 1 and 2 in DMSO-d6
表 1
化合物1和2的1H和13C NMR数据(DMSO-d6)
Table 1.
1H NMR spectroscopic data for compounds 1 and 2 in DMSO-d6
No. 1a 1ab No. 2a δH (J in Hz) δC δH (J in Hz) δC δH (J in Hz) δC 1 4.06, brs 60.8 4.11, dd (2.0, 4.5) 62.7 2 160.5 2 6.49, dt (16.0, 4.5) 149.4 6.35, dt (16.0, 4.5) 147.7 3 6.26, d (9.5) 113.3 3 5.86, d (16.0) 106.2 5.81, brd (16.0) 108.8 4 7.86, d (9.5) 144.4 4 80.6 80.4 5 7.27, s 113.0 5 73.5 74.8 6 143.2 6 74.0 74.7 7 152.9 7 80.6 80.6 8 7.10, s 100.4 8 6.20, d (16.0) 109.3 5.88, d (16.0) 109.9 9 150.1 9 6.38, dd (16.0, 5.0) 147.2 6.40, dd (16.0, 5.0) 149.4 10 111.2 10 4.52, dd (5.0, 2.5) 77.3 4.41, dt (5.0, 2.5) 72.2 11 3.87, s 56.3 11 3.29~3.34, m 73.1 3.42, dd (8.0, 2.5) 74.6 1′ 4.91, d (7.5) 100.4 12 3.51~3.61, m 70.8 3.61~3.66, m 72.9 2′ 3.26~3.29, m 73.1 13a 3.51~3.61, m 63.1 3.57, dd (11.5, 5.0) 64.9 3′ 3.23~3.26, m 76.8 13b 3.35~3.43, m 3.74, dd (11.5, 5.0) 4′ 3.06~3.12, m 69.9 1′ 4.08, d (7.5) 101.8 5′ 3.48~3.51, m 75.6 2′ 3.02~3.07, m 73.5 6′a 3.84, d (11.5) 66.4 3′ 3.09~3.12, m 76.7 6′b 3.37~3.40, m 4′ 2.95~3.01, m 70.6 1'' 4.51, d (1.0) 100.5 5′ 3.13~3.17, m 76.6 2'' 3.50~3.53, m 70.4 6′a 3.69, brd (11.5) 61.5 3'' 3.45, dd (9.0, 3.0) 70.7 6′b 3.35~3.43, m 4'' 3.13~3.19, m 72.0 5'' 3.39~3.42, m 68.4 6'' 1.08, d (6.0) 17.9 a在DMSO-d6溶液中测得的数据; b在MeOH-d4甲醇溶液中测得的数据. 为确定该结构的立体构型, 将化合物1在温和条件下用蜗牛酶进行水解, 得到其苷元1a(图 1).通过纽曼投影式对化合物1a进行构象分析[13], 分别以C10-C11和C11-C12为轴进行投影, 可得到12种构象(图 3).化合物1a的1H NMR谱中显示3J10, 11, 3J11, 12值分别为2.5, 8.0 Hz (测试溶剂: MeOH-d4), 说明H-10/H-11和H-11/H-12分别为邻位交叉式(红色标记)和对位交叉式(紫色标记)构象.化合物1a的1D NOESY显示H-11与H-9相关, H-12与H-10相关, 而未发现H-13和H-10的相关信号, 提示化合物1a中C10-C11与C11-C12的相对构型分别为苏式和赤式(图 3).在甲醇溶液中测得化合物1的ECD谱图(图 4), 通过比较1和已知化合物[(10R, 11R)-, (10R, 11S)-, (10S, 11R)-十三烷-2E, 8E, 12-三烯-4, 6-二炔-1, 10, 11-三醇-10-O-β-D-吡喃葡萄糖苷]的ECD谱图, 得知化合物在200~400 nm范围内的Cotton效应仅体现C-10的手性, 进一步说明C-10的构型为R[14].综上所述, 化合物1的结构最终被确定为(10R, 11R, 12R)-十三烷-2E, 8E-二烯-4, 6-二炔-1, 10, 11, 12, 13-五醇-10-O-β-D-吡喃葡萄糖苷.
1.2 化合物2的结构鉴定
化合物2为白色无定型粉末, 易溶于甲醇、水; [α]D20-82.5 (c 0.10, MeOH), UV-Vis (MeOH) λmax [log ε/(L•mol-1•cm-1)]: 224 (4.56), 255 (3.86), 287 (3.99), 336 (4.14) nm; 其HR-ESIMS和13C NMR谱提示分子量为C22H28O13 (calcd for C22H28O13Na [M+Na]+ 523.1428, found 523.1438), 不饱和度为9.该化合物的红外光谱提示结构中存在羟基(3406 cm−1)、共轭羰基(1710 cm−1)和苯环(1616, 1515 cm−1).结合HSQC二维谱, 1H NMR谱(表 1)显示1组Δ3, 4烯键信号δH 6.26, 7.86, 其3J值(9.5 Hz)提示为顺式构型; 2个孤立的芳香氢信号δH 7.10, 7.27; 1组甲氧基氢信号δH 3.87; 2组糖取代基氢信号, 其端基的3J值为1.0和7.5 Hz. 13C NMR谱(表 1)中可推断出8个芳香碳信号δC 113.3, 144.4, 113.0, 143.2, 152.9, 100.4, 150.1, 111.2; 1个共轭羰基碳信号δC 160.5; 1组吡喃葡萄糖基信号δC 100.4, 73.1, 76.8, 69.9, 75.6, 66.4和1组吡喃鼠李糖基信号δC 100.5, 70.4, 70.7, 72.0, 68.4, 17.9, 其相对构型由端基氢的3J值分别确定为α和β构型(葡萄糖基和鼠李糖基的绝对构型通过气相色谱法分别确定为D和L).除糖取代基和甲氧基信号外, 碳谱中的8个芳香碳信号和1个共轭羰基碳信号, 提示结构中存在1个C6-C3单元, 该化合物为香豆素母核[15]; 结合氢谱中的信号, 进一步推测该化合物为6, 7-二连氧取代型的香豆素类骨架. HMBC二维谱(图 2)显示, 甲氧基氢(H3-11)与C-7存在相关, 葡萄糖基的H-1'与C-6存在相关, 鼠李糖基的H-1''与葡萄糖基的C-6存在相关.确证化合物2的结构为isoscopoletin 6-O-α-L-吡喃鼠李糖基-(1→6)-β-D-吡喃葡萄糖苷.
1.3 体外药理活性筛选
化合物1和2对α-葡萄糖苷酶以及蛋白酪氨酸磷酸酶1B (PTP1B)表现出弱的抑制活性.在10 µmol•L-1的浓度下, 化合物1和2对α-葡萄糖苷酶的体外抑制活性分别为20.4%和9.7%;对PTP1B的体外抑制活性分别为3.0%和18.0%.
2 实验部分
2.1 仪器与试剂
JASCO P-2000型旋光光度仪; JASCO V-650型紫外可见分光光度计; JASCO J-815型圆二色光谱仪; Nicolet 5700型红外光谱分析仪; Bruker AVANCE Ⅲ 500型和Agilent/Varian Directdrive2 500型核磁共振仪(残留溶剂峰为内标); Agilent 6520型高分辨质谱仪; Agilent 1260型高效液相色谱仪; Shimadzu LC-10AT制备型高效液相色谱仪; Rp-18型十八烷基键合反相硅胶(50 μm, 日本YMC公司); LH-20型葡聚糖凝胶(瑞典Pharmacia精细化工); HP-20型大孔吸附树脂(日本三菱化学公司); ODS反相制备色谱柱(25 cm×20 mm, 5 μm, 日本YMC公司); Apollo C18分析色谱柱(25 cm×4.6 mm, 5 μm).
2.2 实验样品
茅苍术根茎于2014年6月购自湖北省黄冈市, 经中国医学科学院(北京协和医学院)药物研究所的马林老师鉴定为Atractylodes lancea.该植物标本(ID-s-2596)现存放于中国医学科学院(北京协和医学院)药物研究所标本室.
2.3 提取与分离
将100 kg干燥的茅苍术根茎粉碎, 80%乙醇浸泡12 h, 然后在85 ℃下回流提取(150 L×3), 每次提取2 h.合并后的提取液经减压浓缩后得25.6 kg浸膏.用50 L蒸馏水将浸膏充分分散, 依次用石油醚、乙酸乙酯和正丁醇萃取.正丁醇萃取液经减压浓缩、冷冻干燥后得1.2 kg萃取物.用1.5 L蒸馏水超声溶解正丁醇萃取物, 过滤后经HP-20型大孔吸附树脂柱(120 cm×15 cm)进行梯度洗脱, 洗脱溶剂依次为蒸馏水、15%乙醇、30%乙醇、50%乙醇及95%乙醇.各梯度溶液洗脱40 L, 合并流份后减压回收溶剂, 得水部位824.0 g (A), 15%乙醇亚部位88.6 g (B), 30%乙醇亚部位106.4 g (C), 50%乙醇亚部位53.3 g (D), 95%乙醇亚部位19.5 g (E).选择30%乙醇亚部位(96.4 g)进行Rp-18型反相硅胶柱(50 cm×8 cm, 50 μm)的中压梯度洗脱, 洗脱液为0~100%甲醇溶液, 每个梯度洗脱约4 L流动相.按照每500 mL为1瓶流份收集样品, 根据HPLC-DAD检测结果合并流份, 得10个亚部位(Fr.C1~Fr.C10). Fr.C1亚部位(30.5 g)经LH-20型葡聚糖凝胶柱(80 cm×6 cm)进行洗脱, 洗脱液为蒸馏水, 共得到123瓶流份(100 mL/瓶, Fr.C1.1~Fr.C1.123).各组分经HPLC-DAD分析后, 减压回收溶剂、冷冻干燥得干燥固体. Fr.C1.49~Fr.C1.56部位直接经C18反相制备液相色谱柱(250 mm×20 mm, 5 μm)纯化[V(甲醇): V(水)=20: 80]后得化合物1 (22.9 mg). Fr.C1.(57~95).8~Fr.C1.(57~95).9部位经C18反相制备液相色谱柱(25 cm×20 mm, 5 μm)纯化[V(甲醇): V(水)=20: 80]后得化合物2 (19.2 mg).
2.4 糖取代基绝对构型的确定
将5.0 mg化合物1溶于3 mL水中, 加入10 mg蜗牛酶, 37 ℃水浴加热6 h, 水解液用乙酸乙酯萃取(5 mL×3), 水相经冷冻干燥后备用.将5.0 mg化合物2溶于5 mL三氟乙酸溶液中(1 mol/L), 60 ℃水浴加热1 h, 回收溶剂, 残渣经冷冻干燥后备用.将上述样品溶于1 mL吡啶溶液, 加入3 mg L-半胱氨酸甲酯盐酸盐, 60 ℃水浴加热1 h.减压回收溶剂后, 加入0.5 mL三甲基硅烷咪唑, 60 ℃继续水浴加热1 h.然后, 加入2 mL水至反应液中, 用正己烷溶液萃取(2 mL×3).有机相浓缩至2 mL, 过滤后进气相色谱分析.称取2 mg单糖标准品(D-葡萄糖, L-鼠李糖), 按照同样方法进行衍生化处理, 过滤后进气相色谱分析.通过比较样品与对照品的保留时间(D-葡萄糖和L-鼠李糖的保留时间分别为20.56和16.61 min), 确定单糖的绝对构型.
2.5 对α-葡萄糖苷酶的抑制作用
测试样品为已配制好的10 µmol•L-1的化合物储备液.在实验组和空白组分别加入0.1 mol•L-1 PBS缓冲液50和80 μL; 各加入样品10 μL, α-葡萄糖苷酶20 μL, 37 ℃恒温摇床中反应5 min, 再各加入4-硝基苯基-α-D-吡喃葡萄糖苷(pNPG, 1 mmol•L-1) 20 μL, 然后37 ℃恒温摇床中反应15 min, 最后用0.4 mol•L-1 Na2CO3 50 μL终止反应.酶标仪400 nm测OD值.计算样品对α-葡萄糖苷酶的抑制率:
抑制率(%)=(OD空白组-OD给药组)/OD空白组×100%.
2.6 对蛋白酪氨酸磷酸酶PTP1B的抑制作用
测试样品为已配制好的10 µmol•L-1的化合物储备液.采用对硝基苯酚磷酸酯(pNPP)作为人基因重组PTP1B的底物.将化合物与酶在室温下孵育5 min, PTP1B催化的pNPP水解反应在100 μL反应体系中测定.每个反应液含有50 mmol•L-1 4-羟乙基哌嗪乙磺酸(HEPES), 5 mmol•L-1二硫苏糖醇(DTT), 150 mmol•L-1 NaCl, 2 mmol•L-1乙二胺四乙酸(EDTA)以及2 mmol• L-1 pNPP, pH为7.0;在30 ℃下孵育10 min; 加入50 μL 3 mol•L-1的氢氧化钠溶液终止酶反应.水解产物对硝基苯酚钠在405 nm处有很强的光吸收, 采用酶标仪测出各孔的OD值, 即可计算出测试样品对酶促水解的抑制作用.
辅助材料(Supporting Information) 化合物1, 1a和2的UV, IR, 1H NMR, 13C NMR, HR-ESIMS, HSQC, HMBC, 1H-1HCOSY和ECD谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
中国科学院中国植物志编辑委员, 中国植物志, 第78卷, 科学出版社, 北京, 1987, pp. 25~27.Chinese Flora Editorial Board of Chinese Academy of Sciences Flora of China, Vol. 78, Science Press, Beijing, 1985, pp. 25~27(in Chinese).
-
[2]
国家药典委员会, 中国药典(第一部), 中国医药科技出版社, 北京, 2015, p. 161, p. 162.Chinese Pharmacopoeia Commission Chinese Pharmacopoeia, Vol. 1, China Medical Science and Technology Press, Beijing, 2015, p. 161, p. 162(in Chinese).
-
[3]
Koonrungsesomboon, N.; Na-Bangchang, K.; Karbwang, J. Asian Pac. J. Trop. Med. 2014, 7, 421. doi: 10.1016/S1995-7645(14)60069-9
-
[4]
Yu, Y.; Jia, T. Z.; Cai, Q.; Jiang, N.; Ma, M. Y.; Min, D. Y.; Yu, Y. J. Ethnopharmacol. 2015, 160, 211. doi: 10.1016/j.jep.2014.10.066
-
[5]
Kitajima, J.; Kamoshita, A.; Ishikawa, T.; Takano, A.; Fukuda, T.; Isoda, S.; Ida, Y. Chem. Pharm. Bull. 2003, 51, 673. doi: 10.1248/cpb.51.673
-
[6]
Duan, J. A.; Wang, L. Y.; Qian, S. H.; Su, S. L.; Tang, Y. P. Arch. Pharm. Res. 2008, 31, 965. doi: 10.1007/s12272-001-1252-z
-
[7]
Tanaka, K.; Ina, A. Nat. Prod. Commun. 2009, 4, 1095.
-
[8]
Chen, Y. J.; Wu, Y. X.; Wang, H. X.; Gao, K. Fitoterapia 2012, 83, 199. doi: 10.1016/j.fitote.2011.10.015
-
[9]
Kamauchi, H.; Kinoshita, K.; Takatori, K.; Sugita, T.; Takahashi, K.; Koyama, K. Tetrahedron 2015, 71, 1909. doi: 10.1016/j.tet.2015.02.041
-
[10]
Xu, K.; Jiang, J. S.; Feng, Z. M.; Yang, Y. N.; Li, L.; Zang, C. X.; Zhang, P. C. J. Nat. Prod. 2016, 79, 1567. doi: 10.1021/acs.jnatprod.6b00066
-
[11]
He, J.; Shen, Y.; Jiang, J. S.; Yang, Y. N.; Feng, Z. M.; Zhang, P. C.; Yuan, S. P.; Hou, Q. Carbohydr. Res. 2011, 346, 1903. doi: 10.1016/j.carres.2011.06.015
-
[12]
He, J. Y.; Zhu, S.; Komatsu, K. Phytochem. Anal. 2014, 25, 213. doi: 10.1002/pca.v25.3
-
[13]
Hu, Y. C.; Wang, K. Z.; MacMillan, J. B. Org. Lett. 2013, 15, 390. doi: 10.1021/ol303376c
-
[14]
Xu, K.; Yang, P. F.; Yang, Y. N.; Feng, Z. M.; Jiang, J. S.; Zhang, P. C. Org. Lett. 2017, 19, 686. doi: 10.1021/acs.orglett.6b03855
-
[15]
冯卫生, 王建超, 何玉环, 郑晓珂, 宋楷, 张艳丽, 李孟, 赵威, 中国药学杂志, 2015, 50, 2103. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Feng, W. S.; Wang, J. C.; He, Y. H.; Zheng, X. K.; Song, K.; Zhang, Y. L.; Li, M.; Zhao, W. Chin. Pharm. J. 2015, 50, 2103(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[1]
-
表 1 化合物1和2的1H和13C NMR数据(DMSO-d6)
Table 1. 1H NMR spectroscopic data for compounds 1 and 2 in DMSO-d6
No. 1a 1ab No. 2a δH (J in Hz) δC δH (J in Hz) δC δH (J in Hz) δC 1 4.06, brs 60.8 4.11, dd (2.0, 4.5) 62.7 2 160.5 2 6.49, dt (16.0, 4.5) 149.4 6.35, dt (16.0, 4.5) 147.7 3 6.26, d (9.5) 113.3 3 5.86, d (16.0) 106.2 5.81, brd (16.0) 108.8 4 7.86, d (9.5) 144.4 4 80.6 80.4 5 7.27, s 113.0 5 73.5 74.8 6 143.2 6 74.0 74.7 7 152.9 7 80.6 80.6 8 7.10, s 100.4 8 6.20, d (16.0) 109.3 5.88, d (16.0) 109.9 9 150.1 9 6.38, dd (16.0, 5.0) 147.2 6.40, dd (16.0, 5.0) 149.4 10 111.2 10 4.52, dd (5.0, 2.5) 77.3 4.41, dt (5.0, 2.5) 72.2 11 3.87, s 56.3 11 3.29~3.34, m 73.1 3.42, dd (8.0, 2.5) 74.6 1′ 4.91, d (7.5) 100.4 12 3.51~3.61, m 70.8 3.61~3.66, m 72.9 2′ 3.26~3.29, m 73.1 13a 3.51~3.61, m 63.1 3.57, dd (11.5, 5.0) 64.9 3′ 3.23~3.26, m 76.8 13b 3.35~3.43, m 3.74, dd (11.5, 5.0) 4′ 3.06~3.12, m 69.9 1′ 4.08, d (7.5) 101.8 5′ 3.48~3.51, m 75.6 2′ 3.02~3.07, m 73.5 6′a 3.84, d (11.5) 66.4 3′ 3.09~3.12, m 76.7 6′b 3.37~3.40, m 4′ 2.95~3.01, m 70.6 1'' 4.51, d (1.0) 100.5 5′ 3.13~3.17, m 76.6 2'' 3.50~3.53, m 70.4 6′a 3.69, brd (11.5) 61.5 3'' 3.45, dd (9.0, 3.0) 70.7 6′b 3.35~3.43, m 4'' 3.13~3.19, m 72.0 5'' 3.39~3.42, m 68.4 6'' 1.08, d (6.0) 17.9 a在DMSO-d6溶液中测得的数据; b在MeOH-d4甲醇溶液中测得的数据. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 2083
- HTML全文浏览量: 184





 下载:
下载:



 下载:
下载:

