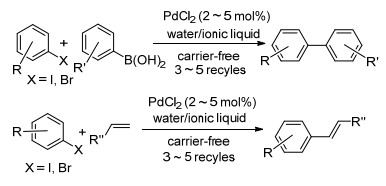
 图式 1
可循环体系中无负载PdCl2催化Suzuki-Miyaura和Mizoroki-Heck反应
Scheme1.
Carrier-free PdCl2-catalyzed Suzuki-Miyaura and Mizoroki-Heck in the recyclable systems
图式 1
可循环体系中无负载PdCl2催化Suzuki-Miyaura和Mizoroki-Heck反应
Scheme1.
Carrier-free PdCl2-catalyzed Suzuki-Miyaura and Mizoroki-Heck in the recyclable systems

Citation: Tang Boxiao, Fang Xiaoniu, Kuang Renyun, Cai Jinhua, Wu Jianhong. Carrier-Free and Recyclable PdCl2-Catalyzed Suzuki-Miyaura and Mizoroki-Heck Reactions in Water/Ionic Liquid Media[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2956-2961. doi: 10.6023/cjoc201706016

水/离子液体中无负载PdCl2循环催化Suzuki-Miyaura和Mizoroki-Heck反应的研究
English
Carrier-Free and Recyclable PdCl2-Catalyzed Suzuki-Miyaura and Mizoroki-Heck Reactions in Water/Ionic Liquid Media
-
Key words:
- carrier-free
- / recyclability
- / water/ionic liquid
- / coupling reaction
-
在有机合成及工业化过程中, 钯催化的交叉偶联反应是构建C—C键最有效的方法之一[1].然而, 钯属于贵重金属价格昂贵, 这在一定程度上限制了它的实际应用.为了适应有机反应工业化的要求, 降低反应成本, 人们在钯催化剂循环使用方面做了大量的研究工作.而大部分研究工作是将金属钯固定在惰性载体材料上, 进而实现催化剂在偶联反应中的重复利用.目前, 这些惰性载体主要包括高分子聚合物[2]、硅材料[3]、碳烯材料[4]、分子筛[5]、磁性材料[6]、SBA-15[7]、金属-有机材料[8]等.最近, 可循环催化的固载钯材料也已应用于Suzuki-Miyaura和Mizoroki-Heck反应, 并表现出很好的催化效率[9].虽然这些固载钯在催化偶联反应中实现了催化剂的循环使用, 而且表现出了很好的催化性能, 但也存在一些瑕疵, 例如把钯固载到惰性材料上是一个多步骤、复杂的制备过程, 时间长, 合成成本高, 而且在繁琐制备过程中, 很可能引入新的杂质.这些问题会影响这类催化材料在工业过程中的实际应用.因此, 发现一些简单、经济、可循环的催化体系, 仍然是这一研究领域的良好策略.我们小组一直致力于无负载可循环偶联反应的研究, 也取得了一些研究成果[10].最近的研究发现, 在水/离子液体条件下, 无负载PdCl2能够有效催化Suzuki-Miyaura和Mizoroki-Heck反应, 并能够得到中等以上的偶联收率, 同时催化体系无需活化就可以重复使用3~5次(Scheme 1).
 图式 1
可循环体系中无负载PdCl2催化Suzuki-Miyaura和Mizoroki-Heck反应
Scheme1.
Carrier-free PdCl2-catalyzed Suzuki-Miyaura and Mizoroki-Heck in the recyclable systems
图式 1
可循环体系中无负载PdCl2催化Suzuki-Miyaura和Mizoroki-Heck反应
Scheme1.
Carrier-free PdCl2-catalyzed Suzuki-Miyaura and Mizoroki-Heck in the recyclable systems
1 结果与讨论
以4-碘苯甲醚(1a)与苯硼酸(2a)偶联反应为模板, 在Pd(OAc)2作为催化剂的条件下, 研究了离子液体种类、不同碱和反应温度对偶联反应的影响(如表 1所示).首先, 考察了不同离子液体对偶联反应的影响, H2O/ TBAB(四丁基溴化铵)表现出最好的反应活性, 其他H2O/离子液体反应活性较差, 偶联产率较低(Entries 1~6).接下来考察了不同碱对偶联反应的影响, 实验结果表明K2CO3的产率最高(Entries 4, 7, 8, 9), 当反应体系没有碱时, 仅得到痕量的目标产物(Entry 10).最后, 考察了不同温度对偶联反应的影响, 如预期的那样, 当反应温度从85 ℃降至60 ℃与室温时, 偶联产率分别下降为90%和36% (Entries 11, 12).
 表 1
水/离子液体中4-碘苯甲醚与苯硼酸的偶联反应a
Table 1.
Coupling reaction between 1-iodo-4-methoxybenzene and phenylboronic acid in water/ionic liquid media
表 1
水/离子液体中4-碘苯甲醚与苯硼酸的偶联反应a
Table 1.
Coupling reaction between 1-iodo-4-methoxybenzene and phenylboronic acid in water/ionic liquid media

Entry Temperature/℃ Water/ionic liquid Base Yieldb/% 1 85 H2O/EMIB K2CO3 26 2 85 H2O/EMPB K2CO3 87 3 85 H2O/EPB K2CO3 96 4 85 H2O/TBAB K2CO3 99 5 85 H2O/BMITF K2CO3 22 6 85 H2O/TBAF·3H2O K2CO3 93 7 85 H2O/TBAB KOAc 78 8 85 H2O/TBAB NaOH 97 9 85 H2O/TBAB Cs2CO3 88 10 85 H2O/TBAB — Trace 11 60 H2O/TBAB K2CO3 90 12c r.t H2O/TBAB K2CO3 36 a Reaction conditions: 1a (0.3 mmol), 2a (0.4 mmol), PdCl2 (0.015 mmol), base (0.6 mmol), water (0.5 g):ionic liquid (0.5 g)=1:1, 10 h, 85 ℃, air; b Isolated yield; c r.t=room temperature. 通过模板反应的探索, 找到了Suzuki-Miyaura反应的最优条件是:卤代芳烃(0.3 mmol), 硼酸(0.4 mmol), 氯化钯(0.015 mmol), K2CO3 (0.6 mmol), m(TBAB):m(H2O)=1:1, 80 ℃.在可循环的H2O/TBAB反应体系中, 选择了一系列芳基卤和芳基硼酸进行了Suzuki-Miyaura偶联反应, 实验结果见表 2.在PdCl2, H2O/TBAB和K2CO3条件下, 芳基碘化物1a~1e无论是含有吸电子基团还是给电子基团都能与苯基硼酸(2a)发生偶联反应, 整个催化反应系统无需活化可以直接重复使用五次, 而且具有良好的催化活性(Entries 1~5).当有位阻的邻甲基碘苯(1c)与2a反应时, 在循环实验中催化体系仍然表现出良好的催化效率(Entry 3).同样, 芳基溴化物1f~1h的Suzuki-Miyaura循环反应也能够得到中等以上的偶联产率(Entries 6~8).另外, 不同芳基硼酸2b~2d和4-碘苯甲醚(1a)的偶联催化体系也无需活化就可以直接重复使用3~5次(Entries 9~11).当反应底物1a扩大到1 mmol和氯化钯从5 mol%降低到2 mol%时, 反应体系仍然能够重复使用3次, 并得到中等以上的产率(Entry 12).

Entry Aryl halide Arylboronic acid 3 No. t/h Yielde/% 1 p-MeOC6H4I
(1a)C6H5B(OH)2
2a3a 1a 10 95 2b 11 90 3b 15 88 4b 18 75 5b 22 68 2 p-O2NC6H4I
(1b)2a 3b 1a 9 93 2b 10 88 3b 11 84 4b 16 77 5b 23 73 3 o-MeC6H4I
(1c)2a 3c 1a 12 94 2b 18 92 3b 20 78 4b 22 72 5b 24 62 4 p-MeC6H4I
(1d)2a 3d 1a 10 96 2b 10 90 3b 11 88 4b 12 82 5b 13 78 5 2-Iodothiophene
(1e)2a 3e 1a 12 95 2b 13 84 3b 15 73 4b 18 69 6 p-MeOC6H4Br
(1f)2a 3a 1a 16 92 2b 20 90 3b 24 83 4b 26 76 5b 29 68 7 p-O2NC6H4Br
(1g)2a 3b 1a 11 92 2b 12 87 3b 14 83 4b 18 78 5b 24 72 8 p-CH3COC6H4Br
(1h)2a 3f 1a 13 92 2b 14 90 3b 16 86 4b 18 78 9 1a m-ClC6H4B(OH)2
2b3g 1a 14 94 2b 15 91 3b 17 87 4b 21 72 5b 26 64 10 1a p-Me2NC6H4B(OH)2
2c3h 1a 14 64 2b 18 69 3b 27 65 11 1a 3, 4-Me2C6H3B(OH)2
2d3i 1a 10 98 2b 11 95 3b 12 84 4b 13 79 5b 14 73 12 1a 2a 3a 1c 12 93 2d 16 91 3d 20 68 a Reaction conditions: 1 (0.3 mmol), 2 (0.4 mmol), PdCl2 (0.015 mmol), K2CO3 (0.6 mmol), water (1 g) : TBAB (1 g)=1:1, 85 ℃, air; b 1 (0.3 mmol), 2 (0.4 mmol), K2CO3 (0.3 mmol), 85 ℃, air; c 1a (1.0 mmol), 2a (1.3 mmol), PdCl2 (0.02 mmol), K2CO3 (2.0 mmol), water (1.5 g):TBAB (1.5 g)=1:1, 85 ℃, air; d1a (1.0 mmol), 2a (1.3 mmol), K2CO3 (1.0 mmol), 85 ℃, air; e Isolated yield. 以氯化钯为催化剂, 探索了4-碘苯甲醚(1a')与丙烯酸叔丁酯(2a')在不同反应条件下对偶联反应的影响情况, 实验结果见表 3.首先考虑水和离子液体比例对反应的影响, 当m(H2O):m(TBAB)=1:9时偶联反应表现出较好反应活性(Entries 1~4);不同氧化剂中Cu(O-Ac)2的反应效果最好(Entries 4~9);当使用不同的碱时, K2CO3的反应活性优于其它碱(Entries 4, 10~12);当用H2O/EPB、H2O/BMITF和H2O/EMIB作为反应介质时, 没有得到目标偶联产物(Entries 13~15);当用H2O/EMPB作为反应介质时, 偶联反应情况有所改善, 得到27%偶联产率(Entry 16);在H2O/TBAF·3H2O反应体系下, 偶联反应表现出最佳的催化活性, 同时大大的缩短了反应时间(Entry 17).实验中得到的偶联产物3a'是E式结构.
 表 3
探索水/离子液体中4-碘苯甲醚与丙烯酸叔丁酯偶联反应情况a
Table 3.
Screening of water/ionic liquid for coupling reaction between 1-iodo-4-methoxybenzene and tert-butyl acrylate
表 3
探索水/离子液体中4-碘苯甲醚与丙烯酸叔丁酯偶联反应情况a
Table 3.
Screening of water/ionic liquid for coupling reaction between 1-iodo-4-methoxybenzene and tert-butyl acrylate

Entry Water/Ionic liquid Base Oxidant Yieldb/% 1 H2O:TBAB=1:1 K2CO3 Cu(OAc)2 51 2 H2O:TBAB=3:7 K2CO3 Cu(OAc)2 64 3 H2O:TBAB=2:8 K2CO3 Cu(OAc)2 68 4 H2O:TBAB=1:9 K2CO3 Cu(OAc)2 82 5 H2O:TBAB=1:9 K2CO3 - 47 6 H2O:TBAB=1:9 K2CO3 O2 37 7 H2O:TBAB=1:9 K2CO3 CuCl2 53 8 H2O:TBAB=1:9 K2CO3 Cu(NO3)2·3H2O 72 9 H2O:TBAB=1:9 K2CO3 CuSO4 40 10 H2O:TBAB=1:9 KOAc Cu(OAc)2 75 11 H2O:TBAB=1:9 NaOH Cu(OAc)2 45 12 H2O:TBAB=1:9 - Cu(OAc)2 32 13 H2O:BMITF=1:9 K2CO3 Cu(OAc)2 NR 14 H2O:EMIB=1:9 K2CO3 Cu(OAc)2 NR 15 H2O:EPB=1:9 K2CO3 Cu(OAc)2 NR 16 H2O:EMPB=1:9 K2CO3 Cu(OAc)2 27 17c H2O:TBAF·3H2O=1:9 K2CO3 Cu(OAc)2 96 aReaction condition: 1a' (0.3 mmol), 2a' (0.4 mmol), PdCl2 (5 mol%), K2CO3 (2 equiv.), Cu(OAc)2 (2 equiv.), water/ionic liquid (1.0 g), 20 h, 85℃, air; b Isolated yield; c 20 minutes. 在最佳的Mizoroki-Heck反应条件下, 探索了不同碘代芳烃在可循环催化体系中的反应活性, 实验结果见表 4.无论是给电子基团还是吸电子基团的碘代芳烃与丙烯酸叔丁基酯(2a')反应, 都能得到较高的收率, 而且催化体系无需活化可以直接循环使用5次仍具有催化活性(Entries 1~6);由于位阻效应的影响, 邻甲基碘苯(1e')比对甲基碘苯(1d')在可循环体系中的反应活性要差(Entries 4, 5);当使用苯乙烯(2b')时, 整个反应体系也能够循环使用5次(Entry 7).当反应底物1a'扩大到1 mmol和钯催化剂从5 mol%降低到2 mol%时, 反应体系仍然能够重复使用3次, 并得到中等以上的偶联产率(Entry 8).以上所得到的偶联产物3'都为E式结构.

Entry Aryl halide Olefine 3 No. t/h Yielde/% 1 p-MeOC6H4I
(1a')tert-butyl acrylate
(2a')3a' 1a 42738 98 2b 42738 91 3b 42738 89 4b 42769 78 5b 1.5 72 2 C6H5I
(1b')2a' 3b' 1a 20 85 2b 20 88 3b 20 93 4b 18 94 5b 18 82 3 p-O2NC6H4I
(1c')2a' 3c' 1a 24 86 2b 24 83 3b 24 80 4b 24 77 5b 24 78 4 p-MeC6H4I
(1d')2a' 3d' 1a 24 93 2b 21 90 3b 21 93 4b 18 97 5b 18 91 5 o-MeC6H4I
(1e')2a' 3e' 1a 24 80 2b 21 90 3b 20 84 4b 18 82 5b 18 80 6 1-Iodonaphthalene
(1f')2a' 3f' 1a 20 88 2b 20 91 3b 20 95 4b 18 93 5b 18 85 7 1a' Styrene
(2b')3g' 1a 48 68 2b 24 82 3b 24 84 4b 24 88 5b 24 78 8 1a' 2a' 3a' 1c 42769 95 2d 1 90 3d 1.5 78 aReaction conditions: 1' (0.3 mmol), 2' (0.4 mmol), PdCl2 (5 mol%), Cu(OAc)2 (2 equiv.), K2CO3 (2 equiv.), H2O (0.2 g) : TBAF·3H2O (1.8 g)=1 : 9, air, 85 ℃; b 1' (0.3 mmol), 2' (0.4 mmol), Cu(OAc)2 (1 equiv.), K2CO3 (1 equiv.), air, 85 ℃; c 1a' (1.0 mmol), 2a' (1.3 mmol), PdCl2 (2 mol%), Cu(OAc)2 (2 equiv.), K2CO3 (2 equiv.), H2O (0.3 g) : TBAF·3H2O (2.7 g)=1 : 9, air, 85 ℃; d1a' (1.0 mmol), 2a' (1.3 mmol), Cu(OAc)2 (1 equiv.), K2CO3 (1 equiv.), air, 85 ℃; e Isolated yield. 2 结论
本文发展了一种无负载PdCl2循环催化Suzuki-Miyaura和Mizoroki-Heck偶联的新方法, 并且能够得到中等及优良的偶联产率.最重要的是氯化钯/碳酸钾/水/离子液组成的反应体系无需活化可以直接循环使用3~5次, 仍然具有良好的催化活性.与固载钯催化剂相比, 本方法避免了繁琐的合成过程, 降低了反应成本, 操作更简便, 这使得贵重金属钯在工业化生产中的循环使用具有了一定的现实意义.
3 实验部分
3.1 仪器与试剂
所用的药品和试剂均为市售的分析纯或化学纯, 未进一步处理.柱层析使用300~400目硅胶.核磁共振仪: Bruker AVANCE Ⅲ, 以TMS为内标, 氘代氯仿为溶剂.岛津GCMS-QP2010 plus.
3.2 实验方法
3.2.1 Suziki-Miyaura偶联反应的循环实验方法
在反应管中加入卤代芳烃(0.3 mmol)、有机硼化物(0.4 mmol)、K2CO3 (0.6 mmol)、PdCl2 (0.015 mmol)、四丁基溴化铵(1.0 g)和水(1.0 g), 在85 ℃油浴下反应, 薄层色谱(TLC)跟踪反应.反应完成后, 用石油醚/乙酸乙酯萃取[V(石油醚):V(乙酸乙酯)=10:1, 10 mL×5], 将石油醚/乙酸乙酯有机相用无水MgSO4干燥, 过滤后, 减压蒸去溶剂得粗产物, 经柱色谱分离得到目标产物.目标化合物3结构经1H NMR和GC-MS确认.将被萃取后的反应体系加热去掉残留石油醚/乙酸乙酯, 冷却至室温, 往反应管中继续加入卤代芳烃(0.3 mmol)、有机硼化物(0.4 mmol)和K2CO3 (0.3 mmol)进行下一次Suzuki-Miyaura偶联反应.
3.2.2 Mizoroki-Heck偶联反应的循环实验方法
在反应管中加入卤代芳烃(0.3 mmol)、烯烃(0.4 mmol)、K2CO3 (0.6 mmol)、Cu(OAc)2 (0.6 mmol)、PdCl2 (0.015 mmol)、四丁基氟化铵(1.8克)和水(0.2克), 在85 ℃油浴下反应, TLC跟踪反应.反应完成后, 用石油醚/乙酸乙酯萃取[V(石油醚):V(乙酸乙酯)=10:1, 10 mL×5], 将石油醚/乙酸乙酯有机相用无水MgSO4干燥, 过滤后, 减压蒸去溶剂得粗产物, 经柱色谱分离得到目标产物.目标化合物3'结构经1H NMR和GC-MS确认.将被萃取后的反应体系加热去掉残留石油醚/乙酸乙酯, 冷却至室温, 往反应管中继续加入卤代芳烃(0.3 mmol)、烯烃(0.4 mmol)、K2CO3 (0.3 mmol)和Cu(OAc)2 (0.3 mmol)进行下一次Mizoroki-Heck偶联反应.
4-甲氧基联苯(3a)[11]: 1H NMR (600 MHz, CDCl3) δ: 7.56~7.52 (m, 4H), 7.42 (t, J=7.8 Hz, 2H), 7.31 (t, J=7.2 Hz, 1H), 6.99~6.96 (m, 2H), 3.84 (s, 3H); LRMS m/z (%): 184 (M+, 100).
4-硝基联苯(3b)[11]: 1H NMR (600 MHz, CDCl3) δ: 8.30~8.28 (m, 2H), 7.74~7.72 (m, 2H), 7.63~7.62 (m, 2H), 7.51~7.48 (m, 2H), 7.46~7.43 (m, 1H); LRMS m/z (%): 199 (M+, 74).
2-甲基联苯(3c)[11]: 1H NMR (600 MHz, CDCl3) δ: 7.42~7.39 (m, 2H), 7.35~7.31 (m, 3H), 7.27~7.23 (m, 4H), 2.27 (s, 3H); LRMS m/z (%): 168 (M+, 100).
4-甲基联苯(3d)[11]: 1H NMR (600 MHz, CDCl3) δ: 7.58 (d, J=7.2 Hz, 2H), 7.50 (d, J=7.8 Hz, 2H), 7.43 (t, J=7.8 Hz, 2H), 7.33 (d, J=7.2 Hz, 1H), 7.25 (t, J=7.8 Hz, 2H), 2.39 (s, 3H); LRMS m/z (%): 168 (M+, 100).
2-苯基噻吩(3e)[12]: 1H NMR (600 MHz, CDCl3) δ: 7.62 (d, J=7.8 Hz, 2H), 7.38 (t, J=7.8 Hz, 2H), 7.32~7.29 (m, 1H), 7.28~7.25 (m, 2H), 7.09~7.08 (m, 1H); LRMS m/z (%): 160 (M+, 100).
4-乙酰基联苯(3f)[11]: 1H NMR (600 MHz, CDCl3) δ: 8.03 (d, J=8.2 Hz, 2H), 7.69 (d, J=8.2 Hz, 2H), 7.63 (d, J=7.8 Hz, 2H), 7.48~7.45 (m, 2H), 7.41~7.38 (m, 1H), 2.63 (s, 3H); LRMS m/z (%): 196 (M+, 49).
4-甲氧基-3'-氯联苯(3g)[13]: 1H NMR (600 MHz, CDCl3) δ: 7.52 (s, 1H), 7.50 (d, J=9.0 Hz, 2H), 7.42 (d, J=7.8 Hz, 1H), 7.32 (t, J=7.8 Hz, 1H), 7.27~7.24 (m, 1H), 6.98 (d, J=9.0 Hz, 2H), 3.84 (s, 3H); LRMS m/z (%): 218 (M+, 100), 220 (M+2+, 36).
N, N-二甲基-4-(4-甲氧基苯基)苯胺(3h)[14]: 1H NMR (600 MHz, CDCl3) δ: 7.48~7.45 (m, 4H), 6.95~6.94 (m, 2H), 6.82 (d, J=7.8 Hz, 2H), 3.84 (s, 3H), 2.98 (s, 6H); LRMS m/z (%): 227 (M+, 97).
3, 4-二甲基-4'-甲氧基联苯(3i)[15]: 1H NMR (600 MHz, CDCl3) δ: 7.50 (d, J=9.0 Hz, 2H), 7.33 (s, 1H), 7.28 (dd, J=7.8, 1.8 Hz, 1H), 7.18 (d, J=7.8 Hz, 1H), 6.96 (d, J=9.0 Hz, 2H), 3.82 (s, 3H), 2.31 (s, 3H), 2.28 (s, 3H); LRMS m/z (%): 212 (M+, 100).
(E)-3-(4-甲氧基苯基)丙烯酸叔丁酯(3a')[16]: 1H NMR (600 MHz, CDCl3) δ: 7.55 (d, J=15.9 Hz, 1H), 7.46 (d, J=8.7 Hz, 2H), 6.89 (d, J=8.8 Hz, 2H), 6.25 (d, J=15.9 Hz, 1H), 3.83 (s, 3H), 1.53 (s, 9H); LRMS m/z (%): 234 (M+, 16).
(E)-3-苯基丙烯酸叔丁酯(3b')[20]: 1H NMR (600 MHz, CDCl3) δ: 7.60 (d, J=16.0 Hz, 1H), 7.51~7.49 (m, 2H), 7.38~7.36 (m, 3H), 6.38 (d, J=16.0 Hz, 1H), 1.54 (s, 9H); LRMS m/z (%): 204 (M+, 14).
(E)-3-(4-硝基苯基)丙烯酸叔丁酯(3c')[17]: 1H NMR (600 MHz, CDCl3) δ: 7.57(d, J=16.0 Hz, 1H), 7.41 (d, J=8.0 Hz, 2H), 7.18 (d, J=8.0 Hz, 2H), 6.34 (d, J=16.0 Hz, 1H), 1.53 (s, 9H); LRMS m/z (%): 249 (M+, 2).
(E)-3-(4-甲基苯基)丙烯酸叔丁酯(3d')[16]: 1H NMR (600 MHz, CDCl3) δ: 7.57 (d, J=16.0 Hz, 1H), 7.40 (d, J=8.0 Hz, 2H), 7.18 (d, J=8.0 Hz, 2H), 6.33 (d, J=16.0 Hz, 1H), 2.36 (s, 3H), 1.53 (s, 9H); LRMS m/z (%): 218 (M+, 19).
(E)-3-(2-甲基苯基)丙烯酸叔丁酯(3e')[16]: 1H NMR (600 MHz, CDCl3) δ: 7.90 (d, J=15.8 Hz, 1H), 7.54 (d, J=7.4 Hz, 1H), 7.26~7.25 (m, 1H), 7.23~7.18 (m, 2H), 6.31 (d, J=15.8 Hz, 1H), 2.42 (s, 3H), 1.54 (s, 9H); LRMS m/z (%): 218 (M+, 34).
(E)-3-(1-萘基)丙烯酸叔丁酯(3f')[18]: 1H NMR (600 MHz, CDCl3) δ: 8.44 (d, J=15.6 Hz, 1H), 8.19 (d, J=8.4 Hz, 1H), 7.87~7.85 (m, 2H), 7.73 (d, J=7.2 Hz, 1H), 7.56~7.51 (m, 2H), 7.47~7.44 (m, 1H), 6.47 (d, J=15.6 Hz, 1H), 1.58 (s, 9H); LRMS m/z (%): 254 (M+, 44).
(E)-1-苯基-2-(4-甲氧基苯基)乙烯(3g')[19]: 1H NMR (600 MHz, CDCl3) δ: 7.48 (d, J=7.4 Hz, 2H), 7.45 (d, J=8.7 Hz, 2H), 7.34 (t, J=7.7 Hz, 2H), 7.24~7.21 (m, 1H), 7.07 (d, J=16.3 Hz, 1H), 6.98 (d, J=16.3 Hz, 1H), 6.89 (d, J=8.7 Hz, 2H), 3.82 (s, 3H); LRMS m/z (%): 210 (M+, 100).
辅助材料(Supporting Information) 所合成偶联产物3和3'的1H NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Jana, R.; Pathak, T. P.; Sigman, M. S. Chem. Rev. 2011, 111, 1417.
(b) Kapdi, A. R.; Prajapati, D. RSC. Adv. 2014, 4, 41245.
(c) Roglans, A.; Pla-Quintana, A.; Moreno-Mañ as, M. Chem. Rev. 2006, 106, 4622.
(d) Sore, H. F.; Galloway, W. R. J. D.; Spring, D. R. Chem. Soc. Rev. 2012, 41, 1845.
(e) Wang, N. Chin. J. Org. Chem. 2011, 31, 1319 (in Chinese).
(王乃兴, 有机化学, 2011, 31, 1319.) -
[2]
(a) Diebold, C.; Derible, A.; Becht, J.-M.; Drian, C. L. Tetrahedron 2013, 69, 264.
(b) Yamada, Y. M. A.; Takeda, K.; Takahashi, H.; Ikegami, S. Org. Lett. 2002, 4, 3371.
(c) Li, J.-H.; Hu, X.-C.; Xie, Y.-X.; Tetrahedron Lett. 2006, 47, 9239.
(d) Islam, M.; Mondal, P.; Roy, A. S.; Tuhina, K. Synthesis 2010, 2399.
(e) Karimi, B.; Akhavan, P. F. Chem. Commun. 2009, 3750. -
[3]
(a) Ghiaci, M.; Zarghani, M.; Khojastehnezhad, A.; Moeinpour, F. RSC Adv. 2014, 4, 15496.
(b) Kang, C.; Huang, J.; He, W.; Zhang, F. J. Organomet. Chem. 2010, 695, 120.
(c) Hajipour, A.; Shirdashtzade, Z.; Azizi, G. Appl. Organomet. Chem. 2015, 29, 143.
(d) Yang, Q.; Ma, S.; Li, J.; Xiao, F.; Xiong, H. Chem. Commun. 2006, 2495. -
[4]
(a) Hussain, N.; Borah, A.; Darabdhara, G.; Gogoi, P.; Azhagan, V. K.; Shelke, M. V.; Das, M. R. New J. Chem. 2015, 39, 6631.
(b) Veisi, H.; Masti, R.; Kordestani, D.; Safaei, M.; Sahin, O. J. Mol. Catal. A: Chem. 2014, 385, 61.
(c) Shang, N.; Gao, S.; Feng, C.; Zhang, H.; Wang, C.; Wang, Z. RSC Adv. 2013, 3, 21863. -
[5]
(a) Choi, M.; Lee, D.-H.; Na, K.; Yu, B.-W.; Ryoo, R. Angew. Chem., Int. Ed. 2009, 48, 3673.
(b) Guan, Z.; Hu, J.; Gu, Y.; Zhang, H.; Li, G.; Li, T. Green Chem. 2012, 14, 1964. -
[6]
(a) Nasrollahzadeh, M.; Maham, M.; Ehsani, A.; Khalaj, M. RSC Adv. 2014, 4, 19731.
(b) Khakiani, B. A.; Pourshamsian, K.; Veisi, H. Appl. Organomet. Chem. 2015, 29, 259.
(c) Movassagh, B.; Takallou, A.; Mobaraki, A. J. Mol. Catal. A: Chem. 2015, 401, 55.
(d) Feng, C.; Hei, L.; Li, Z.; Liu, L. Chin. J. Org. Chem. 2016, 36, 179 (in Chinese).
(冯翠兰, 黑莉楹, 李珍, 刘澜涛, 有机化学, 2016, 36, 179.) -
[7]
(a) Rostamnia, S.; Rahmani, T.; Appl. Organomet. Chem. 2015, 29, 471.
(b) Karimi, B.; Zamani, A. Org. Biomol. Chem. 2012, 10, 4531. -
[8]
(a) Annapurna, M.; Parsharamulu, T.; Reddy, P. V.; Suresh, M.; Likhar, P. R.; Kantam, M. L. Appl. Organomet. Chem. 2015, 29, 234.
(b) Roy, A. S.; Mondal, J.; Banerjee, B.; Mondal, P.; Bhaumik, A.; Islam, S. M. Appl. Catal. A: Gen. 2014, 469, 320. -
[9]
(a) Sadegh, F.; Bagheri, O.; Moghadam, M.; Mirkhani, V.; Tangestaninejad, S.; Mohammadpoor-Baltork, I. J. Organomet. Chem. 2014, 759, 46.
(b) Naghipour, A.; Fakhri, A. Catal. Commun. 2016, 73, 39.
(c) Patel, H. A.; Patel, A. L.; Bedekar, A. V. Appl. Organomet. Chem. 2015, 29, 1.
(d) Reynolds, W. R.; Plucinski, P.; Frost, C. G. Catal. Sci. Technol. 2014, 4, 948.
(e) Nejat, R.; Mahjoub, A. R.; Hekmatian, Z.; Azadbakht, T. RSC Adv. 2015, 5, 16029.
(f) Hei, L.; Feng, C.; Li, Z.; Liu, L.; Gui, J. Chin. J. Org. Chem. 2015, 35, 1673 (in Chinese).
(黑莉楹, 冯翠兰, 李珍, 刘澜涛, 桂建舟, 有机化学, 2015, 35, 1673.) -
[10]
Tang, B.-X.; Fang, X.-N.; Kuang, R.-Y.; Hu, R.-H.; Wang, J.-W.; Li, P.; Li, X.-H. Synthesis 2013, 45, 2971. doi: 10.1055/s-00000084
-
[11]
Mino, T.; Shirae, Y.; Saito, T.; Sakamoto, M.; Fujita, T. J. Org. Chem. 2006, 71, 9499. doi: 10.1021/jo061734i
-
[12]
Kang, S.; Kim J.-S.; Choi, S.-C. J. Org. Chem. 1997, 62, 4208. doi: 10.1021/jo970656j
-
[13]
Liu, J.-B.; Yan, H.; Chen, H.-X.; Luo, Y.; Weng, J.; Lu, G. Chem. Commun. 2013, 49, 5268. doi: 10.1039/c3cc41421c
-
[14]
Liao, L.-Y.; Liu, K.-M.; Duan, X.-F. J. Org. Chem. 2015, 80, 9856. doi: 10.1021/acs.joc.5b01787
-
[15]
Durak, L. J.; Lewis, J. C. Organometallics 2014, 33, 620. doi: 10.1021/om401221v
-
[16]
Liu, J.-B.; Chen, F.-J.; Liu, N.; Hu, J. RSC Adv. 2015, 5, 45843. doi: 10.1039/C5RA05131B
-
[17]
J. Masllorens, J.; Moreno-Mañas, M.; Pla-Quintana, A.; Ro-glans, A. Org. Lett. 2003, 5, 1559. doi: 10.1021/ol034340b
-
[18]
Bergbreiter, D. E.; Osburn, P. L.; Wilson, A.; Sink, E. M. J. Am. Chem. Soc. 2000, 122, 9058. doi: 10.1021/ja001708g
-
[19]
Jha, A. K.; Kishor, S.; Jain, N. RSC Adv. 2015, 5, 55218. doi: 10.1039/C5RA06107E
-
[1]
-
表 1 水/离子液体中4-碘苯甲醚与苯硼酸的偶联反应a
Table 1. Coupling reaction between 1-iodo-4-methoxybenzene and phenylboronic acid in water/ionic liquid media

Entry Temperature/℃ Water/ionic liquid Base Yieldb/% 1 85 H2O/EMIB K2CO3 26 2 85 H2O/EMPB K2CO3 87 3 85 H2O/EPB K2CO3 96 4 85 H2O/TBAB K2CO3 99 5 85 H2O/BMITF K2CO3 22 6 85 H2O/TBAF·3H2O K2CO3 93 7 85 H2O/TBAB KOAc 78 8 85 H2O/TBAB NaOH 97 9 85 H2O/TBAB Cs2CO3 88 10 85 H2O/TBAB — Trace 11 60 H2O/TBAB K2CO3 90 12c r.t H2O/TBAB K2CO3 36 a Reaction conditions: 1a (0.3 mmol), 2a (0.4 mmol), PdCl2 (0.015 mmol), base (0.6 mmol), water (0.5 g):ionic liquid (0.5 g)=1:1, 10 h, 85 ℃, air; b Isolated yield; c r.t=room temperature. 表 2 不同反应底物的Suzuki-Miyaura偶联
Table 2. Suzuki-Miyaura coupling of various substrates

Entry Aryl halide Arylboronic acid 3 No. t/h Yielde/% 1 p-MeOC6H4I
(1a)C6H5B(OH)2
2a3a 1a 10 95 2b 11 90 3b 15 88 4b 18 75 5b 22 68 2 p-O2NC6H4I
(1b)2a 3b 1a 9 93 2b 10 88 3b 11 84 4b 16 77 5b 23 73 3 o-MeC6H4I
(1c)2a 3c 1a 12 94 2b 18 92 3b 20 78 4b 22 72 5b 24 62 4 p-MeC6H4I
(1d)2a 3d 1a 10 96 2b 10 90 3b 11 88 4b 12 82 5b 13 78 5 2-Iodothiophene
(1e)2a 3e 1a 12 95 2b 13 84 3b 15 73 4b 18 69 6 p-MeOC6H4Br
(1f)2a 3a 1a 16 92 2b 20 90 3b 24 83 4b 26 76 5b 29 68 7 p-O2NC6H4Br
(1g)2a 3b 1a 11 92 2b 12 87 3b 14 83 4b 18 78 5b 24 72 8 p-CH3COC6H4Br
(1h)2a 3f 1a 13 92 2b 14 90 3b 16 86 4b 18 78 9 1a m-ClC6H4B(OH)2
2b3g 1a 14 94 2b 15 91 3b 17 87 4b 21 72 5b 26 64 10 1a p-Me2NC6H4B(OH)2
2c3h 1a 14 64 2b 18 69 3b 27 65 11 1a 3, 4-Me2C6H3B(OH)2
2d3i 1a 10 98 2b 11 95 3b 12 84 4b 13 79 5b 14 73 12 1a 2a 3a 1c 12 93 2d 16 91 3d 20 68 a Reaction conditions: 1 (0.3 mmol), 2 (0.4 mmol), PdCl2 (0.015 mmol), K2CO3 (0.6 mmol), water (1 g) : TBAB (1 g)=1:1, 85 ℃, air; b 1 (0.3 mmol), 2 (0.4 mmol), K2CO3 (0.3 mmol), 85 ℃, air; c 1a (1.0 mmol), 2a (1.3 mmol), PdCl2 (0.02 mmol), K2CO3 (2.0 mmol), water (1.5 g):TBAB (1.5 g)=1:1, 85 ℃, air; d1a (1.0 mmol), 2a (1.3 mmol), K2CO3 (1.0 mmol), 85 ℃, air; e Isolated yield. 表 3 探索水/离子液体中4-碘苯甲醚与丙烯酸叔丁酯偶联反应情况a
Table 3. Screening of water/ionic liquid for coupling reaction between 1-iodo-4-methoxybenzene and tert-butyl acrylate

Entry Water/Ionic liquid Base Oxidant Yieldb/% 1 H2O:TBAB=1:1 K2CO3 Cu(OAc)2 51 2 H2O:TBAB=3:7 K2CO3 Cu(OAc)2 64 3 H2O:TBAB=2:8 K2CO3 Cu(OAc)2 68 4 H2O:TBAB=1:9 K2CO3 Cu(OAc)2 82 5 H2O:TBAB=1:9 K2CO3 - 47 6 H2O:TBAB=1:9 K2CO3 O2 37 7 H2O:TBAB=1:9 K2CO3 CuCl2 53 8 H2O:TBAB=1:9 K2CO3 Cu(NO3)2·3H2O 72 9 H2O:TBAB=1:9 K2CO3 CuSO4 40 10 H2O:TBAB=1:9 KOAc Cu(OAc)2 75 11 H2O:TBAB=1:9 NaOH Cu(OAc)2 45 12 H2O:TBAB=1:9 - Cu(OAc)2 32 13 H2O:BMITF=1:9 K2CO3 Cu(OAc)2 NR 14 H2O:EMIB=1:9 K2CO3 Cu(OAc)2 NR 15 H2O:EPB=1:9 K2CO3 Cu(OAc)2 NR 16 H2O:EMPB=1:9 K2CO3 Cu(OAc)2 27 17c H2O:TBAF·3H2O=1:9 K2CO3 Cu(OAc)2 96 aReaction condition: 1a' (0.3 mmol), 2a' (0.4 mmol), PdCl2 (5 mol%), K2CO3 (2 equiv.), Cu(OAc)2 (2 equiv.), water/ionic liquid (1.0 g), 20 h, 85℃, air; b Isolated yield; c 20 minutes. 表 4 不同底物的Mizoroki-Heck偶联
Table 4. Mizoroki-Heck coupling of various substrates

Entry Aryl halide Olefine 3 No. t/h Yielde/% 1 p-MeOC6H4I
(1a')tert-butyl acrylate
(2a')3a' 1a 42738 98 2b 42738 91 3b 42738 89 4b 42769 78 5b 1.5 72 2 C6H5I
(1b')2a' 3b' 1a 20 85 2b 20 88 3b 20 93 4b 18 94 5b 18 82 3 p-O2NC6H4I
(1c')2a' 3c' 1a 24 86 2b 24 83 3b 24 80 4b 24 77 5b 24 78 4 p-MeC6H4I
(1d')2a' 3d' 1a 24 93 2b 21 90 3b 21 93 4b 18 97 5b 18 91 5 o-MeC6H4I
(1e')2a' 3e' 1a 24 80 2b 21 90 3b 20 84 4b 18 82 5b 18 80 6 1-Iodonaphthalene
(1f')2a' 3f' 1a 20 88 2b 20 91 3b 20 95 4b 18 93 5b 18 85 7 1a' Styrene
(2b')3g' 1a 48 68 2b 24 82 3b 24 84 4b 24 88 5b 24 78 8 1a' 2a' 3a' 1c 42769 95 2d 1 90 3d 1.5 78 aReaction conditions: 1' (0.3 mmol), 2' (0.4 mmol), PdCl2 (5 mol%), Cu(OAc)2 (2 equiv.), K2CO3 (2 equiv.), H2O (0.2 g) : TBAF·3H2O (1.8 g)=1 : 9, air, 85 ℃; b 1' (0.3 mmol), 2' (0.4 mmol), Cu(OAc)2 (1 equiv.), K2CO3 (1 equiv.), air, 85 ℃; c 1a' (1.0 mmol), 2a' (1.3 mmol), PdCl2 (2 mol%), Cu(OAc)2 (2 equiv.), K2CO3 (2 equiv.), H2O (0.3 g) : TBAF·3H2O (2.7 g)=1 : 9, air, 85 ℃; d1a' (1.0 mmol), 2a' (1.3 mmol), Cu(OAc)2 (1 equiv.), K2CO3 (1 equiv.), air, 85 ℃; e Isolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 2510
- HTML全文浏览量: 91


 下载:
下载:
 下载:
下载:

