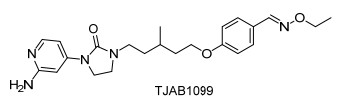
 图1
TJAB1099
Figure1.
Structure of TJAB1099
图1
TJAB1099
Figure1.
Structure of TJAB1099

Citation: He Wanli, Zhao Yangyang, Mao Yonghong, Zhao Peipei, Wang Ying, Cai Yan. Practical Synthesis of TJAB1099:An Effective Anti EV71 Inhibitor[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2361-2368. doi: 10.6023/cjoc201704002

肠道病毒71型抑制剂TJAB1099的实用合成方法研究
English
Practical Synthesis of TJAB1099:An Effective Anti EV71 Inhibitor
-
Key words:
- enterovirus 71
- / inhibitor
- / synthetic method
-
手足口病(HFMD)多发于5岁以下的婴幼儿, 并且表现出广泛的临床症状, 中国一直以来都是人手足口病的高发区.引发手足口病的肠道病毒有20多种(型)[1, 2], 其中以肠道病毒71型(EV71) 及柯萨奇病毒A16 (CVA16) 最为常见, CVA16感染通常只造成轻症病例且占比例小, 而EV71感染不仅造成轻症病例, 还能造成重症和死亡病例[3, 4], 因此目前的药物研究主要是针对EV71.目前我国已有预防儿童手足口病的EV71型灭活疫苗上市[5], 然而由于病毒的高变异率, 通过接种疫苗预防EV71病毒感染仍然具有很大的挑战性.现阶段临床上针对EV71引起的手足口病感染, 一般情况下主要通过使用阿昔洛韦、利巴韦林等常用广谱抗病毒药物进行对症的支持性治疗, 而没有有效的特异性针对EV71的抗病毒药物上市[6].
作者所在的研究团队在解析了EV71的全病毒颗粒结构后[7], 根据其衣壳蛋白VP1的结构特点并借助计算机辅助药物设计, 合成筛选出了一个EV71的强效抑制剂TJAB1099(图 1)[8].其IC50值达到了25 pmol/L, 并且动物实验显示在中剂量组条件下对乳鼠的保护率接近90%, 在前期的药代动力学实验中显示出了良好的成药性, TJAB1099是目前最有可能成为特异性抗手足口病药物的候选化合物.
1 结果与讨论
TJAB1099的分子结构由吡啶咪唑酮部分、作为连接的烷基链以及氧乙基肟取代的芳基三部分构成, 经过分析, 对于TJAB1099的合成主要有两种策略, 一种是以2-溴-4-氨基吡啶2为起始原料(策略a), 另一种是以2-氨基-4-溴吡啶3为起始原料(策略b), 两种策略都是经过构建吡啶咪唑酮环, 之后通过烷基链与氧乙基肟取代的芳基连接合成得到TJAB1099 (Scheme 1).
我们前期采用策略a对TJAB1099进行合成[9], 以2-溴-4-氨基吡啶(2)为起始原料, 首先与2-氯乙基异氰酸酯进行无溶剂反应, 之后原位关环得到吡啶咪唑烷酮中间体4, 以该中间体为起始原料, 我们先后分别采用了两种方法进行合成, 第一种方法是中间体4与1, 5-二溴-3-甲基戊烷反应得到中间体5, 接着与对羟基苯甲醛反应得到中间体6, 随后在醋酸钯的催化下与氨水进行封管反应得到中间体7, 最后与羟胺缩合得到TJAB1099 (Scheme 2, path a), 该路线由于在吡啶环上的溴转化氨基这一步反应的收率过低, 通过大量的条件优化, 产率未能得到明显改善, 最终未被采纳.第二种方法是先将中间体4上的溴原子转化为叠氮基团, 再与1, 5-二溴-3-甲基戊烷反应得到中间体9, 之后将叠氮基团还原为氨基得到中间体10, 最后与中间体11反应得到TJAB1099 (Scheme 2, path b), 该方法的总收率为10%, 经过多次投料收率稳定, 其制备量满足了我们前期进行药效学方面实验对化合物的需求, 但是该方法仍然有着固有缺点, 第一是反应用到的2-氯乙基异氰酸酯毒性较大, 大规模制备时容易对环境和操作人员造成危害, 第二是反应中用到了大量易爆的叠氮化钠, 限制了之后的放大生产, 第三还原叠氮基团时会产生大量的锡盐废渣, 不易后处理且很容易造成最终产品的重金属超标, 因此, 随着临床前实验对化合物的需求量增加, 以及考虑到会对之后药物申报方面带来不利的影响, 最终放弃了这个合成方法.
为了克服以上路线的缺点, 我们设计开发了以2-氨基-4-溴吡啶(3)为起始原料(Scheme 1, 策略b), 利用钯催化偶联的方法来合成TJAB1099的方法.其合成始于用对甲氧基苄基(PMB)对2氨基-4-溴吡啶(3)的氨基进行保护得到中间体化合物12[10], 随后与单乙酰基咪唑酮13进行钯催化的偶联反应, 得到吡啶咪唑烷酮中间体14, 然后在碱性条件下脱去乙酰基保护得到中间体化合物15, 之后在碱性条件下与1, 5-二溴-3-甲基-戊烷反应得到中间体化合物16, 随后脱去PMB保护基得到中间体化合物10, 最后在碱性条件下与化合物11反应得到TJAB1099 (Scheme 3), 该路线避免了之前所采用制备方法存在的问题, 满足了我们在进行临床前实验对TJAB1099的化合物需求量, 也利于之后的放大生产.
1.1 氨基保护基的选择以及偶联反应条件的优化
该路线的关键步骤在于通过偶联反应形成C-N键来构建吡啶咪唑烷酮14这个关键中间体, 我们在优化偶联反应条件的同时, 也考察了氨基保护基的影响.我们首先选择甲酸酯作为氨基保护基, 铜盐作为催化剂进行反应, 但是未得到预期产物, 原料全部分解(表 1, Entries 1, 2).之后我们选择Pd2dba3作为催化剂, BINAP作为配体进行反应, 发现反应可以进行, 但是产率极低(表 1, Entries 3~6), 当将配体换为Xantphos, Cs2CO3作为碱时, 反应可以23%的分离收率得到预期的产物14(表 1, Entry 7), 随后我们通过更换不同的碱、催化剂以及溶剂以期能够进一步提高收率, 但效果不理想(表 1, Entries 8~11).我们考虑可能2-氨基-4-溴吡啶(3)上的氨基保护基会对偶联反应造成影响, 所以将甲酸酯保护基换为了叔丁氧羰基进行考察, 但是反应却未得到预期的产物(表 1, Entries 12~14).令我们惊喜的是, 当将氨基保护基换为对甲氧基苄基时, 以Pd2dba3作为催化剂, Xantphos为配体, Cs2CO3作为碱时, 反应可以60%的分离收率得到预期产物(表 1, Entry 15), 随后的条件优化却未能进一步提高收率(表 1, Entries 16~19), 当将反应温度或催化剂/配体的量降低时, 反应收率也会降低(表 1, Entries 20, 21).因此, 反应优化后的条件为:以对甲氧基苄基作为2-氨基-4-溴吡啶(3)上的氨基保护基, 以10 mol%的Pd2dba3作为催化剂, 11 mol%的Xantphos为配体, 1.5 equiv.的Cs2CO3作为碱, 甲苯作为溶剂, 反应温度为90 ℃.在后续的放大实验中, 我们发现产物可以通过乙酸乙酯/石油醚进行重结晶而得到纯化, 无需再用硅胶柱纯化.
 表 1
氨基保护基的选择以及偶联反应条件的优化a
Table 1.
Selection of protect group of amino and the condition optimization of coupling reaction
表 1
氨基保护基的选择以及偶联反应条件的优化a
Table 1.
Selection of protect group of amino and the condition optimization of coupling reaction

Entry R Cat. Ligand Base Solvent Yieldb/% 1 
CuI N, N'-Dimethylethylenediamine K2CO3 n-BuOH ND 2 CuI N, N'-Dimethylethylenediamine Cs2CO3 Dioxnae ND 3 Pd2dba3 BINAP K3PO4 Toluene Trace 4 Pd2dba3 BINAP Cs2CO3 Toluene Trace 5 Pd2dba3 BINAP t-BuONa Toluene ND 6 Pd2dba3 Johnphos Cs2CO3 Toluene Trace 7 Pd2dba3 Xantphos Cs2CO3 Toluene 23 8 Pd2dba3 Xantphos K3PO4 Toluene Trace 9 Pd2dba3 Xantphos t-BuONa Toluene ND 10 Pd(OAc)2 Xantphos Cs2CO3 Toluene 12 11 Pd(OAc)2 Xantphos Cs2CO3 Dioxane 4 12 Pd2dba3 Xantphos Cs2CO3 Toluene ND 13 Pd2dba3 Xantphos K3PO4 Toluene ND 14 Pd2dba3 Xantphos t-BuONa Toluene ND 15 Pd2dba3 Xantphos Cs2CO3 Toluene 60 16 Pd2dba3 Xantphos K3PO4 Toluene 26 17 Pd2dba3 Xantphos t-BuONa Toluene 8 18 Pd2dba3 Johnphos Cs2CO3 Toluene 47 19 Pd2dba3 Xantphos Cs2CO3 Dioxane 31 20 Pd2dba3 Xantphos Cs2CO3 Toluene 53c 21 Pd2dba3 Xantphos Cs2CO3 Toluene 37d a一般反应条件:将200 mg化合物12以及1.2 equiv.的化合物13置于5 mL甲苯中, 加入10 mol%的催化剂、11 mol%的配体以及1.5 equiv.的碱, 氮气保护, 90℃反应15 h. b硅胶柱分离收率. c反应温度为60 ℃. d催化剂的加入量为5 mol%, 配体的加入量为6 mol%. ND, no desired. 1.2 吡啶咪唑烷酮与1, 5-二溴-3-甲基-戊烷反应条件的优化
接下来我们筛选优化了吡啶咪唑烷酮(中间体15)与1, 5-二溴-3-甲基-戊烷[11]的反应条件.我们首先筛选了不同的碱, 发现叔丁醇钾、氢氧化钾以及碳酸钾均无法使原料发生转化(表 2, Entries 1~3), 即便在加入相转移催化剂的情况下, 反应也无法发生(表 2, Entry 4).当将碱换为脱氢能力更强的氢化钠时, 反应顺利进行, 并以50%的收率得到目标产物(表 2, Entry 5).将氢化钠的用量增加, 发现会对反应不利, 收率会降至41%(表 2, Entry 6), 提升1, 5-二溴-3-甲基-戊烷的量会使反应的收率增加到67%(表 2, Entry 7), 但继续增加1, 5-二溴-3-甲基-戊烷的量, 却无法进一步提升收率, 收率反而会有所下降(表 2, Entry 8), 降低氢化钠的用量也会使得反应收率下降(表 2, Entry 9).因此, 该步反应的最优条件确定为: 1, 5-二溴-3-甲基-戊烷的投料量为2 equiv., 1.5 equiv.氢化钠作为碱, N, N-二甲基甲酰胺(DMF)作为溶剂, 室温反应.此外, 我们在条件优化的过程中, 发现总是有1, 5-二溴-3-甲基-戊烷的两侧都连接有吡啶咪唑烷酮的副产物16', 无论条件如何优化, 都难以避免, 但是该副产物可以通过乙酸乙酯萃取的方法有效除去, 在之后的放大过程中, 该步反应的产物粗品可以不经纯化直接用于后续反应投料.
 表 2
吡啶咪唑烷酮与1, 5-二溴-3-甲基-戊烷反应条件的优化a
Table 2.
Condition optimization of the reaction of pyridine imidazolidinone and 1, 5-dibromide-3-methyl-pentane
表 2
吡啶咪唑烷酮与1, 5-二溴-3-甲基-戊烷反应条件的优化a
Table 2.
Condition optimization of the reaction of pyridine imidazolidinone and 1, 5-dibromide-3-methyl-pentane

Entry x/equiv. Base y/equiv. Solvent Temp./℃ Yieldb/% 1 1.5 t-BuOK 1.5 THF 60 NR 2 1.5 KOH 1.5 Toluene 90 NR 3 1.5 K2CO3 1.5 Acetone 60 NR 4c 1.5 K2CO3 1.5 Acetone 60 NR 5 1.5 NaH 1.5 DMF 25 50 6 1.5 NaH 2 DMF 25 41 7 2 NaH 1.5 DMF 25 67 8 2.5 NaH 1.5 DMF 25 63 9 2 NaH 1.1 DMF 25 52 a一般反应条件:将500 mg化合物15以及x equiv.的1, 5-二溴-3-甲基-戊烷加入到10 mL DMF中, 体系于冰水浴条件下冷却, 之后逐渐加入y equiv.的碱, 加入完毕后搅拌10 min, 之后升至相应的温度反应3 h. b硅胶柱分离收率. c反应过程中加入了1 equiv.的四丁基硫酸氢铵(TBAB). NR, no reaction. 1.3 TJAB1099的合成
中间体16在三氟乙酸存在的条件下脱去氨基上的PMB保护基得到中间体10, 它与1.6 equiv.中间体11, 在5 equiv.碳酸钾作用下, 65 ℃反应8 h, 得到TJAB1099的粗品, 经过乙醇洗涤, 乙酸乙酯重结晶, 可以得到纯度大于99%的产品, 该步反应产物结晶后的收率为56% (Scheme 4).其中中间体11可以通过对羟基苯甲醛与氧乙基羟肟盐酸盐在乙酸钠的作用下, 室温反应得到[12].
1.4 TJAB1099的合成成本的初步核算对比
工艺路线合成设计中的成本是一个比较重要的考量要素, 我们将之前采用的合成策略a与目前采用的合成策略b中使用的主要原料成本做了初步的罗列对比, 以制备10 g纯度大于99%的TJAB1099为例进行核算, 所需主要试剂的用量以及价格如表 3和表 4所示, 可以看出采用策略b进行制备所需主要试剂的成本要略低于之前的合成策略.
 表 3
采用策略a制备10 g纯度大于99%的TJAB1099所需主要试剂的成本
Table 3.
Cost of main reagents required in the preparation of 10 g of TJAB1099 ( > 99% purity) with the use of strategy
表 3
采用策略a制备10 g纯度大于99%的TJAB1099所需主要试剂的成本
Table 3.
Cost of main reagents required in the preparation of 10 g of TJAB1099 ( > 99% purity) with the use of strategy
原料名称 采购单价/元 采购包装规格/g 实际用量/g 总价/元 供应商 2-溴-4-氨基吡啶 576.00 25 40.4 930.81 北京伊诺凯科技有限公司 2-氯乙基异氰酸酯 1742.00 100 100 1742.00 百灵威科技有限公司 叠氮化钠 160.00 50 33.4 106.88 西亚试剂 氯化亚锡二水合物 59.00 100 35.3 20.83 百灵威科技有限公司 价格总计/元 2800.52  表 4
采用策略b制备10 g纯度大于99%的TJAB1099所需主要试剂的成本
Table 4.
Cost of main reagents required in the preparation of 10 g TJAB1099 ( > 99% purity) with the use of strategy
表 4
采用策略b制备10 g纯度大于99%的TJAB1099所需主要试剂的成本
Table 4.
Cost of main reagents required in the preparation of 10 g TJAB1099 ( > 99% purity) with the use of strategy
原料名称 采购单价/元 采购包装规格 实际用量/g 总价/元 供应商 2-氨基-4-溴吡啶 540.00 25 g 31.8 686.88 北京伊诺凯科技有限公司 4-甲氧基苄氯 499.00 100 mL 91.8 398.33 天津希恩思奥普德科技有限公司 Pd2(dba)3 756.00 10 g 14.4 1088.64 北京伊诺凯科技有限公司 Xantphos 432.00 25 g 10.0 172.80 北京伊诺凯科技有限公司 N-乙酰基-2-咪唑烷酮 283.10 25 g 24.2 274.00 安耐吉化学 价格总计/元 2620.65 2 结论
我们成功设计开发了以2-氨基-4-溴吡啶为起始原料, 利用钯催化偶联的方法来合成TJAB1099的方法, 该方法避免了之前的制备方法存在的问题, 该合成路线均不需要硅胶柱层析, 所有的中间体经过适当洗涤或结晶纯化后直接进行下一步投料, 且终产物TJAB1099通过重结晶可以达到99%以上纯度, 该路线已进行了多次百克级的起始放大投料, 产率较为稳定, 同时满足了我们在进行临床前实验对TJAB1099的化合物需求量, 也利于之后的放大生产.
3 实验部分
3.1 仪器与试剂
仪器:核磁共振仪Bruker Plus 400M型, 质谱仪Waters 3100 Mass Detctor, 分析型液相色谱仪Hitachi L-2000型, 旋转蒸发仪YRE-2000A型, UAT-02暗箱式紫外分析仪, WRX-4显微熔点仪.
试剂: 1, 5-二溴-3-甲基-戊烷与化合物11为自制; 其余所用试剂均为分析纯, 氮气为高纯氮, 柱层析所用硅胶(200~300目)和GF254薄层硅胶板均为青岛海洋化工厂生产.
3.2 实验方法
3.2.1 4-溴-N, N-双(4-甲氧基苄基)吡啶-2-氨(12)的制备
将100 g的2-氨基-4-溴吡啶溶于2 L的DMF中, 将体系置于低温反应釜中冷却, 使温度降至-5 ℃, 之后将89.2 g质量分数为60%的NaH分批加入到上述反应体系中, 加料完毕后在氮气保护下保温搅拌0.5 h, 之后向反应体系缓慢滴加4-甲氧基苄氯(PMBCl) 288.6 g, 滴加完毕后自然恢复至室温, 反应7 h后, 薄层色谱(TLC)监测原料基本反应完全, 将反应体系控制在30 ℃以下, 加入2.5 L H2O将反应淬灭, 有大量固体析出, 用真空隔膜泵进行抽滤, 收集析出的固体, 滤饼用1.5 L H2O进行洗涤, 之后干燥得到204.5 g黄色固体, 即中间体12, 产率85.6%. m.p. 126.2~126.9 ℃; 1H NMR (400 MHz, Chloroform-d) δ: 8.03 (d, J=5.3 Hz, 1H), 7.15 (d, J=8.6 Hz, 4H), 6.87 (d, J=8.7 Hz, 4H), 6.75 (dd, J=5.4, 1.5 Hz, 1H), 6.67 (d, J=1.5 Hz, 1H), 4.69 (s, 4H), 3.82 (s, 6H); HR-ESI-MS calcd for C21H22BrN2O2 [M+H]+ 414.3150, found 414.3102.
3.2.2 1-乙酰基-3-(2-(双(4-甲氧基苄基)氨基)吡啶-4)-咪唑烷-2-酮(14)的制备
将170.7 g的化合物12加入到3 L的甲苯中, 之后依次向上述体系中加入55.2 g的N-乙酰基咪唑烷酮、175.4 g Cs2CO3、20.6 g Pd2(dba)3和22.8 g Xantphos, 氮气保护, 加热体系使内温升至90 ℃, 加热回流反应15 h, TLC监测原料反应完全, 停止反应, 待体系降至室温, 将体系过滤, 收集滤液并旋去溶剂, 剩余物溶于乙酸乙酯中, 滤饼用1 L乙酸乙酯淋洗, 之后合并所有的乙酸乙酯相再用1.5 L饱和NaCl溶液洗涤一次, 收集有机相并用无水硫酸钠干燥, 之后将有机相减压浓缩除去溶剂, 得259 g棕色油状物, 对产物粗品进行重结晶:将259 g棕色油状物用250 mL的乙酸乙酯加热至75 ℃, 向体系中缓慢加入250 mL的石油醚, 体系析出大量白色固体, 自然降温至25 ℃, 抽滤, 收集固体, 并将所得固体进行真空干燥得104.8 g白色固体, 即为中间体14, 产率为53.7%. m.p. 132.5~133.1 ℃; 1H NMR (400 MHz, Chloroform-d) δ: 8.17 (d, J=5.8 Hz, 1H), 7.18 (d, J=8.6 Hz, 4H), 6.88~6.90 (m, 1H), 6.83~6.88 (m, 4H), 6.68~6.71 (m, 1H), 4.73 (s, 4H), 3.87~3.95 (m, 2H), 3.81 (s, 6H), 3.69~3.77 (m, 2H), 2.56 (s, 3H); IR (KBr) ν: 3259.34, 3167.51, 1738.1, 1654.23, 1609.55, 1598.37, 1511.48, 1500.06, 1477.01, 1406.9, 1382.01, 1365.33, 1349.41, 1307.6, 1303.5, 1290.6, 1264.8, 1247.29, 1219.37, 1176.11, 1170.13, 606.66 cm-1; HR-ESI-MS calcd for C26H29N4O4 [M+H]+ 461.5340, found 461.5304.
3.2.3 1-(2-(双(4-甲氧基苄基)氨基)吡啶-4) 咪唑烷-2-酮的制备(15)的制备
将104.8 g化合物14分散到900 mL的MeOH中, 再将80 g的K2CO3加入到体系中, 室温反应3 h, TLC监测至原料反应完全, 向体系中加入450 mL的水, 搅拌30 min后, 将体系直接过滤, 滤饼用450 mL的水洗涤, 后将所得固体真空干燥, 得90.4 g类白色固体, 即为中间体15, 产率为92%. m.p. 155.2~155.6 ℃; 1H NMR (400 MHz, Chloroform-d) δ: 8.11 (d, J=5.8 Hz, 1H), 7.17~7.21 (m, 4H), 6.87~6.89 (m, 1H), 6.83~6.87 (m, 4H), 6.71~6.74 (m, 1H), 4.72 (s, 4H), 4.68 (s, 1H), 3.81 (s, 6H), 3.74~3.80 (m, 2H), 3.49~3.58 (m, 2H); IR (KBr) ν: 3238.77, 3166.25, 2904.66, 1721.67, 1597.58, 1548.44, 1511.2, 1494.74, 1478.78, 1030.82, 811.3 cm-1. HR-ESI-MS calcd for C24H27N4O3 [M+H]+ 419.4970, found 419.4906.
3.2.4 1-(2-(双(4-甲氧基苄基)氨基)吡啶-4)-3-(5-溴-3-甲基戊基)咪唑烷-2-酮(16)的制备
将44.4 g化合物15溶于740 mL的DMF中, 将21.2 g 3-甲基-1, 5-二溴戊烷加入上述体系, 氮气保护下将体系置于低温反应釜中, 并降温至0 ℃, 之后向体系中分批加入5.5 g质量分数为60%的NaH, 加料完毕后保温反应30 min, 之后自然升温至25 ℃反应, 反应3 h后, TLC监测原料反应完全, 将体系冷却至0 ℃, 之后向反应体系中加入500 mL的水, 体系用乙酸乙酯萃取(300 mL×3), 合并有机相, 有机相依次用300 mL H2O和300 mL饱和NaCl溶液洗涤, 收集有机相, 之后用无水Na2SO4干燥, 减压浓缩除去溶剂, 得82 g棕黄色油状物, 即为化合物16粗品, 不经纯化可直接用于下一步反应投料. 1H NMR (400 MHz, Chloroform-d) δ: 8.09 (d, J=5.9 Hz, 1H), 7.15~7.21 (m, 4H), 6.89 (dd, J=5.9, 1.9 Hz, 1H), 6.81~6.88 (m, 4H), 6.73 (d, J=1.9 Hz, 1H), 4.71 (s, 4H), 3.81 (s, 6H), 3.63~3.70 (m, 2H), 3.24~3.52 (m, 6H), 1.87~1.96 (m, 1H), 1.69~1.81 (m, 2H), 1.64~1.69 (m, 1H), 1.35~1.42 (m, 1H), 0.98 (d, J=6.1 Hz, 3H); IR (KBr) ν: 3435.4, 2927.9, 1708.53, 1608.76, 1509.88, 1477.05, 1422.99, 1384.43, 816.48 cm-1; HR-ESI-MS calcd for C30H38BrN4O3 [M+H]+ 582.5550, found 582.5508.
3.3.5 1-(2-氨基吡啶-4-基)-3-(5-溴-3-甲基戊基)咪唑烷-2-酮(10)的制备
将82 g化合物16的粗品溶于660 mL的二氯甲烷(DCM)中, 后将328 mL三氟乙酸加入到体系中, 室温反应3 h, TLC监测原料反应完全.直接将反应体系减压浓缩除去溶剂, 后向体系中加入饱和NaHCO3溶液, 将pH调节为7, 之后向体系中加入400 mL的乙酸乙酯进行萃取、分液, 收集乙酸乙酯相, 水相再次用乙酸乙酯萃取(200 mL×2), 合并有机相, 并用300 mL的饱和NaCl溶液洗涤, 之后用无水Na2SO4干燥, 减压浓缩除去溶剂, 得72 g黄色粘稠物, 对产物粗品进行重结晶:向体系中加入50 mL的乙酸乙酯加热至75 ℃, 向其中缓慢加入75 mL甲基叔丁基醚, 有白色固体析出, 后自然恢复至25℃, 过滤、收集固体, 真空干燥得19.5 g白色固体, 即中间体10, m.p. 116.5~117.2 ℃, 与上步反应收率合计为54%. 1H NMR (400 MHz, Chloroform-d) δ: 7.96 (d, J=5.9 Hz, 1H), 6.93~6.98 (m, 1H), 6.75 (dd, J=6.1, 1.9 Hz, 1H), 4.37~4.49 (m, 2H), 3.80 (t, J=8.1 Hz, 2H), 3.51~3.59 (m, 2H), 3.43~3.50 (m, 2H), 3.27~3.42 (m, 2H), 1.89~1.99 (m, 1H), 1.72~1.82 (m, 2H), 1.59~1.69 (m, 1H), 1.37~1.47 (m, 1H), 1.01 (d, J=6.0 Hz, 3H); IR (KBr) ν: 3419.94, 3295.1, 3158.42, 2964.13, 2926.95, 2371.29, 1700.87, 1691.3, 1639.83, 1605.56, 1547.82, 1483.84, 1433.89, 1297.29, 1277.34, 824.2 cm-1; HR-ESI-MS calcd for C14H22BrN4O [M+H]+ 342.2530, found 342.2510.
3.2.6 (E)-4-((5-(3-(2-氨基吡啶-4)-2-氧代咪唑烷-1)-3-甲基戊基)氧基)苯甲醛-O-乙基肟(TJAB1099) 的制备
将12.4 g化合物10和6.9 g的化合物11、17.4 g的K2CO3加入到86 mL CH3CN中, 65 ℃加热回流, 反应6 h后, TLC监测原料反应完毕, 停止反应, 待体系温度降至室温, 过滤除去体系中的固体, 收集滤液, 滤饼用DCM洗涤, 合并有机相并减压浓缩除去溶剂, 得18.7 g黄色固体.对所得产物粗品用乙醇进行洗涤后进行重结晶:向体系中加入10 mL乙酸乙酯稀释, 75 ℃加热回流, 后缓慢加入乙酸乙酯直至体系刚刚澄清透明, 自然降至室温, 有白色固体析出, 减压抽滤, 收集滤饼, 并将所得固体真空干燥, 得白色固体粉末8.6 g, 收率为56%.即TJAB1099. m.p. 135.4~136.9 ℃; 1H NMR (400 MHz, Chloroform-d) δ: 8.04 (s, 1H), 7.96 (d, J=5.9 Hz, 1H), 7.47~7.55 (m, 2H), 6.9~6.98 (m, 1H), 6.84~6.91 (m, 2H), 6.74 (dd, J=6.0, 2.0 Hz, 1H), 4.38 (s, 2H), 4.18~4.26 (m, 2H), 4.00~4.10 (m, 2H), 3.69~3.81 (m, 2H), 3.45~3.54 (m, 2H), 3.29~3.43 (m, 2H), 1.74~1.93 (m, 2H), 1.63~1.74 (m, 2H), 1.41~1.51 (m, 1H), 1.34 (t, J=7.1 Hz, 3H), 1.05 (d, J=6.4 Hz, 3H); 13C NMR (101 MHz, Chloroform-d) δ: 160.22, 159.36, 156.93, 148.65, 148.47, 147.95, 128.39, 124.98, 114.61, 102.79, 94.74, 69.54, 65.89, 41.77, 41.54, 41.34, 35.92, 34.16, 27.50, 19.46, 14.63; IR (KBr) ν: 3418.06, 3294.25, 3157.71, 2931.26, 2879.04, 1699.9, 1689.97, 1641.06, 1606.71, 1547.88, 1506.67, 1482.88, 1376.71, 1250.65, 1055.84, 961.97, 825.75 cm-1; HR-MS calcd for C23H32N5O3 [M+H]+ 426.5330, found 426.5303.
-
-
[1]
(a) McMinn, P. C. FEMS Microbio. Rev. 2002, 26, 91.
(b) Shih, S. R.; Chen, S. J.; Hakimelahi, G. H.; Liu, H. J.; Tseng, C. T.; Shia, K. S. Med. Res. Rev. 2004, 24, 449. -
[2]
桂娟娟, 刘志芳, 华启航, 董长征, 遗传, 2015, 37, 426. http://www.ebiotrade.com/emagazine/content/1/2015_5_37_5/21CE8BB3-02C2-45F5-AC59-AE6EBD1671D2/pdf/426.pdf
-
[3]
(a) Chang, L.Y.; Lin, T. Y.; Hsu, K. H.; Huang, Y. C.; Lin, K. L.; Hsueh, C.; Shih, S. R.; Ning, H. C.; Hwang, M. S.; Wang, H. S.; Lee, C. Y. Lancet 1999, 354, 1682.
(b) Chan, K. P.; Goh, H. T.; Chong, C. Y.; Teo, E. S.; Lau, G.; Ling, A. E. Emerging Infect. Dis. 2003, 9, 78.
(c) Huang, K. Y.; Zhang, X.; Chung, P. H.; Tsao, K. C.; Lin, T. S.; Su, L. H., Chiu, C. H. Scand. J. Infect. Dis. 2008, 40, 571. -
[4]
(a) Tan, X.; Huang, X.; Zhu, S.; Chen, H.; Yu, Q.; Wang, H.; Huo, X.; Zhou, J.; Wu, Y.; Yan, D. PLos One 2011, 6, e25662.
(b) Zeng, D. B.; Ma, Y. Y.; Zhang, R.; Nie, Q. D.; Cui, Z. J.; Wang, Y. X.; Shang, L. Q.; Yin, Z. Bioorg. Med. Chem. 2016, 26, 1762. -
[5]
Li, R. C.; Liu, L. D.; Mo, Z. J.; Wang, X. Y.; Xia, J. L.; Liang, Z. L.; Zhang, Y.; Li, Y. P.; Mao, Q. Y.; Wang, J. J.; Jiang, L.; Dong, C. H.; Che, Y. C.; Huang, T.; Jiang, Z. W.; Xie, Z. P.; Wang, L. C.; Liao, Y.; Liang, Y.; Nong, Y.; Liu, J. S.; Zhao, H. L.; Na, R. X.; Guo, L.; Pu, J.; Yang, E.; Sun, L.; Cui, P. F.; Shi, H. J.; Wang, J. Z.; Li, Q. H. New Engl. J. Med. 2014, 370, 829. doi: 10.1056/NEJMoa1303224
-
[6]
郭辉, 贾贻红, 中国医药指南, 2009, 7, 66. doi: 10.3969/j.issn.1671-8194.2009.01.048Guo, H.; Jia, Y. H. Guid. Chin. Med. 2009, 7, 66(in Chinese). doi: 10.3969/j.issn.1671-8194.2009.01.048
-
[7]
Wang, X. X.; Peng, W.; Ren, J. S.; Hu, Z. Y.; Xu, J. W.; Lou, Z. Y.; Li, X. M.; Yin, W. D.; Shen, X. L.; Porta, C.; Walter, T. S.; Evans, G.; Axford, D.; Owen, R.; Rowlands, D.; Wang, J. Z.; Stuart, D. I.; Fry, E. E.; Rao, Z. H. J. Nat. Struct. Mol. Biol. 2012, 19, 424. doi: 10.1038/nsmb.2255
-
[8]
De Colibus, L.; Wang, X. X.; Spyrou, J. A. B.; Kelly, J.; Ren, J. S.; Grimes, J.; Puerstinger, G.; Stonehouse, N.; Walter, T. S.; Hu, Z. Y.; Wang, J. Z.; Li, X. M.; Peng, W.; Rowlands, D. J. Fry, E. E.; Rao, Z. H.; Stuart, D. I. J. Nat. Struct. Mol. Biol. 2014, 21, 282. doi: 10.1038/nsmb.2769
-
[9]
Rao, Z. H.; Yang, C.; Cai, Y.; Guo, Y.; Li, S.; Wang, Y.; Mao, Y. H.; Zhao, P. P.; He, W. L.; Zhao, Y. Y.; Liu, Y. H.; Meng, F. F. CN 201610315888.7, 2016. http://www.sibcb.ac.cn/ePI.asp?id=137
-
[10]
Lin, L. S.; Cui, M. X.; Hu, B.; Hao, J. L.; Chen, Z. X. WO 2014022528[Chem. Abstr. 2014, 160, 265016].
-
[11]
Avis, T. J.; Boulanger, R. R.; Belanger, R. R. J. Chem. Ecol. 2000, 26, 987. doi: 10.1023/A:1005464326573
-
[12]
Chern, J. H.; Lee, C. C.; Chang, C. S.; Lee, Y. C.; Tai, C. L.; Lin, Y. T.; Shia, K. S.; Lee, C. Y.; Shih, S. R. Bioorg. Med. Chem. Lett. 2004, 14, 5051. doi: 10.1016/j.bmcl.2004.07.084
-
[1]
-
表 1 氨基保护基的选择以及偶联反应条件的优化a
Table 1. Selection of protect group of amino and the condition optimization of coupling reaction

Entry R Cat. Ligand Base Solvent Yieldb/% 1 
CuI N, N'-Dimethylethylenediamine K2CO3 n-BuOH ND 2 CuI N, N'-Dimethylethylenediamine Cs2CO3 Dioxnae ND 3 Pd2dba3 BINAP K3PO4 Toluene Trace 4 Pd2dba3 BINAP Cs2CO3 Toluene Trace 5 Pd2dba3 BINAP t-BuONa Toluene ND 6 Pd2dba3 Johnphos Cs2CO3 Toluene Trace 7 Pd2dba3 Xantphos Cs2CO3 Toluene 23 8 Pd2dba3 Xantphos K3PO4 Toluene Trace 9 Pd2dba3 Xantphos t-BuONa Toluene ND 10 Pd(OAc)2 Xantphos Cs2CO3 Toluene 12 11 Pd(OAc)2 Xantphos Cs2CO3 Dioxane 4 12 Pd2dba3 Xantphos Cs2CO3 Toluene ND 13 Pd2dba3 Xantphos K3PO4 Toluene ND 14 Pd2dba3 Xantphos t-BuONa Toluene ND 15 Pd2dba3 Xantphos Cs2CO3 Toluene 60 16 Pd2dba3 Xantphos K3PO4 Toluene 26 17 Pd2dba3 Xantphos t-BuONa Toluene 8 18 Pd2dba3 Johnphos Cs2CO3 Toluene 47 19 Pd2dba3 Xantphos Cs2CO3 Dioxane 31 20 Pd2dba3 Xantphos Cs2CO3 Toluene 53c 21 Pd2dba3 Xantphos Cs2CO3 Toluene 37d a一般反应条件:将200 mg化合物12以及1.2 equiv.的化合物13置于5 mL甲苯中, 加入10 mol%的催化剂、11 mol%的配体以及1.5 equiv.的碱, 氮气保护, 90℃反应15 h. b硅胶柱分离收率. c反应温度为60 ℃. d催化剂的加入量为5 mol%, 配体的加入量为6 mol%. ND, no desired. 表 2 吡啶咪唑烷酮与1, 5-二溴-3-甲基-戊烷反应条件的优化a
Table 2. Condition optimization of the reaction of pyridine imidazolidinone and 1, 5-dibromide-3-methyl-pentane

Entry x/equiv. Base y/equiv. Solvent Temp./℃ Yieldb/% 1 1.5 t-BuOK 1.5 THF 60 NR 2 1.5 KOH 1.5 Toluene 90 NR 3 1.5 K2CO3 1.5 Acetone 60 NR 4c 1.5 K2CO3 1.5 Acetone 60 NR 5 1.5 NaH 1.5 DMF 25 50 6 1.5 NaH 2 DMF 25 41 7 2 NaH 1.5 DMF 25 67 8 2.5 NaH 1.5 DMF 25 63 9 2 NaH 1.1 DMF 25 52 a一般反应条件:将500 mg化合物15以及x equiv.的1, 5-二溴-3-甲基-戊烷加入到10 mL DMF中, 体系于冰水浴条件下冷却, 之后逐渐加入y equiv.的碱, 加入完毕后搅拌10 min, 之后升至相应的温度反应3 h. b硅胶柱分离收率. c反应过程中加入了1 equiv.的四丁基硫酸氢铵(TBAB). NR, no reaction. 表 3 采用策略a制备10 g纯度大于99%的TJAB1099所需主要试剂的成本
Table 3. Cost of main reagents required in the preparation of 10 g of TJAB1099 ( > 99% purity) with the use of strategy
原料名称 采购单价/元 采购包装规格/g 实际用量/g 总价/元 供应商 2-溴-4-氨基吡啶 576.00 25 40.4 930.81 北京伊诺凯科技有限公司 2-氯乙基异氰酸酯 1742.00 100 100 1742.00 百灵威科技有限公司 叠氮化钠 160.00 50 33.4 106.88 西亚试剂 氯化亚锡二水合物 59.00 100 35.3 20.83 百灵威科技有限公司 价格总计/元 2800.52 表 4 采用策略b制备10 g纯度大于99%的TJAB1099所需主要试剂的成本
Table 4. Cost of main reagents required in the preparation of 10 g TJAB1099 ( > 99% purity) with the use of strategy
原料名称 采购单价/元 采购包装规格 实际用量/g 总价/元 供应商 2-氨基-4-溴吡啶 540.00 25 g 31.8 686.88 北京伊诺凯科技有限公司 4-甲氧基苄氯 499.00 100 mL 91.8 398.33 天津希恩思奥普德科技有限公司 Pd2(dba)3 756.00 10 g 14.4 1088.64 北京伊诺凯科技有限公司 Xantphos 432.00 25 g 10.0 172.80 北京伊诺凯科技有限公司 N-乙酰基-2-咪唑烷酮 283.10 25 g 24.2 274.00 安耐吉化学 价格总计/元 2620.65 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 6
- 文章访问数: 1917
- HTML全文浏览量: 189






 下载:
下载:




 下载:
下载:

