 图式 1
目标化合物的合成路线
图式 1.
Synthetic route for target compounds.
图式 1
目标化合物的合成路线
图式 1.
Synthetic route for target compounds.

Citation: Zhang Ying, Lü Mengjiao, Zhang Yaling, Chen Li, Wang Wei, Li Baolin. Synthesis and Antitumor Activity of Heterozygous Isatin-Quinazoline Compounds[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1787-1793. doi: 10.6023/cjoc201701037

靛红杂合喹唑啉类化合物的合成及抗肿瘤活性研究
English
Synthesis and Antitumor Activity of Heterozygous Isatin-Quinazoline Compounds
-
Key words:
- isatin
- / quinazoline
- / synthesis
- / antitumor activity
-
近年来, 以表皮生长因子受体(EGFR)酪氨酸激酶为作用靶点的抗肿瘤治疗成为研究热点.目前, 已经有二十多种靶向酪氨酸激酶的小分子抑制剂.例如, 吉非替尼[1]、埃罗替尼[2, 3]、拉帕替尼[4, 5]等已成功用于多种肿瘤的临床治疗[6].其中, 拉帕替尼(Lapatinib, 结构如1)由英国葛兰素史克公司研制开发.它是一种可以口服的、可逆的、小分子表皮生长因子受体1和2 (ErbB1和ErbB2) 抑制剂, 可以同时竞争性结合EGFR和HER2胞内激酶区域的ATP结合位点, 从而抑制癌细胞的增殖.体内外的临床试验证明, Lapatinib对治疗EGFR过度表达引起的晚期或转移性乳腺癌、胃癌、非小细胞肺癌以及结肠癌和膀胱癌均具有较好的疗效, 并且Lapatinib可明显延长患者的生存时间.但是在使用过程中发现, 它仍存在着许多不良反应, 包括腹泻、恶心、呕吐、皮疹和肝损伤, 个别患者出现左室射血分数下降(可逆的且可以导致呼吸短促)、间质性肺炎[7]等副作用.
靛红(Isatin, 结构如2)及其衍生物具有广泛的药理活性, 对靛红可进行全方位的结构修饰, 包括苯环的取代, 1-N取代及2-C和3-C的衍生, 其中以3-C上的结构修饰最丰富, 其数量最多.在3-C衍生得到的靛红类化合物的药理活性中突出表现为抗癌作用[8, 9]. 3-C衍生得到的靛红衍生物是丝氨酸/苏氨酸蛋白激酶和受体酪氨酸激酶(RTKS)抑制剂.激酶调节许多与细胞增长、分化和死亡相关的胞内外信号通路, 它们功能的失调会导致一系列生理异常, 最终导致癌症的发生[10].例如, 舒尼替尼(Sunitinib, 结构如3)是由辉瑞制药公司研发的一种新型多靶向性的治疗肿瘤的口服药物, 2006年被食品药品监督管理局(FDA)批准上市, 广泛用于治疗肾细胞癌、胃肠间质瘤、肺癌、肝癌等疾病[11].由于靛红衍生物的多样性及其广泛的药理活性, 因此, 含有靛红结构单元的小分子化合物成为近年来抗肿瘤药物研究领域的一大热点[12].
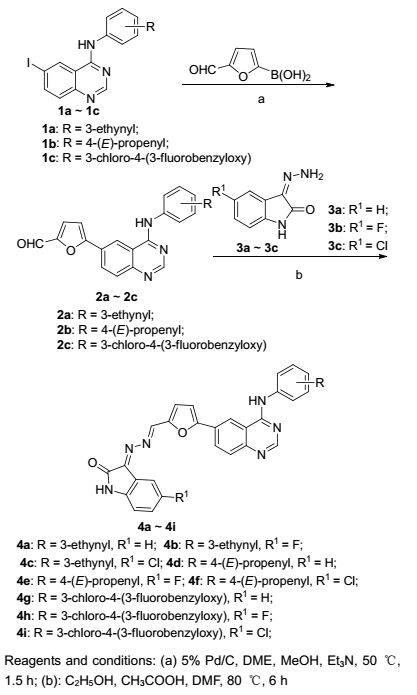
临床应用显示:一些针对某一靶标的药物使用一段时间后, 会产生明显的耐药性, 给肿瘤的后期治疗带来比较大的困难.因此, 发现结构新颖、低毒、低耐药性的抗肿瘤化合物仍是目前重要任务之一.其中, 药效基团的杂合是一种有效的、常用的合成新型药物的方法.两个或两个以上的生物活性片段的杂合, 有互补的药效功能或不同的作用机制, 其表现出的协同作用可以有效地治疗癌症[13~15]. Fares等[16]将靛红与喹唑啉结构进行杂合, 制备了一系列新颖的靛红衍生物, 其体外活性结果显示:部分化合物对人肝癌细胞(HepG2) 的增殖有较强的抑制活性.基于以上启示, 本文在保持拉帕替尼药效基团喹唑啉母核结构不变的基础上, 在其6位的呋喃环上用3种不同的靛红衍生物替代原来的仲胺结构, 在其4位保留拉帕替尼的芳胺基结构, 同时增加另外2种不同的芳胺基结构单元, 共合成了9种结构新颖的靛红杂合喹唑啉类化合物4a~4i, 其合成路线如Scheme 1所示.
1 结果与讨论
1.1 中间体及目标化合物的合成
化合物1参考文献[17], 以邻硝基苯甲醛为起始原料, 经过氰基化、硝基还原、碘代、成脒、Dimroth重排6步自行合成.化合物2的合成采用Suzuki偶联法[17~19], 以质量分数5%钯炭为催化剂, 体积比为1:2的甲醇与乙二醇二甲醚作混合溶剂, 三乙胺为缚酸剂, 在50 ℃的条件下反应2~4 h, 得到化合物2.该方法具有反应时间较短, 产率较高等优点.化合物3的合成参照文献方法[16, 20], 以甲醇为溶剂回流0.5 h即可反应完全, 经过抽滤, 重结晶, 就可以直接用于下步反应.该反应具有反应时间短, 操作简单, 后处理简单及收率高等优点.化合物4参照文献方法[21, 22]合成.最初根据文献[22], 用哌啶等弱碱作催化剂, 催化该反应并没有得到理想的产物.后参考文献[21]用醋酸作催化剂, 乙醇和N, N-二甲基甲酰胺(DMF)作溶剂, 79 ℃反应6 h.反应完全, 经抽滤、重结晶得到目标化合物.该反应具有操作简单, 后处理容易等优点.该反应是酸性催化的反应, 但不能用强酸, 因为氢离子与羰基结合可以增加羰基亲电性的同时, 还可以和氨基结合, 这样丧失了胺的亲核能力.在弱酸醋酸的存在下, 一方面使羰基质子化增强了其亲电性, 促进反应, 另一方面也避免了胺过度质子化而造成亲核性下降.
1.2 目标化合物4的结构确证
目标化合物4的结构通过NMR、IR和HRMS确证.现以化合物4a为例说明它们结构.在化合物4a的1H NMR谱中, δ 10.86 (s, 1H)处出现1个单峰, 这是靛红1位NH的共振峰, δ 10.18 (s, 1H)和9.04 (s, 1H)处各出现1个单峰, 这是4位芳胺基喹唑啉类化合物的两个特征共振信号, 前者是4位芳胺基NH的共振峰, 后者为喹唑啉母核2位氢的共振峰. δ 8.68 (s, 2H)处出现1个单峰, 分别是H—C=N的共振峰和喹唑啉母核4位氢的共振峰, δ 8.36 (d, J=8.7 Hz, 1H)和8.02 (d, J=8.7 Hz, 1H)处为喹唑啉母核7, 8位2个氢的共振峰, δ 7.60 (d, J=3.6 Hz, 1H)和7.49 (d, J=3.6 Hz, 1H)处为呋喃环2个氢的共振峰, δ 4.25 (s, 1H)处为炔基氢的共振峰.进一步通过13C NMR、IR和HRMS证明了化合物4a是目标化合物.在目标化合物中存在顺反构型, 为了进一步确定其构型, 我们以DMSO为培养液, 对目标化合物进行单晶的培养, 得到了化合物4a的单晶, 结果表明其为(E, E)构型.化合物4a的晶体数据存于英国剑桥数据中心, CCDC号为1509375.化合物4a的晶体结构和分子结构见图 1.
在该化合物的晶体结构中, 存在三种分子间氢键: N(3)—H(3)…O(1), C(10)—H(10)…O(1), N(6)—H(6)…N(1)(图 2), 键长分别为2.936(2), 3.338(3), 2.854(2) ,键角分别为N(3)—H(3)…O(1)=158°, C(10)—H(10)…O(1)=149°, N6—H(6)…N(1)=162°, 这些氢键在单晶堆积过程中起到很重要的作用.
1.3 抗肿瘤活性
本文以临床抗肿瘤药物Lapatinib为阳性对照, 以人结直肠癌细胞SW480、人非小细胞肺癌细胞A549和NCI-H1975、人表皮鳞癌细胞A431为受试细胞株, 用噻唑蓝(MTT)法对所合成的新化合物4a~4i进行了初步的抗肿瘤活性测试, 其实验数据如表 1所示.实验数据表明, 所合成化合物4a、4b、4c、4g、4h表现出较强的抑制肿瘤细胞增殖活性.受试化合物4a、4b、4c、4g、4h对A431的增殖具有明显的抑制作用, 其IC50值分别为1.93±1.06, 0.64±0.07, 1.31±0.50, 1.06±0.40, 1.84± 0.84 μmol•L-1, 其效果优于阳性对照拉帕替尼(4.80± 0.71μmol•L-1); 受试化合物4a、4c、4g对SW480的增殖抑制作用与阳性对照拉帕替尼相当, 受试化合物4a、4b、4c对NCI-H1975的增殖具有明显的抑制作用, 受试化合物4a对A549的增殖具有明显的抑制作用.综上所述, 化合物4a对4种所试肿瘤细胞的增殖均表现出良好的抑制作用, 其活性均优于临床用药拉帕替尼.根据实验数据可知:当喹唑啉母核4位为3-乙炔苯胺基时, 抑制肿瘤细胞增殖活性最好; 当4位为3-氯-4-(3-氟苄氧基)苯胺基时, 活性次之; 当4位为4-(E)-丙烯基苯胺基时, 对肿瘤细胞增殖的抑制不明显.靛红5位无取代基时, 抑制肿瘤细胞增殖活性最好.
 表 1
目标化合物对4种受试细胞的体外抑制活性[IC50/(μmol•L-1)]a
Table 1.
Inhibitory activity [IC50/(μmol•L-1)] of target compounds against four tested cells growth in vitro
表 1
目标化合物对4种受试细胞的体外抑制活性[IC50/(μmol•L-1)]a
Table 1.
Inhibitory activity [IC50/(μmol•L-1)] of target compounds against four tested cells growth in vitro
Compound SW480 A549 A431 NCI-H1975 Lapatinib 12.58±1.35 14.90±1.21 4.80±0.71 12.68±0.73 Isatin >100 >100 >100 >100 4a 14.86±1.08 10.15±3.91 1.93±1.06 11.54±1.29 4b >100 >100 0.64±0.07 12.85±1.85 4c 8.44±4.64 22.72±10.53 1.31±0.50 5.77±1.43 4d >100 >100 33.67±6.87 32.67±0.50 4e >100 >100 105.90±40.50 >100 4f >100 >100 >100 >100 4g 15.43±3.54 >100 1.06±0.40 16.70±0.36 4h 89.41±15.68 >100 1.84±0.84 143.10±22.91 4i >100 >100 >100 >100 a IC50 values are shown as the mean±SD (μmol•L-1) from three independent experiments. 2 结论
本文经8步反应合成了9种结构新颖的拉帕替尼类似物, 其反应原料易得, 操作步骤简单.利用NMR、IR和HRMS波谱学方法对反应中间体及目标化合物结构进行了确证, 并通过X射线衍射对其构型进行了确认.另外以4种人肿瘤细胞为模型, 采用MTT法对目标化合物进行了初步的体外抗肿瘤活性评价.测试结果表明, 化合物4a、4b、4c、4g、4h表现出较强的抑制肿瘤细胞增殖活性.化合物4b对A431和NCI-H1975的增殖具有明显的抑制作用, 化合物4g对SW480和A431的增殖具有明显的抑制作用, 化合物4h对A431的增殖具有明显的抑制作用, 化合物4c对SW480、A431和NCI-H1975的增殖具有明显的抑制作用, 尤其是化合物4a在4种所试肿瘤细胞上均表现出良好的抑制肿瘤细胞增殖活性, 优于临床使用的抗肿瘤药物拉帕替尼(Lapatinib), 这预示着通过对化合物4a的进一步研究, 有望开发出新的具有抗肿瘤活性的药物.
3 实验部分
3.1 仪器与试剂
核磁共振数据由Bruker Avance 300、400、600超导核磁共振仪测定, TMS作为内标; 红外光谱数据采用Nicolet 170SX FT-IR红外光谱仪测定; 质谱数据用Bruker Esquire 3000plus质谱仪测定; 熔点采用X-6显微熔点测定仪(北京泰克仪器有限公司)测定(温度未进行校正); 晶体数据由德国Bruker APEX-Ⅱ CCD单晶X射线衍射仪在153 K温度下收集数据.人结直肠癌细胞SW480、人非小细胞肺癌细胞A549和NCI-H1975、人表皮鳞癌细胞A431均购自中国科学院细胞库.所用试剂均为分析纯.
3.2 实验方法
3.2.1 化合物2的合成
取6.0 mmol化合物1, 1.12 g (8.0 mmol) 5-甲酰基呋喃-2-硼酸、0.56 g 5%钯炭, 40 mL乙二醇二甲醚、20 mL甲醇和2.42 g (24 mmol)三乙胺加入到反应瓶中, 50 ℃搅拌, TLC跟踪(展开剂V乙酸乙酯:V氯仿=1:3) 至反应完毕, 约需反应时间3 h.趁热抽滤, 减压旋蒸滤液, 所得残留物进行硅胶柱色谱分离(V乙酸乙酯:V氯仿=1:9) 得到橘黄色固体2.
4-(3-乙炔基苯胺基)-6-(5-甲酰基呋喃-2-基)喹唑啉(2a)[18]: m.p. 247.8~249.3 ℃.橘黄色固体, 1.55 g, 收率为76.3%.
4-[4-(E)-丙烯基苯胺基]-6-(5-甲酰基呋喃-2-基)喹唑啉(2b)[18]: m.p. 230.1~231.9 ℃.橘黄色固体, 1.23 g, 收率为57.7%.
4-[3-氯-4-(3-氟苄氧基)苯胺基]-6-(5-甲酰基呋喃-2-基)喹唑啉(2c): m.p. 229.6~231.4 ℃(文献值[17]: m.p. 229~233 ℃).橘黄色固体, 2.46 g, 收率为86.6%.
3.2.2 化合物4的合成
取0.5 mmol化合物2、0.5 mmol化合物3、0.5 mL醋酸、10 mL乙醇和2 mL N, N-二甲基甲酰胺, 加入到反应瓶中, 80 ℃回流, TLC跟踪(展开剂V乙酸乙酯:V氯仿=1:1) 至反应完毕, 约需反应时间6 h.冷却后抽滤, 用乙醇冲洗滤饼, 滤饼中的固体用二甲亚砜重结晶, 析出大量红色固体4.
(E)-3-(((E)-(5-(4-(3-乙炔苯胺基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)吲哚啉-2-酮(4a):红色固体0.18 g, 收率为73.5%. m.p.>280 ℃; 1H NMR (600 MHz, DMSO-d6) δ: 10.86 (s, 1H), 10.18 (s, 1H), 9.04 (s, 1H), 8.68 (s, 2H), 8.36 (d, J=8.7 Hz, 1H), 8.35 (d, J=7.9 Hz, 1H), 8.07 (s, 1H), 8.02 (d, J=8.7 Hz, 1H), 7.93 (d, J=8.7 Hz, 1H), 7.60 (d, J=3.6 Hz, 1H), 7.49 (d, J=3.6 Hz, 1H), 7.46 (t, J=7.9 Hz, 1H), 7.39 (t, J=7.4 Hz, 1H), 7.28 (d, J=7.6 Hz, 1H), 7.07 (t, J=7.6 Hz, 1H), 6.90 (d, J=7.8 Hz, 1H), 4.25 (s, 1H); 13C NMR (101 MHz, DMSO-d6) δ: 165.2, 158.2, 157.2, 155.4, 152.1, 151.9, 150.4, 149.7, 145.3, 139.8, 134.1, 130.1, 129.8, 129.4, 129.3, 127.3, 127.2, 125.3, 123.1, 122.9, 122.8, 122.3, 119.5, 117.2, 116.0, 111.1, 111.0, 83.8, 81.1; IR (KBr) ν: 3545, 3417, 3235, 2062, 1639, 1617, 1487, 1396, 1174, 623 cm-1; HRMS calcd for C29H19N6O2 [M+H]+: 483.1569, found 483.1581.
(E)-3-(((E)-(5-(4-(3-乙炔苯胺基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氟吲哚啉-2-酮(4b):红色固体0.18 g, 收率为72.6%. m.p.>280 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 10.83 (s, 1H), 10.05 (s, 1H), 9.00 (s, 1H), 8.67 (s, 1H), 8.63 (s, 1H), 8.26 (d, J=8.7 Hz, 1H), 8.07 (d, J=9.2 Hz, 2H), 7.95 (d, J=8.7 Hz, 1H), 7.85 (d, J=8.6 Hz, 1H), 7.58 (d, J=3.3 Hz, 1H), 7.42 (t, J=7.8 Hz, 2H), 7.26 (d, J=7.9 Hz, 1H), 7.21 (d, J=8.7 Hz, 1H), 6.86 (dd, J=8.4, 4.1 Hz, 1H), 4.20 (s, 1H); 13C NMR (151 MHz, DMSO-d6) δ: 164.8, 158.4, 157.7, 157.0, 155.9 (d, 1JC-F=277.9 Hz), 152.3, 151.6 (d, 4JC-F=2.5 Hz), 150.0, 149.1, 141.1, 139.2, 129.0, 128.9, 128.8, 127.0, 126.7, 125.2, 122.9, 121.8, 120.0, 119.9, 119.2, 117.2 (d, 3JC-F=9.2 Hz), 116.2 (d, 2JC-F=26.4 Hz), 115.4 (d, 2JC-F=12.5 Hz), 111.6 (d, 3JC-F=7.7 Hz), 110.6, 83.4, 80.6; IR (KBr) ν: 3563, 3416, 3235, 2061, 1718, 1698, 1616, 1519, 1035, 624 cm-1; HRMS calcd for C29H18FN6O2 [M+H]+: 501.1475, found 501.1491.
(E)-3-(((E)-(5-(4-(3-乙炔苯胺基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氯吲哚啉-2-酮(4c):红色固体0.20 g, 收率为76.3%. m.p.>280 ℃; 1H NMR (600 MHz, DMSO-d6) δ: 10.90 (s, 1H), 9.96 (s, 1H), 8.93 (s, 1H), 8.64 (s, 1H), 8.59 (s, 1H), 8.33 (s, 1H), 8.24 (d, J=8.7 Hz, 1H), 8.00 (s, 1H), 7.90 (d, J=8.0 Hz, 1H), 7.78 (d, J=8.7 Hz, 1H), 7.50 (s, 1H), 7.42 (t, J=7.9 Hz, 1H), 7.38~7.36 (m, 2H), 7.26 (d, J=7.4 Hz, 1H), 6.84 (d, J=8.2 Hz, 1H), 4.20 (s, 1H); 13C NMR (101 MHz, DMSO-d6) δ: 164.5, 157.7, 156.9, 155.0, 152.5, 151.6, 149.9, 149.0, 143.4, 139.2, 132.8, 129.1, 128.9, 128.6, 127.1, 126.6, 126.0, 125.4, 123.6, 123.5, 123.1, 121.7, 119.3, 118.0, 115.4, 112.0, 110.4, 83.4, 80.7; IR (KBr) ν: 3555, 3416, 3235, 2062, 1719, 1638, 1616, 1396, 1174, 623 cm-1; HRMS calcd for C29H18ClN6O2 [M+H]+: 517.1180, found 517.1182.
(E)-3-(((E)-(5-(4-(4-(E)-丙烯基苯胺基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)吲哚啉-2-酮(4d):红色固体0.18 g, 收率为72.1%. m.p.>280 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 10.85 (s, 1H), 10.08 (s, 1H), 8.98 (s, 1H), 8.64 (s, 1H), 8.60 (s, 1H), 8.30 (d, J=8.0 Hz, 2H), 7.87 (d, J=8.7 Hz, 1H), 7.81 (d, J=8.4 Hz, 2H), 7.56 (d, J=3.3 Hz, 1H), 7.43~7.40 (m, 3H), 7.36 (d, J=7.5 Hz, 1H), 7.04 (t, J=7.5 Hz, 1H), 6.90 (d, J=7.8 Hz, 1H), 6.41 (d, J=15.9 Hz, 1H), 6.25 (dq, J=15.9, 6.1 Hz, 1H), 1.86 (d, J=6.1 Hz, 3H); 13C NMR (151 MHz, DMSO-d6)δ: 164.8, 157.7, 156.7, 154.9, 151.6, 151.1, 149.6, 149.2, 144.9, 137.6, 133.6, 133.3, 130.4, 129.6, 129.1, 128.5, 126.7, 125.8, 124.5, 122.7, 122.5, 122.0, 119.1, 116.8, 115.5, 110.6, 110.4, 18.2; IR (KBr) ν: 3416, 3001, 2062, 1617, 1518, 1487, 1397, 1175, 787, 622 cm-1; HRMS calcd for C30H23N6O2[M+H]+: 499.1882, found 499.1900.
(E)-3-(((E)-(5-(4-(4-(E)-丙烯基苯胺基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氟吲哚啉-2-酮(4e):红色固体0.20 g, 收率为75.8%. m.p.>280 ℃; 1H NMR (600 MHz, DMSO-d6) δ: 1H NMR (600 MHz, DMSO-d6)δ: 10.84 (s, 1H), 10.00 (s, 1H), 9.00 (s, 1H), 8.67 (s, 1H), 8.58 (s, 1H), 8.25 (dd, J=8.5, 1.2 Hz, 1H), 8.07 (d, J=8.7 Hz, 1H), 7.84 (d, J=8.7 Hz, 1H), 7.81 (d, J=8.4 Hz, 2H), 7.59 (d, J=3.6 Hz, 1H), 7.42 (d, J=3.6 Hz, 1H), 7.40 (d, J=8.4 Hz, 2H), 7.25 (td, J=9.0, 2.7 Hz, 1H), 6.89 (dd, J=8.5, 4.2 Hz, 1H), 6.41 (d, J=15.7 Hz, 1H), 6.26 (dq, J=15.7, 6.5 Hz, 1H), 1.86 (d, J=6.5 Hz, 3H); 13C NMR (151 MHz, DMSO-d6) δ: 164.8, 158.4, 157.6, 157.1, 155.9 (d, 1JC-F=258.1 Hz), 152.3, 151.6, 149.9, 149.1, 141.2, 137.6, 133.2, 130.4, 128.8, 128.7, 126.6, 125.7, 124.5, 122.8, 122.5, 120.0, 119.9 (d, 2JC-F=23.8 Hz), 117.2 (d, 3JC-F=9.1 Hz), 116.2 (d, 2JC-F=25.7 Hz), 115.5, 111.6 (d, 3JC-F=8.1 Hz), 110.5, 18.2; IR (KBr) ν: 3417, 2986, 2062, 1617, 1486, 1397, 1173, 1003, 787, 622 cm-1; HRMS calcd for C30H22FN6O2 [M+H]+: 517.1788, found 517.1795.
(E)-3-(((E)-(5-(4-(4-(E)-丙烯基苯胺基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氯吲哚啉-2-酮(4f):红色固体0.21 g, 收率为79.3%. m.p.>280 ℃; 1H NMR (600 MHz, DMSO-d6) δ: 10.96 (s, 1H), 10.03 (s, 1H), 9.04 (s, 1H), 8.71 (s, 1H), 8.59 (s, 1H), 8.41 (s, 1H), 8.32 (d, J=7.7 Hz, 1H), 7.85 (d, J=8.2 Hz, 1H), 7.78 (d, J=6.7 Hz, 2H), 7.58 (s, 1H), 7.43~7.38 (m, 4H), 6.91 (d, J=8.0 Hz, 1H), 6.43 (d, J=15.8 Hz, 1H), 6.28 (dd, J=15.8, 5.6 Hz, 1H), 1.87 (d, J=5.6 Hz, 3H); 13C NMR (101 MHz, DMSO-d6) δ: 164.5, 157.7, 157.0, 155.1, 152.5, 151.6, 149.8, 148.9, 143.5, 137.5, 133.2, 132.8, 130.4, 129.1, 128.7, 128.5, 126.5, 126.0, 125.7, 124.5, 123.6, 122.7, 119.4, 118.0, 115.5, 112.1, 110.4, 18.3; IR (KBr) ν: 3448, 3409, 2990, 1722, 1614, 1515, 1394, 1178, 786, 624 cm-1; HRMS calcd for C30H22ClN6O2 [M+H]+: 533.1493, found 533.1509.
(E)-3-(((E)-(5-(4-(3-氯-4-(3-氟苄氧基)苯胺基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)吲哚啉-2-酮(4g):红色固体0.21 g, 收率为69.3%. m.p.>280 ℃; 1H NMR (600 MHz, DMSO-d6) δ: 10.85 (s, 1H), 10.07 (s, 1H), 8.97 (s, 1H), 8.65 (s, 1H), 8.61 (s, 1H), 8.32~8.30 (m, 2H), 8.03 (d, J=2.4 Hz, 1H), 7.88 (d, J=8.9 Hz, 1H), 7.79 (dd, J=8.9, 2.4 Hz, 1H), 7.57 (d, J=3.6 Hz, 1H), 7.50~7.46 (m, 1H), 7.43 (d, J=3.6 Hz, 1H), 7.36~7.33 (m, 3H), 7.29 (d, J=9.0 Hz, 1H), 7.19 (t, J=8.5 Hz, 1H), 7.04 (t, J=7.5 Hz, 1H), 6.90 (d, J=7.7 Hz, 1H), 5.27 (s, 2H); 13C NMR (151 MHz, DMSO-d6) δ: 165.3, 162.7 (d, 1JC-F=243.8 Hz), 158.2, 157.3, 155.5, 152.1, 151.7, 150.4, 150.3, 149.7, 145.4, 140.1 (d, 3JC-F=7.5 Hz), 134.1, 133.6, 131.0 (d, 3JC-F=8.3 Hz), 130.2, 129.7, 129.3, 127.2, 124.5, 123.8 (d, 4JC-F=2.5 Hz), 122.9, 122.7, 121.6, 119.4, 117.3, 115.9, 115.2 (d, 2JC-F=20.8 Hz), 114.8, 114.7, 114.5 (d, 2JC-F=22.0 Hz), 111.1, 110.9, 69.9; IR (KBr) ν: 3550, 3416, 2062, 1638, 1617, 1487, 1396, 1174, 787, 622 cm-1; HRMS calcd for C34H23ClFN6O3[M+H]+: 617.1504, found 617.1512.
(E)-3-(((E)-(5-(4-(3-氯-4-(3-氟苄氧基)苯胺基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氟吲哚啉-2-酮(4h):红色固体0.23 g, 收率为72.1%. m.p.>280 ℃; 1H NMR (600 MHz, DMSO-d6) δ:10.85 (s, 1H), 9.99 (s, 1H), 8.95 (s, 1H), 8.66 (s, 1H), 8.58 (s, 1H), 8.24 (d, J=8.6 Hz, 1H), 8.08 (dd, J=8.3, 2.4 Hz, 1H), 8.01 (d, J=1.8 Hz, 1H), 7.82 (d, J=8.6 Hz, 1H), 7.76 (dd, J=9.0, 1.8 Hz, 1H), 7.57 (d, J=3.5 Hz, 1H), 7.50~7.46 (m, 1H), 7.40 (d, J=3.5 Hz, 1H), 7.35~7.31 (m, 2H), 7.26 (d, J=9.0 Hz, 1H), 7.23 (dd, J=8.5, 2.5 Hz, 1H), 7.19 (d, J=8.9 Hz, 1H), 6.88 (dd, J=8.5, 4.2 Hz, 1H), 5.25 (s, 2H); 13C NMR (151 MHz, DMSO-d6) δ: 164.8, 162.2 (d, 1JC-F=243.6 Hz), 158.4, 157.6, 157.0, 155.9 (d, 1JC-F=265.2 Hz), 152.3, 151.7, 149.8, 149.7, 149.1, 141.1, 139.6 (d, 3JC-F=7.9 Hz), 132.9, 130.5 (d, 3JC-F=8.4 Hz), 128.8 (d, 2JC-F=30.9 Hz), 126.6, 124.2, 123.3 (d, 4JC-F=2.6 Hz), 122.9, 122.4, 121.1, 120.0 (d, 4JC-F=2.6 Hz), 119.9 (d, 2JC-F=24.1 Hz), 119.1, 117.2 (d, 3JC-F=9.6 Hz), 116.3, 115.3, 114.7 (d, 2JC-F=21.1 Hz), 114.2, 114.0 (d, 2JC-F=21.9 Hz), 111.5 (d, 3JC-F=7.4 Hz), 110.4, 69.4; IR (KBr) ν: 3549, 3416, 3235, 2062, 1638, 1617, 1488, 1396, 1174, 623 cm-1; HRMS calcd for C34H22ClF2N6O3[M+H]+: 635.1410, found 635.1418.
(E)-3-(((E)-(5-(4-(3-氯-4-(3-氟苄氧基)苯胺基)喹唑啉-6-基)呋喃-2-基)亚甲基)亚肼基)-5-氯吲哚啉-2-酮(4i):红色固体0.26 g, 收率为78.7%. m.p.>280 ℃; 1H NMR (600 MHz, DMSO-d6) δ: 10.93 (s, 1H), 9.93 (s, 1H), 8.92 (s, 1H), 8.66 (s, 1H), 8.55 (s, 1H), 8.36 (s, 1H), 8.24 (d, J=8.7 Hz, 1H), 7.97 (s, 1H), 7.78 (d, J=8.7 Hz, 1H), 7.72 (d, J=8.0 Hz, 1H), 7.52 (d, J=3.4 Hz, 1H), 7.50~7.46 (m, 1H), 7.39 (d, J=8.5 Hz, 1H), 7.37~7.32 (m, 3H), 7.26 (d, J=8.9 Hz, 1H), 7.19 (t, J=8.9 Hz, 1H), 6.87 (d, J=8.3 Hz, 1H), 5.26 (s, 2H); 13C NMR (151 MHz, DMSO-d6) δ: 164.5, 162.2 (d, 1JC-F=243.7 Hz), 157.7, 157.0, 155.0, 152.5, 151.6, 149.8, 148.9, 143.4, 139.6 (d, 3JC-F=7.4 Hz), 132.9, 132.7, 130.5 (d, 3JC-F=8.4 Hz), 129.2, 128.6 (d, 2JC-F=24.2 Hz), 126.5, 126.0, 124.3, 123.4, 123.3 (d, 4JC-F=2.6 Hz), 122.5, 121.0, 119.2, 118.0, 115.3, 114.7 (d, 2JC-F=20.8 Hz), 114.3, 114.2, 114.1, 113.9, 112.0, 110.3, 69.4; IR (KBr) ν: 3551, 3417, 2062, 1617, 1487, 1397, 1174, 1002, 787, 622 cm-1; HRMS calcd for C34H22Cl2FN6O3[M+H]+: 651.1114, found 651.1118.
3.2.3 抗肿瘤活性实验
化合物4a~4i对肿瘤细胞的生长抑制活性利用MTT法进行测定.分别取对数生长期的人肿瘤细胞, 用胰蛋白酶消化液消化、离心、重悬后计数, 调整细胞悬液浓度为2.0×104~5.0×104个/mL, 随后接种于96孔细胞培养板中(100 μL/孔), 置饱和湿度、37 ℃和5% CO2培养箱中培养24 h.受试化合物用培养基稀释至所需浓度, 加入已接种人肿瘤细胞的细胞培养板中(100 μL/孔), DMSO终浓度为0.5%, 置于培养箱中继续培养. 72 h后, 加入MTT (20 μL/孔), 培养箱中反应4 h.吸弃孔内液体, 加入DMSO (150 μL/孔), 摇床上震荡10 min.待甲臜完全溶解后, 用酶标仪测定570 nm波长处的吸光度(OD值), 630 nm波长处的吸光度作为参比, 以相应溶剂作为对照, 计算细胞生长抑制率.
受试化合物对肿瘤细胞生长抑制率的计算公式:抑制率(%)=[1-(ODS-ODNC)/(ODPC-ODNC)]×100%.其中: ODS表示样品孔的吸光度值(细胞+待测化合物+MTT); ODPC表示对照孔的吸光度值(细胞+DMSO+MTT); ODNC表示调零孔的吸光度值(培养基+DMSO+MTT). ODS=OD570S-OD630S; ODPC=OD570PC-OD630PC; ODNC=OD570NC-OD630NC.
受试化合物对肿瘤细胞生长抑制曲线的拟合及IC50的计算:采用GraphpadPrism5拟合受试化合物对肿瘤细胞生长的抑制曲线, 并得出IC50值.每组设置3个复孔, 至少重复3次.
辅助材料(Supporting Information) 化合物4a~4i的NMR, HRMS, IR图谱和晶体数据的PDF文件.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Lipunova, G. N.; Nosova, E. V.; Charushin, V. N.; Chupakhin, O. N. Russ. Chem. Rev. 2016, 85, 759. doi: 10.1070/RCR4591
-
[2]
Gordana, V.; Jeffrey, C. Oncologist 2003, 8, 531. doi: 10.1634/theoncologist.8-6-531
-
[3]
Ioannou, N.; Seddon, A. M.; Dalgleish, A.; Mackintosh, D.; Solca, F.; Modjtahedi, H. Int. J. Oncol. 2016, 48, 908.
-
[4]
Ravaud, A.; Hawkins, R.; Gardner, J. P.; Vonder Maase, H.; Zantl, N.; Harper, P.; Rolland, F.; Audhuy, B.; Machiels, J. P.; Petavy, F.; Gore, M.; Schoffski, P.; El-Hariry, I. J. Clin. Oncol. 2008, 26, 2285. doi: 10.1200/JCO.2007.14.5029
-
[5]
El-Ansary, A. K.; Kamal, A. M.; Abd-Hafiz, A. G. M. Chem. Pharm. Bull. 2016, 64, 1172. doi: 10.1248/cpb.c16-00291
-
[6]
王维佳, 李江, 张娅玲, 张喜全, 顾红梅, 李宝林, 化学通报, 2015, 78, 1017.Wang, W.-J.; Li, J; Zhang, Y.-L.; Zhang, X.-Q.; Gu, H.-M.; Li, B.-L. Chem. Bull 2015, 78, 1017(in Chinese).
-
[7]
Nahta, R.; Yuan, L. X. H.; Du, Y.; Esteva, F. J. Mol. Cancer Ther. 2007, 6, 667. doi: 10.1158/1535-7163.MCT-06-0423
-
[8]
Lee, D.; Long, S. A.; Murray, J. H.; Adams, J. L.; Nuttall, M. E.; Nadeau, D. P.; Kikly, K.; Winkler, J. D.; Sung, C. M.; Ryan, M. D.; Levy, M. A.; Keller, P. M.; DeWolf, W. E. Jr. J. Med. Chem. 2001, 44, 2015. doi: 10.1021/jm0100537
-
[9]
Chapman, J. G.; Magee, W. P.; Stukenbrok, H. A.; Beckius, G. E.; Milici, A. J.; Ross Tracey, W. Eur. J. Pharmacol. 2002, 456, 59. doi: 10.1016/S0014-2999(02)02484-6
-
[10]
Smith, B. D.; Smith, G. L.; Hurria, A.; Hortobagyi, G. N.; Buchholz, T. A. Clin. Oncol. 2009, 27, 2758. doi: 10.1200/JCO.2008.20.8983
-
[11]
Atkins, M.; Jones, C. A.; Kirkpatrick, P. Nat. Rev. Drug Discovery 2006, 5, 279. doi: 10.1038/nrd2012
-
[12]
王京, 朱春媛, 国佳莹, 张泽国, 陈凡, 张磊, 广东化工, 2015, 42, 106. doi: 10.3969/j.issn.1007-1865.2015.14.052Wang, J.; Zhu, C.-Y.; Guo, J.-Y.; Zhang, Z.-G.; Chen, F.; Zhang, L. Guangdong Chem. Ind. 2015, 42, 106(in Chinese). doi: 10.3969/j.issn.1007-1865.2015.14.052
-
[13]
Hu, C.; Solomon, V. R.; Cano, P.; Lee, H. Eur. J. Med. Chem. 2010, 45, 705. doi: 10.1016/j.ejmech.2009.11.017
-
[14]
Sella, A.; Yarom, N.; Zisman, A.; Kovel, S. Oncology 2009, 76, 442. doi: 10.1159/000217264
-
[15]
Solomon, V. R.; Hu, C.; Lee, H. Bioorg. Med. Chem. 2009, 17, 7585. doi: 10.1016/j.bmc.2009.08.068
-
[16]
Fares, M.; Eldehna, W. M.; Abou-Seri, S. M.; Abdel-Aziz, H. A.; Aly, M. H.; Tolba, M. F. Arch. Pharm. 2015, 348, 144. doi: 10.1002/ardp.v348.2
-
[17]
季兴, 王武伟, 许贯虹, 李飞, 姚社春, 中国医药工业杂志, 2009, 40, 801. doi: 10.3969/j.issn.1001-8255.2009.11.001Ji, X.; Wang, W.-W.; Xu, G.-H.; Li, F.; Yao, S.-C. Chin. J. Pharm. 2009, 40, 801(in Chinese). doi: 10.3969/j.issn.1001-8255.2009.11.001
-
[18]
刘娟, 张娅玲, 张喜全, 顾红梅, 李宝林, 化学通报, 2016, 79, 360. doi: 10.3969/j.issn.1007-2802.2016.02.018Liu, J; Zhang, Y.-L.; Zhang, X.-Q.; Gu, H.-M.; Li, B.-L. Chem. Bull. 2016, 79, 360(in Chinese). doi: 10.3969/j.issn.1007-2802.2016.02.018
-
[19]
McClure, M. S.; Osterhout, M. H.; Roschangar, F.; Sacchetti, M. J. WO 2002002552, 2002[Chem. Abstr. 2002, 136, 102396].
-
[20]
Hassan, T. A. F. M.; Kadi, A. A.; Abdel-Aziz, H. A. K. US 20120252860, 2012[Chem. Abstr. 2012, 157, 548485].
-
[21]
Dweedar, H. E.; Mahrous, H.; Ibrahim, H. S.; Abdel-Aziz, H. A. Eur. J. Med. Chem. 2014, 78, 275. doi: 10.1016/j.ejmech.2014.03.058
-
[22]
Nikalje, A. P.; Ansari, A.; Bari, S.; Ugale, V. Arch. Pharm. 2015, 348, 433. doi: 10.1002/ardp.v348.6
-
[1]
-
表 1 目标化合物对4种受试细胞的体外抑制活性[IC50/(μmol•L-1)]a
Table 1. Inhibitory activity [IC50/(μmol•L-1)] of target compounds against four tested cells growth in vitro
Compound SW480 A549 A431 NCI-H1975 Lapatinib 12.58±1.35 14.90±1.21 4.80±0.71 12.68±0.73 Isatin >100 >100 >100 >100 4a 14.86±1.08 10.15±3.91 1.93±1.06 11.54±1.29 4b >100 >100 0.64±0.07 12.85±1.85 4c 8.44±4.64 22.72±10.53 1.31±0.50 5.77±1.43 4d >100 >100 33.67±6.87 32.67±0.50 4e >100 >100 105.90±40.50 >100 4f >100 >100 >100 >100 4g 15.43±3.54 >100 1.06±0.40 16.70±0.36 4h 89.41±15.68 >100 1.84±0.84 143.10±22.91 4i >100 >100 >100 >100 a IC50 values are shown as the mean±SD (μmol•L-1) from three independent experiments. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1589
- HTML全文浏览量: 216




 下载:
下载:


 下载:
下载:

