江西省科学院应用化学研究所 南昌 330096
2016-04-14 收稿, 2016-08-15 接受
基金项目: 国家自然科学基金项目(31260400)和江西省科学院对外合作重点项目(2013H005)资助
Papain-Catalyzed Asymmetric Aldol Reactions of Heterocyclic Ketoneswith Aldehydes
Institute of Applied Chemistry, Jiangxi Academy of Sciences, Nanchang 330096
生物催化由于具有高选择性、反应条件温和和潜在的可再生性,因此被认为是一种有效且绿色的现代有机合成手段[1, 2]。酶催化多样性主要是指酶催化不同的反应类型,经历不同的转化状态,这项发现近年来吸引了大量的关注[3, 4],已成为生物有机催化研究的热点。系统地研究已知酶的非天然活性具有重要意义,它能为有机合成提供新的手段。近几年,大量文献报道了酶多功能性催化的Aldol反应、Mannich反应、Micheal加成反应、Markovnikov加成反应[5-7]、Henry反应[8, 9]和串联反应等反应类型。
碳碳键的构建是有机合成的基础,而Aldol反应被认为是构建碳碳键的重要方法之一。因此,在合成中控制Aldol反应产物的相对和绝对构型就显得尤为重要[10]。有机小分子和金属有机化合物催化的不对称Aldol反应已经被大量报道。其中,Aldol反应的受体已经得到了很好的研究,然而,对给体适用范围的研究却很有限,只有Chen等[11]和Pihko等[12]报道的不对称杂环酮的Aldol反应取得了很好的效果。但是,有机小分子和金属有机化合物催化剂都有不足,如催化剂合成繁琐、对环境有害、不可再生和有毒等。然而生物催化剂恰恰能弥补这些缺陷。2008年,余孝其等[13]首次报道了脂肪酶催化的不对称Aldol反应。何延红等[14]报道了猪胰脂肪酶催化的杂环酮的不对称Aldol反应。但是,更多高效且具空间选择性催化潜能的酶仍亟待被发掘。
木瓜蛋白酶(Papain)是一种有待于开发利用的半胱氨酸蛋白酶,通常用于多肽合成、生产抗体的Fab片段等领域,由于对某些组织损伤很小,所以也用于细胞裂解。木瓜蛋白酶多功能性催化杂环酮与醛的直接不对称Aldol反应目前还没有报道。本文通过对反应溶剂、含水量、温度、投料比和酶载量等影响因素的筛选,优化了反应条件,并在最优条件下催化合成了一系列的Aldol缩合产物,获得了中等的产率和较好的立体选择性。
木瓜蛋白酶(≥3unit/mg)购于上海晶纯生化科技股份有限公司。N-叔丁氧羰基-4-哌啶酮、吡喃酮、噻喃酮和各类芳香醛及四氢呋喃、N,N-二甲基甲酰胺(DMF)、乙腈、二甲亚砜、异丙醇、1,4-二氧六环、二甲苯均为市售分析纯试剂,水为去离子水。
SHB-Ⅲ双A循环水式多用真空泵;ZF-2I型三用紫外分析仪;RE52CS-1型旋转蒸发仪;ABL-224型分析天平;DLSB-5/10型低温冷却液循环泵;DF-101S型集热式恒温加热磁力搅拌器;DHJF-4002型低温恒温搅拌反应浴;DHG-9076A型电热恒温鼓风干燥箱;KQ250DE型超声波清洗器。薄层色谱法(GF254硅胶板)监测反应进程;快速柱色谱法采用100-200目硅胶加压柱。采用Bruker AV-300型核磁共振谱仪测定1H NMR和13C NMR;采用手性HPLC法测定产物的对映体过量值(ee)和非对映体过量值(dr),手性HPLC采用AD-H、OD-H、AS-H和OJ-H手性柱。
木瓜蛋白酶催化合成一系列杂环酮Aldol反应产物的一般步骤:在25mL圆底烧瓶中加入0.25mmol醛、0.50mmol酮、0.8mL乙腈、0.2mL去离子水和75mg木瓜蛋白酶,在30℃下搅拌反应。反应完毕后,过滤,滤饼用二氯甲烷洗涤,合并洗液与滤液,加入适量水,用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥,减压蒸馏除去溶剂得粗产物,粗产物经快速柱色谱法纯化,即得目标产物。
碱催化合成杂环酮Aldol缩合外消旋产物的一般步骤:取0.5mmol醛、0.5mmol酮放入25mL圆底烧瓶中,然后加入2.0mL无水乙醇,逐滴加入1.0mL饱和碳酸氢钠溶液,室温下搅拌反应,TLC监测至反应完成。用二氯甲烷稀释反应液,加入无水硫酸钠干燥反应体系,抽虑,减压蒸馏除去溶剂得粗产物,粗产物经快速柱色谱法纯化,即得目标消旋体产物。
化合物1a:ee值通过HPLC用AD-H手性柱测得(测试条件为,流动相:正己烷/异丙醇=94/6,流速1.0mL/min,检测波长254nm),反式的主要对映体出峰时间为59.0min,次要对映体出峰时间为65.4min。1H NMR(300MHz,CDCl3) δ:8.24 (d,J=7.8Hz,2H),7.54 (t,J=8.4Hz,2H),4.97 (dd,J=7.6、2.9Hz,1H),4.18 (m,1H),3.81 (d,J=1.6Hz,1H),3.81-3.60 (m,1H),3.27 (br,1H),2.93 (t,J=11.7Hz,1H),2.76 (br,1H),2.60-2.50 (m,2H),1.39 (br,s,9H);13C NMR(75MHz,CDCl3)δ:210.4,154.4,147.7,147.4,127.6,123.6,80.9,71.8,56.3,45.6,43.6,41.5,28.1 (3C)。
化合物1b:ee值通过HPLC用AD-H手性柱测得(测试条件为,流动相:正己烷/异丙醇=96/4,流速1.0mL/min,检测波长254nm),反式的主要对映体出峰时间为40.9min,次要对映体出峰时间为35.1min。1H NMR (300MHz,CDCl3) δ:8.25 (d,J=7.74Hz,1H),8.16 (d,J=11.5Hz,1H),7.70 (t,J=6.9Hz,1H),7.55 (t,J=7.5Hz,1H),4.96 (d,J=8.0Hz,1H),4.30-4.10 (m,1H),3.90-3.80 (m,1H),3.80-3.69 (m,1H),3.27 (br,1H),2.96-2.77 (m,2H),2.55-2.44 (m,2H),1.38 (br,s,9H);13C NMR(75MHz,CDCl3) δ:210.5,154.1,148.3,142.5 132.8,129.5,123.2,121.8,80.9,71.8,56.4,43.7,42.8,41.5,28.1(3C)。
化合物1c:ee值通过HPLC用OJ-H手性柱测得(测试条件为,流动相:正己烷/异丙醇=95/5,流速1.0mL/min,检测波长220nm),反式的主要对映体出峰时间为28.8min,次要对映体出峰时间为44.2 min。1H NMR (300MHz,CDCl3) δ:7.48 (d,J=7.9Hz,2H),7.22 (d,J=8.3Hz,2H),4.79 (d,J=6.0Hz,1H),4.11 (br s,1H),3.87-3.70 (m,2H),3.24 (br s,1H),2.83 (t,J=11.7Hz,1H),2.67 (br s,1H),2.48 (m,1H),1.37 (br s,9H);13C NMR(75MHz,CDCl3)δ:211.0,154.2,139.0,131.7,128.4,122.2,80.9,80.8,72.0,44.0,43.5,41.4,28.2 (3C)。
化合物1d:ee值通过HPLC用AD-H手性柱测得(测试条件为,流动相:正己烷/异丙醇=96/4,流速1.0mL/min,检测波长220nm),反式的主要对映体出峰时间为35.1min,次要对映体出峰时间为28.0min。1H NMR (300MHz,CDCl3) δ:7.51 (d,J=8.1Hz,1H),7.46-7.38 (m,2H),7.25 (d,J=5.8Hz,1H),4.80 (d,J=8.3Hz,1H),4.13 (br s,1H),3.92-3.80 (m,9H),3.80-3.68 (m,1H),3.27 (br s,1H),2.92-2.69 (m,2H),2.51-2.42 (m,2H),1.48 (br,s,1H);13C NMR (75MHz,CDCl3) δ:210.8,154.2,142.5,131.4,130.1,129.9,125.4,122.7,80.7,71.9,56.6,46.1,43.6,41.3,28.1 (3C)。
化合物1e:ee值通过HPLC用AD-H手性柱测得(测试条件为,流动相:正己烷/异丙醇=85/15,流速1.0mL/min,检测波长254nm),反式的主要对映体出峰时间为37.2min,次要对映体出峰时间为31.4min。1H NMR (300MHz,CDCl3) δ:8.23 (d,J=7.9Hz,2H),7.53 (d,J=7.9Hz,2H),5.00(d,J =8.0Hz,1H),4.28-4.21 (m,1H),3.90 (d,J=6.5Hz,1H),3.80-3.72 (m,2H),3.46 (t,J=10Hz,1H),2.94-2.86 (m,1H),2.78-2.63 (m,1H),2.57-2.45 (m,1H);13C NMR (75MHz,CDCl3) δ:209.2,148.0,147.3,127.4,123.8,71.2,69.7,68.3,57.5,42.8。
化合物1f:ee值通过HPLC用OD-H手性柱测得(测试条件为,流动相:正己烷/异丙醇=93/7,流速1.0mL/min,检测波长254nm),反式的主要对映体出峰时间为36.0min,次要对映体出峰时间为48.0min。1H NMR (300MHz,CDCl3) δ:8.22-8.12 (m,2H),7.67 (d,J=7.2Hz,1H),7.54 (t,J=7.0Hz,1H),4.99 (d,J=8.0Hz,1H),4.27-4.21 (m,1H),3.80-3.71 (m,1H),3.93-3.70 (m,2H),3.46 (t,J=10.6Hz,1H),2.96-2.94 (m,1H),2.78-2.64 (m,1H),2.57-2.45 (m,1H);13C NMR (75MHz,CDCl3) δ:209.3,148.4,142.4,132.7,129.6,123.2,121.6,71.3,69.7,57.5,42.8。
化合物1g:ee值通过HPLC用AD-H手性柱测试得到(测试条件为,流动相:正己烷/异丙醇=90/10,流速1.0mL/min,检测波长254nm),反式的主要对映体出峰时间为27.3min,次要对映体出峰时间为29.6min。1H NMR (300MHz,CDCl3) δ:7.93 (dd,J=8.1、8.1Hz,1H),7.83-7.77 (m,1H),7.69-7.63 (m,1H),7.45 (t,J=7.6Hz,1H),5.48 (d,J=6.5Hz,1H),4.28-4.18 (m,1H),4.10-3.93 (m,1H),3.93-3.85 (m,1H),3.83-3.67 (m,2H),3.20-3.02 (m,1H),2.79-2.62 (m,1H),2.54-2.41 (m,1H);13C NMR (75MHz,CDCl3) δ:209.4,148.1,136.0,133.4,128.8,128.3,124.3,70.4,68.3,67.3,57.8,43.2。
化合物1h:ee值是通过HPLC用OJ-H手性柱测得(测试条件为,流动相:正己烷/异丙醇=80/20,流速1.0mL/min,检测波长254nm),反式的主要对映体出峰时间为38.6min,次要对映体出峰时间为48.4min。1H NMR (300MHz,CDCl3) δ:8.25-8.10 (m,2H),7.2 (t,J=8.0Hz,1H),7.59-7.56 (m,1H),5.05 (d,J=7.7Hz,1H),3.73 (s,1H),3.10-2.97 (m,3H),2.89-2.81 (m,2H),2.73-2.64 (m,1H),2.59-2.42 (m,1H);13C NMR (75MHz,CDCl3) δ:211.2,148.4,142.6,129.5,129.5,123.1,121.9,73.1,59.4,44.7,32.7,30.7。
化合物1i:ee值通过HPLC用OD-H手性柱测得(测试条件为,流动相:正己烷/异丙醇=92/8,流速1.0mL/min,检测波长254nm),反式的主要对映体出峰时间为32.4min,次要对映体出峰时间为45.7min。1H NMR (300MHz,CDCl3) δ:7.65 (d,J=7.4Hz,2H),7.46 (t,J=7.2Hz,2H),5.02 (d,J=7.8Hz,1H),3.69 (br,s,1H),3.07-2.95 (m,3H),2.82-2.79 (m,2H),2.68-2.52 (m,2H);13C NMR (75MHz,CDCl3)δ:209.1,145.6,132.4,127.4,118.5,112.0,71.4,69.7,68.3,57.7,42.7。
以N-叔丁氧羰基-4-哌啶酮与4-硝基苯甲醛的Aldol反应为模板,进行反应条件的探索研究。反应媒介是影响反应进行的重要因素,因此考察了一系列溶剂对反应进程的作用(表 1)。相对于水介质中酶催化的优点,在非水体系中酶同样表现出令人惊奇的性质,如提高了酶的稳定性、可以催化非天然反应等。从表中可以清楚地看出,反应溶剂对木瓜蛋白酶的催化活性影响很大,其中,在亲水性溶剂四氢呋喃、乙腈、二甲亚砜和DMF中表现出较好的催化活性。
表 1
Table 1
表 1(Table 1)
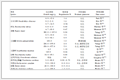
表 1 木瓜蛋白酶催化的Aldol反应溶剂的筛选以及控制实验a
Table 1 Screen of solvents of papain-catalyzed direct asymmetric aldol reaction and control experiments
|
序号 | 溶剂或催化剂 | 反应时间/h | 产率/%b | de(anti:syn)c | %ee(anti)d |
|
1 | 四氢呋喃 | 120 | 32 | 31:69 | 29 | |
2 | 异丙醚 | 144 | trace | — | — | |
3 | DMF | 120 | 23 | 30:60 | 3 | |
4 | 乙腈 | 120 | 34 | 41:59 | 58 | |
5 | 二甲亚砜 | 120 | 26 | 37:63 | 5 | |
6 | 异丙醇 | 132 | 11 | 32:68 | 29 | |
7 | 1,4-二氧六环 | 144 | trace | — | — | |
8 | 氯仿 | 144 | trace | — | — | |
9 | 无酶 | 120 | nr | — | — | |
10 | 100 ℃下尿素处理24h的酶e | 120 | 5 | 36:64 | 1 | |
11 | MMTS 25℃下处理24h的酶f | 120 | trace | — | — | |
12 | 牛血清白蛋白 | 120 | 44 | 37:63 | 0 | |
13 | 碳酸氢钠 | 48 | 45 | 31:69 | 0 |
| a 酮(0.25mmol)、4-硝基苯甲醛(0.50mmol)、酶(50mg)在25℃下1mL混合溶剂(H2O/(H2O+CH3CN)=1:10,体积比)中反应120h。b柱层析之后得到分离产率。c手性HPLC法确定。d手性HPLC法确定。e提前将酶在100℃下用尿素处理24h。f提前将酶在25℃下用50mg甲基甲硫甲基亚砜处理24h。 |
|
表 1 木瓜蛋白酶催化的Aldol反应溶剂的筛选以及控制实验a
Table 1 Screen of solvents of papain-catalyzed direct asymmetric aldol reaction and control experiments
|
另外,为了验证木瓜蛋白酶对该Aldol反应的催化作用,我们设计了一系列控制实验。从表 1可以看出,在不加酶的情况下,该Aldol反应几乎不能进行(表 1,序号9)。而非酶的牛血清蛋白(BSA)和碳酸氢钠催化时,分别得到了44%和45%的消旋体产物,证明非酶蛋白能在一定程度上催化该Aldol反应,但没有立体选择性(ee值为0)。用尿素处理过的木瓜蛋白酶催化反应仍然得到了5%的产物,但没有立体选择性,说明酶的三维结构对产物的立体选择性是必不可少的。此外,若用丝氨酸蛋白酶抑制剂甲基甲硫甲基亚砜(MMTS)处理酶,只在薄层色谱板上观察到了痕量的产物(表 1,序号11),这就排除了酶的氨基酸残基催化的可能性,进一步证明了木瓜蛋白酶的活性位点对催化多功能性起到了决定作用。以上实验结果充分说明该不对称直接Aldol反应是发生在木瓜蛋白酶催化活性位点的特殊结构上。
水通常被认为在酶结构中起着润滑剂的作用,它可以增加酶结构的韧性,体系中适宜的水可以提高酶的稳定性与催化活性。因此,确定反应体系中水的最佳含量具有重要意义。将反应在不同比例[H2O/(H2O+CH3CN)]的混合反应溶剂中进行,结果见表 2。从表中可以看出,随着含水量从0增加到20%,产率和ee值不断增加(表 2,序号1-5)。水含量为20%时,产率和ee值达到最佳,此时产率为34%。当水含量超过20%,产率和ee值都开始降低。因此,选择含水量20%来进行接下来的研究。
表 2
Table 2
表 2(Table 2)

表 2 含水量对木瓜蛋白酶催化Aldol反应的影响
Table 2 Effect of water content on the aldol reactiona
|
序号 | 含水量/% | 产率/% | de(anti:syn) | % ee (anti)
|
|
1 | 0 | 21 | 33:67 | 43 | |
2 | 5 | 25 | 37:63 | 45 | |
3 | 10 | 28 | 39:61 | 50 | |
4 | 15 | 32 | 41:59 | 53 | |
5 | 20 | 34 | 44:56 | 56 | |
6 | 25 | 30 | 43:57 | 48 | |
7 | 30 | 27 | 41:59 | 41 |
| a酮(0.25mmol)、4-硝基苯甲醛(0.50mmol)、酶(50mg)在25℃下1mL混合溶剂(H2O/(H2O+CH3CN)=(0-3)/10,体积比)中反应120h。 |
|
表 2 含水量对木瓜蛋白酶催化Aldol反应的影响
Table 2 Effect of water content on the aldol reactiona
|
我们还对该Aldol反应底物的投料比、酶载量和温度对反应的影响情况进行了探讨。当4-硝基苯甲醛与酮的比为3:1时,得到了最高的产率和较高的ee值(表 3,序号4);但是当投料比为2:1时产率也相差不大,ee值最高,dr值也较投料比为3:1时好,从原子经济性和反应结果的角度考虑,选择底物摩尔比2:1为优选投料比。当酶载量从25mg增加到150mg时,产率持续升高(表 4,序号1-5),但是酶载量为75mg与150mg时产率相差不大,而酶量为75mg时产物的ee值和dr值最高,因此本反应的酶量优选为75mg。反应温度对酶的活性影响也很大,如表 5所示,当反应温度为35℃时,产率最高(表 5,序号1-6),而反应温度为30℃时ee值最好。因此本反应的温度优选为30℃。
表 3
Table 3
表 3(Table 3)

表 3 投料比对木瓜蛋白酶催化Aldol反应的影响a
Table 3 Effect of the molar ratio of substrates on the aldol reaction
|
序号 | 投料比b | 产率/% | de(anti:syn) | % ee (anti)
|
|
1 | 1:2 | 22 | 34:66 | 54 | |
2 | 1:1 | 28 | 37:63 | 55 | |
3 | 2:1 | 32 | 42:58 | 58 | |
4 | 3:1 | 33 | 41:59 | 56 | |
5 | 4:1 | 30 | 41:59 | 53 | |
6 | 5:1 | 26 | 40:60 | 50 |
| a酮(0.25 mmol)、4-硝基苯甲醛(0.125-1.25 mmol)、酶(50mg)在25℃下1mL混合溶剂(H2O/(H2O+CH3CN)=2:10,体积比)中反应120h。b4-硝基苯甲醛比酮。 |
|
表 3 投料比对木瓜蛋白酶催化Aldol反应的影响a
Table 3 Effect of the molar ratio of substrates on the aldol reaction
|
表 4
Table 4
表 4(Table 4)

表 4 酶载量对木瓜蛋白酶催化Aldol反应的影响a
Table 4 Effect of the enzyme loading on the aldol reaction
|
序号 | 酶载量/ mg | 产率/% | de(anti:syn) | % ee (anti)
|
|
1 | 25 | 23 | 42:58 | 43 | |
2 | 50 | 29 | 40:60 | 54 | |
3 | 75 | 38 | 41:59 | 61 | |
4 | 100 | 40 | 38:62 | 56 | |
5 | 150 | 41 | 39:61 | 55 | |
6 | 200 | 38 | 40:60 | 45 |
| a酮(0.25 mmol)、4-硝基苯甲醛(0.50mmol)、酶(25-200mg)在25℃下1mL混合溶剂(H2O/(H2O+CH3CN)=2:10,体积比)中反应120h。 |
|
表 4 酶载量对木瓜蛋白酶催化Aldol反应的影响a
Table 4 Effect of the enzyme loading on the aldol reaction
|
表 5
Table 5
表 5(Table 5)

表 5 温度对木瓜蛋白酶催化Aldol反应的影响a
Table 5 Effect of the temperature on the aldol reaction
|
序号 | 温度/℃ | 产率/% | de(anti:syn) | % ee (anti)
|
|
1 | 15 | 20 | 59:41 | 56 | |
2 | 20 | 24 | 40:60 | 58 | |
3 | 25 | 30 | 42:58 | 58 | |
4 | 30 | 34 | 41:59 | 60 | |
5 | 35 | 36 | 41:59 | 55 | |
6 | 40 | 34 | 39:61 | 43 | |
7 | 45 | 31 | 38:61 | 40 |
| a酮(0.25 mmol)、4-硝基苯甲醛(0.50mmol)、酶(75mg)在15-40℃下1mL混合溶剂(H2O/(H2O+CH3CN)=2:10,体积比)中反应120h。 |
|
表 5 温度对木瓜蛋白酶催化Aldol反应的影响a
Table 5 Effect of the temperature on the aldol reaction
|
图 1显示了反应时间对反应进程的影响。第120h之前,产率持续随反应时间延长而增加,之后,增加不再明显;ee值随反应时间的变化不大,且反应时间过长有下降趋势。因此,反应时间优选为120h。
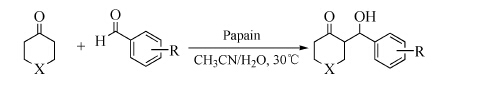
在确定的优化反应条件下探究了该反应体系的底物适应范围,将各种酮和芳香醛进行Aldol缩合反应,结果见表 6。
表 6
Table 6
表 6(Table 6)

表 6 木瓜蛋白酶催化的杂环酮与芳香醛Aldol反应底物的拓展情况a
Table 6 Substrate scope of Papain-catalyzed asymmetric Aldol reactions of heterocyclic ketones with aldehydes
 |
|
序号 | R | 产物 | X | 时间/h | 产率 (%)b | de(anti:syn)c | %ee(anti)d |
|
1 | 4-NO2 | 1a | NBoc | 120 | 37 | 61:39 | 61 | |
2 | 3-NO2 | 1b | NBoc | 120 | 29 | 51:49 | 59 | |
3 | 4-Br | 1c | NBoc | 120 | 35 | 76:24 | 68 | |
4 | 3-Br | 1d | NBoc | 120 | 25 | 48:52 | 65 | |
5 | 4-NO2 | 1e | O | 120 | 31 | 53:47 | 25 | |
6 | 3-NO2 | 1f | O | 120 | 28 | 37:63 | 50 | |
7 | 2-NO2 | 1g | O | 144 | 21 | 49:51 | 63 | |
8 | 3-NO2 | 1h | S | 120 | 26 | 87:13 | 78 | |
9 | 4-CN | 1i | S | 144 | 23 | 55:45 | 61 |
| a酮 (0.25mmol)、芳香醛(0.50mmol)、酶(75mg)在30℃下1mL混合溶剂(H2O/(H2O+CH3CN)=2:10,体积比)中反应。b柱层析之后得到的分离产率。c手性HPLC法确定。d手性HPLC法确定。 |
|
表 6 木瓜蛋白酶催化的杂环酮与芳香醛Aldol反应底物的拓展情况a
Table 6 Substrate scope of Papain-catalyzed asymmetric Aldol reactions of heterocyclic ketones with aldehydes
|
从表 6中可以看出,木瓜蛋白酶催化杂环酮与芳香醛的Aldol反应得到了较好的产率(21%-37%),同时发现,芳香醛苯环上取代基的空间位阻和电子效应对反应结果有很大影响。具有最大位阻的2-硝基苯甲醛反应得到的产物具有最佳ee值,但是产率随着位阻的增大迅速降低。例如,噻喃酮和哌啶酮与具有最大位阻的2-硝基苯甲醛不反应;吡喃酮与2-硝基苯甲醛的反应随着苯环位阻增大,产率下降,而ee值却有提高(表 6,序号7)。另外,芳香醛苯环上连有吸电子取代基时反应较好;而芳香醛苯环上连有供电子取代基时,只得到痕量产物。原因可能是由于吸电子取代基增加了羰基碳的正电性,使其更容易受到酮α位碳上负电荷的进攻,由此促进了反应的进行。
我们首次发现木瓜蛋白酶能够作为不对称杂环酮Aldol反应的催化剂,其具有催化活性较好、对映选择性较高、经济性好、环保等优点。虽然比猪胰脂肪酶催化该反应时获得的手性选择性(87%的ee值)低,但本文的工作拓宽了木瓜蛋白酶的应用范围,为不对称杂环酮Aldol反应提供了一种新的生物酶催化剂,在生物有机化学领域具有广阔的应用前景。
 2016,
Vol. 79
2016,
Vol. 79 Issue (11): 1052-1057
Issue (11): 1052-1057 2016,
Vol. 79
2016,
Vol. 79 Issue (11): 1052-1057
Issue (11): 1052-1057