1 昆明理工大学冶金与能源工程学院 昆明 650093;
2 昆明理工恒达科技股份有限公司 昆明 650106
2015-09-15 收稿
基金项目: 国家自然科学基金项目(51504111)和云南省自然科学基金项目(20113FA012和20113FB022)资助
Study on the Polymerization Process of Polyaniline in Acetone/Water System
1 Faculty of Metallurgical and Energy Engineering, Kunming University of Science and Technology, Kunming 650093;
2 Kunming Hendera Science and Teachnology Co. Ltd, Kunming 650093
聚苯胺(PAn)的物理化学性能强烈依赖于合成和掺杂工艺,不同条件下得到的产物性能有所差异。即使同一条件下不同的研究者往往得到不同的结果,因此PAn在掺杂态下的加工性依然是一大难题,限制了PAn的应用。
PAn的化学聚合一般在酸性水溶液中用氧化剂使An氧化聚合。聚合反应一般要求在较低温度和氮气保护下进行,所得产物一般为墨绿色粉末,电导率为1~10 S/cm,产率为30%~70%[1-3]。在聚合反应过程中,氧化剂引发An聚合,质子酸掺杂使PAn分子链间发生氧化还原反应而生成苯醌阳离子自由基,部分削弱了共轭键,使电荷能在分子链上振动而导电[4]。由于An的聚合是一种阳离子自由基氧化沉淀聚合反应,聚合首先生成PAn低聚物,从而引发反应,但在链增长阶段反应发生自加速而迅速进行;整个过程难以控制,导致分子量分布变宽,缺陷增多,严重影响了产物的导电性。在水体系下,PAn的电位稳定窗口比较低,并且水溶液环境可以促进PAn部分分解的发生,会很大程度影响PAn材料的应用。有机体系虽没有这些问题,但是成本比较高。而且,在水体系或有机溶剂体系合成的PAn导电性和稳定性均不佳[5, 6]。因此,研究有机/水双组分体系合成PAn是人们研究的热点。本文尝试用丙酮和水双组分体系,通过调节丙酮含量来控制聚合速度和氧化程度,以达到控制PAn分子量、提高PAn导电性和稳定性的目的。
掺杂态PAn的合成条件参见参考文献[7],但是把水体系调整为丙酮/水双组分均相体系,具体如下:
(1) 将1.5mol/L H2SO4、丙酮和水配成250mL混合溶液,取150mL 混合溶液和0.25mol An单体混合并超声分散30min后,得到An盐溶液;并将An盐溶液转入三颈瓶中待用;
(2) 取一定量0.5mol 过硫酸铵溶于剩余H2SO4、丙酮和水混合溶液。在磁力搅拌下,再将过硫酸铵混合溶液缓慢加入三口瓶的反应体系中,滴加时间在1h左右。整个反应持续数小时,实验温度用冰水溶液控制在5~15℃;
(3) 反应结束后,静止24h后用G4砂芯漏斗过滤,沉淀,洗涤数次,60℃真空干燥备用,所得墨绿色粉末即为掺杂态PAn。
为了确定产率,将上述所得PAn浸泡在1mol/L氨水溶液中,超声15min脱掺杂,过滤,洗涤,60℃真空干燥,得到粉末状本征态PAn。
由于An聚合是氧化聚合,可以通过测量开路电压监视反应过程。实验中氧化剂需一次性加入,V丙酮/V水的比值为0.2,其他条件不变。将铂电极和甘汞电极插入反应液,用欧姆表测量聚合过程的开路电压,并在不同反应时间和电位下分别取出中间产物,迅速用大量水冲洗,60℃下真空干燥,从而获得反应过程中间分离体。
根据文献[8],合成的本征态PAn中称取0.8g用50mL四氢呋喃(THF)搅拌溶解24h,过滤,收集深蓝色滤液,对剩余的PAn粉末用30mL THF搅拌24h,过滤,收集得浅蓝色滤液,用20mL THF将滤渣洗涤至无色。将所有的滤液收集到烧杯中,然后挥发至干,称量,得到PAn的质量为0.2g。再将此0.2g PAn用N-甲基吡咯烷酮(NMP)溶解,配成已知浓度的溶液,并加入少量的电解质LiCl以消除溶剂NMP和PAn的氢键作用。采用乌氏粘度计测定其特性粘度[η]。根据Mark-Houwink公式[η]=KMα (其中,K=1.4×10-4,α=0.93,M为粘均分子量),可以分别计算出THF溶解的PAn的粘均分子量和NMP溶解的PAn的粘均分子量。
电导率是选择评判导电材料性能的一个很重要的参数,可以通过测量样品电阻而算得。将干燥后的PAn的粉末研磨过筛(60目),在25±2℃下,采用SD2002型数字欧姆表测定,然后根据电导率=1/电阻率进行换算。红外光谱采用KBr压片法,美国PK6000型傅里叶红外光谱仪,分辨率4cm-1,扫描范围4000~400 cm-1。
研究丙酮/水双组分体系中丙酮的含量对PAn的产率和电导率的影响,结果见图 1所示。由图可知,随着V丙酮/V水从0上升到0.35,PAn的电导率和产率均是先增加后减小。当V丙酮/V水为0.2时,PAn的产率和电导率均最大,并且此比值两侧呈现较明显的变化,说明此时获得PAn的各项性能指标较好。由PAn的粘度计算的产物的粘均分子量结果如表 1所示。
表 1
Table 1
表 1(Table 1)
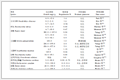
表 1 不同比例的丙酮/水体系中合成的样品溶解在THF/NMP和NMP中的粘均分子量
Table 1 The molecular weight in THF/NMP and NMP of products synthesized in different ratio of aceton/water
|
V丙酮/V水 | 溶剂组分 | 溶解量/% | [η]/(dL/g) | 粘均分子量(M)
|
| 0.0 |
同时溶于THF和 NMP | 63.5 | 0.032 | 344 |
|
仅溶于NMP | 34.5 | 0.158 | 1698 |
| 0.1 |
同时溶于THF和 NMP | 32.7 | 0.045 | 484 |
|
仅溶于NMP | 66.3 | 0.378 | 4064 |
| 0.2 |
同时溶于THF和 NMP | 10.8 | 0. 051 | 548 |
|
仅溶于NMP | 89.2 | 0.505 | 5429 |
| 0.25 |
同时溶于THF和 NMP | 15.7 | 0.069 | 742 |
|
仅溶于NMP | 84.3 | 0.513 | 5515 |
| 0.3 | 同时溶于THF和 NMP | 20.6 | 0.072 | 774 |
|
仅溶于NMP | 79.4 | 0.558 | 5998 |
|
表 1 不同比例的丙酮/水体系中合成的样品溶解在THF/NMP和NMP中的粘均分子量
Table 1 The molecular weight in THF/NMP and NMP of products synthesized in different ratio of aceton/water
|
由表 1可知,随着混合溶剂中丙酮比例的加大,溶解于THF和NMP(先溶于THF,后溶于NMP)中的PAn的质量百分比先减小后增大,仅溶解于NMP中的则是先增大后减小;而粘度和粘均分子量都是逐渐增大。当V丙酮/V水比为0.2时,产物仅有89.2%溶解于NMP,其粘均分子量为5429,说明此时PAn中大分子数量多,小分子数量较少。另外,除去可溶于THF和NMP的粉末外,还有极少量不溶性粉末,这可能是由于在An氧化聚合过程中,一些副反应导致的副产物和交联产物。
取少量粉末放入激光粒度分析仪中,分散介质为无水乙醇,超声分散5min后,不同比例的混合溶剂体系中的PAn的粒径分布如图 2所示。从图可以看出,丙酮比例的加大使得所得PAn的粒度分布均匀,且平均粒径较小;但丙酮比例过大,又会使得产物的粒度急剧增大。因此,V丙酮/V水比为0.2时,对控制PAn的粒度和分子量最有利。
为研究丙酮对An聚合过程的调节作用,通过对水体系和V丙酮/V水=0.2的混合体系聚合过程的开路电压和聚合温度进行实时跟踪,结果如图 3所示。由图 3可见,氧化剂加入后,开路电压随时间先迅速上升,但此时反应体系的颜色、温度无明显变化;当体系出现淡蓝色(即A或A′点),预示着聚合反应开始,这时体系温度没有明显升高;随着聚合反应进行,体系出现蓝色沉淀,并越来越多,反应温度开始升高(B或B′点),且升温速度越来越快,说明聚合反应过程放出大量的热,同时发生自加速反应。反应进行到C或C′点时,电压开始明显下降,升温速度减慢,并很快达到最高(D或D′点),蓝色沉淀变为蓝绿色,同时开路电压和溶液温度都迅速下降,PAn变为绿色沉淀。因此,An在丙酮/水体系中的聚合过程与在水体系中的相同,均可分为3个阶段:①加入氧化剂后的诱导期及链引发期,由于诱导和链引发无法观察区分,因此很难确定具体链的引发反应时间;②链增长期(A~D),反应越来越快,但沉淀基本保持蓝色,在聚合后期,氧化剂几乎消耗殆尽,沉淀由蓝色向绿色转变(C~D);③链终止期(D~结束),PAn由蓝绿色完全转变为翠绿色,即PAn的中间氧化态生成。
实验中还发现,在丙酮/水双组份体系中,聚合过程维持高电位的时间比在纯水体系中聚合有很大延长,聚合的链增长时间(tA-tD)和自加速反应时间(tB-tD)均有延长。显然,链增长时间和自加速反应时间的延长对改善PAn结构是有利的。由于链增长过程中链引发仍然存在,相对于链引发速度,链增长速度的降低造成链增长活性点增多,最终导致PAn分子量升高。同时,较低的聚合速度有利于生成具有规整结构的PAn,使聚合物具有更好的溶解性。
由前面的分析得出,在链增长期,聚合溶液及生成的沉淀为蓝色。因为有丙酮的加入延长了链增长时间,使得有足够的时间对聚合中间体进行分离和分析。图 4中的FT IR谱线1、2、3、4分别为图 3中B、C、D、E点取出的产物的FT IR图谱。
表 2
Table 2
表 2(Table 2)

表 2 不同反应阶段醌环和苯环的强度比
Table 2 IQ/IB at different reaction stages
|
样品 | 取样时间 | IQ | IB | IQ/IB |
|
1 | 图 3B点 | 2058.2 | 905.0 | 2.27 | |
2 | 图 3C点 | 1833.4 | 1170.0 | 1.57 | |
3 | 图 3D点 | 1547.5 | 1258.0 | 1.23 | |
4 | 图 3E点 | 1259.0 | 1298.3 | 0.97 |
| aQ指醌环单元,B指苯环单元 |
|
表 2 不同反应阶段醌环和苯环的强度比
Table 2 IQ/IB at different reaction stages
|
从图 4可以看出,不同反应阶段所得样品的FT IR在总体上是相似的,醌环(Q)骨架振动在1565cm-1左右,苯环(B)骨架振动在1475cm-1左右,N-B-N伸缩振动在1297cm-1左右,N=Q=N结构模式振动在1120cm-1左右,1,4取代苯环C-H平面外弯曲振动在800cm-1左右,说明An是以头-尾连接形式聚合的。但各图
谱也略有不同,特别是醌环骨架振动与苯环骨架振动峰的相对强度呈现差别,即随着聚合时间的延长,醌环骨架振动峰强度逐渐减弱,而苯环骨架振动峰强度逐渐增强。根据醌环的骨架振动对应的吸收峰和苯环的骨架振动对应的吸收峰的强度比值(IQ/IB)可以定性判断氧化程度[9],结果如表 2所示。
在中间氧化态,醌环骨架振动所对应的吸收峰稍弱于苯环骨架振动所对应的吸收峰,即IQ/IB值接近于1;在完全还原态,没有出现醌环骨架振动对应的吸收峰;而在较高氧化态,醌环骨架振动所对应的吸收峰强于苯环骨架振动所对应的吸收峰,IQ/IB值大于1。由表 2可知,在B、C点(图 3)时IQ/IB值大于1,PAn处于较高的氧化态。随着聚合进行到E点(图 3)时IQ/IB值为0.97,PAn处于中间氧化态。由此可以推断:在An聚合的链增长期,PAn以较高氧化态存在;在An聚合的链终止期,PAn由较高氧化态逐渐转变为中间氧化态。
在实验中观察到,温度迅速升高总是在沉淀大量出现以后;另外,由于PAn齐聚物或聚合物的氧化电位比An低,可以认为An聚合过程的自加速实际是因为大量生成易反应的An齐聚物所导致。由此可以推测聚合机理如下:
在图 3中A点之前电压急剧升高,由于An在氧化引发剂的作用下氧化形成阳离子自由基(见图式1)。此过程称为诱导期和链引发期,由于诱导期和链引发期无法观察区分,因此很难确定具体链引发的反应时间。
酸性介质中An阳离子自由基可发生1,4-聚合和邻位加成,生成An二聚体(PADPA),而且此时主要影响An单体的链接方式,如头-头、头-尾和尾-尾连接(图式2)等[10, 11]。图 4中1,4取代苯环C-H平面外弯曲振动在800cm-1左右出现比较强的特征峰,可以说明An是以头-尾连接形式聚合的。
链增长过程从图 3中A点开始,每增长2个环,需要由氧化剂提供6个电子,阳离子自由基聚合生成二聚体,部分二聚体失电子形成新阳离子自由基(图式3)。新阳离子自由基和An阳离子聚合生成三聚体、四聚体直至聚合物长链 (图式4),这与Genies等[12]提出的机理一致。
链终止期聚合体系的氧化电位大约在0.71V(图 3中C点),并且随时间的变化氧化电位迅速下降。当电位低于0.6V时(图 3中D点以后)An很难被氧化,并且An齐聚体和PAn的氧化电位均低于An的氧化电位。An单体的氧化电位约为0.7V,而二聚体PADPA的氧化电位则较低(0.4~0.5 V)[13],所以二聚体PADPA比An更易被氧化,从而生成N-苯基 -1,4-苯醌亚二胺 (PBQ),加入氧化剂,PBQ可以在介质中生成(氧化电位与介质的pH无关)。因此,可以认为在链终止阶段高氧化态PAn迅速还原转变为中间氧化态PAn有两种可能:①高氧化态PAn可以和An发生氧化还原反应,使高氧化态PAn迅速转变为中间氧化态PAn,链终止初期,体系电位较高,这一反应可能占优势;②高氧化态PAn可以发生链内氧化还原反应,在链端形成聚合活性中心,与An或An低聚体进一步反应,直至高氧化态PAn完全转化为中间氧化态PAn,这在链终止后期可能起主要作用。
通过探索丙酮/水双组分体系中合成PAn的聚合过程发现,在水中加入一定量的丙酮对控制产物的粒度和分子量都有利;在V丙酮/V水=0.2左右的条件下聚合,所得产物的各项性能较好。在丙酮/水双组份体系中,聚合过程维持高电位的时间比纯水体系有很大延长,聚合的链增长时间和自加速反应时间均有延长。显然,链增长时间和自加速反应时间的延长对改善PAn的结构是有利的。在An聚合的链增长期,PAn以较高氧化态存在;在An聚合的链终止期,PAn由较高氧化态逐渐转变为中间氧化态。头-尾连接形式聚合,在链终止阶段高氧化态PAn迅速还原转变为中间氧化态PAn。
 2016,
Vol. 79
2016,
Vol. 79 Issue (5): 443-447
Issue (5): 443-447 2016,
Vol. 79
2016,
Vol. 79 Issue (5): 443-447
Issue (5): 443-447