Progress in the Synthesis and Application of Perfluoroalkyl Vinyl Ether
1 School of Chemical Engineering and Environment, Beijing Institute of Technology, Beijing 100081;
2 College of Environmental Science and Technology, Nankai University, Tianjin 300071
全氟烷基乙烯基醚(Rf-O-CF=CF2,perfluoroalkyl vinyl ether,PAVE)作为含氟单体,与含氟烯烃发生共聚,得到具有特殊功能的有机高分子材料,广泛用于含氟塑料、含氟橡胶和功能材料等领域[1]。1938年,Plunkett[2]首次由四氟乙烯合成了聚四氟乙烯(PTFE),并由杜邦公司于1950年正式投入工业化生产。PTFE具有优异的性能:较宽的高低温使用范围、高度电绝缘性、优异的化学惰性、极低的表面摩擦系数和极佳的耐气候性,这些性能使PTFE在化工、机械、电气、建筑、医疗等众多领域成为不可缺少的特种材料[3]。尽管PTFE具有较多优点,但也有耐蠕变能力较差、耐磨性差、高度的结晶性和有极高的熔体粘度等缺陷[4]。PTFE的这些缺陷在一定程度上限制了它的广泛应用。目前国内外对PTFE的研究重点在于寻找适当的方法对其进行改性,从而在一定程度上改善其性能,以扩大其在各方面的应用。
PAVE作为共聚或改性单体参与四氟乙烯(TFE)聚合,能够改善氟聚合物的耐低温性能、耐溶剂性能、韧性、耐撕裂性能、与基材的粘结性能等,并且不会改变聚合物原有的耐腐蚀和耐老化性能[5]。例如,通过在普通氟橡胶大分子主链上引入全氟烷基乙烯基醚链段而成的氟醚橡胶,提高了分子链柔顺性,改善了氟橡胶分子链的低温柔顺性。同时,分子结构中仍含有四氟乙烯链段,其大分子主要化学结构没有变化,在改善氟橡胶低温性能的同时,保留了其对耐化学介质、耐高温的突出优点[6]。
PAVE作为合成具有特殊性能的氟聚合物单体,其合成方法随着氟聚合物的发展而不断发展。1963年,全氟丙基乙烯基醚作为合成氟共聚物单体首先见诸于报道[7],比如,可熔性聚四氟乙烯(PFA)中含有1(wt)%~10(wt)%的全氟丙基乙烯基醚,显著改善了PFA高分子链的柔顺性,降低了PFA的结晶度,使PFA具有良好的热塑性,从而克服了聚四氟乙烯加工难的缺点。全氟丙基乙烯基醚的应用,开启了PAVE作为聚合单体在合成氟共聚物和功能型氟聚合物中的应用。热解法,包括直接热解法和催化热解法,从20世纪50年代开始至今,由于其制备方法相对简单,产率较高,一直作为制备PAVE的主要方法。随着技术的发展和合成具有特定性能PAVE的要求,从1990年代开始,含氟砌块法和利用还原法还原脱氯制备PAVE得以发展。
本文综述了PAVE的合成方法,并分析其在工业生产上的优点和不足,以期对PAVE的合成和应用研究提供有益的借鉴。
热解法是以全氟羧酸金属盐或者全氟烷氧基丙酰氟及其衍生物为原料,进行热解得到PAVE的方法。按照是否使用催化剂,可以分为直接热解法和催化热解法两种。
直接热解法是以全氟烷氧基丙酰氟为原料,通过与碱金属盐(或者碱)反应,生成相对应的全氟羧酸盐,然后在无催化剂存在和高温条件下,全氟羧酸盐发生热解得到PAVE的方法。
有专利文献[7~9]报道了一种全氟羧酸金属盐热解制备CnF2n+1OCF=CF2的方法:在反应温度为120~160℃时,在极性溶剂二甘醇二甲醚中,Rf-O-CF(CF3)COF和Ⅰ-A和Ⅱ-A族元素的碱金属盐反应生成CnF2n+1OCF(CF3)CO2M,然后CnF2n+1OCF(CF3)CO2M受热脱去酰氟基而形成CnF2n+1OCF=CF2(式1) 。

|
(1)
|
Lebedev等[10]对此反应的机理进行了研究,解释了Rf-O-CF(CF3)COF与碳酸钠的不同摩尔比对热解产物的影响。当Rf-O-CF(CF3)COF与碳酸钠的摩尔比为0.5时,最终产物中没有CnF2n+1OCF=CF2的生成,而是生成了RfOCF(CF3)COCF(CF3)ORf和RfOCF(CF3)CF=CFORf;当Rf-O-CF(CF3)COF与碳酸钠的摩尔比大于1时,主要产物为CnF2n+1OCF=CF2 (式2)
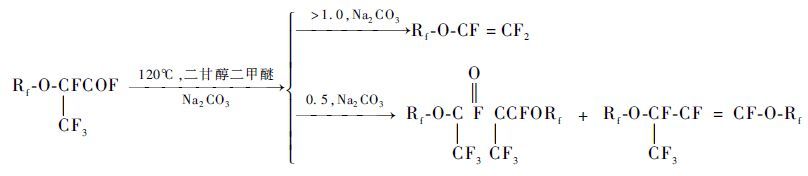
|
(2)
|
Morita等[11]报道了另一种Rf-O-CF=CF2合成方法:在反应温度为100~150℃之间,以极性溶剂比如二甘醇二甲醚作为溶剂,全氟-2-甲氧基丙酰氟(Rf-O-CF(CF2X)COY)和碳酸钠(钾)反应生成Rf-O-CF(CF2X)COONa(K),然后Rf-O-CF(CF2X)COONa(K)受热脱去羧酸根形成Rf-O-CF=CF2(式3) 。

|
(3)
|
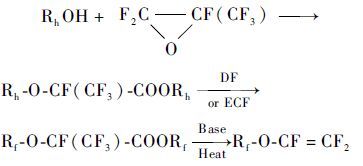
Sullivan[12]根据全氟羧酸金属盐热解产物,通过红外与气相色谱分析,解释了全氟羧酸金属盐的热解机理,指出了热解副产物的产生是由于热解速率不同和分子链中双键发生了位移引起的。Worm等[13]报道了利用长链醇和六氟环氧丙烷制备长链Rf-O-CF=CF2的方法。这种长链全氟烷氧基醚单体能够极大地提高含氟弹性体的低温性能。六氟环氧丙烷与长链醇(1~20个碳)反应,生成前体丙酸2-烷氧基酯,前体由电化学氟化(ECF)或直接氟化(DF)生成全氟化产物,然后用碱(例如氢氧化钾、碳酸钠、氢氧化钠)皂化,即转化得相应的全氟羧酸金属盐。然后将盐加热到170~250℃热解得到长链Rf-O-CF=CF2(式4) 。
|
(4)
|
2003年,3M公司[14, 15]报道了一种有磺酰氟端基的全氟乙烯基醚[FSO2-(CF2)n-O-CF=CF2]的制备方法(n为2~5) 。有磺酰氟端基的全氟乙烯基醚是合成离子交换树脂中的一类重要的单体。该方法以烷烃磺酸内酯为起始原料,通过HF电化学氟化生成FSO2-(CF2)n-1-COF,使FSO2-(CF2)n-1-COF与等摩尔量的六氟环氧丙烷(HFPO)在极性溶剂二甘醇二甲醚中与氟化钾反应,形成FSO2-(CF2)n-O-CF(CF3)-COF和六氟环氧丙烷单元的高沸点副产物;FSO2-(CF2)n-O-CF(CF3)-COF与碳酸钠在极性溶剂二甘醇二甲醚中反应生成羧酸盐FSO2-(CF2)n-O-CF(CF3)-COO-Na+,所得的羧酸盐除去溶剂,干燥后,在160~210℃之间热解得到产率大于60%的目标产物FSO2-(CF2)n-O-CF=CF2。
催化热解法是在催化剂存在和高温条件下,全氟-2-烷氧基丙酰氟发生热解得到PAVE的方法。
1967年,Carl等[16]报道了以全氟-2-烷氧基丙酰氟(CnF2n+1OCF(CF3)COF)为原料,以II-A、II-B、III-A和IV-A族元素的固体氧化物作为催化剂,催化热解生成CnF2n+1OCF=CF2,还有CO2、金属氟化物和少量其他副产物。优先采用的催化剂是氧化锌、氧化钙、氧化铝、氧化钡、氧化铅和氧化硅。以氮气稀释的全氟-2-烷氧基丙酰氟在催化剂床层中,在275~400 ℃之间热解生成CnF2n+1OCF=CF2 (式5) 。该专利通过实例,报道了各种催化剂在不同反应条件下全氟-2-甲氧基丙酰氟的转化率和产物全氟甲基乙烯基醚(PMVE)的产率情况,见表 1。
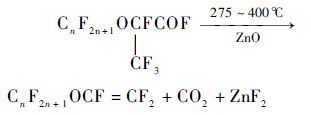
|
(5)
|
表 1
Table 1
表 1(Table 1)
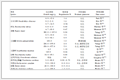
表 1 不同催化剂对热解全氟-2-甲氧基丙酰氟生成PMVE的影响
Table 1 Effect of different catalysts on the generation PMVE by pyrolysis of perfluoromethoxy-propionoyl fluoride
| 催化剂 | 反应温度/℃ | 接触时间/min | 转化率/% | 产率/% |
| ZnO | 300~325 | 0.5 | 100 | 95 |
| CaO | 300~325 | 0.5 | 100 | 95 |
| CaO | 300~325 | 4 | 70 | 57 |
| BaO | 300~325 | 3.7 | 62 | 80 |
| Al2O3 | 300~325 | 4 | — | 50 |
| SiO2 | 380~400 | — | 90 | 95 |
| SiO2 | 250 | — | 60 | 85 |
|
表 1 不同催化剂对热解全氟-2-甲氧基丙酰氟生成PMVE的影响
Table 1 Effect of different catalysts on the generation PMVE by pyrolysis of perfluoromethoxy-propionoyl fluoride
|
从表 1可以看出,不同的催化剂,原料的转化率,目标产物的选择性相差较大。当延长反应接触时间时,易产生全氟烷基醚副产物,这种副产物的理化性质与目标产物比较接近,用普通的精馏方法很难分离,使后续产品分离提纯的成本大幅提高。
Yamabe等[17, 18]报道了一种以不对称二酰基卤化物热解制备具有酰基的全氟烷基乙烯基醚的方法:将以N2或者空气等稀释气体稀释过的不对称二酰基氟化物(一端有FOC-CF(CF3)-O-基团另一端有XOC-CF2-基团),通过温度为200~350 ℃的热解管,热解生成末端有—COX基团的全氟烷基乙烯基醚。其化学反应式如式(6) 该热解反应不需要任何催化剂,在工业应用上具有一定的优势;通过调整反应时间,原料转化率可以达到100%,目标产物选择性90%以上。
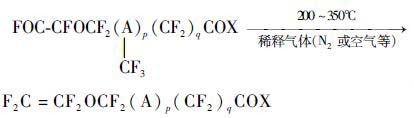
|
(6)
|
在该式中,p表示0或1;q表示0或1至3;X表示F,Cl或Br优选F
Okazoe等[19, 20]报道了一种合成全氟烷基乙烯基醚的“完美”方法。首先,烃醇(Rh-O-CH(CH3)-CH2-OH)与作为保护剂的全氟化酰基氟化物(R’f-O-CF(CF3)-COF)发生酯化反应,生成产率为99%以上部分氟化酯;接着,以1, 1, 2-三氯三氟乙烷(R113) 为溶剂,通入经N2稀释过的F2与部分氟化酯发生反应,生成收率为90%以上的全氟化酯;然后,全氟化酯进行热分解生成目标产物全氟烷基乙烯基醚Rf-O-CF=CF2和保护剂的全氟化酰基氟化物(R’f-O-CF(CF3)-COF)。从反应过程可以看出,保护剂在反应过程中可以重复利用。该反应的主要步骤是对生成的酯通入经N2稀释过的F2进行液相氟化反应,反应条件温和,目标产物较高。该循环反应已经实现了工业化生产。其循环化学反应式如式(7) 。
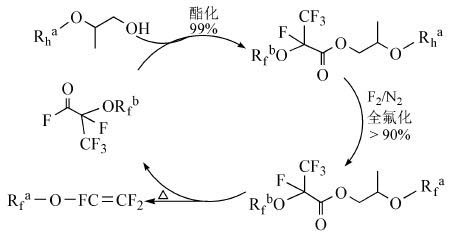
|
(7)
|
直接热解法的缺点是金属盐无法重复利用,造成生产成本的升高和资源的浪费。而催化热解法的优点是设备工艺流程简单容易操作,且催化剂可以反复使用,降低生产成本,但是催化剂的催化效果仍没有达到工业催化剂的使用要求。因此,现在工业上仍采用直接热解法来制备PAVE。
还原法是以全氟烷基1, 2-二氯三氟乙基醚为原料,进行脱氯反应,得到PAVE。依据使用的脱氯试剂和反应条件,分为Zn还原法和加氢脱卤法。
Zn还原法是以Zn为脱氯试剂脱去全氟烷基1, 2-二氯三氟乙基醚中的两个氯原子,得到PAVE的方法。锌原子的电子排布式为3d104s2,其最外层的电子非常容易失去,其独特的电子结构决定了其独特的反应活性;锌是一种强还原剂,它在中性、酸性和碱性条件下均具有较强的还原能力,在不同介质中可以还原碳卤键,锌作为一种重要的还原剂,已广泛地应用于脱卤尤其是脱氯的反应中。
Hung等[21]报道了伯醇和四氟乙烯为原料,四步法合成全氟烷基乙烯基醚。第一步反应首先将醇和氢化钠在溶剂1, 4-二氧六环中反应合成醇钠盐,醇钠盐再与四氟乙烯反应生成部分氟化乙烯醚。第二步和第三步分别对所得的乙烯醚进行氯化和氟化,生成卤代氟醚。第四步反应在非质子极性溶剂如DMF中进行,在N2保护下加入锌粉脱去Cl原子,最后得到PAVE。该过程具体的反应式如式(8~11) 。
|
${{\text{R}}^{\text{1}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH+C}{{\text{F}}_{\text{2}}}\text{=C}{{\text{F}}_{\text{2}}}\xrightarrow{\text{NaH}}{{\text{R}}^{\text{1}}}\text{C}{{\text{H}}_{\text{2}}}\text{OCF=C}{{\text{F}}_{\text{2}}}$
|
(8)
|
|
${{\text{R}}^{\text{1}}}\text{C}{{\text{H}}_{\text{2}}}\text{OCF=C}{{\text{F}}_{\text{2}}}\text{+C}{{\text{l}}_{\text{2}}}\xrightarrow[\text{CC}{{\text{l}}_{\text{4}}}]{\text{0 }\!\!\tilde{\ }\!\!\text{ 30}℃}{{\text{R}}^{\text{1}}}\text{C}{{\text{H}}_{\text{2}}}\text{OCFClC}{{\text{F}}_{\text{2}}}\text{Cl}$
|
(9)
|
R1CH2OCFClCF2Cl+F2-10~0℃全氟(2-正丁基四氢呋喃)R2CF2OCFClCF2Cl(10)
|
$\begin{align}
& {{\text{R}}^{\text{1}}}\text{C}{{\text{H}}_{\text{2}}}\text{OCFClC}{{\text{F}}_{\text{2}}}\text{Cl+}{{\text{F}}_{\text{2}}}\xrightarrow[全氟(2-正丁基四氢呋喃)]{\text{-10 }\!\!\tilde{\ }\!\!\text{ 0}℃} \\
& {{\text{R}}^{\text{2}}}\text{C}{{\text{F}}_{\text{2}}}\text{OCFClC}{{\text{F}}_{\text{2}}}\text{Cl} \\
\end{align}$
|
(10)
|
|
${{\text{R}}^{\text{2}}}\text{C}{{\text{F}}_{\text{2}}}\text{OCFClC}{{\text{F}}_{\text{2}}}\text{Cl}\xrightarrow[\text{DMF}]{\text{80 }\!\!\tilde{\ }\!\!\text{ 140}℃}{{\text{R}}^{\text{2}}}\text{C}{{\text{F}}_{\text{2}}}\text{OCF=C}{{\text{F}}_{\text{2}}}$
|
(11)
|
Zn还原法尽管脱氯效率较高,但是有机原料全氟烷基1, 2-二氯三氟乙基醚不易获得。在全氟烷基1, 2-二氯三氟乙基醚已知的合成方法中,使用了难以操控、易爆的氟气对烷氧基上的C-H直接进行氟化,极大地限制了该合成路线的工业化应用。
加氢脱氯法是在加氢脱氯催化剂和氢气存在下,以全氟烷基1, 2-二氯三氟乙基醚为原料,发生加氢脱氯反应,得到PAVE的方法。Millefanti等[22]报道了在加氢脱氯催化剂存在下,氯氟醚(Rf-O-CFClCF2Cl,Rf代表 1个C1~C6的全氟(氧基)烷基基团)发生气相加氢脱氯反应生成PAVE。其中,加氢脱氯催化剂是由0.5(wt)%~1.5(wt)%的VIII B 族过渡金属元素负载于活性炭载体组成的催化剂,活性组分优选Ru和Ni。反应式如式(12) 。
|
$\begin{array}{*{35}{l}}
{{\text{R}}_{\text{f}}}\text{OCFClC}{{\text{F}}_{\text{2}}}\text{Cl+}{{\text{H}}_{\text{2}}}\xrightarrow{\text{Ru/C or Ni/C}} \\
{{\text{R}}_{\text{f}}}\text{OCF=C}{{\text{F}}_{\text{2}}}\text{+2HCl} \\
\end{array}$
|
(12)
|
专利通过实例,报道了催化剂Ni和Ru在不同反应条件下,H2/CF3OCFClCF2Cl摩尔速率=1下,CF3OCF
ClCF2Cl的转化率和产物全氟甲基乙烯基醚(PMVE)的产率情况,见表 2。
表 2
Table 2
表 2(Table 2)

表 2 不同催化剂对加氢脱氯生成PMVE的影响
Table 2 The influence of different catalysts to the generation of PMVE
| 催化剂 | 反应温度/℃ | WHSV | 转化率/% | 产率/% |
| 1.5(wt)% Ni/C | 310 | 2 | 4.9 | 96.5 |
| 1.0(wt)% Ru/C | 220 | 1.3 | 20.6 | 97.6 |
| 1.0(wt)% Ru/C | 280 | 1.3 | 20.3 | 98.5 |
| 1.5(wt)% Ni/C | 350 | 2.2 | 4.7 | 78.7 |
| 1.0(wt)% Ru/C | 350 | 1.4 | 27.2 | 65.4 |
|
表 2 不同催化剂对加氢脱氯生成PMVE的影响
Table 2 The influence of different catalysts to the generation of PMVE
|
加氢脱氯法具有操作简单、易于控制、对环境污染小、反应原料易于循环利用的优点,但其存在原料不易获得而且加氢脱氯催化剂的催化效率较低的不足。
含氟砌块法一般是指采用全氟烯烃作为含氟砌块,与金属醇盐为代表的有机金属盐发生置换反应,得到全氟烷氧基乙烯基醚。在这里,全氟乙烯主要是四氟乙烯,而金属醇盐中的—OR基既可以是各种常见的含氢或含氟烷氧基,也可以是全氟烷氧基。该种方法中,金属醇盐的选择是关键。
一般说来,全氢烷氧基的金属醇盐的获取较为容易。1959年Stanley等[1]提出采用TFE和醇钠(RONa)为原料合成三氟乙烯基醚系列衍生物(ROCF=CF2),该方法反应通式:
|
$\text{C}{{\text{F}}_{\text{2}}}\text{=C}{{\text{F}}_{\text{2}}}\text{+RONa}\to \text{ROCF=C}{{\text{F}}_{\text{2}}}\text{+NaF}$
|
|
其中,R 基团为系列碳氢链。
含氟烷氧基的金属醇盐参与的反应则显得困难重重,特别是含氟烷氧基的金属醇盐稳定性较差,难以合成和保存。Stanley等采用四氟乙烯(CF2=CF2)和醇钠(RONa)为原料合成三氟乙烯基醚系列衍生物(ROCF=CF2),该方法反应通式:
|
$\text{C}{{\text{F}}_{\text{2}}}\text{=C}{{\text{F}}_{\text{2}}}\text{+RONa}\to \text{ROCF=C}{{\text{F}}_{\text{2}}}\text{+NaF}$
|
|
其中,R基团为甲基、1, 1, 1-三氟乙基、1-正戊烯基、正丙基。该专利可以作为合成PAVE的一个设想。Redwood等[23, 24]报道了部分RfOM化合物的合成,由于该类化合物难于合成,并且性质极不稳定,该方法用于合成RfOCF=CF2系列化合物很少报道。
三氟甲烷氧基的金属醇盐可以通过碳酰氟与金属氟化物发生化合反应而得到。周晓猛等[25]采用碳酰氟(COF2)、氟化盐和TFE为原料,两步法合成PMVE。其反应机理是:COF2与氟化盐在极性溶剂中反应生成三氟甲醇盐(CF3OM),CF3OM再与TFE发生取代反应生成PMVE。反应式如式(13) 。
|
$\begin{align}
& \text{CO}{{\text{F}}_{\text{2}}}\xrightarrow[\text{DMF}]{\text{DF}}\text{C}{{\text{F}}_{\text{3}}}\text{OM}\xrightarrow{\text{TFE}}\text{C}{{\text{F}}_{\text{3}}}\text{O-CF=} \\
& \text{C}{{\text{F}}_{\text{2}}}\text{+MF PMVE} \\
\end{align}$
|
(13)
|
含氟砌块法具有无需催化剂、反应条件温和的优点。但是该方法使用四氟乙烯作为原料,必须在无氧和稀释的环境下进行,以防止四氟乙烯爆聚而发生危险。
目前,PAVE的研究主要集中于其应用研究,尤其是研制新型的高性能含氟有机材料,而对PAVE的合成研究,在过去半个多世纪里得到迅速的发展,主要以专利形式存在。在已知的PAVE合成方法中,催化热解法和含氟砌块法是两种比较有应用前景的方法。催化热解法的关键在于开发高催化活性的催化剂。含氟砌块法的关键在于全氟烷氧基的金属醇盐的合成和引入。开发出PAVE工业化的成熟技术,不但能促进我国高性能PTFE材料开发与可持续发展,而且对我国不断发展中的氟橡胶产业的成长也具有重大的意义。
 2016,
Vol. 79
2016,
Vol. 79 Issue (4): 299-303
Issue (4): 299-303 2016,
Vol. 79
2016,
Vol. 79 Issue (4): 299-303
Issue (4): 299-303