酰基硫脲作为一种重要的硫化物,具有良好生物和生理活性。此类化合物不仅具有抗病毒、杀虫、 除草、 调节植物生长[1, 2]等多种生物活性,而且在治疗癌症、结核病及神经系统疾病等方面也有着独特的疗效[3, 4],在医药和农药领域已有较为广泛的应用。根据药物骈合原理,对具有多种生物活性的酰基硫脲进行化学修饰,会得到具有其他生物活性的化合物,进而开发出具有更高价值的酰基硫脲衍生物[5~8],因此,对于酰基硫脲化合物的修饰已成为研究的热点之一。D-氨基葡萄糖是一种天然单糖,主要是以虾、蟹等外壳为原料加工制得。因具有多种生物活性,如抗炎、刺激蛋白多糖的合成等活性[9~11]而受到广泛关注。它是合成糖脂质、糖蛋白和氨基葡萄糖聚糖等的基础骨架[12],是合成胶原质的前体,能够修复受损的软骨[13],对骨关节炎有一定疗效[14]。在氨基葡萄糖分子中引入特定结构单元,合成新颖的糖基化小分子化合物用于生物活性研究已成为研究热点[15~19]。鉴于此,将具有多种生物活性的氨基葡萄糖分子与酰基硫脲拼合,期望充分发挥两类或多类分子的活性特点,得到具有其他活性的新型化合物。为了寻找一种高效便捷的合成含有氨基葡萄糖分子的酰基硫脲类化合物,本文以D-氨基葡萄糖盐酸盐和芳酰氯作为原料,经一系列反应制备出12种新型的糖基酰基硫脲衍生物。合成路线如图式1所示。
WRS-1B数字熔点仪(上海精密仪器科学仪器有限公司);Bruker-Avance-300MHz型核磁共振谱仪(四甲基硅烷为内标);FT IR红外光谱仪(Bruker公司,KBr压片)。所用试剂均为市售分析纯级。
称取50g(0.232mol) 氨基葡萄糖盐酸盐,倒入圆底烧瓶中,加入240mL 1mol/L氢氧化钠溶液,搅拌至溶液澄清。室温条件下缓慢滴加28.5mL(0.235mol) 对甲氧基苯甲醛,并不断搅拌,有白色固体出现,TLC和碘蒸汽检测反应进程显示反应完毕后,减压抽滤,得粗产品。粗产品先用大量蒸馏水洗涤,再用甲醇和乙醚的混合液(V∶V=1∶1) 洗涤,即得化合物2,产率80%。
称取50g(0.168mol) 化合物2,在冰水浴中,加入150mL(1.59mol) 乙酸酐、270mL(3.34mol) 吡啶、0.5g二甲氨基吡啶 (DMAP,作为催化剂),不断搅拌,白色固体慢慢溶解后,升温至室温,反应12h。向反应液中加入冰水,有大量絮状固体产生,过滤得白色固体。用水以及甲醇洗涤,即得化合物3,产率75%。
称取50g(0.108mol) 化合物3,加入到250mL丙酮溶液中,加热溶解后,缓慢滴加25mL 5mol/L盐酸溶液,5min后出现固体,冷却到室温,得到白色固体,用丙酮洗涤,即得到化合物4。
1.3 芳酰基异硫氰酸酯5a~5l的合成(以5a为例)
将1.15mL(10mmol) 苯甲酰氯加入50mL的圆底烧瓶,加入二氯甲烷与丙酮各10mL,再加入1g(10mmol) 异硫氰酸钾,滴加0.5mL相转移催化剂PEG-600,搅拌反应4h,出现大量固体。过滤取黄色滤液,制得芳酰基异硫氰酸酯5a,产率90%~95%。
类似方法合成5b~5l。
称取1g(2.6mmol) 的化合物4,溶于15mL二氯甲烷中,在室温下搅拌,缓慢滴入三乙胺直至溶液澄清,缓慢滴加含0.3mL(2.2mmol) 苯甲酰基异硫氰酸酯的二氯甲烷溶液5mL,滴毕,升温到40℃,用TLC跟踪反应进度,6~8 h后反应结束。旋蒸除去溶剂,经硅胶柱层析提纯(洗脱剂为V石油醚∶V乙酸乙酯=1∶1),真空干燥得目标产物6a。
类似方法合成6b~6l。
N-苯甲酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6a):黄色固体,产率86%,mp 155~157 ℃。IR (KBr),v/cm-1: 3175,3037 (NH),2955(CH3),1749(C=O),1689 (NH),1538(Ar),1368,1340(C=O),1221,1174 (C-O),913(β,C-H); 1H NMR (300MHz,DMSO-d6) δ: 11.41 (s,1H,C2NH),10.96 (d,J=9.5Hz,1H,NH),7.96~7.89 (m,2H,Ar-H),7.65 (t,J=7.4Hz,1H,Ar-H),7.51 (t,J=7.6Hz,2H,Ar-H),6.22 (d,J=8.5Hz,1H,H-1),5.68 (t,J =9.7Hz,1H,H-3),5.11~5.03 (m,1H,H-4),4.97 (t,J=9.6Hz,1H,H-2),4.22 (dd,J=12.3、4.3 Hz,1H,H-6),4.12~4.05 (m,1H,H-5),4.02 (dd,J=9.2、4.9 Hz,1H,H-6’),2.03 (d,J=3.5Hz,6H,2CH3),2.00 (s,3H,CH3),1.93 (s,3H,CH3). 13C NMR (75MHz,CDCl3) δ: 171.19,170.93,169.67,169.22,156.39,154.92,152.47,139.95,130.36,127.20,126.13,89.78,72.63,70.98,67.75,61.43,55.31,21.53,21.21,21.02,20.88,20.82。
N-烟酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6b):黄色固体,产率75%,mp 108~110 ℃。IR (KBr),v/cm-1: 3333,3186 (NH),2977,2841 (CH3),1744(C=O),1694 (NH),1535(Ar),1368,1325(C=O),1251,1178 (C-O),918(β,C-H); 1H NMR (300MHz,CDCl3) δ:8.16 (s,1H,C2NH),7.66 (d,J=8.8Hz,2H,RNH,Ar-H),7.27 (s,1H,Ar-H),6.92 (d,J=8.7Hz,2H,Ar-H),5.94 (d,J=8.3Hz,1H,H-1),5.43 (t,J=9.6Hz,1H,H-3),5.15 (t,J=9.8Hz,1H,H-4),4.42~4.28 (m,1H,H-2),4.16~4.09 (m,1H,H-6),3.97 (ddd,J=10.0、4.4、2.0 Hz,1H,H-5),3.45 (dd,J=9.6、8.5 Hz,1H,H-6’),2.10 (s,3H,CH3),2.04 (t,J=3.5Hz,6H,2CH3),1.88 (s,3H,CH3); 13C NMR (75MHz,CDCl3) δ: 170.97,169.75,169.62,155.77,153.98,151.15,137.80,131.10,128.88,125.97,89.52,72.89,70.60,68.00,67.66,61.49,55.55,21.16,21.08,20.93,20.87。
N-异烟酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6c):黄色固体,产率77%,m p 105~107 ℃。 IR (KBr),v/cm-1: 3187 (NH),2941,2896 (CH3),1746(C=O),1694 (NH),1536(Ar),1368 (C=O),1215,1178 (C-O),916(β,C-H); 1H NMR (300MHz,CDCl3) δ: 10.69 (d,J=9.4Hz,1H,C2NH),9.13 (s,1H,RNH),8.86 (s,2H,Ar-H),7.68 (s,2H,Ar-H),5.95 (d,J=8.1Hz,1H,H-1),5.42~5.34 (m,1H,H-3),5.21 (t,J=9.1Hz,1H,H-4),5.06 (dd,J =17.8、9.5 Hz,1H,H-2),4.33 (dd,J=12.4、4.7 Hz,1H,H-6),4.16 (dd,J=12.5、2.4 Hz,1H,H-5),3.91 (ddd,J=9.3、4.6、2.6 Hz,1H,H-6’),2.11 (d,J=6.2Hz,6H CH3),2.06 (s,3H CH3),2.04 (s,3H CH3); 13C NMR (75MHz,CDCl3) δ:182.51,171.06,170.79,169.74,169.72,165.06,151.39,138.79,121.24,92.42,73.14,72.47,67.73,61.97,58.19,21.41,21.13,21.08,20.99。
N-对氟苯甲酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6d):黄色固体,产率80%,mp 105~108 ℃。IR (KBr),v/ cm-1: 3184 (NH),2946 (CH3),1737(C=O),1681 (NH),1540(Ar),1369,1338(C=O),1231,1160 (C-O),914(β,C-H); 1H NMR (300MHz,CDCl3) δ: 10.88 (d,J=9.4Hz,1H,C2NH),8.94 (s,1H,RNH),7.87 (dd,J=8.8、5.1 Hz,2H,Ar-H),7.19 (t,J=8.5Hz,2H,Ar-H),5.92 (d,J=8.2Hz,1H,H-1),5.36 (t, J=9.3Hz,1H,H-3),5.21 (t,J=9.1Hz,1H,H-4),5.07 (dd,J=17.9、9.4 Hz,1H,H-2),4.33 (dd,J=12.4、4.7 Hz,1H,H-6),4.17 (dd,J=12.4、2.4 Hz,1H,H-5),3.90 (ddd,J=9.2、4.5、2.6 Hz,1H,H-6’),2.12 (d,J=6.1Hz,6H,CH3),2.06 (d,J=5.5Hz,6H,CH3); 13C NMR (75MHz,CDCl3) δ: 182.04,171.07,170.76,169.74,169.66,168.06,165.48,164.66,130.72,130.60,127.63,127.59,116.91,116.61,92.50,77.82,77.40,76.98,73.16,72.56,67.79,61.96,58.13,21.42,21.13,21.08,21.00。
N-对氯苯甲酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6e):黄色固体,产率78%,mp 114~116 ℃. IR (KBr),v/cm-1: 3347,3175 (NH),2949 (CH3),1747(C=O),1687 (NH),1595(Ar),1370(C=O),1227,1170 (C-O),914(β,C-H); 1H NMR (300MHz,CDCl3) δ: 10.85 (d,J=9.4Hz,1H,C2NH),8.98 (s,1H,RNH),7.78 (d,J=8.6Hz,2H,Ar-H),7.49 (d,J=8.6Hz,2H,Ar-H),5.93 (d,J=8.1Hz,1H,H-1),5.36 (t, J=9.3Hz,1H,H-3),5.21 (t,J=9.1Hz,1H,H-4),5.07 (dd,J=17.9、9.3 Hz,1H,H-2),4.33 (dd,J=12.3、4.6 Hz,1H,H-6),4.17 (dd,J=12.4、2.4 Hz,1H,H-5),3.94~3.85 (m,1H,H-6’),2.12 (d,J=6.1Hz,6H,CH3),2.05 (d,J=5.8Hz,6H,CH3); 13C NMR (75MHz,CDCl3) δ: 181.94,171.06,170.79,169.73,165.55,140.75,129.74,129.38,92.47,73.12,72.57,67.81,61.97,60.76,58.17,21.42,21.12,21.08,20.99,14.54。
N-间氯苯甲硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6f): 黄色固体,产率75%,mp 105~108 ℃。IR (KBr),v/cm-1: 3233 (NH),2952 (CH3),1754(C=O),1678 (NH),1538(Ar),1386(C=O),1221,1040 (C-O),902(β,C-H); 1H NMR (300MHz,CDCl3) δ: 10.83 (d,J=9.4Hz,1H,C2NH),9.05 (s,1H,RNH),7.84 (s,1H,Ar-H),7.71 (d,J=7.7Hz,1H,Ar-H),7.61 (d,J=7.4Hz,1H,Ar-H),7.46 (t,J=7.9Hz,1H,Ar-H),5.97 (d,J=8.2Hz,1H,H-1),5.41 (t,J=9.3Hz,1H,H-3),5.24 (t,J =9.1Hz,1H,H-4),5.10 (dd,J=18.3、9.1 Hz,1H,H-2),4.35 (dd,J=12.4、4.6 Hz,1H,H-6),4.16 (dd,J=13.7、9.9 Hz,1H,H-5),3.96~3.88 (m,1H,H-6’),2.14 (d,J=6.6Hz,6H,CH3),2.08 (d,J=5.5Hz,6H,CH3); 13C NMR (75MHz,CDCl3) δ: 182.87,171.08,170.78,169.74,169.62,165.39,135.80,134.16,133.21,130.74,128.33,125.89,92.50,73.20,72.53,67.75,61.96,58.17,21.43,21.14,21.08,21.00。
N-对溴苯甲酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6g): 黄色固体,产率76%,mp 70~72 ℃。IR (KBr),v/cm-1: 3340,3174 (NH),2951 (CH3),1749(C=O),1686 (NH),1589(Ar),1369,1338(C=O),1226,1170 (C-O),912(β,C-H); 1H NMR (300MHz,CDCl3) δ: 10.84 (d,J =9.4Hz,1H,C2NH),8.96 (s,1H,RNH),7.71 (d, J=8.7Hz,2H,Ar-H),7.65 (d,J=8.7Hz,2H,Ar-H),5.93 (d,J=8.2Hz,1H,H-1),5.36 (t,J=9.3Hz,1H,H-3),5.21 (t,J=9.1Hz,1H,H-4),5.07 (dd,J=18.1、9.4 Hz,1H,H-2),4.33 (dd,J=12.4、4.6 Hz,1H,H-6),4.21~4.12 (m,1H,H-5),3.94~3.86 (m,1H,H-6’),2.12 (d,J=6.0Hz,6H,2CH3),2.06 (d,J=5.8Hz,6H,CH3); 13C NMR (75MHz,CDCl3) δ: 182.22,171.08,170.60,169.75,169.52,169.35,132.72,132.45,132.21,127.31,126.51,92.44,73.11,72.44,67.68,62.01,57.91,21.39,21.12,21.07,20.99,21.46。
N-对甲基苯甲酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6h): 黄色固体,产率70%,mp 114~116 ℃。IR (KBr),v/cm-1: 3345 (NH),2928 (CH3),1736(C=O),1680 (NH),1543(Ar),1386,1337(C=O),1230,1172 (C-O),904(β,C-H); 1H NMR (300MHz,CDCl3) δ :10.98 (d,J=9.4Hz,1H,C2NH),8.98 (s,1H,RNH),7.72 (d,J =8.3Hz,2H,Ar-H),7.30 (d,J=8.0Hz,2H,Ar-H),5.93 (d,J=8.2Hz,1H,H-1),5.42~5.33 (m,1H,H-3),5.21 (t,J=9.1Hz,1H,H-4),5.08 (dd,J=17.9、9.5 Hz,1H,H-2),4.32 (dt,J=10.0,5.6Hz,1H,H-6),4.17 (dd,J=12.4、2.5 Hz,1H,H-5),3.90 (ddd,J=9.3、4.6、2.6 Hz,1H,H-6’),2.43 (s,3H,CH3),2.12 (d,J=6.0Hz,6H,CH3),2.06 (d,J=5.3Hz,6H,CH3); 13C NMR (75MHz,CDCl3) δ: 182.27,171.07,170.75,169.76,169.49,145.24,130.19,130.10,128.48,127.98,92.51,73.12,72.59,67.87,61.99,58.08,30.04,22.03,21.42,21.13,21.09,21.00。
N-间甲基苯甲酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6i): 黄色固体,产率72%,mp 95~97 ℃。IR (KBr),v/cm-1: 3233 (NH),2952 (CH3),1754(C=O),1678 (NH),1538(Ar),1386(C=O),1221,1040 (C-O),902(β,C-H); 1H NMR (300MHz,CDCl3) δ: 10.94 (d,J=9.5Hz,1H,C2NH),8.98 (s,1H,RNH),7.61 (d,J=8.4Hz,2H,Ar-H),7.42 (dd,J=12.1、7.4 Hz,2H,Ar-H),5.94 (d,J=8.2Hz,1H,H-1),5.42~5.35 (m,1H,H-3),5.22 (t, J =9.1Hz,1H,H-4),5.09 (dd, J=17.9、9.6 Hz,1H,H-2),4.33 (dd, J=12.4、4.7 Hz,1H,H-6),4.17 (dd,J=12.4、2.6 Hz,1H,H-5),3.91 (ddd,J =9.4,4.6,2.6Hz,1H,H-6’),2.42 (s,3H,CH3),2.15~2.10 (m,6H,CH3),2.05 (t,J =3.6Hz,6H,CH3); 13C NMR (75MHz,CDCl3) δ: 182.18,171.07,170.81,169.87,169.77,166.61,139.44,134.88,131.23,128.43,125.02,92.47,73.06,72.65,67.93,61.99,58.17,21.64,21.44,21.12,21.09,21.00。
N-邻甲基苯甲酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6j):黄色固体,产率68%,mp 92~94 ℃。IR (KBr),v/cm-1: 3233 (NH),2952 (CH3),1754(C=O),1678 (NH),1538(Ar),1386(C=O),1221,1040 (C-O),902(β,C-H); 1H NMR (300MHz,CDCl3) δ: 10.86 (d,J=9.4Hz,1H,C2NH),8.78 (s,1H,RNH),7.50~7.40 (m,2H,Ar-H),7.29 (d,J=7.6Hz,2H,Ar-H),5.95 (d,J=8.0Hz,1H,H-1),5.40~5.32 (m,1H,H-3),5.21 (t,J =8.9Hz,1H,H-4),5.06 (dd,J =17.5,9.4 Hz,1H,H-2),4.33 (dd,J =12.4、4.7 Hz,1H,H-6),4.18 (dd, J=12.4、2.7 Hz,1H,H-5),3.91 (ddd,J =9.1、4.7、2.8 Hz,1H,H-6’),2.50 (s,3H,CH3),2.15 (s,3H,CH3),2.11 (s,3H,CH3),2.06 (d,J =8.0Hz,6H,CH3); 13C NMR (75MHz,CDCl3) δ: 182.96,171.08,170.82,169.75,169.70,165.79,132.74,131.93,130.24,129.48,129.41,129.18,92.48,73.14,72.56,67.80,61.97,58.16,21.43,21.14,21.09,21.00。
N-对甲氧基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6k): 黄色固体,产率75%,mp 93~94 ℃。IR (KBr),v/ cm-1: 3171 (NH),2948 (CH3),1754(C=O),1674 (NH),1535(Ar),1368,1355(C=O),1221,1175 (C-O),912(β,C-H); 1H NMR (300MHz,CDCl3) δ: 11.00 (d,J=9.4Hz,1H,C2NH),8.91 (s,1H,RNH),7.79 (d,J=8.8Hz,2H,Ar-H),6.97 (d,J=8.9Hz,2H,Ar-H),5.93 (d,J=8.2Hz,1H,H-1),5.37 (t,J=9.3Hz,1H,H-3),5.21 (t,J=9.1Hz,1H,H-4),5.08 (dd,J=18.0、9.5 Hz,1H,H-2),4.32 (dd,J=12.4、4.6 Hz,1H,H-6),4.16 (dd,J=12.4、2.4 Hz,1H,H-5),3.94~3.89 (m,1H,H-6’),3.88 (s,3H,CH3),2.12 (d, J=6.4Hz,6H,CH3),2.05 (d,J =5.0Hz,6H,CH3); 13C NMR (75MHz,CDCl3) δ: 182.34,171.07,170.76,169.76,165.95,164.36,130.13,123.27,114.65,92.51,73.10,72.62,67.89,61.98,58.08,55.99,21.44,21.13,21.09,21.00。
N-萘甲酰基硫脲-1,3,4,6-四-O-乙酰基-2-脱氧-β-D-氨基葡萄糖(6l):黄色固体,产率66%,mp 107~109 ℃。IR (KBr),v/cm-1: 3237,3049 (NH),2949 (CH3),1747(C=O),1687 (NH),1595(Ar),1370(C=O),1221,1040(C-O),911(β,C-H); 1H NMR (300MHz,CDCl3) δ: 10.97 (d,J=9.4Hz,1H,C2NH),8.99 (s,1H,RNH),8.35 (d,J=8.3Hz,1H),8.06 (d,J=8.2Hz,1H),7.94 (d,J=7.6Hz,1H),7.77 (d,J=6.8Hz,1H),7.64 (tt,J=13.7、6.7 Hz,2H),7.57~7.50 (m,1H),6.02 (d,J=8.0Hz,1H,H-1),5.43 (t,J=9.1Hz,1H,H-3),5.26 (t,J=8.9Hz,1H,H-4),5.13 (dd,J=17.6、9.3 Hz,1H,H-2),4.36 (dd, J=12.4、4.7 Hz,1H,H-6),4.21 (dd, J=12.3、2.6 Hz,1H,H-5),3.99~3.91 (m,1H,H-6’),2.19 (s,3H,CH3),2.15~2.08 (m,9H,CH3); 13C NMR (75MHz,CDCl3) δ: 182.28,171.07,170.70,169.77,169.61,169.01,134.00,133.46,130.13,128.51,126.74,124.95,124.73,92.49,73.04,72.56,67.74,61.99,58.04,21.43,21.12,21.00。
实验以合成化合物6a为反应模型进行条件优化,筛选出最佳的反应条件。优化条件主要考察配比、溶剂、温度、时间因素对反应产率的影响。
实验中固定时间、温度、溶剂等因素,采用相同的后处理方法,通过改变化合物5与化合物4的摩尔比考察其对产率的影响,其结果见表 1。
表 1
Table 1
表 1(Table 1)
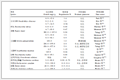
表 1 摩尔比对产率的影响
Table 1 Effect of molar ratio on the yield
| n化合物 5∶ n化合物 4 |
|
产率/% |
1∶0.9 |
1∶1 |
1∶1.1 |
1∶1.2 |
1∶1.3 |
|
65 |
76 |
81 |
87 |
86 |
|
表 1 摩尔比对产率的影响
Table 1 Effect of molar ratio on the yield
|
由表 1可以看出,化合物5与化合物4的摩尔比对目标产物的产率有较大的影响,当反应物的摩尔比为1∶1.2时,可得到最佳产率。当反应物摩尔比大于此值时,产率没有较大的变化;当反应物的摩尔比小于此值时,会出现少量的副产物,导致目标产物的产率减少,而且为提纯带来不便。
实验中固定反应物摩尔比、温度、时间等因素,采用相同的处理方法,通过改变反应溶剂考察其对产率的影响,其结果见表 2。
表 2
Table 2
表 2(Table 2)

表 2 溶剂对产率的影响
Table 2 Effect of solvent on the yield
|
溶剂
|
|
CH2Cl2 |
DMF |
EtOH |
CH3CN |
|
产率/% |
86 |
82 |
45 |
85 |
|
表 2 溶剂对产率的影响
Table 2 Effect of solvent on the yield
|
由表 2可以看出,对于溶剂的选择,应避免质子性溶剂,芳酰基异硫氰酸酯能够与质子性溶剂反应,产生副产物。在使用非质子性溶剂二氯甲烷、N,N-二甲基甲酰胺、乙腈作为溶剂时,产率均较高,但考虑到溶剂毒性及沸点对后处理的影响,最终选择二氯甲烷作为溶剂。
实验中固定反应物摩尔比、溶剂、时间等因素,采用相同的处理方法,通过改变实验温度考察其对产率的影响,其结果见表 3。
表 3
Table 3
表 3(Table 3)

表 3 温度对产率的影响
Table 3 Effect of temperature on the yield
| 温度/℃ |
|
产率/% |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
45 |
67 |
73 |
80 |
86 |
82 |
78 |
|
表 3 温度对产率的影响
Table 3 Effect of temperature on the yield
|
由表 3可以看出,温度对目标产物的产率有较大影响。当反应温度为0℃时,产率最低,随着温度的增加,产率不断增高,当温度达到40℃时,目标产物产率最高,反应温度超过40℃后,产率逐渐减少。当反应温度低于40℃时,由于温度较低,导致反应不完全。当反应温度高于40℃时,推测为芳酰基异硫氰酸酯的活性较高,发生副反应,导致目标产物产率减少。因此,40℃为适宜反应温度。
实验中固定反应物摩尔比、溶剂、温度等因素,采用相同的处理方法,通过改变实验时间考察其对产率的影响,其结果见表 4。
表 4
Table 4
表 4(Table 4)

表 4 时间对产率的影响
Table 4 Effect of time on the yield
| 时间/h |
|
产率/% |
2 |
4 |
6 |
8 |
10 |
|
45 |
69 |
85 |
86 |
86 |
|
表 4 时间对产率的影响
Table 4 Effect of time on the yield
|
由表 4可以看出,当反应时间超过6h时,目标产物产率没有明显变化。反应时间在6h左右,TLC检测反应基本完成。因此,6h为最佳反应时间。
实验以D-氨基葡萄糖盐酸盐和芳酰氯为原料经一系列反应合成出12种新型糖基酰基硫脲衍生物,反应机理如图式2所示。
实验以氨基葡萄糖盐酸盐和芳酰氯为原料,经一系列反应合成了12种糖基酰基硫脲衍生物。实验中选取模型反应对实验条件进行优化,得到最佳反应条件为:在二氯甲烷为溶剂条件下,反应摩尔比为反应物5∶反应物 4=1∶1.2,反应温度为40℃,反应时间为6h。在初步条件优化的基础上,拓展合成了多种糖基酰基硫脲衍生物化合物。将氨基葡萄糖小分子与酰基硫脲结构拼合在一个分子中,期望充分发挥两类活性基团的特点,得到具有其他活性的新型化合物。
 2016,
Vol. 79
2016,
Vol. 79 Issue (1): 77-82,76
Issue (1): 77-82,76 2016,
Vol. 79
2016,
Vol. 79 Issue (1): 77-82,76
Issue (1): 77-82,76