Study on the Synthesis and Safety of Long Chain Quaternary Ammonium Salt with Vinyl Benzyl
季铵盐化合物具有杀菌效果好、毒性低、水溶性好等特点,且具有广谱的杀菌活性[1]。人们可以通过调节不同的官能团来改变季铵盐的抗菌性能,近年来,一些带有不同官能团的季铵盐相继诞生。Kourai等[2]在研究一系列小分子季铵盐对大肠杆菌和绿脓假单胞菌的杀死能力时发现,最佳杀菌活性时的烷基链长度取决于盐的类型,N-烷基碘喹啉和碘异喹啉显示最高杀菌活性的烷基链长是C14,然而N-烷基碘化吡啶和N-烷基二甲基苯基碘化吡啶的最佳链长度则是C16,这表明季铵盐取代链的长短对其抗菌力有很大的影响。
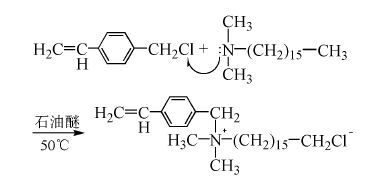
为了在聚烯烃复合材料上引入季铵盐基团并从低毒高效出发,本文设计合成了便于在聚烯烃大分子链上接枝的、含有乙烯基的季铵盐化合物——二甲基十六烷基对乙烯基苄基氯化铵(C9H9Cl-16DMA),并通过FT IR、1H NMR、元素分析(EA) 对目标产物的结构进行了表征。具体合成路线为:
季铵盐类抗菌剂的抗菌机理和毒理在生物学领域已有深入的研究。不过,鉴于所设计合成的季铵盐抗菌剂在分子结构中引进了乙烯基苄基,本文从未来应用和人体安全性出发,通过家兔的生理特征测试和急性皮肤刺激性实验表征了该季铵盐单体对人体的安全性;通过透射电镜分别观察经过抗菌剂处理前后的大肠杆菌的内部结构变化,以与季铵盐类抗菌剂的一般作用机制进行对比分析讨论。
Spectorm-One型红外光谱仪(美国Perkin Elmer公司),Avance400超导核磁共振谱仪(瑞士公司),2400 CHNS/O有机元素分析仪(美国PerkinElmer分析仪器公司),DF40型热重-差热分析仪(美国 TA 公司),日立H-7000FA透射电子显微镜(日本日立公司)。
十六烷基二甲基胺(16DMA) (化学纯,东京化成工业株式会社);对乙烯基苄基氯(C9H9Cl)(化学纯,成都西亚化工有限公司);石油醚、乙酸乙酯、丙酮、氯化钙、胰蛋白胨、氯化钠、酵母提取物(分析纯,天津科密欧化学试有限公司),以上试剂均为分析纯;新西兰家兔、昆明种小鼠[购自哈尔滨医科大学实验动物学部,生产许可证号:SCXK(黑)2013-001]。
在装有回流冷凝管的100mL三口瓶中加入20mL石油醚,按计量加入0.6mL对乙烯基苄基氯和1.5mL十六烷基二甲基胺,反应控制在40~60℃,每间隔0.5h测定胺值[3],当胺值不再变化时(约3h) 结束反应。用旋转蒸发仪蒸除溶剂,得到黄色稠状液体,用石油醚萃取,再经丙酮和乙酸乙酯混合溶剂(体积比1∶3) 重结晶,干燥得到白色(淡黄色) 粉末状目标产物C9H9Cl-16DMA,收率81%。
新鲜培养的菌液以2700r/min的速度离心分离6min,倒去上层清液,继续离心分离6min,用PBS缓冲液冲洗2~3次,用戊二醛固定4h。接着用0.1mol/L的PBS缓冲液清洗6次,每次10~15 min,然后分别用30%,50%,70%和100%的酒精逐级脱水,每次脱水15min,再用加有氯化钙的无水丙酮脱水3次,每次15min,最后用包埋剂包5d。制备的样品在超薄切片机上切片,然后用饱和的柠檬酸铅和醋酸铀染色后在日立H-7000FA透射电镜上观察。
试验菌株为大肠杆菌,金黄色葡萄球菌,枯草芽孢杆菌。具体抑菌测试方法见文献[4~6]。
用接枝C9H9Cl-16DMA抗菌剂的木塑复合材料(WPC) 制作笼舍,将检疫过的家兔饲养其中,养殖15d,每天对其生理指标进行测试。
取1.2mg C9H9Cl-16DMA样品,用饮用纯净水定容至50mL,即为其应用浓度0.024g/L的5倍浓度溶液。经检疫7d后的6只体重约2.5kg的新西兰家兔,于试验前24h去除脊柱两侧背毛,范围3cm×3cm。取受试物0.5mL涂于动物一侧皮肤,范围为2.5cm×2.5cm,用两层纱布和一层玻璃纸覆盖,用无刺激性胶布固定,另一侧作为空白对照,封闭4h后,用温水去除残留受试物,观察结果和其他中毒体征。
根据寇氏法[7]预实验探索找到最大剂量(Dm) 为6000mg/kg,最小剂量(Dn) 为1160mg/kg。确定剂量组(N) 计算各组剂量值。按小鼠灌胃药物容量0.02mL/10g配制已确定好的各剂量组药物的浓度,作好标记,备用。昆明种小鼠,体重18~22g,60只,雌雄各半。给药后立即观察并记录动物的中毒表现、死亡数和死亡时间,观察期为7d。根据急性毒性分级标准进行毒性分级。
从FT IR谱图(图 1) 可以看出,2916.67cm-1为C9H9Cl-16DMA的苯环上CC振动吸收峰,2854.17cm-1为C—H伸缩振动峰;1630.68cm-1为CC伸缩振动峰;1377.93cm-1为C—N特征吸收峰;1485.18、1467.19、1410.29 cm-1为苯环特征吸收;726.03cm-1是苯环的面外弯曲振动。 FT IR所提供的这些信息与我们对季铵盐的结构要求基本符合;但是,与反应物C9H9Cl和16DMA的红外谱图相比,新引入的烷基链的吸收峰大部分出现在低波数区,在红外谱图上表现得并不明显,为了精确验证这些新型季铵盐化合物的结构,我们继续做了核磁分析。
H1NMR分析 1H NMR (400MHz,CD3OD,TMS)δ 7.76 (d,J = 8.0Hz,2H,ArH),7.58 (d,J = 8.0HZ,2H,ArH),6.28 (dd,J = 8.0、17.6 Hz,1H,H2C=CH),5.92 (d,J = 17.6Hz,1H, 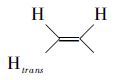 ),5.35 (d,J = 17.6Hz,1H,
),5.35 (d,J = 17.6Hz,1H, 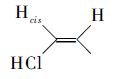 ),5.00 (s,2H,Ph-CH2-N),3.48(m,5H,H3C-N,N-CH2CH2-),2.99(S,3H,H3C-N),1.50~1.10 (m,28H,-N-CH2(CH2)14-CH2),0.84 (m,2H,-N-CH2(CH2)14-CH2)。通过氢谱可以看出,δ= 5.00处出现了亲核取代的特征峰[8],从而有力地证明了产物的结构与设计要求相符。
),5.00 (s,2H,Ph-CH2-N),3.48(m,5H,H3C-N,N-CH2CH2-),2.99(S,3H,H3C-N),1.50~1.10 (m,28H,-N-CH2(CH2)14-CH2),0.84 (m,2H,-N-CH2(CH2)14-CH2)。通过氢谱可以看出,δ= 5.00处出现了亲核取代的特征峰[8],从而有力地证明了产物的结构与设计要求相符。
测得的C 、H、N含量分别为76.71%、11.36%、3.96%,与计算值76.75%、11.37%、4.03%基本吻合。
图 2是季铵盐在氮气氛围下的TG曲线。分析表明,当烷基链上有苄基时,热重曲线上出现了3个快速失重峰,当温度低于100℃左右时,两种单体的失重率10%左右,失去的是单体在空气中吸附的水分,说明单体在空气中容易吸水,这与它在水中良好的溶解性也是一致的。当温度达到210℃左右时,分解速率达到最快,说明单体开始分解,此时失重率达到30%~40%;在370℃时,乙烯基苄基基团脱离长链,失重率达到70%左右;在450℃时,2个季铵盐几乎都彻底分解,失重率都在97%以上。根据上述季铵盐的失重行为,可知它们的使用温度不能太高,否则将会失去杀菌活性,但只要物体的加工使用温度不超过200℃,它们均可以作为抑菌添加剂被应用[7]。
通过抑菌圈法测试产品对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的抑菌性能。
从表 1数据可知,合成的C9H9Cl-16DMA分别对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的抑菌直径为86.8mm、43.9mm、61.3mm,抑菌效果非常明显。
表 1
Table 1
表 1(Table 1)
表 1 单体的抑菌数据
Table 1 Antibacterial diameter data of the monomers
|
样品名称及用量 |
大肠杆菌
/mm |
金黄色葡萄
球菌/mm |
枯草芽孢
杆菌/mm |
|
C9H9Cl-16DMA(0.100g) |
86.8 |
43.9 |
61.3 |
|
表 1 单体的抑菌数据
Table 1 Antibacterial diameter data of the monomers
|
图 4、图 5、图 6是培养时间为18h,16DMA 、十六烷基三甲基溴化铵(CTAB) 和C9H9Cl-16DMA季铵盐单体各0.100g,对枯草芽孢杆菌、大肠杆菌和金黄色葡萄球菌的抑菌图,数值总结于抑菌直径表 4。
表 2
Table 2
表 2(Table 2)

表 2 单体的抑菌数据
Table 2 Antibacterial diameter data of the monomers
|
菌种 |
16DMA/mm |
CTAB/mm |
C9H9Cl-16DMA/mm
|
|
E.Coli |
30 |
29 |
33 |
|
S.Aureus |
24 |
21 |
25 |
|
B.subtilisa |
24 |
20 |
26 |
|
表 2 单体的抑菌数据
Table 2 Antibacterial diameter data of the monomers
|
从图 4、5、6和表 2看出,三个单体的抑菌圈较大,表明它们都有很好的抑菌能力,抑菌圈大小顺序C9H9Cl-16DMA>16DMA> CTAB。从对比结果看,在相同的用量下,合成的季铵盐单体C9H9Cl-16DMA比原料16DMA和市售链长相同的CTAB抑菌效果好。
图 7可以清楚地看出,自然死亡的菌体[图 7 (a)]细胞完整,与抗菌单体作用的大肠杆菌菌体[图 7 (b)]确实遭到严重破坏,细胞壁和细胞膜出现破损,内核出现分裂,导致菌体[图 7(c)]出现严重变形,有大量内容物流出。与季铵盐类抗菌剂的一般作用机制[10~17]进行对比分析,认为本文合成的季铵盐与一般季铵盐类抗菌剂类似,合成季铵盐表面含有大量的正电荷,正电荷密度高,对细菌的吸附能力很强;大肠杆菌为革兰氏阴性菌,对正电荷有强烈的吸附作用,而且可以通过正电荷作用于细菌表面,破坏其静电平衡。通过渗透和扩散作用,穿过表面进入细胞膜,阻碍细胞膜的半渗透作用,并进一步进入细胞内部,使细胞酶钝化,蛋白质酶不能产生,从而使蛋白质变性,进而杀死细菌,其亲油基团能溶解并损伤细胞表面的脂肪壁,改变细胞原生质膜的物化性质。亲油基的溶解性越好,越有利于破坏细胞原生质膜,加速细菌的死亡。阳离子与磷脂双层反应时,先后与亲水基团、疏水部分发生作用,而且大量的研究表明[18],对于大多数阳离子杀菌剂,与菌体的疏水作用是杀死细菌的关键过程。因此,疏水基团间的疏水作用应该是最后也是重要的杀死过程。
我们将家兔安放在接枝后WPC制成的笼舍里进行饲养,观察其形貌及测试生理指标,具体参数见表 3。
表 3
Table 3
表 3(Table 3)

表 3 家兔的生理指标测试数据
Table 3 The testing data of physiological indicators of rabbits
|
天数 |
进食状态 |
体重/kg |
体温/(38.5~39.5℃)
|
|
1 |
良好 |
正常 |
39. 1 |
|
2 |
良好 |
正常 |
38.7 |
|
3 |
良好 |
正常 |
38.7 |
|
4 |
良好 |
正常 |
39.2 |
|
5 |
良好 |
正常 |
38.6 |
|
6 |
良好 |
正常 |
38.1 |
|
7 |
良好 |
正常 |
38.3 |
|
8 |
良好 |
正常 |
38.7 |
|
9 |
良好 |
正常 |
38.1 |
|
10 |
良好 |
正常 |
39.4 |
|
11 |
良好 |
正常 |
38.5 |
|
12 |
良好 |
正常 |
38.2 |
|
13 |
良好 |
正常 |
38.3 |
|
14 |
良好 |
正常 |
38.9 |
|
15 |
良好 |
正常 |
38.1 |
|
表 3 家兔的生理指标测试数据
Table 3 The testing data of physiological indicators of rabbits
|
表 3表明,饲养的15d的家兔的进食状态良好,体温、体重正常,可见接枝抗菌剂的WPC对人体是安全的。
通过1h、24h、48h、72h、4d、5d、6d和7d的连续观察,家兔皮肤没有出现红斑和浮肿,说明该结构抗菌剂单体对家兔皮肤没有任何刺激作用,同时也可以证明它对人体的皮肤也应该是非常安全的。
记录各组死亡鼠数,求出死亡率,结果填入表 4。
表 4
Table 4
表 4(Table 4)

表 4 C9H9Cl-16DMA的小鼠急性经口毒性实验结果
Table 4 Results of toxicological tests per os of C9H9Cl-16DMA
|
组别 |
剂量
/(mg/kg) |
性别 |
实验鼠数
/只 |
死亡鼠数
/只 |
死亡时间
/d |
死亡
率P
|
|
1 |
6000(Dm) |
雄 |
5 |
5 |
1~3 |
1 |
|
|
|
雌 |
5 |
5 |
1~3 |
|
|
2 |
4320 |
雄 |
5 |
5 |
1~7 |
0.9 |
|
|
|
雌 |
5 |
4 |
1~6 |
|
|
3 |
3110 |
雄 |
5 |
2 |
2 |
0.5 |
|
|
|
雌 |
5 |
3 |
2~4 |
|
|
4 |
2040 |
雄 |
5 |
0 |
— |
0.1 |
|
|
|
雌 |
5 |
1 |
4 |
|
|
5 |
1610 |
雄 |
5 |
0 |
— |
0.1 |
|
|
|
雌 |
5 |
1 |
3 |
|
|
6 |
1160(Dn) |
雄 |
5 |
0 |
— |
0 |
|
|
|
雌 |
5 |
0 |
— |
|
|
表 4 C9H9Cl-16DMA的小鼠急性经口毒性实验结果
Table 4 Results of toxicological tests per os of C9H9Cl-16DMA
|
按公式计算LD50[19]
(1) LD50=lg-1[Xm-i(ΣP-0.5)]
=lg-1[3.7782-0.1428×(1+0.9+0.5+0.1+0.1+0-0.5)]
=lg-1[3.7782-0.1428×2.1]
=lg-1[3.7782-0.2999]
=lg-13.4783
=3000.68
式中Xm:最大剂量的对数;i:对数剂量的组间距离=3.7782-3.6354=0.1428;P:各剂量组死亡率。
(2) 95%可信限
LD50±4.5SlgLD50·LD50
$slgL{{D}_{50}}=i\sqrt{\sum \frac{P\left( 1-P \right)}{n}}$
slgLD50=0.1428
$\sqrt{\frac{1\times \left( 1-1 \right)+0.9\times \left( 1-0.9 \right)+0.5\times \left( 1-0.5 \right)+0.1x\left( 1-0.9 \right)+0.1\times \left( 1-0.1 \right)+0\times \left( 1-0 \right)}{10}}$
slgLD50=0.1428×$\sqrt{\frac{0.52}{10}}$
slgLD50=0.1428×0.2280
slgLD50=0.0326
式中,SlgLD50:lgLD50的标准误差;P:各组死亡率;n:各组例数。
95%可信限=LD50±4.5SlgLD50·LD50
=3000.68±4.5×0.0326×3000.68
=3000.68±440.11
寇氏法公式求出单体对小鼠的7d的LD50及其95%可信限范围为3000.68 (2560.57~3440.79) mg/kg,远远高于其他阳离子的半数致死量(500~2000 mg/kg)[19],根据急性毒性分级标准[16],该抗菌剂对小鼠的半数致死量说明该物质属于低毒产品。对其尸体解剖实验结果发现,在小鼠胃内强烈溶胀,致使无法摄入其他食物,导致小鼠而死亡。
本文合成N,N-二甲基十四烷基对乙烯基苄基氯化铵(C9H9Cl-16DMA),用FT IR、1H NMR、EA、TG等手段表征其结构,利用抑菌圈法测试其对常见菌种的抑菌性;并对季铵盐的毒性进行了评价及抗菌机理进行了分析讨论。通过家兔的生理特征测试、急性皮肤刺激性实验和小鼠经口毒性实验表征了该系列季铵盐单体对人体的安全性;毒理实验结果显示,家兔生理特征无异样变化;家兔的皮肤没有任何变化,根据寇氏法公式求出单体对小鼠的7d的LD50及其95%可信限范围为3000.68(2560.57~3440.79)mg/kg ,根据急性毒性分级标准,该抗菌剂对小鼠的半数致死量说明该物质属于低毒产品,表明本文合成的抗菌单体是安全的。通过透射电镜分别观察经过抗菌剂处理前后的大肠杆菌内部结构变化,与季铵盐类抗菌剂的一般作用机制相近。
 2016,
Vol. 79
2016,
Vol. 79 Issue (1): 56-61
Issue (1): 56-61 2016,
Vol. 79
2016,
Vol. 79 Issue (1): 56-61
Issue (1): 56-61