Syntheses of Functional Polysulfones with Bonding Salicylaldehyde-Type Bidentate Schiff Base Ligand on Side Chain and Luminescence Properties of Their Rare Earth Complexes
在发光材料领域,键合型高分子-稀土配合物是一类十分重要的材料。该类材料兼具小分子稀土配合物独特的发光性能(窄带发射、内量子效率、荧光寿命长及大的斯托克斯位移等[1~4]) 与聚合物良好的力学性能及易于加工成型的特点(尤其是易成膜性能),材料内部还呈现均相特性,因此是一类高性能的稀土配合物发光材料[5, 6],在光致发光、电致发光以及太阳能转换系统等领域[7~9],都具有潜在的应用价值和发展前景,尤其在电致发光领域,可作为发光层材料,制备电致发光器件,而且由于其上述特性,与其他发光材料相比较,在电致发光领域,键合型聚合物-稀土配合物发光材料具有明显的优势[10, 11]。目前,所报道的较成功的键合型高分子-稀土配合物发光材料还比较少[12, 13],需要大力发展,以满足高新科学技术的需求。
键合型聚合物-稀土配合物发光材料一般是通过键合在聚合物侧链上的小分子配基(这些配基可通过功能单体的聚合或大分子的化学修饰获得) 与稀土离子之间的配位作用而形成的。然而,在已报道的键合型聚合物-稀土配合物发光材料中,聚合物侧链上参与配位的配基多数为脂肪羧基(主要来自于单体丙烯酸或甲基丙烯酸),脂肪羧基对稀土离子只起配位螯合的作用,无敏化功能,即不产生“天线”效应,需要加入协同配位的小分子配体,才能形成发光的材料[11, 14],这在很大程度上局限了该类功能材料的发光性能。针对此种情况,本课题组通过大量的研究实践,提出了一条制备高性能高分子-稀土配合物发光材料的新思路:通过分子设计,设法在聚合物侧链键合对稀土离子兼具有配位螯合和敏化发光双重功能的配基,即可获得稳定性高、发光性能强的高分子-稀土配合物。在前期的研究中,我们将具有此双功能的芳羧酸(苯甲酸和萘甲酸) 配基引入聚砜及聚苯乙烯侧链,制得了多种高性能的光致发光高分子-稀土配合物材料及其薄膜[15~18]。
席夫碱化合物是一类重要的金属离子配基,而且还能以多齿配基的形式存在,与金属离子实现螯合配位;更重要的是席夫碱配基大多具有共轭芳环,具有很强的光吸收性能,可能会发生强烈的分子内能量转移,因此,多齿的席夫碱配基也是一类兼具有配位螯合和敏化发光双重功能的配基。基于这一推断,我们曾报道将苯甲醛基团键合于聚砜侧链,制得了双齿席夫碱配基功能化的聚砜,通过大分子配体与Eu(Ⅲ) 离子的配位,获得了发射红光的席夫碱型高分子-稀土配合物[19]。本文则通过分子设计的另一思路,首先将水杨醛基团键合于聚砜侧链,然后制得了两种不同结构的水杨醛型双齿席夫碱配基功能化的聚砜,再与Eu(Ⅲ) 离子及Tb(Ⅲ) 离子配位,分别获得了发射红光与发射绿光的席夫碱型高分子-稀土配合物。本文重点报道两种大分子配体的制备与表征,也初步探索了所制备的高分子-稀土配合物的发光性能。
聚砜(PSF,MW:67000Da,上海塑料工业联合公司曙光化工厂),工业级;1,4-二氯甲氧基丁烷(BCMB,自制);对羟基水杨醛(HSA,阿拉丁工业公司),分析纯;苯胺(AN,国药集团化学试剂有限公司),分析纯;环己胺(CA,成都市科龙化工试剂厂),分析纯;Eu2O3(国药集团化学试剂有限公司),分析纯;Tb4O7(国药集团化学试剂有限公司),分析纯;N,N-二甲基乙酰胺(DMAC,天津市博迪化工股份有限公司),分析纯;N,N-二甲基甲酰胺(DMF,天津市博迪化工股份有限公司),分析纯;1,4-二氧六环(1,4-dioxane,天津市博迪化工股份有限公司),分析纯;其余试剂均为市售分析纯试剂。
1700型傅立叶变换红外光谱仪(FTIR,美国Perkin-Elmer公司);UV-2602型紫外/可见分光光度计(上海尤尼柯公司);DRX300型核磁共振谱仪(瑞士Bruker公司);HITACHIF-2500荧光光度计(日本日立公司)。
1.2 双齿席夫碱配基功能化聚砜PSF-SAN和PSF-SCA的制备
通过三步大分子反应,在聚砜侧链合成与键合双齿席夫碱配基,从而制得两种结构不同的双齿席夫碱配基功能化聚砜。
1.2.1 氯甲基化聚砜(CMPSF) 参照文献[20]
所述步骤制备。首先自制氯甲基化试剂BCMB[21],然后以SnCl4为路易斯酸催化剂,制得CMPSF,测得其氯含量为1.75mmol/g。
1.2.2 通过CMPSF氯甲基的亲核取代反应将水杨醛基团键合于聚砜侧链
在装有电动搅拌器、冷凝回流管及温度计的四口瓶中,加入0.5g CMPSF和25mL DMAC,再加入25mL溶有0.363g HSA的DMAC,并加入0.15g缚酸剂Na2CO3,恒温于80℃,在搅拌条件下,反应12h,反应结束后在产物溶液中加入150mL乙醇,沉淀出改性聚合物PSF-SA。此时体系中共有200mL上清液(50mL DMAC+150mL乙醇),取上清液样品,采用紫外分光光度法(λ=279nm) 测定反应液中未反应的HSA浓度,从而计算出SA在聚砜侧链的键合量,进一步计算出聚砜侧链氯甲基的转化率。抽滤分离出聚合物,用乙醇和蒸馏水交替洗涤,真空干燥至恒重,即得侧链键合有水杨醛SA的改性聚砜PSF-SA。
在四口烧瓶中加入50mL DMAC和0.35g PSF-SA,使之全部溶解,再加入0.1mL AN,恒温于65℃,搅拌下使改性聚砜PSF-SA大分子链中的水杨醛基团SA与AN分子中的伯氨基之间发生席夫碱缩合反应,8h后结束反应,加入150mL蒸馏水,将产物聚合物沉淀出来。此时体系中也共有200mL混合上清液(50mL DMAC+150mL水),取上清液样品,采用紫外分光光度法(λ=290nm) 测定反应液中未反应的AN浓度,从而计算双齿席夫碱配基SAN在聚砜侧链的键合量。分离出聚合物,用乙醇和蒸馏水交替洗涤,真空干燥至恒重,即得侧链键合有双齿席夫碱配基的功能化聚砜PSF-SAN。
在上述反应体系中,用0.1mL CA代替AN进行席夫碱缩合反应,最后得到另一种双齿席夫碱配基的功能化聚砜PSF-SCA。采用酸碱滴定法测定反应液中未反应的CA浓度,从而计算双齿席夫碱配基SCA在聚砜侧链的键合量。
IR 用KBr压片法测定PSF-SAN和PSF-SCA的红外光谱。
NMR 以氘代氯仿为溶剂,测定CMPSF和PSF-SA以及PSF-SAN和PSF-SCA的1H NMR谱,通过比较,进一步确认PSF-SAN和PSF-SCA的的化学结构。
如上所述,采用紫外分光光度法,间接测定PSF-SAN侧链上双齿席夫碱配基SAN的键合量;采用酸碱滴定法,间接测定PSF-SCA侧链上双齿席夫碱配基SCA的键合量。本研究在适宜的条件下所制得的PSF-SAN,其SAN的键合量为0.997mmol/g;所制得的PSF-SCA,其SCA的键合量为1.294mmol/g。
在上述三步大分子反应中,聚砜的氯甲基化反应本课题组已多有研究,而醛基与伯氨基之间的席夫碱缩合反应又易于进行,故为制得双齿席夫碱配基SAN键合量高的PSF-SAN,本研究重点考察了主要因素对CMPSF与HSA之间的亲核取代反应的影响。固定其他反应条件,分别系列地改变反应溶剂的种类和反应温度,考察这些因素对CMPSF与HSA之间亲核取代反应的影响,优化了反应条件,并探讨反应机理。
参照文献[22]所述步骤,分别以Eu(Ⅲ) 离子和Tb(Ⅲ) 离子为中心离子,PSF-SAN与PSF-SCA为大分子配体,制备了4种二元高分子-稀土配合物PSF-(SAN)3-Eu(Ⅲ)、PSF-(SAN)3-Tb(Ⅲ) 和PSF-(SCA)3-Eu(Ⅲ)、PSF-(SCA)3-Tb(Ⅲ)。以PSF-(SAN)3-Eu(Ⅲ) 为例,简述制备步骤:将0.40g PSF-SAN(含0.399mmol的配基SAN) 溶解于50mL DMAC中,再加入0.049g EuCl3·6H2O晶体(EuCl3的物质的量为0.133mmol),恒温于55℃,搅拌条件下反应8h。然后,以乙醇为沉淀剂沉淀出聚合物,用乙醇和蒸馏水洗涤,真空干燥,即得高分子-稀土配合物PSF-(SAN)3-Eu(Ⅲ)。
分别配制上述合成的4种配合物的DMAC溶液(使Tb3+及Eu3+的浓度均为2.0×10-5mol/L);先以Eu3+在620nm处的特征发射扫描PSF-(SAN)3-Eu(Ⅲ) 和PSF-(SCA)3-Eu(Ⅲ) 溶液的激发光谱,测得最佳激发峰在312nm,然后使用荧光光谱仪,以此为激发波长,测定此两种溶液的荧光发射光谱;以Tb3+在545nm处的特征发射扫描PSF-(SAN)3-Tb(Ⅲ) 和PSF-(SCA)3-Tb(Ⅲ) 溶液的激发光谱,测得最佳激发峰在274nm,以此为激发波长,测定此两种溶液的荧光发射光谱。
2.1 双齿席夫碱配基功能化聚砜PSF-SAN与PSF-SCA的制备
首先,以BCMB为氯甲基化试剂,使聚砜发生氯甲基化反应,制得CMPSF;然后以HSA为试剂,使CMPSF的氯甲基与HSA分子中4位羟基发生亲核取代反应(由于位阻的影响,醛基邻位的羟基不发生变化),获得侧链键合SA的PSF-SA;最后,分别以AN和CA为试剂,使PSF-SA侧链上的醛基与AN或CA分子中的伯氨基发生席夫碱缩合反应,从而分别在聚砜侧链上形成双齿席夫碱配基SAN和SCA(原水杨醛分子中邻位酚羟基的O原子与亚胺结构C=N中的N原子为“双齿”,使得两配基均可与稀土离子发生配位螯合),即获得了侧链键合有双齿席夫碱配基的功能化聚砜PSF-SAN和PSF-SCA。上述制备两种功能化聚砜的化学反应过程如图式1所示。从图式1中可以看出,两种配基SAN和SCA的化学结构不同,共轭体系的大小也不同,这将显著影响高分子-稀土配合物的光致发光性能(见后面的讨论)。
2.2 功能化聚砜PSF-SAN和PSF-SCA的表征
图 1 给出了CMPSF、PSF-SA、PSF-SAN和PSF-SCA这4种聚合物的红外光谱。
在CMPSF的谱图中,除显示出聚砜所有特征吸收峰外,还于1442cm-1处出现了氯甲基-CH2Cl中C—H键的面内弯曲振动吸收峰,于665cm-1处出现了C—Cl键的伸缩振动吸收峰,于881cm-1处还出现了苯环1、2、4号位上发生了三元取代后的特征吸收峰,表明CMPSF的生成。
在PSF-SA的谱图中,吸收峰发生了明显变化。氯甲基于1442cm-1和665cm-1处的特征吸收峰明显减弱甚至基本消失;与此同时,谱图上出现4个新峰:1677cm-1处出现了醛基CO键的特征吸收;2752cm-1处出现了醛基上C—H键伸缩振动吸收峰,1218cm-1处出现了芳香醚键的伸缩振动吸收;3450cm-1处出现了羟基的特征吸收峰。上述谱峰的变化充分表明,CMPSF的氯甲基已与HSA分子中4位羟基发生了亲核取代反应,形成了侧链键合有水杨醛基团的PSF-SA。
在PSF-SAN的谱图中,1677与2752 cm-1处的醛基特征吸收已明显减弱,而在1641cm-1处出现了CN键的伸缩振动吸收,这证实,大分子PSF-SA侧链上的醛基与AN分子中的伯胺基已发生了席夫碱缩合反应,形成了侧链键合双齿席夫碱配基SAN的PSF-SAN。
同样,在PSF-SCA的谱图中,1677与2752 cm-1处的醛基特征吸收已明显减弱甚至消失,而在1628cm-1处出现了C=N键的伸缩振动吸收,这证实大分子PSF-SA侧链上的醛基已与CA分子中的伯胺基发生了席夫碱缩合反应,形成了侧链键合双齿席夫碱配基SCA的PSF-SCA。
NMR 以氘代氯仿为溶剂,分别测定了CMPSF、PSF-SA、PSF-SAN和PSF-SCA的1H-NMR谱,图 2(A)、2(B)、图 2(C)与图 2(D)分别给出了4种聚合物的1H NMR谱图,并标出了各吸收峰与4种聚合物结构中诸氢质子的对应关系。
在CMPSF的谱图中,在 δ=6.831~7.883(b~h) 范围内的一组峰,对应于PSF大分子主链苯环上的各种氢的特征共振信号;双酚A单体单元上甲基氢的化学位移 δ=1.734(a);氯甲基上氢(i) 的化学位移 δ=4.541。
在PSF-SA的谱图中,除显示出聚砜主链上各种氢的共振吸收峰外,也出现了侧链所含各种氢的共振吸收峰:伴随着氯甲基的醚化,原氯甲基上氢已转变为醚键结构中的甲氧基氢(i),其化学位移由δ=4.541变化至δ=5.028(i);在化学位移 δ=11.421(j) 处出现了水杨醛上醛基-CHO氢的共振峰;δ=10.083(k) 处的峰为水杨醛上酚羟基氢的特征共振吸收;水杨醛苯环上3种氢的特征共振吸收(l,m和n) 与聚砜主链苯环上各种氢的特征共振信号交叠形成一组峰(b~h,l~n)。上述氢谱数据表明,经过CMPSF与HSA之间的亲核取代反应,在聚砜侧链上已成功键合水杨醛基团SA。
与 PSF-SA的谱图相比,在PSF-SAN的谱图中发生了如下变化:(1)δ=11.421处醛基-CHO氢的共振峰已消失;(2) 在δ=8.048(j) 处出现了亚胺基-CH=N-氢的共振吸收;(3) 苯胺苯环上氢(o,p及q处) 的特征共振吸收与聚砜主链苯环上各种氢及水杨醛苯环上各种氢的特征共振信号相互交叠形成一组峰(b~h,l~q)。上述氢谱数据进一步证实,改性聚砜PSF-SA侧链的醛基已与AN分子中的伯氨基发生了席夫碱缩合反应,形成了双齿席夫碱配基功能化的聚砜PSF-SAN。
同样,在PSF-SCA的谱图中发生了如下变化:(1)δ=11.421处醛基-CHO氢的共振峰已消失;(2) 在δ=8.563(j) 处出现了亚胺基-CH=N-氢的共振吸收;(3)δ=3.234(o) 处的峰为环己胺上与亚胺基相连的次甲基氢的共振吸收峰,而环己胺环上其他3种氢的共振吸收(p,q和r) 与聚砜主链上甲基氢的特征共振信号相互交叠形成一组峰(a,p~r)。上述氢谱数据也进一步证实,改性聚砜PSF-SA侧链的醛基已与CA分子中的伯氨基发生了席夫碱缩合反应,形成了双齿席夫碱配基功能化的聚砜PSF-SCA。
2.3 主要因素对CMPSF与HSA亲核取代反应的影响
如前所述,在制备双齿席夫碱配基功能化聚砜的三步大分子反应中,聚砜的氯甲基化是本课题组所建立的较为成熟的反应过程,而席夫碱缩合反应又易于进行,故氯甲基化聚砜CMPSF与4-羟基水杨醛之间的亲核取代反应是制备功能化聚砜PSF-SAN和PSF-SCA的关键的步骤。本研究重点考察了主要条件对此反应步骤的影响,以期优化反应条件,制备配基SAN及SCA键合量高的功能化聚砜。
亲核取代反应受溶剂极性的影响很大,故本研究选用极性不同的溶剂实施了CMPSF与HSA之间的反应,使用的溶剂分别为DMAC、DMF、DMF与1,4-二氧六环的混合液(V/V=1/1) 及1,4-二氧六环。表 1列出了各种溶剂的介电常数与极性常数数据,图 3则为4种反应体系中CMPSF大分子侧链上氯甲基的转化率随时间的变化曲线。
表 1
Table 1
表 1(Table 1)
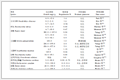
表 1 各种溶剂的介电常数与极性常数
Table 1 Dielectric constant and polarity parameter data for various solvents
|
Substance |
DMAC |
DMF |
DMF+Dioxane |
Dioxane
|
|
ε |
37.8 |
36.71 |
19.46 |
2.21 |
|
ET(30)/(kcal/mol) |
44.2 |
43.8 |
39.9 |
36 |
|
表 1 各种溶剂的介电常数与极性常数
Table 1 Dielectric constant and polarity parameter data for various solvents
|
从图 3中可以看出,在相同的条件下,于4种溶剂中亲核取代反应的速率大小顺序为:DMAC>DMF>Dioxane +DMF>Dioxane,与表 1中4种溶剂极性强弱顺序完全一致,此实验数据表明,使用极性较强的溶剂更有利于CMPSF与HSA之间的亲核取代反应。
CMPSF大分子链中氯甲基与HSA分子4位羟基之间亲核取代反应的实质是:在缚酸剂的存在下,氯甲基的C—Cl键断裂,失氯变为烷基碳正离子,HSA的酚羟基变为酚氧离子,成为亲核进攻基团,于是两者发生醚化反应,形成PSF-SA。氯甲基失氯变为碳正离子的容易程度与溶剂的极性关系密切,溶剂的极性越强,溶剂与氯甲基之间的偶极-偶极相互作用越强,越有利于氯原子的脱去,越有利于亲核取代反应的进行,显然,溶剂的极性增强可促进亲核取代反应的进行,故在极性较强的溶剂中,CMPSF与HSA之间的亲核取代反应越容易进行。本研究选择 DMAC为适宜的反应溶剂,在80 ℃下反应12 h,可使CMPSF的氯甲基转化率达到90%。
以DMAC为溶剂,在不同温度下进行了CMPSF与HSA之间的亲核取代反应,图 4 给出了不同温度下CMPSF的氯甲基转化率随反应时间的变化曲线。
从图 4可以看出,在所选取的温度范围内,CMPSF和HSA之间亲核取代反应速率随温度的升高而加快。图 4也显示,当温度升至90℃时,相同反应时间内氯甲基的转化率与80℃已十分接近,即此两个温度下亲核取代反应速率已十分相近,故本研究选取80℃作为CMPSF与HSA之间的取代反应的适宜温度,反应12h,可使CMPSF的氯甲基转化率达90%。
以功能化聚砜PSF-SAN为大分子配基,分别与Eu(Ⅲ) 离子及Tb(Ⅲ) 离子配位,得到二元配合物PSF-(SAN)3-Eu(Ⅲ) 和PSF-(SAN)3-Tb(Ⅲ),图 5给出了配合物PSF-(SAN)3-Eu(Ⅲ) 的红外光谱(配合物PSF-(SAN)3-Tb(Ⅲ) 的红外光谱与其具有一定的相似性),为进行比较,同时也给出了大分子配基PSF-SAN的红外光谱。
图 5显示,二元配合物PSF-(SAN)3-Eu(Ⅲ) 的红外光谱与大分子配基PSF-SAN的红外光谱相比较,有3个明显的特点:(1) 于418cm-1处出现了Eu—O键的伸缩振动吸收峰,表明配位键的形成;(2) 席夫碱亚胺CN键的伸缩振动吸收峰从1641cm-1处红移至1635cm-1,说明席夫碱亚胺CN键上的N原子与Eu(Ⅲ) 离子发生了配位作用;(3) 与原3450cm-1处酚羟基的特征吸收峰相比,该吸收峰的位置移动至3426cm-1,且宽度变大,强度变弱,可能的原因是酚羟基已变为酚氧离子与Eu(Ⅲ) 离子配位,此峰已不再是酚羟基的特征吸收峰,而可能是Eu(Ⅲ) 离子周围少量配位水分子的羟基。上述数据表明,键合配基SAN以双齿配基的形式与Eu(Ⅲ) 离子发生了螯合配位,形成了二元高分子-稀土配合物PSF-(SB)3-Eu(Ⅲ)。
以PSF-SAN为大分子配基,分别与Eu(Ⅲ) 离子及Tb(Ⅲ) 离子配位,得到二元配合物PSF-(SAN)3-Eu(Ⅲ) 和PSF-(SAN)3-Tb(Ⅲ),将配合物物溶于DMAC,配制成稀土离子浓度为2.0×10-5 mol/L的溶液,以最佳激发波长测定其荧光发射光谱,发现配合物PSF-(SAN)3-Eu(Ⅲ) 发射红光,而配合物PSF-(SAN)3-Tb(Ⅲ) 无光致发光性能。 图 6给出配合物PSF-(SAN)3-Eu(Ⅲ) 和EuCl3溶液的荧光发射光谱,图 7则给出两溶液在紫外光辐射下光致发光的照片。
图 6显示,大分子配体PSF-SAN本身在345nm处有荧光发射。从图式1 可以看到,在PSF-SAN侧链双齿席夫碱配基SAN的结构中,通过亚胺基CN的纽带,两边的芳环形成了一个大的共轭体系,会强烈地吸收紫外光而发生 π-π* 电子跃迁,电子激发至第二激发态,再通过弛豫过程降至第一激发态,然后发射出自身的荧光。但是,当大分子配体PSF-SAN与Eu(Ⅲ) 离子配位形成二元配合物PSF-(SAN)3-Eu(Ⅲ) 后,其本身的荧光发射大为减弱,几乎消失,这是发生了分子内能量转移的显著信号[22, 23]。
从图 6与图 7 可以看出:(1) 二元配合物PSF-(SAN)3-Eu(Ⅲ) 的荧光发射谱带的位置与形状与Eu(Ⅲ) 离子相同,表明配合物发射出Eu(Ⅲ) 离子的特征荧光,谱图中主要显示出Eu(Ⅲ) 离子580nm处的5D0→7F0跃迁、593nm处的5D0→7F1跃迁与620nm处的5D0→7F2跃迁所导致的发射。其中5D0→7F2跃迁所产生的发射最强,发射出强烈的红光;(2) 二元配合物PSF-(SAN)3-Eu(Ⅲ) 的荧光强度远比EuCl3强,提高约13倍,EuCl3的荧光发射很弱,溶液几乎是无色的。上述实验事实充分表明,对于二元配合物PSF-(SAN)3-Eu(Ⅲ),大分子配体PSF-SAN对Eu(Ⅲ) 离子的荧光发射产生了强烈的敏化作用,即产生了显著的天线效应,表明大分子配体侧链上的双齿席夫碱配基SAN的三线态能级与Eu(Ⅲ) 离子的共振能级是相互匹配的[24, 25],大分子配体PSF-SAN(实体是配基SAN) 吸收能量后,处于最低激发单重态(S1) 的电子大部分经系间窜越至三重态,再由最低激发三重态(T1) 以非辐射方式将能量传递给Eu(Ⅲ) 离子,然后受激的Eu(Ⅲ) 离子再以辐射方式跃迁到基态能级,从而发射出Eu(Ⅲ) 离子的特征荧光(红光)。与此同时,伴随着上述分子内的能量转移的发生,大分子配体PSF-SAN自身的荧光发射则几乎消失。
至于二元配合物PSF-(SAN)3-Tb(Ⅲ) 不发生光致发光现象,其可能的原因在于大分子配体PSF-SAN侧链上的双齿席夫碱配基SAN其三线态能级与Tb(Ⅲ) 离子的共振能级相互不匹配,即配基SAN对Tb(Ⅲ) 离子无敏化作用,详细的机理有待于进行进一步的深入研究。
以PSF-SCA为大分子配基,分别与Tb(Ⅲ) 离子及Eu(Ⅲ) 离子配位,得到二元配合物PSF-(SCA)3-Tb(Ⅲ) 和PSF-(SCA)3-Eu(Ⅲ),将配合物溶于DMAC,配制成稀土离子浓度为2.0×10-5mol/L的溶液,以最佳激发波长测定其荧光发射光谱,发现配合物PSF-(SCA)3-Tb(Ⅲ) 发射绿光,而配合物PSF-(SCA)3-Eu(Ⅲ) 无光致发光性能(其可能的原因也在于能级的不匹配)。图 8给出配合物PSF-(SCA)3-Tb(Ⅲ) 和TbCl3溶液的荧光发射光谱,图 9则给出两溶液在紫外光辐射下光致发光的照片。
图 8显示,大分子配体PSF-SCA本身在427nm处有荧光发射,但是,当大分子配体PSF-SCA与Tb(Ⅲ) 离子配位形成二元配合物PSF-(SCA)3-Tb(Ⅲ) 后,其本身的荧光发射大为减弱,表明发生了分子内能量转移。从图 7与图 8可以看出:(1) 二元配合物PSF-(SCA)3-Tb(Ⅲ) 的荧光发射谱带的位置与形状与Tb(Ⅲ) 离子相同,表明配合物发射出Tb(Ⅲ) 离子的特征荧光,谱图中主要显示出Tb(Ⅲ) 离子490nm处的5D4→7F6跃迁、547nm处的5D4→7F5跃迁、585nm处的5D4→7F4及621nm处的5D4→7F3跃迁所导致的发射,其中5D4→7F5跃迁所产生的发射最强,发射出较强的绿光;(2) 二元配合物的荧光强度远比TbCl3强,提高约8倍,TbCl3的荧光发射很弱,溶液几乎是无色的。上述实验事实表明,大分子配体PSF-SCA对Tb(Ⅲ) 离子的荧光发射产生了强烈的敏化作用,说明大分子配体侧链上的双齿席夫碱配基SCA的三线态能级与Tb(Ⅲ) 离子的共振能级是相互匹配的。大分子配体(实体是配基SCA) 吸收能量后,通过分子内能量转移,将能量传递给Tb(Ⅲ) 离子,使配合物发射出Tb(Ⅲ) 离子的特征荧光(绿光)。
总之,初步的探索研究表明,所制备的两种水杨醛型双齿席夫碱配基功能化聚砜PSF-SAN和PSF-SCA对稀土离子具有双重功能,即既具有配位螯合作用,又对其荧光发射具有显著的敏化作用。不过,由于两种双齿席夫碱配基的结构不同,导致它们所敏化的稀土离子不同,SAN强烈敏化Eu(Ⅲ) 离子的荧光发射,对Tb(Ⅲ) 离子的荧光发射则不产生敏化作用,二元配合物PSF-(SAN)3-Eu(Ⅲ) 发射红光;而SCA敏化Tb(Ⅲ) 离子的荧光发射,对Eu(Ⅲ) 离子的荧光发射则不产生敏化作用,配合物PSF-(SCA)3-Tb(Ⅲ) 发射绿光。关于上述高分子-稀土配合物详细的光物理过程与机理、结构与性能关系将另文报道。
通过分子设计,经过三步大分子反应(氯甲基化反应、亲核取代反应和席夫碱缩合反应),在聚砜侧链合成与键合了两种水杨醛型双齿席夫碱配基,成功地制备了两种双齿席夫碱配基功能化的聚砜PSF-SAN和PSF-SCA。氯甲基化聚砜与4-羟基水杨醛之间的亲核取代反应,适宜的溶剂为极性较强的N,N-二甲基乙酰胺,适宜的反应温度为80 ℃。双齿席夫碱配基SAN对Eu(Ⅲ) 离子具有敏化作用,高分子-稀土配合物 PSF-(SAN)3-Eu(Ⅲ) 是发射红光的光致发光材料;双齿席夫碱配基SCA对Tb(Ⅲ) 离子具有敏化作用,高分子-稀土配合物PSF-(SCA)3-Tb(Ⅲ) 是发射绿光的光致发光材料。
 2016,
Vol. 79
2016,
Vol. 79 Issue (1): 48-55,42
Issue (1): 48-55,42 2016,
Vol. 79
2016,
Vol. 79 Issue (1): 48-55,42
Issue (1): 48-55,42