2 西北大学生命科学学院, 西安 710069
2 College of Life Science, Northwest University, Xi'an 710027, China
蛋白质纳米孔分析技术融合了纳米技术、 生物技术和单分子技术,是最简单、 成本最低、 高灵敏的单分子检测技术。目前,基于α-溶血素纳米孔的分析技术已经在单分子检测、 单分子化学反应及单分子DNA测序等领域得到广泛应用,研究对象包括金属离子、 有机小分子、 DNA、 RNA、 多肽和蛋白质等多种物质[1~13]。α-溶血素纳米孔是由7个相同的蛋白质单体组装形成的蘑菇形离子通道,每个单体蛋白含有293个氨基酸。纳米通道长10 nm,口径2.6 nm,腔最大直径处4.6 nm,通道最窄处在中间位置,孔径1.5 nm,跨膜主干区长5 nm,直径2 nm[14]。溶血素纳米孔作为有机小分子传感器,主要是通过装配在纳米孔中的单个β-环糊精分子与有机分子的主-客体化学完成的。尽管环糊精的主-客体化学反应已有大量研究和应用,数千种有机分子能够通过非共价键作用键合在环糊精疏水腔中,然而装配环糊精的溶血素纳米孔仅能识别和检测非常有限的有机分子[3, 4, 15~17],这主要与溶血素纳米孔的形状、 大小和孔内电荷分布有关。因此,开发不同形状和性质的蛋白质纳米孔单分子传感器有重要的意义。
Mycobacterium smegmatis porin A(MspA)是耻垢分支杆菌Mycobacterium smegmatis细胞外膜中的主要成分。MspA蛋白质纳米孔是由分子量20 kDa的MspA单体蛋白构建的同源性八聚体,其形状为"八"字形杯状结构[18]。MspA蛋白质纳米孔最小处直径1.0 nm,长度0.5 nm,极短的β桶和"八"字形结构非常适合于制备纳米孔分子器件[19],空间效应和电荷效应影响较小。MspA纳米孔具有超强的热稳定性和化学稳定性,能够在pH 0-14的酸碱性溶液中保持结构稳定,在100℃下提取30 min,80℃在2% 十二烷基磺酸钠溶液中温育15 min仍能保持良好的通道活性[20]。同时,MspA易于进行多位点突变修饰,是一种良好的纳米孔检测传感器[19, 21]。
已经报道的MspA蛋白质纳米孔研究主要集中在DNA检测方面[19, 21~24],关于主客体化学研究及其有机小分子检测还未见报道。本研究以MspA蛋白质纳米孔为传感元件,研究了MspA纳米孔与全-6-氨基-β-环糊精(am7-β-CD)以及MspA/am7-β-CD纳米孔与有机药物分子盐酸金刚烷胺(1-AdNH2·HCl)的相互作用,发展了一种新的纳米孔传感器。对于全面认识MspA纳米孔的特性,探索其在主客体化学研究和有机小分子检测领域的应用,拓宽纳米孔单分子检测范围有着重要意义。
2 实验部分 2.1 仪器与试剂Axopatch 200B膜片钳放大器 (Axon Instruments,USA),4040A函数发生器 (BK Precision,USA)和1440A A/D数字转换器 (Axon Instruments,USA) 用于纳米通道的电流纪录。植烷酸卵磷脂1,2-diphytanoyl-sn-glycero-3-phosphocholine (DPhPC) 购自美国Avanti Polar Lipids公司; 戊烷 (>99.7%,Honeywell Burdick & Jackson公司); 十六烷 (>99%)和分析纯α-环糊精(α-CD)、 β-环糊精(β-CD)、 γ-环糊精(γ-CD)、 全-6-磺基-β-环糊精(S7-β-CD)、 全-6-氨基-β-环糊精(am7-β-CD)、 羧甲基-β-环糊精钠盐(CM-β-CD)、 全-6-季铵盐-β-环糊精(per-6-N+(CH3)3-β-CD)、 全-6-氨基-γ-环糊精(per-6-NH3Cl-γ-CD)、 盐酸金刚烷胺(1-AdNH2·HCl)均购自Sigma-Aldrich公司。 实验用水为超纯水(18.25 MΩ·cm)。
2.2 MspA蛋白质纳米孔制备MspA蛋白质纳米孔采用大肠杆菌BL21(DE3)pLysS体内表达制备方法。实验中以pT7(α-HL)质粒为模板,通过HindIII酶和NdeI酶双酶切反应获得pT7空质粒,通过酶连接反应将MspA合成基因连入pT7空质粒,得到pT7(MspA)重组质粒;将此pT7(MspA)重组质粒转入E.coil BL-21(DE3)pLysS菌株中,并在37℃条件下培养宿主菌,当细菌生长到对数期时,利用异丙基硫代半乳糖苷(IPTG)诱导MspA蛋白质在细菌体内高效表达。基于MspA蛋白质的超强稳定性,利用Triton-100/PBS缓冲液高温条件下选择性提取,所得提取液经凝胶电泳及切胶纯化获得高纯度的MspA蛋白质纳米孔,并通过膜片钳实验观测制备的MspA纳米孔能否在磷脂双分子层上打孔形成通道,并对比其通道参数与相关文献[19, 21]的一致性,验证其通道参数及成孔活性。
2.3 实验方法脂双层和单蛋白质通道的形成以及单通道电流记录按文献方法完成[9]。将MspA蛋白加入cis端隔室中,将一对Ag/AgCl电极浸入缓冲溶液中,施加在样品池两端的跨膜电压为+40 mV(指定cis端隔室为虚拟地)。待MspA蛋白自组装到磷脂双分子层膜上形成纳米通道时,记录不同电位下的通道电流及其环糊精分子和客体分子导致的电流变化。实验中采用的Axopatch 200B pA级电流通过膜片钳放大器(Axon Instruments,USA)进行采集,信号通过低通贝塞尔滤波进行过滤并将采集的模拟信号通过Digidata 1440A A/D 转换器(Axon Instruments)进行转换。使用的支持电解质为1 mol/L KCl-10 mmol/L Tris缓冲液(pH 9.0)。采样频率为20 kHz,滤波频率5 kHz。pClamp 10.3软件和Origin 8.5 用于数据统计和分析。
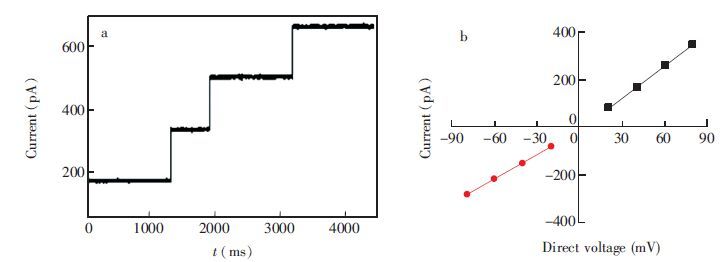
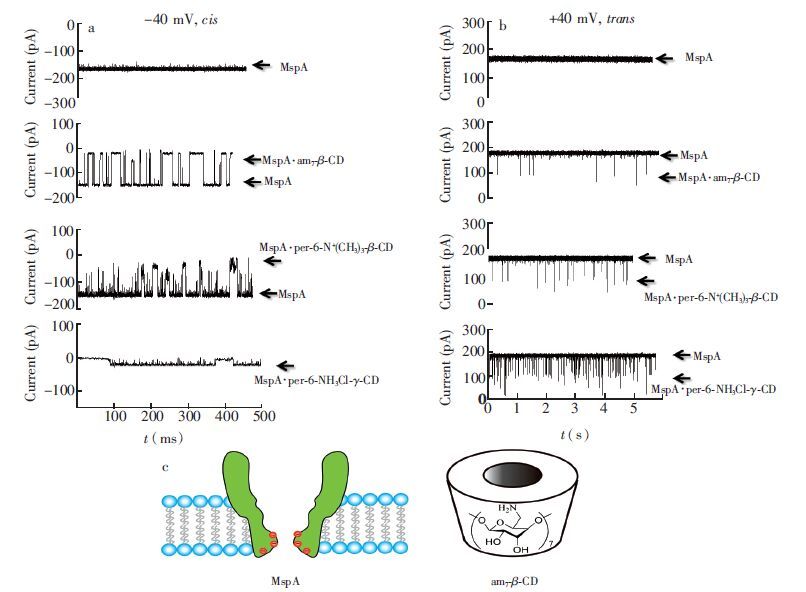
3 结果与讨论 3.1 环糊精适配体分子的选择本实验中,MspA蛋白纳米孔在宿主菌中表达良好,最佳提取条件为利用浓度0.5%的提取剂90℃提取30 min; 膜片钳实验结果表明,形成磷脂双分子层后,于检测池cis端加入1-2 μL稀释1000倍的MspA八聚体蛋白,等待数分钟,很快形成通道,且通道电流值呈台阶状递增,即很快形成多通道,证明MspA八聚体蛋白活性良好(图 1a)。在1 mol/L KCl-10 mmol/L Tris-HCl缓冲液中,+40 mV电压下,单通道电流为I=(180±5) pA,-40 mV下通道电流值为I=(-169±4) pA,通道电流值随电压增加呈线性增加,正电压下,I=4.4395VDC-9.3,R2=0.999;负电压下,I=3.4165VDC -11.9,R2=0.998(图 1b),相关通道参数与文献研究相符,通道背景干净,无干扰信号,证明所制备的MspA蛋白纳米孔纯度较高,通道性质良好,可用于后续单分子检测研究。为了筛选构建MspA/环糊精单分子传感器的环糊精适配体分子,实验考察了MspA纳米孔对多种环糊精分子:α-CD,β-CD,γ-CD,S7-β-CD,CM-β-CD,am7-β-CD,per-6-N+(CH3)3-β-CD,per-6-NH3Cl-γ-CD的响应情况。 在1 mol/L KCl-10 mmol/L Tris-HCl缓冲液(pH=9.0)中,无论环糊精加在纳米孔的cis端还是trans端,电中性的α-CD、 β-CD、 γ-CD分子以及带负电荷的S7-β-CD、 CM-β-CD分子均没有电流响应信号或持续时间太短;相反,带正电荷的am7-β-CD、 per-6-N+(CH3)3-β-CD和 per-6-NH3Cl-γ-CD分子加在cis端时,负电压下出现大量电流阻塞信号,加在trans端时,正电压下也有少量电流阻塞信号,但阻塞电流较小(图 2)。这种实验结果表明,特别是对正电荷氨基化环糊精分子的响应应该与MspA蛋白质纳米孔的自身结构和高负电荷密度区有关。MspA纳米孔收缩区β桶的长度仅为0.5 nm,当中性和负电荷环糊精分子从cis端(大口端)进入MspA纳米孔后,在收缩区停留时间太短,以至于很难检测到信号。然而,MspA八聚体纳米孔在90、 91和93位的天冬氨酸可形成密集的负电荷区域(图 2c),通过电荷相互作用可键合正电荷的am7-β-CD、 per-6-N+(CH3)3-β-CD和 per-6-NH3Cl-γ-CD分子。另一方面,当正电荷环糊精分子加在trans端时,环糊精分子从很短的收缩区向大口端运动,因而只能产生较小的阻塞电流,并且阻塞时间较短。从图 2a 还可见,在这些正电荷的环糊精分子中,am7-β-CD分子与MspA纳米孔之间相互作用特征较为明显。
|
图 1 MspA蛋白质纳米孔通道活性表征。(a): +40 mV电压下MspA蛋白质纳米孔通道形成情况; (b): MspA蛋白纳米通道开路电流随电压变化的I-V图 Figure 1 Electric properties of mycobacterium smegmatis porin A (MspA) nanopore: (a) Current recording from MspA nanopore at +40 mV; (b) I-V curves determined for single pore |
|
图 2 (a)和(b): MspA单通道电流及am7-β-CD、 per-6-N+(CH3)3-β-CD和 per-6-NH3Cl-γ-CD的阻塞电流记录,5 µmol/L正电荷环糊精分子分别加在cis端(a)和trans端(b),相应的施加电位分别为-40 mV和+40 mV;(c): MspA 纳米通道的平面结构图和am7-β-CD的化学结构图,其中90,91和93位的天冬氨酸用圆圈表示。 Figure 2 (a) and (b):single-channel current of MspA and current blocking records of am7-β-CD,per-6-N+(CH3)3-β-CD and per-6-NH3Cl-γ-CD. 5 µmol/L positively charged CDs were added to the cis side (a) and trans side (b),and the applied voltages were -40 mV and +40 mV accordingly. (c) plane structure diagram of MspA nanopore and chemical structure of am7-β-CD,while the aspartic acids in locations of 90,91 and 93 are marked as circles. CD: cyclodextrin |
3.2 MspA纳米孔与am7-β-CD单分子相互作用
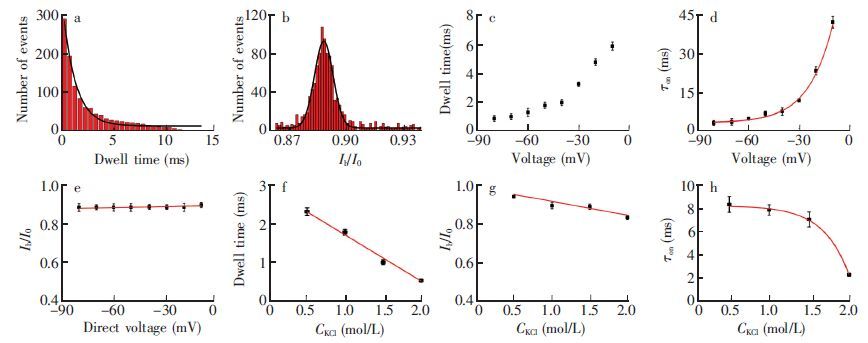
为了构建灵敏度高、 稳定性好的纳米孔主客体作用检测平台,进一步详细研究了am7-β-CD与MspA的相互作用,并考察了影响am7-β-CD与MspA相互作用的因素。am7-β-CD在MspA纳米孔中滞留时间与事件数符合指数分布,可通过指数拟合获得滞留时间统计值,而阻塞电流与开路电流比值Ib/I0与事件数符合高斯分布,可通过高斯拟合获得其Ib/I0值。
结果表明,-40 mV电压下,am7-β-CD在MspA纳米孔中滞留时间tD=1.89±0.06 ms (图 3a),阻塞电流与开路电流比值Ib/I0=0.89±0.01(图 3b)。kon=6.07×107 (mol/L)-1 s-1,koff= 5.29×102s-1,平衡常数K=1.15×105 L/mol,热力学常数ΔG=-6.90 kcal/mol。 MspA纳米孔与am7-β-CD的相互作用是电压相关的,随电压增大,am7-β-CD在MspA蛋白纳米孔中滞留时间有逐渐减小的趋势(图 3c)。 当电压由-40 mV变到-60 mV 时,平衡常数K由1.15×105 L/mol 变为1.43×105 L/mol,热力学常数ΔG由-6.90 kcal/mol变为-7.03 kcal/mol。 然而,am7-β-CD在MspA纳米孔中阻塞电流Ib/I0受电压改变的影响较小,基本保持不变(图 3e)。此外,盐浓度还对am7-β-CD与MspA的相互作用有影响。随KCl浓度增大,am7-β-CD在MspA纳米孔中的滞留时间及阻塞程度Ib/I0均随盐浓度增加而线性减小(图 3f和3g),拟合的线性方程分别为:tD=-1.1855CKCl+2.9065(R2=0.987); Ib/I0=-0.06958CKCl + 0.9735(R2=0.994)。 -40 mV检测电压下,当KCl浓度分别为1和2 mol/L时,kon分别为5.81×107和1.36×107 (mol/L)-1 s-1,koff分别为5.12×102和1.87×103s-1。盐浓度由1 mol/L变为2 mol/L时,平衡常数K由1.13×105 L/mol改变到7.27×103 L/mol,热力学常数ΔG由-6.89 kcal/mol变为-5.27 kcal/mol。这种盐浓度的影响表明,am7-β-CD和MspA纳米孔的作用主要是电荷相互作用[18]。
|
图 3 电压和盐浓度对MspA 和am7-β-CD相互作用的影响:(a)-40 mV电压下am7-β-CD阻塞信号的滞留时间柱状图;(b)-40 mV电压下am7-β-CD电流阻塞幅度柱状图;(c)am7-β-CD滞留时间随电压的变化;(d)am7-β-CD事件间隔时间随电压的变化;(e)am7-β-CD阻塞电流幅度随电压的变化(f)am7-β-CD滞留时间与KCl浓度的关系;(g)am7-β-CD阻塞电流幅度与KCl浓度的关系; (h) am7-β-CD事件间隔时间与KCl浓度的关系。其中am7-β-CD浓度为2 μmol/L,从MspA纳米孔cis端加入。 Figure 3 Effect of transmembrane voltage and salt concentration on interactions between am7-β-CD and MspA nanopore. (a) Histogram of dwell time for am7-β-CD; (b) Histogram of blockage current for am7-β-CD; (c) Effect of transmembrane voltage on dwell time of am7-β-CD; (d) Effect of transmembrane voltage on interval time of am7-β-CD; (e) [JP3]Effect of transmembrane voltage on blockage current of am7-β-CD; (f) Dwell time of am7-β-CD versus concentrations of KCl; (g) Blockage current of am7-β-CD versus concentrations of KCl; (h) Interval time of am7-β-CD versus concentrations of KCl . am7-β-CD was added to cis side of MspA nanopore with a concentration of 2 μmol/L. |
3.3 单分子主客体化学研究
药物分子金刚烷1-AdNH2·HCl 常作为一种代表性的模型化合物用于环糊精主客体化学的研究。本研究以MspA纳米孔作为分析元件,使用非共价键装配单个am7-β-CD适配体分子,并在单分子水平研究am7-β-CD和1-AdNH2·HCl之间的主客体化学,以证明构建的MspA/am7-β-CD纳米孔传感器能够用于有机小分子的单分子测定的可行性。
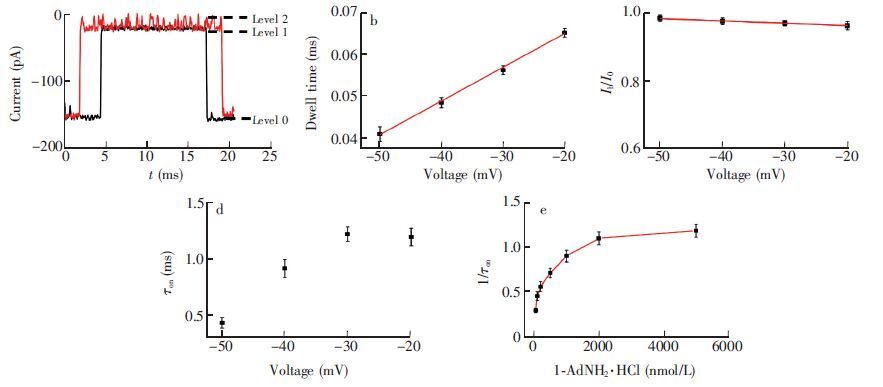
MspA/am7-β-CD纳米孔传感器对1-AdNH2·HCl的响应如图 4a所示,-40 mV电压下,MspA开路电流I0(level 0)为 (-159.46±1.52) pA,am7-β-CD响应平台(MspA·am7-β-CD复合物)Level 1电流值I1=(143.63±2.12)pA,1-AdNH2·HCl 响应平台(MspA·am7-β-CD·1-AdNH2·HCl复合物)level 2电流阻塞值为I2=(150.31±0.89)pA。在-40 mV电压下,加1-AdNH2·HCl于cis端导致MspA/am7-β-CD纳米孔传感器电流变化I2-I1≈ 6.68 pA。图 4b 是检测电压对1-AdNH2·HCl 响应的影响。随电压增大,1-AdNH2·HCl滞留时间减小,且与施加电压呈线性关系,tD=8.154×10-4VDC + 0.08(R2=0.996),而其阻塞程度Ib/I0随电压增大而略有增大(图 4c),且与电压呈线性关系,Ib/I0=-7.16×10-4VDC+ 0.950(R2= 0.916)。 -30 mV电压下,kon= 8.20×107 (mol/L)-1s-1,koff=1.79×104s-1,平衡常数K=4.58×103 L/mol,热力学常数ΔG=-4.99 kcal/mol。当电压从-30 mV降低至-50 mV时,平衡常数K由4.58×103 L/mol改变到1.59×103 L/mol,热力学常数ΔG由- 4.99 kcal/mol改变为-4.37 kcal/mol。
|
图 4 MspA/am7-β-CD纳米孔传感器对1-AdNH2·HCl的响应: (a) 1-AdNH2·HCl加入前后阻塞情况 (b) 电压对滞留时间的影响(c)电压对阻塞电流的影响 (d) 电压对事件间隔时间的影响 (e) -30 mV不同浓度1-AdNH2·HCl对应的事件频率 其中am7-β-CD浓度为2 μmol/L,1-AdNH2·HCl浓度为5 μmol/L,二者均从MspA纳米孔cis端加入 Figure 4 Response of MspA/am7-β-CD nanopore sensor to 1-AdNH2·HCl. (a) Representative events of am7-β-CD before (black) and after addition of 1-AdNH2·HCl. (b) Effect of voltage on dwell time of 1-AdNH2·HCl. (c) Effect of voltage on blockage current of 1-AdNH2·HCl. (d) Effect of voltage on event interval time of 1-AdNH2·HCl. (e) Plot of event frequency for level 2 corresponding to 1-AdNH2·HCl at various concentrations at -30 mV. Both the am7-β-CD and 1-AdNH2·HCl were added to the cis side of MspA nanopore with corresponding concentrations of 2 and 5 μmol/L. 1-AdNH2·HCl: 1-Amantadine hydrochloride. |
4 结 论
本研究考察了天然野生型MspA蛋白质纳米孔的生物物理性质,发展了一种可用于有机小分子分析的单分子传感器。结果表明,MspA蛋白质纳米孔的特殊结构非常适合于制备单分子传感器,高电荷密度的单个全-6-氨基-β-环糊精分子能够作为适配体分子组装在MspA蛋白质纳米孔的负电荷密度β桶收缩区,构建MspA/am7-β-CD单分子分析器件,并可通过单分子主-客体包结反应用于检测有机小分子。本研究对于探索MspA蛋白的应用,推进其在单分子检测领域的应用具有重要的意义,也为发展新型纳米孔传感器提供了一种新思路。
| 1 |
Yang C, Liu L, Zeng T, Yang D W, Yao Z Y, Zhao Y L, Wu H C. Anal. Chem, 2013, 85 :7302–7307 doi:10.1021/ac401198d |
| 2 |
Wang G H, Zhao Q T, Kang X F, Guan X Y. J. Phys. Chem. B, 2013, 117 (17):4763–4769 doi:10.1021/jp309541h |
| 3 |
Gu L Q, Braha O, Conlan S, Cheley S, Bayley H. Nature, 1999, 398 (6729):686–690 doi:10.1038/19491 |
| 4 |
Asandei A, Mereuta L, Luchian T. J. Phys. Chem. B, 2011, 115 :10173–10181 doi:10.1021/jp204640t |
| 5 |
Liu A H, Zhao Q T, Krishantha D M, Guan X Y. J. Phys. Chem. Lett, 2011, 2 :1372–1376 doi:10.1021/jz200525v |
| 6 |
Lathrop D K, Ervin E N, Barrall G A, Keehan M G, Kawano R, Krupka M A, White H S, Hibbs A H. J. Am. Chem. Soc, 2010, 132 :1878–1885 doi:10.1021/ja906951g |
| 7 |
Wanunu M, Cohen-Karni D, Johnson R R, Fields L, Benner J, Peterman N, Zheng Y, Klein M L, Drndic M. J. Am. Chem. Soc, 2011, 133 :486–492 doi:10.1021/ja107836t |
| 8 |
Yao F J, Zhang Y N, Wei Y F, Kang X F. Chem. Commun, 2014, 50 :13853–13856 doi:10.1039/C4CC06135G |
| 9 |
Yao F J, Duan J, Wang Y, Zhang Y, Guo Y L, Guo H L, Kang X F. Anal. Chem, 2015, 87 (1):338–342 doi:10.1021/ac503926g |
| 10 |
Wang Y, Yao F J, Kang X F. Anal. Chem, 2015, 87 (19):9991–9997 doi:10.1021/acs.analchem.5b02611 |
| 11 |
Cracknell J A, Japrung D, Bayley H. Nano Lett, 2013, 13 :2500–2505 doi:10.1021/nl400560r |
| 12 |
Tian K, He Z J, Wang Y, Chen S J, Gu L Q. ACS Nano, 2013, 7 (5):3962–3969 doi:10.1021/nn305789z |
| 13 |
Rotem D, Jayasinghe L, Salichou M, Bayley H. J. Am. Chem. Soc, 2012, 134 :2781–2787 doi:10.1021/ja2105653 |
| 14 |
SongL Z, Hobaugh M R, Shustak C, Cheley S, Bayley H, Gouaux J E. Science, 1996, 274 (5294):1859–1865 doi:10.1126/science.274.5294.1859 |
| 15 |
Kang X F, Cheley S, Guan X Y, Bayley H. J. Am. Chem. Soc, 2006, 128 :10684–10685 doi:10.1021/ja063485l |
| 16 |
WuH C, Astier Y, Maglia G, Mikhailova E, Bayley H. J. Am. Chem. Soc, 2007, 128 :16142–16148 |
| 17 |
Ayub M, Hardwick S W, Luisi B F, Bayley H. Nano Lett, 2013, 13 :6144–6150 doi:10.1021/nl403469r |
| 18 |
Faller M, Niederweis M, Schulz G E. Science, 2004, 303 (5661):1189–1192 doi:10.1126/science.1094114 |
| 19 |
Butler T Z, Pavlenok M, Derrington I M, Niederweis M, Gundlach J H. PNAS, 2008, 105 (52):20647–20652 doi:10.1073/pnas.0807514106 |
| 20 |
Heinz C, Karosi S, Niederweis M. J. Chromatogr. B, 2003, 790 :337–348 doi:10.1016/S1570-0232(03)00130-2 |
| 21 |
Derrington I M, Butler T Z, Collins M D, Manrao E, Pavlenokb M, Niederweis M, Gundlach J H. PNAS, 2010, 107 (37):16060–16065 doi:10.1073/pnas.1001831107 |
| 22 |
Manrao E A, Derrington I M, Pavlenok M, Niederweis M, Gundlach J H. PloS one, 2011, 6 (10):e25723 doi:10.1371/journal.pone.0025723 |
| 23 |
Laszlo A H, Derrington I M, Brinkerhoff H, Langford K W, Nova I C, Samson J M, Bartlett J J, Pavlenok M, Gundlach J H. PNAS, 2013, 110 (47):18904–18909 doi:10.1073/pnas.1310240110 |
| 24 |
Bhattacharya S, Derrington I M, Pavlenok M, Niederweis M, Gundlach J H, Aksimentiev A. ACS Nano, 2012, 6 (8):6960–6968 doi:10.1021/nn3019943 |
 2016, Vol. 44
2016, Vol. 44


