
Citation: Zhang Xiaoping, He Yongqin. Iodine Mediated Thioetherification of Indole at the 3-Position[J]. Chemistry, 2017, 80(5): 482-486.

碘作用下吲哚3位硫醚化反应
English
Iodine Mediated Thioetherification of Indole at the 3-Position
-
Key words:
- Iodine mediated
- / Indoles
- / Selective thioetherification
- / Heterocyclic thiols
- / C-S formation
-
吲哚及其衍生物是一类重要的芳香杂环化合物,普遍存在于自然界中,并广泛应用在农药、染料、香料、医药和精细化工等领域[1]。目前已从天然产物中分离出大量具有生物活性的3位硫醚化的吲哚及其衍生物[2~5]。此类化合物是一类重要的药物中间体,具有多种生物和药物活性,可用于治疗细菌传染病、肥胖症、HIV、心脏病、过敏症和癌症等[6~12],并且作为环氧酶抑制剂,能够很好地抑制微管蛋白的聚合[13],在医药化学中有着不可替代的地位[14]。
因此,吲哚及其衍生物与各类含硫化合物反应合成吲哚3位硫醚化合物,受到越来越多研究者的关注。文献已经报道了很多种吲哚3位硫醚化合物的合成方法,通常采用二硫化合物、苯磺酰氯、苯亚磺酸钠和烷基硫代硫酸盐等作为硫源[15~25]。然而,部分合成方法所用硫源试剂对水和氧气敏感、底物兼容性差并且伴有副产物生成[26, 27]。为了克服上述困难,研究者们选择N-氯代丁二酰亚胺、三氟醋酸碘苯或者过渡金属催化吲哚及其衍生物与硫醇的硫醚化反应[28, 29],发现其中一些合成方法只适用于2-羧基吲哚的硫醚化反应[24];而且,加入过渡金属对环境造成了一定的污染,加大了反应的后续处理难度;除此之外,部分反应需要惰性气体保护,使反应操作复杂化,不适合大规模生产。以上因素导致这些研究成果很难应用于实际生产。因而,探索一种条件温和、操作简单、环保经济的合成方法非常有必要。
2013年,Yang等[30]报道了吲哚及其衍生物与苯磺酰肼的硫醚化反应,该方法首次利用碘作为催化剂在较温和条件下合成吲哚3位硫醚化产物,但这类反应并没有得到深入研究与拓展。我们探索在碘作用下吲哚与其他硫源的反应,发现碘可促进吲哚及其衍生物与各类芳香族硫醇类化合物的直接硫醚化反应,在吲哚3位形成C-S键,得到吲哚3位硫醚产物。本文报道的合成方法操作简单、反应时间短、产率高,无需过渡金属催化与惰性气体保护,在空气中就可以进行反应。
1 实验部分
1.1 仪器与试剂
1H NMR和13C NMR均由Varian Mercury-plus 300 MHz或Bruker Avance 400MHz核磁共振谱仪测定;高分辨率质谱由Bruker APEX Ⅳ傅立叶变换离子回旋共振质谱仪(ESI源)测定;熔点用X-4精密显微熔点测定仪测定。所有实验药品均为市售分析纯试剂,购于上海萨恩化学科技有限公司和北京百灵威科技有限公司。柱层析使用200~300目硅胶,展开剂为石油醚(60~90℃)和乙酸乙酯。
1.2 实验方法
选择在简易的反应试管中进行试验。将0.20mmol的吲哚类化合物、0.30mmol芳香族硫醇类化合物、0.30mmol碘和1.0mL的二甲基亚砜(DMSO)一起加入装有搅拌子的反应器中,在90℃下反应8h。然后将反应液冷却至室温,加乙酸乙酯稀释,过滤,滤液中加水,用乙酸乙酯萃取,合并有机相,减压蒸馏得到粗产物,经过柱层析分离得到纯品。
3-(2-吡啶硫代)-(1H)-吲哚(3a):黄色固体41mg,产率92%,熔点106~108℃;1H NMR (400MHz,DMSO-d6)δ:11.79(s,1H),8.36(ddd,J=4.8、1.8、0.8 Hz,1H),7.80(d,J=2.7Hz,1H),7.53(d,J=8.1Hz,1H),7.47(td,J=7.8、1.9 Hz,1H),7.40(d,J=7.9Hz,1H),7.23~7.17(m,1H),7.11~7.06(m,1H),7.03(ddd,J=7.4、4.9、0.9 Hz,1H),6.61(d,J=8.1Hz,1H);13C NMR (101MHz,DMSO-d6)δ:162.22,149.08,136.98,136.81,132.73,128.51,122.24,120.29,119.51,118.95,118.18,112.44,98.07,40.13,39.92,39.71,39.50,39.29,39.08,38.87;HRMS(ESI) m/z:C13H10N2S [M+H]+,理论值227.0638,实测值227.0636。
5-甲氧基-3-(2-吡啶硫代)-(1H)-吲哚(3b):黄色油状物41mg,产率79%;1H NMR (300MHz,DMSO-d6)δ:11.64(s,1H),8.36(d,J=3.9Hz,1H),7.73(d,J=2.8Hz,1H),7.50(ddd,J =8.0、7.5、1.9 Hz,1H),7.45~7.38(m,1H),7.04(ddd,J=7.4、4.8、1.0 Hz,1H),6.93~6.76(m,2H),6.62(d,J=8.1Hz,1H),3.69(s,3H);13C NMR (75MHz,DMSO-d6)δ:162.80,154.92,149.57,137.48,133.64,132.17,129.78,119.98,119.36,113.78,112.93,100.02,98.08,55.76;HRMS (ESI) m/z:C14H12N2OS [M+H]+,理论值257.0743,实测值257.0745。
7-甲氧基-3-(2-吡啶硫代)-(1H)-吲哚(3c):白色固体40mg,产率78%,熔点167~169℃;1H NMR (300MHz,DMSO-d6)δ:11.93(s,1H),8.35(dd,J=4.8、1.0 Hz,1H),7.67(d,J=2.8Hz,1H),7.46(td,J=7.8、1.9 Hz,1H),7.10~6.93(m,3H),6.76(dd,J=6.0、2.6 Hz,1H),6.60(d,J=8.1Hz,1H),3.95(s,3H);13C NMR (75MHz,DMSO-d6)δ:162.73,149.53,147.12,137.42,132.63,130.65,127.37,121.48,119.96,119.44,111.29,103.22,99.12,55.77;HRMS(ESI) m/z:C14H12N2OS [M+H]+,理论值257.0743,实测值257.0745。
5-苄氧基-3-(2-吡啶硫代)-(1H)-吲哚(3d):白色固体54mg,产率81%,熔点155~157℃;1H NMR (300MHz,DMSO-d6)δ:11.65(s,1H),8.45~8.28(m,1H),7.73(d,J=2.8Hz,1H),7.58~7.17(m,7H),7.06(ddd,J=7.4、4.9、1.0 Hz,1H),6.93(m,2H),6.61(d,J=8.1Hz,1H),5.02(s,2H);13C NMR (75MHz,DMSO-d6)δ:173.78,154.59,137.23,135.37,134.38,128.42,126.62,124.42,123.09,122.04,121.57,121.33,118.49,113.13,97.68;HRMS(ESI) m/z:C20H16N2OS [M+H]+,理论值333.1056,实测值333.1053。
3-(2-吡啶硫代)-5-(1H)-吲哚甲酸甲酯(3e):白色固体43mg,产率75%,熔点172~174℃;1H NMR (300MHz,DMSO-d6)δ:12.15(s,1H),8.37(ddd,J=4.8、1.9、0.9 Hz,1H),8.11~8.01(m,1H),7.95(d,J=2.6Hz,1H),7.84(dd,J=8.6、1.7 Hz,1H),7.62(dd,J=8.6、0.6 Hz,1H),7.51 (ddd,J=8.1、7.5、1.9 Hz,1H),7.07(ddd,J=7.4、4.8、1.0 Hz,1H),6.66 (dt,J=8.1、0.9 Hz,1H),3.80(s,3H);13C NMR (75MHz,DMSO-d6)δ:167.36,161.96,149.73,139.99,137.75,135.35,128.79,123.67,122.31,120.93,120.33,119.61,113.14,100.31,52.31;HRMS(ESI) m/z:C15H12N2O2S [M+H]+,理论值285.0692,实测值285.0691。
6-氯-3-(2-吡啶硫代)-(1H)-吲哚(3f):白色固体45mg,产率87%,熔点192~195℃;1H NMR (300MHz,DMSO-d6)δ:12.11(s,1H),8.39~8.29(m,1H),7.81(d,J=2.7Hz,1H),7.60(d,J=1.6Hz,1H),7.48(td,J=7.8、1.9 Hz,1H),7.36(d,J=8.5Hz,1H),7.12~6.99(m,2H),6.61(d,J=8.1Hz,1H);13C NMR (75 MHz,DMSO-d6)δ:162.24,149.74,137.79,137.69,134.38,127.94,127.54,121.24,120.30,120.19,119.62,112.76,99.11;HRMS(ESI) m/z:C13H9ClN2S [M+H]+,理论值261.0248,实测值261.0245。
5-氯-3-(2-吡啶硫代)-(1H)-吲哚(3g):白色固体42mg,产率80%,熔点228~232℃;1H NMR (400MHz,DMSO-d6)δ:11.99(s,1H),8.36 (dd,J=4.8、0.9Hz,1H),7.89(d,J=2.7Hz,1H),7.56~7.48(m,2H),7.36(d,J=2.0Hz,1H),7.21(dd,J=8.6、2.1 Hz,1H),7.05(ddd,J=7.4、4.8、0.9 Hz,1H),6.64(d,J=8.1Hz,1H);13C NMR (101MHz,DMSO-d6)δ:161.61,149.22,13.15,135.32,134.58,129.95,125.15,122.35,119.73,119.02,117.27,114.18,98.02;HRMS(ESI) m/z:C13H9ClN2S [M+H]+,理论值261.0248,实测值261.0244。
2-(3-(1H)-吲哚硫代)苯并[d]噻唑(3h):黄色固体46mg,产率83%,熔点191~194℃;1H NMR (300MHz,DMSO-d6)δ:12.03(s,1H),8.03(d,J=2.8Hz,1H),7.87~7.72(m,2H),7.63~7.51(m,2H),7.47~7.35(td,J=7.5、3.0 Hz,1H),7.24(m,2H),7.15(m,1H);13C NMR(75MHz,DMSO-d6)δ:173.78,154.58,137.23,135.37,134.37,128.42,126.62,124.41,123.09,122.03,121.56,121.33,118.49,113.13,97.68;HRMS(ESI) m/z:C15H10N2S2 [M+H]+,理论值283.0358,实测值283.0357。
5-甲基-2-(3-(1H)-吲哚硫代)-1, 3, 4-噻二唑(3i):白色固体46mg,产率93%,熔点164~168℃;1H NMR (400MHz,DMSO-d6)δ:11.96(s,1H),7.97(d,J=2.8Hz,1H),7.56~7.50(m,2H),7.27~7.21(m,1H),7.16(td,J=7.5,0.9Hz,1H),2.50(s,3H);13C NMR (101MHz,DMSO-d6)δ:171.97,165.28,136.66,133.11,127.49,122.66,120.86,117.91,112.66,98.33;HRMS(ESI) m/z:C8H7N3S2 [M+H]+,理论值248.0311,实测值248.0309。
3-(4-吡啶硫代)-(1H)-吲哚(3j):黄色固体38mg,产率85%,熔点154~156℃;1H NMR (300MHz,DMSO-d6)δ:11.85(s,1H),8.26(s,2H),7.82(m,1H),7.60~7.48(m,1H),7.37(d,J=7.9Hz,1H),7.26~7.15(m,1H),7.14~7.02(m,1H),6.93(m,2H);13C NMR (75MHz,DMSO-d6)δ:151.47,149.55,137.29,133.60,128.73,122.90,120.96,120.01,118.50,113.08,96.51;HRMS(ESI) m/z:C13H10N2S[M+H]+,理论值227.0638,实测值227.0635。
3-(1-甲基-(1H)-四唑-5-硫代)-(1H)-吲哚(3k):黄色固体39mg,产率84%,熔点220~224℃;1H NMR (400MHz,DMSO-d6)δ:11.85(s,1H),7.93(d,J=2.8Hz,1H),7.51(t,J=8.4Hz,2H),7.25~7.17(m,1H),7.16~7.08(m,1H),4.02(s,3H);13C NMR (101MHz,DMSO-d6)δ:153.35,136.39,133.01,128.31,122.41,120.48,118.14,112.46,94.02,34.01;HRMS(ESI) m/z:C10H9N5S [M+H]+,理论值232.0652,实测值232.0653。
3-苯硫基-(1H)-吲哚(3l):黄色固体40mg,产率88%,熔点150~154℃;1H NMR (400MHz,CDCl3)δ:8.35(s,1H),7.61(d,J=8.0Hz,1H),7.43(dd,J=12.8、5.4 Hz,2H),7.28~7.22(m,1H),7.19~7.08(m,5H),7.08~7.00(m,1H);13C NMR(101MHz,CDCl3)δ:139.18,136.45,130.65,129.06,128.67,125.83,124.75,123.01,120.87,119.62,111.56,102.77;HRMS(ESI) m/z:C14H11NS[M+H]+,理论值226.0685,实测值226.0682。
3-对甲苯硫基-(1H)-吲哚(3m):白色固体44mg,产率91%,熔点169~172℃;1H NMR (400MHz,CDCl3)δ:8.37(s,1H),7.61(d,J=7.9Hz,1H),7.41(dd,J=11.8、5.2 Hz,2H),7.28~7.21(m,1H),7.14(t,J=7.5Hz,1H),7.02(d,J=8.2Hz,2H),6.96(d,J=8.2Hz,2H),2.24(s,3H);13C NMR (101MHz,CDCl3)δ:136.44,135.45,134.61,130.42,129.45,129.07,126.22,122.91,120.77,119.63,111.52,103.39,20.82;HRMS(ESI) m/z:C15H13NS[M+H]+,理论值240.0842,实测值240.0844。
二苯二硫醚(4):熔点55~56℃;1H NMR (400MHz,CDCl3) δ:8.46(m,2H),7.67~7.55(m,4H),7.11(m,2H);13C NMR (101MHz,CDCl3)δ:158.82,149.46,137.29,121.02,119.58。
2 结果与讨论
2.1 反应条件优化
选择吲哚(1a)和2-巯基吡啶(2b)作为反应底物,对反应条件进行优化。分别考察碘的用量、反应温度、溶剂对反应的影响。当碘用量由化学剂量比0.5倍量增加至1.5当量时,3a分离产率由45%增至86%(表 1,Entries 1~4)。考察温度对反应的影响(表 1,Entries 4~7),结果表明,90℃下反应时产物的收率最高。最后我们对溶剂进行了筛选,分别以甲苯、DMF、乙腈、1, 4-二氧六环、1, 2-二氯乙烷、N-甲基吡咯烷酮和DMSO为溶剂进行反应。结果表明,以DMSO作为溶剂时产率相对较高(表 1,Entries 6,8~13)。综合以上比较分析,确定的优化反应条件为:I2的加入量为1.5倍量,反应温度90℃,溶剂为DMSO,反应时间为8h(表 1,Entry 6)。

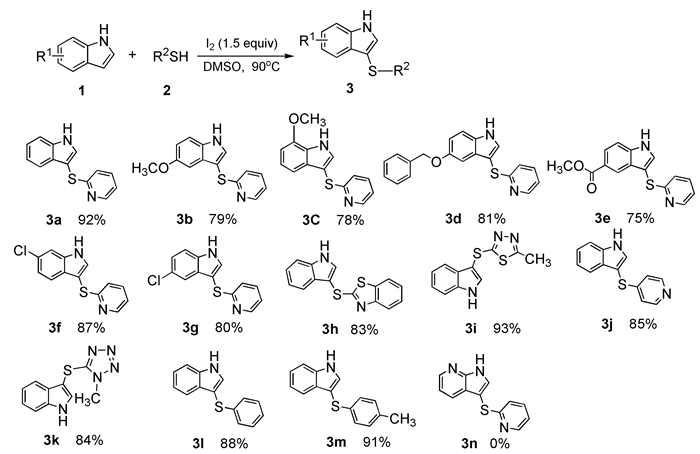
2.2 吲哚与各类芳香族硫醇的硫醚化反应底物拓展
在所确立的优化反应条件下对底物进行了拓展。首先,以2-巯基吡啶作为硫代试剂,考察吲哚苯环上的取代基对反应的影响。如图式1所示,吲哚苯环上连有供电子基5-OCH3、7-OCH3或吸电子基6-Cl、5-CO2Me时,都能以较高的产率得到相应的产物(75%~87%),并且取代基的位置对产率影响不大(图式1,3b和3c,3f和3g)。随后,考察了硫醇化合物对反应的影响,结果表明,各类杂环硫醇都能很好地与吲哚进行硫醚化反应,并以较高的产率(84%~93%)得到相应的产物(图式1,3h~3k);当硫源为苯基硫醇及取代苯基硫醇时,反应依然能够顺利进行(图式1,3l,3m)。但是,以7-氮杂吲哚为底物进行反应时,并没有得到相应的产物(图式1,3n)。
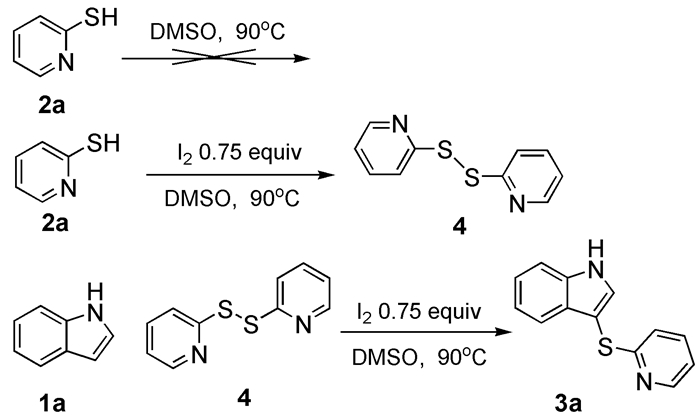
2.3 反应机理探讨
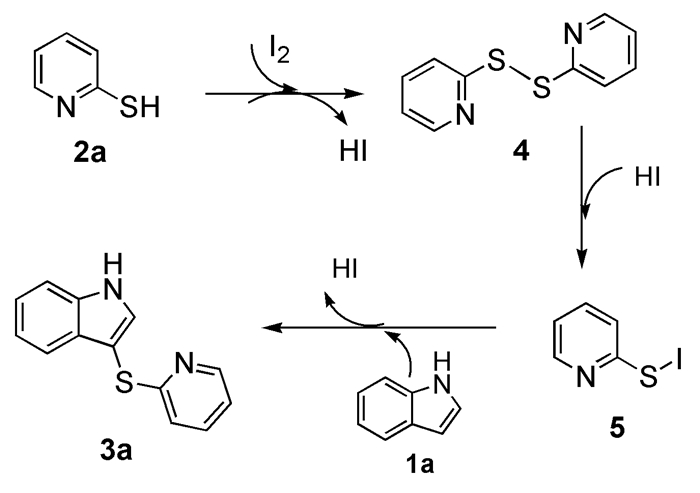
为了研究反应机理,我们进行了一些控制实验(图式2)。首先,当2-巯基吡啶加入到不含有碘的溶剂中搅拌,发现没有发生任何反应;接着将2-巯基吡啶加入含0.75倍量I2的DMSO溶液中,于90℃下搅拌反应,2h后发现有新的产物生成,8h后反应全部完成。分离产物(收率92%)经核磁数据分析得出为二硫醚化合物4。将化合物4与吲哚以摩尔比3:2加入含0.75倍量I2的DMSO溶液中,于90℃下搅拌反应5h后对产物进行分离,以90%的产率得到了目标产物3a。因此可以判定化合物4为反应的一个中间产物。
综合以上实验结果并参考文献报道[30, 31],我们给出以下反应机理:在碘作用下2-巯基吡啶(2a)自身发生反应生成二硫醚中间体4,中间体4在碘化氢作用下生成碘代硫醚中间体5,中间体5与吲哚进行偶联反应生成最终产物3a(图式3)。
3 结论
本文探索了一种条件温和、操作简便、无需过渡金属催化的吲哚3位硫醚化反应方法。在空气条件下,以DMSO为溶剂,在廉价易得的碘作用下吲哚衍生物与各种芳香族硫醇直接进行硫醚化反应,得到高产率的目标产物。本文的方法为吲哚3位硫醚化提供了一种高效的新途径。
-
-
[1]
P Sang, Y Xie, J Zou et al. Org. Lett., 14(15): 3894~3897. https://www.researchgate.net/publication/229089517_ChemInform_Abstract_Copper-Catalyzed_Sequential_Ullmann_N-Arylation_and_Aerobic_Oxidative_C-H_Amination_A_Convenient_Route_to_Indolo12-cquinazoline_Derivatives?ev=auth_pub
-
[2]
R J Sundberg. Indoles. Academic Press, 1996.
-
[3]
A Casapullo, G Bifulco, I Bruno et al. J. Nat. Prod., 2000, 63(4): 447~451. http://www.researchgate.net/publication/12532187_New_bisindole_alkaloids_of_the_topsentin_and_hamacanthin_classes_from_the_Mediterranean_marine_sponge_Rhaphisia_lacazei
-
[4]
T R Garbe, M Kobayashi, N Shimizu et al. J. Nat. Prod., 2000, 63(5): 596~598. http://www.researchgate.net/publication/248738667_Indolyl_Carboxylic_Acids_by_Condensation_of_Indoles_with_-Keto_Acids
-
[5]
B Bao, Q Sun, X Yao et al. J. Nat. Prod. 2005, 68(5): 711~715. http://www.researchgate.net/publication/7821291_Cytotoxic_bisindole_alkaloids_from_a_marine_sponge_Spongosorites_sp
-
[6]
T M Williams, T M Ciccarone, S C MacTough et al. J. Med. Chem., 1993, 36: 1291~1294. http://www.researchgate.net/publication/15514890_5-chloro-3-(phenylsulfonyl)indole-2-carboxamide_a_novel_non-nucleoside_inhibitor_of_hiv-1_reverse_transcriptase?ev=prf_cit
-
[7]
P Hamel. J. Org. Chem., 2002, 67(9): 2854~2858.
-
[8]
R Silvestri, G De Martino, G La Regina et al. J. Med. Chem., 2003, 46(12): 2482~2493. http://www.researchgate.net/publication/10737727_Novel_indolyl_aryl_sulfones_active_against_HIV-1_carrying_NNRTI_resistance_mutations_synthesis_and_SAR_studies
-
[9]
I Avis, A Martinez, J Tauler et al. Cancer Res., 2005, 65(10): 4181~4190. http://www.researchgate.net/publication/7841383_Inhibitors_of_the_arachidonic_acid_pathway_and_peroxisome_proliferator-activated_receptor_ligands_have_superadditive_effects_on_lung_cancer_growth_inhibition
-
[10]
C D Funk. Nat. Rev. Drug Disc., 2005, 4(8): 664~672. http://www.researchgate.net/profile/Colin_Funk/publication/7704851_Leukotriene_modifiers_as_potential_therapeutics_for_cardiovascular_disease/links/58065af508aeb85ac85f4a10/Leukotriene-modifiers-as-potential-therapeutics-for-cardiovascular-disease.pdf
-
[11]
G De Martino, G La Regina, A Coluccia et al. J. Med. Chem., 2004, 47(25): 6120~6123. http://www.researchgate.net/publication/8161771_Arylthioindoles_potent_inhibitors_of_tubulin_polymerization
-
[12]
S S Khandekar, D R Gentry, G S Van Aller et al. J. Biol. Chem., 2001, 276(32): 30024~30030. http://www.researchgate.net/profile/Glenn_Van_Aller/publication/11963807_Identification_Substrate_Specificity_and_Inhibition_of_theStreptococcus_pneumoniae_-Ketoacyl-Acyl_Carrier_Protein_Synthase_III_FabH/links/56ebdaf608ae24f05099078a.pdf
-
[13]
G De Martino, M C Edler, G La Regina et al. J. Med. Chem., 2006, 49(3): 947~954. http://www.researchgate.net/publication/7323145_New_arylthioindoles_potent_inhibitors_of_tubulin_polymerization._2._Structure-activity_relationships_and_molecular_modeling_studies
-
[14]
Y Maeda, M Koyabu, T Nishimura et al. J. Org. Chem., 2004, 69(22): 7688~7693 http://www.researchgate.net/publication/8219137_Vanadium-catalyzed_sulfenylation_of_indoles_and_2-naphthols_with_thiols_under_molecular_oxygen
-
[15]
J G Atkinson, P Hamel, Y Girard. Synthesis, 1988, 480~481. http://www.researchgate.net/publication/244564667_A_New_Synthesis_of_3-Arylthioindoles
-
[16]
Z Wu, Y Li, W Ding et al. Asian. J. Org. Chem., 2016, 5(5): 625~628.
-
[17]
F Xiao, H Xie, S Liu et al. J. Adv. Synth. Catal., 2014, 356: 364~368. http://www.researchgate.net/publication/264313987_ChemInform_Abstract_Iodine-Catalyzed_Regioselective_Sulfenylation_of_Indoles_with_Sodium_Sulfinates
-
[18]
H Qi, T Zhang, K Wan et al. J. Org. Chem., 2016, 81(10): 4262~4268.
-
[19]
E Scoffone, A Fontana, R Rocchi. Biochemistry, 1968, 7(3): 971~979. http://www.researchgate.net/publication/18867827_Sulfenyl_halides_as_modifying_reagents_for_polypeptides_and_proteins._I._Modification_of_tryptophan_residues
-
[20]
K Anzai. J. Heterocycl. Chem., 1979, 16(3): 567~569. http://www.researchgate.net/publication/243939032_Alkyl_and_arylthiation_of_uracil_and_indole
-
[21]
M Raban, L Chern. J. Org. Chem., 1980, 45(9): 1688~1691. http://www.researchgate.net/publication/231618261_Reactions_of_arenesulfenyl_chlorides_with_indole_Carbon-13_and_proton_nuclear_magnetic_resonance_spectra_of_3-arylthioindoles
-
[22]
P F Ranken, B G McKinnie. J. Org. Chem., 1989, 54(12): 2985~2988. http://www.researchgate.net/publication/231580165_Alkylthio_aromatic_amines
-
[23]
C C Browder, M O Mitchell, R L Smith et al. Tetrahed. Lett., 1993, 34(39): 6245~6246.
-
[24]
M Matsugi, K Murata, K Gotanda et al. J. Org. Chem., 2001, 66(7): 2434~2441. http://www.researchgate.net/publication/12051333_Facile_and_efficient_sulfenylation_method_using_quinone_mono-OS-acetals_under_mild_conditions
-
[25]
M Tudge, M Tamiya, C Savarin et al. Org. Lett., 2006, 8(4): 565~568. http://www.researchgate.net/publication/7305164_Development_of_a_novel_highly_efficient_halide-catalyzed_sulfenylation_of_indoles
-
[26]
C C Silveira, S R Mendes, L Wolf et al. Tetrahed. Lett., 2010, 51(15): 2014~2016.
-
[27]
J S Yadav, B V S Reddy, Y J Reddy. Tetrahed. Lett., 2007, 48(39): 7034~7037. http://www.researchgate.net/publication/232378542_A_rapid_synthesis_of_3-sulfenyl_indoles_using_Selectfluor
-
[28]
J A Campbell, C A Broka, L Gong et al. Tetrahed. Lett., 2004, 45(21): 4073~4075.
-
[29]
K M Schlosser, A P Krasutsky, H W Hamilton et al. Org. Lett., 2004, 6(5): 819~821. http://www.researchgate.net/publication/8683339_A_highly_efficient_procedure_for_3-sulfenylation_of_indole-2-carboxylates
-
[30]
F Yang, S Tian. Angew. Chem., 2013, 125, 5029~5032.
-
[31]
X Kang, R Yan, G Yu et al. J. Org. Chem., 2014, 79(21): 10605~10610.
-
[1]
-
表 1 反应条件优化a
Table 1. Optimization of the reaction conditions

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 14
- 文章访问数: 3818
- HTML全文浏览量: 1441


 下载:
下载:


 下载:
下载:

