
Citation: LI Shu-na, SHI Qi, LI Xiao-jun, FANG Zhen-hua, SUN Ping, ZHOU Yue-hua, ZHANG Xing-mei, YANG Xiao-hui. Low temperature CO oxidation over the ceria oxide catalysts doped with Fe, Ni and Cu[J]. Journal of Fuel Chemistry and Technology, 2017, 45(6): 707-713.

金属掺杂Ce-M(M=Fe、Ni和Cu)催化剂的CO低温氧化性能研究
English
Low temperature CO oxidation over the ceria oxide catalysts doped with Fe, Ni and Cu
-
Key words:
- doped ceria
- / iron oxide
- / nickel oxide
- / copper oxide
- / oxygen vacancies
- / CO oxidation
-
CO低温氧化催化剂在燃料电池、CO传感器、CO2激光器及环境保护等方面具有重要作用。Au、Pt及Pd等贵金属催化剂虽具有良好的低温活性,但其价格昂贵,资源有限,限制了其大规模的应用;非贵金属催化剂价格低廉、资源丰富,在一定程度上也是良好的CO低温氧化催化剂,因此,非贵金属催化剂的开发研制也是该领域的热点之一。
在众多非贵金属催化剂中,具有萤石型结构的稀土氧化物CeO2具有易氧化还原性,可以很快达到Ce3+/Ce4+平衡,因此,它可以在富氧条件下贮存氧,而在贫氧条件下释放氧。在催化领域,CeO2被广泛用作催化剂的结构助剂和电子助剂以提高催化剂的催化活性、选择性和热稳定性,如在甲烷催化燃烧、CO低温氧化及水煤气变换等反应中,CeO2作为催化剂的关键组分均具有重要的作用[1-4]。
但是,CeO2单独使用时,其本身热稳定性较差、储氧能力也有限,限制了其应用效果。在CeO2中引入低价阳离子形成固溶体能够显著提高其热稳定性、储氧能力和催化活性。这是由于掺杂离子与Ce4+半径和价态的差异导致CeO2的晶格畸变和表面缺陷,有利于氧空位形成。此外,氧空位的存在也能促进体相氧的氧化还原,增加体相氧的迁移速率,提高表层对氧的吸附和释放的能力[5]。Liu等[6]研究发现,用Co、Ni等过渡金属氧化物对CeO2掺杂,可以提高其抗H2O和CO2能力。Laguna等[7]制备了一系列过渡金属掺杂的CeM复合氧化物(M=Zr、Zn和Fe),发现掺杂得到的复合氧化物还原能力得到提升,并且掺杂后催化剂的CO低温氧化活性高于纯CeO2。Han等[8]发现,在CeO2中引入CuO能够促进氧空位的形成,提高晶格氧的流动性,提升其富氢气氛中CO选择性氧化的活性。近年来,通过引入其他金属氧化物来提升CeO2稳定性、催化活性的研究较多。然而,采用水热合成法制备不同金属掺杂的Ce-M(M=Fe、Ni和Cu)复合氧化物并系统研究Fe、Ni及Cu掺杂对CeO2结构及其CO低温氧化催化性能影响的报道较少。与传统的共沉淀法相比,于非平衡态的水热合成体系内进行液相反应能够制备出具有特殊优良性质的催化剂材料。作者前期的研究中也证实了水热合成法制备的CeO2-TiO2复合氧化物催化剂具有独特的棒状结构,其CO低温氧化活性高于共沉淀法制备的催化剂[9];并且水热合成过程中无模板剂添加、环境友好、反应条件温和易于控制。因此,本研究采用水热合成法制备了一系列不同金属掺杂的Ce-M(M=Fe、Ni和Cu)复合氧化物,以此产生更多的缺陷位,增加晶格氧的流动性,达到提高CO氧化催化活性的目的。重点考察了掺杂金属对Ce-M复合氧化物催化剂结构及CO低温氧化催化性能的影响;并运用低温N2吸附-脱附、XRD、H2-TPR、拉曼光谱、XPS等表征技术对Ce-M复合氧化物的结构与其催化性能之间的关系进行了关联。
1 实验部分
1.1 催化剂的制备
Ce-M(M=Fe、Ni、Cu)复合氧化物采用水热合成法制备。室温下,配制90 mL 6 mol/L的KOH溶液,剧烈搅拌下,将Ce(NO3)3·6H2O和掺杂金属的混合溶液(Fe(NO3)3·9H2O、Ni(NO3)2·6H2O和Cu(NO3)2·3H2O)滴加到上述KOH溶液中(Ce3+与掺杂金属离子的物质的量比为8:1),继续搅拌30 min,而后将其转移至不锈钢反应釜中,于100 ℃干燥箱中放置24 h。待反应釜冷却至室温,过滤,洗涤,收集样品。80 ℃空气条件下干燥12 h,400 ℃焙烧4 h,得到Ce-M复合氧化物,分别记为CeFe、CeNi和CeCu。作为参比的纯CeO2也采用相似的方法制备。
1.2 催化剂的表征
催化剂中金属元素的含量采用美国TJA公司的Atom Scan-16电感耦合等离子发射光谱仪(Inductively coupled plasma atomic emission spectroscopy)进行测定。
催化剂的比表面积采用Tri Star 3000型自动物理吸附仪(美国Micromeritics),通过低温N2吸附-脱附等温线测定;吸附前样品经200 ℃、0.133 Pa下在线脱气预处理。
XRD物相分析在Bruker公司的AXS D8衍射仪上进行。Cu Kα辐射(λ = 0.154 06 nm),管电压40 kV,管电流40 mA,步长0.02°,扫描速率6(°)/min,5°-85°扫描。
H2-TPR表征在Micromeritics AutoChem Ⅱ 2920上进行,H2/Ar为还原气(H2体积分数为10%),样品装量50 mg,热导检测(TCD)。样品首先在250 ℃下用O2/Ar(O2体积分数约5%)气流吹扫30 min;然后在相同的温度下,用Ar气流吹扫30 min,降至室温,切换为还原气(30 mL/min);待TCD信号稳定后,以10 ℃/min的升温速率从室温升至800 ℃,记录程序升温过程中的TCD信号。
催化剂的XPS谱图采用ULVAC PHI-5800光谱仪测量,X射线源使用Al Kα,结合能(BE)用284.6 eV的污染炭作校准。使用XPSPEAK 4.1软件对样品的能谱图进行拟合解迭,对样品表面的元素进行定性及半定量分析。
催化剂的拉曼光谱在Horiva Jobin Yvon Lab Ram HR800激光拉曼光谱仪上采集得到,光源是波长为154.5 nm的氩离子激光器,功率为20 mW,物镜为100×,光斑尺寸为10 μ m。记录光谱在0-4 000 cm-1,整个测试在室温和常压下完成。
1.3 CO氧化反应
CO氧化反应在固定床连续流动微型反应器(U形反应管

2 结果与讨论
2.1 Ce-M复合氧化物催化剂的比表面积和物相组成
表 1为Ce-M复合氧化物催化剂的ICP检测结果。由表 1可知,所有催化剂中Ce元素与掺杂金属元素的物质的量比均接近8,与制备催化剂时的投料比相差不大。说明采用水热合成法能够制得一定化学计量比的复合氧化物。

不同金属掺杂CeO2得到的Ce-M复合氧化物催化剂的比表面积见表 2。由表 2可知,与纯CeO2相比,不同金属掺杂后的催化剂比表面积有不同程度的降低。其中,CeFe催化剂的比表面积降幅较小,约为6%;CeNi和CeCu催化剂的比表面积降幅较大,约为33%。
 表 2
CeO2及Ce-M复合氧化物催化剂的比表面积和XRD分析
Table 2.
Surface area and XRD results of CeO2 and Ce-M mixed oxides with different dopants
表 2
CeO2及Ce-M复合氧化物催化剂的比表面积和XRD分析
Table 2.
Surface area and XRD results of CeO2 and Ce-M mixed oxides with different dopants

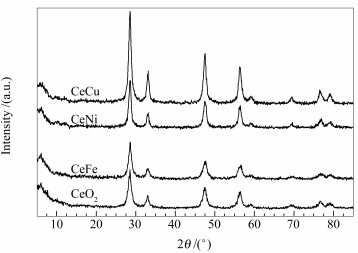
图 1为Ce-M复合氧化物催化剂的XRD谱图,作为参比的纯CeO2的XRD谱图也在图 1中给出,样品的晶胞参数和粒径分析结果见表 2。由图 1可知,纯CeO2的物相为方铈矿立方晶相,以方铈矿(111) 晶面计算的CeO2平均粒径为22.2 nm。在金属掺杂的Ce-M复合氧化物催化剂XRD谱图中,均只检测到CeO2方铈矿立方晶相的特征峰,而没有观察到有关掺杂物种的衍射峰,由此推断, 掺杂物种可能以无定型状态存在或是其颗粒粒径很小超出了XRD的检测限。Bao等[10]研究发现,Fe2O3-CeO2复合氧化物中Fe物相的物质的量比超过30%时,才检测到有关Fe物相的特征衍射峰。与此类似,NiO-CeO2复合氧化物中Ni物相及CuO-CeO2复合氧化物中Cu物相的物质的量比分别超过20%、15%时,才能检测到相关物相的特征衍射峰[3, 11, 12]。
由表 2的晶胞参数可知,金属掺杂后的Ce-M复合氧化物催化剂的晶胞参数均小于纯CeO2的晶胞参数,表明金属离子的掺杂导致了CeO2晶格的收缩变形。由于Fe3+(0.064 nm)、Ni2+(0.072 nm)及Cu2+(0.073 nm)的离子半径均小于Ce3+(0.103 nm)和Ce4+(0.099 nm)的离子半径,因此, 部分掺杂离子可能进入到了CeO2的晶格中,形成了固溶体[9, 13, 14]。此外,由表 2给出的晶粒粒径可知,CeFe催化剂的晶粒粒径与纯CeO2的接近,而CeNi和CeCu催化剂的晶粒粒径与纯CeO2相比较大,与其比表面积的急剧减小相符。
2.2 Ce-M复合氧化物催化剂的氧化还原性能
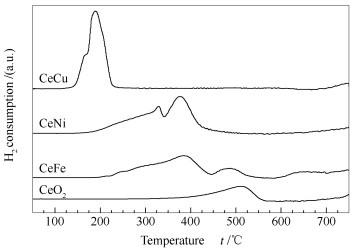
大量研究表明,第二组分进入CeO2晶格形成固溶体,不仅可以显著提高其热稳定性,而且可以提高其氧化还原能力。图 2为纯CeO2及Ce-M复合氧化物催化剂的H2-TPR谱图。由图 2可知,对于纯CeO2,H2-TPR谱图在514 ℃处出现一个还原峰,可归属为CeO2表面氧的还原,其体相晶格氧的还原出现在800 ℃左右[9]。由图 2还可知,Fe、Ni及Cu的掺入改变了CeO2的还原性,Ce-M复合氧化物的还原峰温度明显降低,峰面积更大,说明掺杂提高了CeO2的还原能力。联系XRD分析结果,这一现象应该与Ce-M复合氧化物中固溶体的形成有关。Laguna等[7]在研究Zr、Zn和Fe对CeO2的掺杂时也观察到类似的现象。对于CeFe复合氧化物,Fe3+的掺杂导致氧空位的形成,而氧空位比较容易吸附氧并生成活泼的氧物种,该氧物种比较容易被还原。联系Fe2O3的还原过程可知,Fe2O3到单质Fe的还原需经历两个步骤,即还原温度在约370 ℃处的赤铁矿到磁铁矿的还原(Fe2O3→Fe3O4)和还原温度约在600 ℃处的磁铁矿到单质Fe的还原(Fe3O4→FeO→Fe)[15]。因此,CeFe复合氧化物中384 ℃处的还原峰可归属为表面Fe2O3的初步还原;489 ℃处的还原峰归属为表面Fe2O3进一步还原和表面CeO2还原的叠加,以及少量铈铁固溶体的贡献[16]。
CeNi复合氧化物的H2-TPR谱图形状与CeFe复合氧化物相似,但其还原峰温度低于CeFe复合氧化物。在172-342 ℃出现的宽还原峰,可归属为表面吸附氧的还原[1]。Ni2+(0.072 nm)的离子半径和价态均不同于Ce3+(0.103 nm)和Ce4+(0.099 nm)。当Ni2+进入到CeO2的晶格中形成固溶体时,它们离子半径和价态之间的差异会导致CeO2的晶格畸变及电荷不平衡,进而导致氧空位的形成。氧空位的存在能增加体相氧的迁移速率;提高表层对氧的吸附能力,从而形成低温下就易被还原的活性氧物种。纯NiO的还原温度为300-400 ℃,CeNi复合氧化物H2-TPR谱图中378 ℃处的还原峰可归属为游离NiO的还原[17]。XRD谱图中没有检测到NiO的衍射峰,说明NiO的粒径很小或以无定型状态存在。
CeCu复合氧化物的H2-TPR谱图出现两个还原峰,189 ℃处的还原峰可归属为与CeO2相互作用的铜物种的还原,166 ℃处的肩峰归属为高分散的CuOx物种的还原[18, 19]。与CeFe、CeNi复合氧化物相比,CeCu复合氧化物的还原峰明显向低温方向移动,说明其氧化还原能力较前两者高。CO低温氧化反应的活性与催化剂的氧化还原能力密切相关,低的还原温度利于氧化反应的起燃。与纯CeO2相比,金属掺杂提高了CeO2的还原能力,由此可以推断,Ce-M复合氧化物催化剂的CO低温氧化反应的活性优于纯CeO2,尤其是CeCu复合氧化物催化剂。
2.3 Ce-M复合氧化物催化剂的拉曼光谱分析
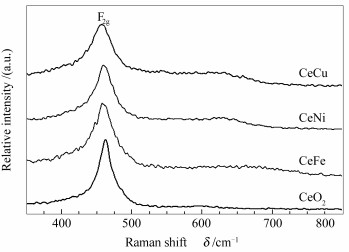
图 3为纯CeO2及Ce-M复合氧化物催化剂的拉曼光谱谱图。由图 3可知,纯CeO2出现两个拉曼振动峰,位于460 cm-1处的强峰归属为CeO2的F2g特征振动峰[20]。大约600 cm-1处的弱峰则归属为氧空位的特征峰[21],此拉曼峰的出现也证实了Ce3+的存在。
与纯CeO2相比,掺杂后Ce-M复合氧化物两个拉曼振动峰的位置和宽度都发生了变化,进一步证实了CeO2与掺杂金属离子之间的相互作用,与XRD分析结果相符。由图 3可知,Ce-M复合氧化物中F2g拉曼峰向低波数方向移动并且峰形宽化,这是由于Fe、Ni和Cu的引入改变了Ce离子周围的化学环境。其他有关CeFe和CeNi2O复合氧化物的文献报道中也观察到类似F2g拉曼峰向低波数方向移动和宽化的现象[17, 22]。F2g拉曼峰位置的偏移和峰形的宽化与很多因素有关,如声子限域效应、应变、尺寸分布效应、缺陷、尺寸引起的声子弛豫变化等[23]。纯CeO2与CeFe复合氧化物的晶粒粒径相差不大,因此,CeFe复合氧化物催化剂F2g拉曼峰位置的偏移和峰形的宽化归因于氧空位的形成;CeNi和CeCu复合氧化物催化剂的晶粒粒径与纯CeO2相差较大,其F2g拉曼峰的变化则是由尺寸效应和氧空位共同决定的 。此外,由图 3还可知,掺杂后得到的Ce-M复合氧化物中氧空位特征峰的强度高于纯CeO2,说明Ce-M复合氧化物中氧空位的数量多于纯CeO2。由此可知,Fe、Ni和Cu对CeO2的掺杂促进了氧空位的形成,这些氧空位被固定下来,最终使得Ce-M复合氧化物中F2g拉曼峰向低波数方向偏移且宽化。通常,以氧空位拉曼峰(Ov)与F2g拉曼峰的峰面积之比(Ov/F2g)表示材料中氧空位的相对含量,Ov/F2g值越大说明材料中氧空位越多。表 3为纯CeO2、不同金属离子掺杂的Ce-M复合氧化物催化剂的Ov/F2g值。由表 3可知,Ce-M复合氧化物中Ov/F2g值大于纯CeO2,进一步证实用Fe、Ni和Cu对CeO2掺杂能够促进其表面氧空位的形成。其中,经Ni、Cu掺杂得到的CeNi、CeCu复合氧化物催化剂Ov/F2g值较大,说明选择合适的掺杂金属离子对于氧空位的形成来说非常重要。据文献报道,氧空位的存在利于含CeO2组分催化剂上CO氧化反应的进行;此外,CO氧化反应Marsvan Krevelen-type机理中也包括伴随有表面氧空位形成并被气相氧补充的表面氧化还原重要步骤[24]。因此,催化剂中氧空位越多,越有利于提升其在CO氧化反应中的活性。
 表 3
CeO2及Ce-M复合氧化物催化剂的拉曼光谱和XPS分析
Table 3.
Raman and XPS analysis results of CeO2 and Ce-M mixed oxides with different dopants
表 3
CeO2及Ce-M复合氧化物催化剂的拉曼光谱和XPS分析
Table 3.
Raman and XPS analysis results of CeO2 and Ce-M mixed oxides with different dopants

2.4 Ce-M复合氧化物催化剂的X射线光电子能谱分析
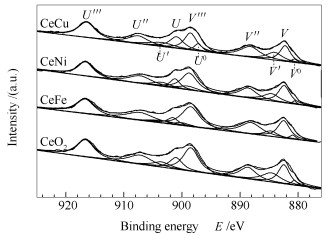
图 4为纯CeO2及Ce-M复合氧化物催化剂的Ce 3d XPS谱图。由图 4可知,纯CeO2及Ce-M复合氧化物催化剂中都含有两种Ce物种,即Ce3+(Ce(Ⅲ))和Ce4+(Ce(Ⅳ))。图 4中901.3和882.7 eV处的U和V信号峰、907.7和888.9 eV处的U″和V″信号峰及916.5和898.4 eV处的U′′′和V′′′信号峰的出现,证实了Ce(Ⅳ)的存在;899.0、880.6、903.5和884.6 eV处U0、V0、U′和V′信号峰的出现,则证实了Ce(Ⅲ)的存在[25]。Ce(Ⅲ)的存在归因于CeO2与周围原子的相互作用,同时也揭示了氧空位的存在。此外,不同价态Ce物种的存在易于进行Ce4+和Ce3+之间的氧化还原循环,有利于活性氧的储存和释放,促使了CO氧化成CO2反应的进行,进而有利于CO催化氧化反应的进行。表 3给出了纯CeO2及Ce-M复合氧化物催化剂中Ce(Ⅲ)的含量CCe(Ⅲ),它是由Ce 3d XPS谱图中Ce(Ⅲ)和Ce(Ⅳ)的积分面积计算得到的,其计算公式如下:
由表 3的数据可以看出,纯CeO2中Ce(Ⅲ)的含量为16.35%,而Fe、Ni和Cu掺杂得到的Ce-M复合氧化物中Ce(Ⅲ)的含量明显增加,尤其是CeCu复合氧化物,其Ce(Ⅲ)的含量达到了20.39%,进一步说明用不同价态和半径的金属离子对CeO2进行掺杂能够形成更多的氧空位,与以上的拉曼光谱分析结果一致。
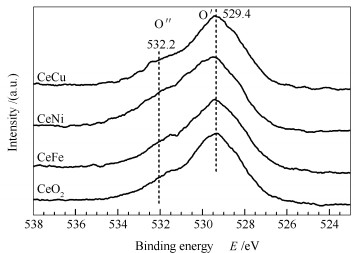
图 5为纯CeO2及Ce-M复合氧化物催化剂的O 1s XPS谱图。图 5中位于529.4 eV处的O′主峰是铈氧化物和掺杂金属氧化物晶格氧的峰,532.2 eV处出现的O″肩峰归属于催化剂表面化学吸附氧及氢氧化物、吸附水中的氧[26]。
表 3给出了纯CeO2及Ce-M复合氧化物催化剂中表面化学吸附氧与晶格氧的峰面积比值,由表 3可知,将Fe、Ni和Cu掺入CeO2得到的Ce-M复合氧化物催化剂中,表面化学吸附氧的含量高于纯CeO2,说明掺杂得到的Ce-M复合氧化物催化剂更有利于氧的吸附和活化。
2.5 Ce-M复合氧化物催化剂的CO催化氧化活性
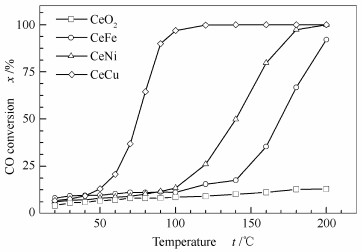
图 6为纯CeO2及Ce-M复合氧化物催化剂的CO转化率随反应温度的变化。由图 6可知,纯CeO2的催化活性非常低,200 ℃时,其CO转化率仅为13.05%。但是,将Fe、Ni和Cu掺入CeO2后,Ce-M复合氧化物催化剂的活性明显提高。200 ℃时,CeFe复合氧化物催化剂的CO转化率为92.07%;CeNi及CeCu复合氧化物完全催化氧化CO的温度分别是180和130 ℃。结合前面H2-TPR谱图及拉曼光谱分析结果可知,Fe、Ni和Cu对CeO2掺杂能够促进其表面氧空位的形成,提高晶格氧的流动性,从而使得催化剂的还原能力和催化活性得到提升。其中,Cu掺杂得到的催化剂氧空位最多且其还原能力最好,因而其催化活性最高;Ni掺杂得到的催化剂氧空位的量及还原能力优于Fe掺杂得到的催化剂,因而,其催化活性较CeFe催化剂高。
3 结论
将Fe、Ni和Cu掺入CeO2明显提高了Ce-M催化剂中氧空位的含量及晶格氧的流动性,从而使Ce-M催化剂的还原能力和催化活性高于纯CeO2。其中,CeCu催化剂氧空位最多,还原能力最好,催化活性最高,130 ℃时可将CO完全氧化;其次是CeNi催化剂,180 ℃时可将CO完全氧化;与之相比,CeFe催化剂的活性最差,200 ℃时的CO转化率仅为92%。
-
-
[1]
SHAN W J, LUO M F, YING P L, SHEN W J, LI C. Reduction property and catalytic activity of Ce1-xNixO2 mixed oxide catalysts for CH4 oxidation[J]. Appl Catal A: Gen, 2003, 246(1): 1-9. doi: 10.1016/S0926-860X(02)00659-2
-
[2]
KIM H Y, HENKELMAN G. CO oxidation at the interface between doped CeO2 and supported Au nanoclusters[J]. J Phys Chem Lett, 2012, 3(16): 2194-2199. doi: 10.1021/jz300631f
-
[3]
TANG C J, LI J C, YAO X J, SUN J F, CAO Y, ZHANG L, GAO F, DENG Y, DONG L. Mesoporous NiO-CeO2 catalysts for CO oxidation: Nickel content effect and mechanism aspect[J]. Appl Catal A: Gen, 2015, 494: 77-86. doi: 10.1016/j.apcata.2015.01.037
-
[4]
SI R, FLYTZANI-STEPHANOPOULOS M. Shape and crystal-plane effects of nanoscale ceria on the activity of Au-CeO2 catalysts for the water-gas shift reaction[J]. Angew Chem Int Ed, 2008, 47(15): 2884-2887. doi: 10.1002/(ISSN)1521-3773
-
[5]
李岚, 胡庚申, 鲁继青, 罗孟飞. CeO2基固溶体氧缺位拉曼光谱表征的研究进展[J]. 物理化学学报, 2012,28,(5): 1012-1020. LI Lan, HU Geng-shen, LU Ji-qing, LUO Meng-fei. Review of oxygen vacancies in CeO2-doped solid solutions as characterized by Raman spectroscopy[J]. Acta Phys-Chim Sin, 2012, 28(5): 1012-1020.
-
[6]
LIU W, SAROFIM A F, FLYTZANI-STEPHANOPOULOS M. Reduction of sulfur dioxide by carbon monoxide to elemental sulfur over composite oxide catalysts[J]. Appl Catal B: Environ, 1994, 4(2/3): 167-186.
-
[7]
LAGUNA O H, ROMERO SARRIA F R, CENTENO M A, ODRIOZOLA J A. Gold supported on metal-doped ceria catalysts (M=Zr, Zn and Fe) for the preferential oxidation of CO (PROX)[J]. J Catal, 2010, 276(2): 360-370. doi: 10.1016/j.jcat.2010.09.027
-
[8]
HAN J, KIM H J, YOON S, LEE H. Shape effect of ceria in Cu/ceria catalysts for preferential CO oxidation[J]. J Mol Catal A, 2011, 335(1/2): 82-88.
-
[9]
LI S N, ZHU H Q, QIN Z F, WANG G F, ZHANG Y G, WU Z W, LI Z K, CHEN G, DONG WW, WU Z H, ZHENG L R, ZHANG J, HU T D, WANG J G. Morphologic effects of nano CeO2-TiO2 on the performance of Au/CeO2-TiO2 catalysts in low-temperature CO oxidation[J]. Appl Catal B: Environ, 2014, 144(2): 498-506.
-
[10]
BAO H Z, CHEN X, FANG J, JIANG Z Q, HUANG W X. Structure-activity relation of Fe2O3-CeO2 composite catalysts in CO oxidation[J]. Catal Lett, 2008, 125(1): 160-167.
-
[11]
AVGOUROPOULOS G, IOANNIDES T, MATRALIS H. Influence of the preparation method on the performance of CuO-CeO2 catalysts for the selective oxidation of CO[J]. Appl Catal B: Environ, 2005, 56(1/2): 87-93.
-
[12]
PAPAVASILIOU J, AVGOUROPOULOS G, IOANNIDES T. Effect of dopants on the performance of CuO-CeO2 catalysts in methanol steam reforming[J]. Appl Catal B: Environ, 2007, 69(3/4): 226-234.
-
[13]
LI J, ZHU P F, ZHOU R X. Effect of the preparation method on the performance of CuO-MnOx-CeO2 catalysts for selective oxidation of CO in H2-rich streams[J]. J Power Sources, 2011, 196(22): 9590-9598. doi: 10.1016/j.jpowsour.2011.07.052
-
[14]
MAHAMMADUNNISA S, MANOJ KUMAR REDDY P, LINGAIAH N, SUBRAHMANYAM C H. NiO/Ce1-xNixO2-δ as an alternative to noble metal catalysts for CO oxidation[J]. Catal Sci Technol, 2013, 3(3): 730-736. doi: 10.1039/C2CY20641B
-
[15]
LLIEVA L, PANTALEO G, IVANOV I, MEXIMOVA A, ZANELLA R, KASZKUR Z, VENEZIA A M, ANDREEVA D. Preferential oxidation of CO in H2 rich stream (PROX) over gold catalysts supported on doped ceria: Effect of preparation method and nature of dopant[J]. Catal Today, 2010, 158(1/2): 44-55.
-
[16]
晏冬霞, 王华, 李孔斋, 魏永刚, 祝星, 程显名. Ce1-xFexO2复合氧化物的结构及其催化碳烟低温燃烧性能[J]. 物理化学学报, 2010,26,(2): 331-337. YAN Dong-xia, WANG Hua, LI Kong-zhai, WEI Yong-gang, ZHU Xing, CHENG Xian-ming. Structure and catalytic property of Ce1-xFexO2 mixed oxide catalysts for low temperature soot combustion[J]. Acta Phys-Chim Sin, 2010, 26(2): 331-337.
-
[17]
LIU Y M, WANG L C, CHEN M, XU J, CAO Y, HE H Y, FAN K N. Highly selective Ce-Ni-O catalysts for efficient low temperature oxidative dehydrogenation of propane[J]. Catal Lett, 2009, 130(3): 350-354.
-
[18]
SI R, RAITANO J, YI N, ZHANG L H, CHAN S W, FLYTZANI-STEPHANOPOULOS M. Structure sensitivity of the low-temperature water-gas shift reaction on Cu-CeO2 catalysts[J]. Catal Today, 2012, 180(1): 68-80. doi: 10.1016/j.cattod.2011.09.008
-
[19]
郑修成, 张晓丽, 王淑荣, 于丽华, 王向宇, 吴世华. 不同CuO/CeO2催化剂上CO低温氧化反应[J]. 催化学报, 2005,26,(11): 971-976. doi: 10.3321/j.issn:0253-9837.2005.11.010ZHENG Xiu-cheng, ZHANG Xiao-li, WANG Shu-rong, YU Li-hua, WANG Xiang-yu, WU Shi-hua. Low-temperature CO oxidation over different CuO/CeO2 catalysts[J]. Chin J Catal, 2005, 26(11): 971-976. doi: 10.3321/j.issn:0253-9837.2005.11.010
-
[20]
FRANCISCO M S P, MASTRLARO V R, NASCENTE P A P, FLORENTINO A O. Activity and characterization by XPS, HR-TEM, Raman spectroscopy, and BET surface area of CuO/CeO2-TiO2 catalysts[J]. J Phys Chem B, 2001, 105(43): 10515-10522. doi: 10.1021/jp0109675
-
[21]
REDDY B M, KHAN A, YAMADA Y, KOBAYASHI T, LORIDANT S, VOLTA J C. Structural characterization of CeO2-MO2 (M = Si4+, Ti4+, and Zr4+) mixed oxides by Raman spectroscopy, X-ray photoelectron spectroscopy, and other techniques[J]. J Phys Chem B, 2003, 107(41): 11475-11484. doi: 10.1021/jp0358376
-
[22]
LAGUNA O H, CENTENO M A, ARZAMENDI G, GANDÍA L M, ROMERO-SARRIA F, ODRIOZOLA J A. Iron-modified ceria and Au/ceria catalysts for total and preferential oxidation of CO (TOX and PROX)[J]. Catal Today, 2010, 157(1/4): 155-159.
-
[23]
HERNÁNDEZ W Y, CENTENO M A, ROMERO-SARRIA F, ODRIOZOLA J A. Synthesis and characterization of Ce1-xEuxO2-x/2 mixed oxides and their catalytic activities for CO oxidation[J]. J Phys Chem C, 2009, 113(14): 5629-5635. doi: 10.1021/jp8092989
-
[24]
QIAN K, LV S S, XIAOX Y, SUNH X, LU J Q, LUO M F, HUANG W X. Influences of CeO2 microstructures on the structure and activity of Au/CeO2/SiO2 catalysts in CO oxidation[J]. J Mol Catal A, 2009, 306(1/2): 40-47.
-
[25]
BÊCHE E, CHARVIN P, PEREARNAU D, ABANADES S, FLAMANT G. Ce 3d XPS investigation of cerium oxides and mixed cerium oxide (CexTiyOz)[J]. Surf Interface Anal, 2008, 40(3/4): 264-267.
-
[26]
ŚWIATOWSKA J, LAIR V, PEREIRA-NABAIS C, COTE G, MARCUS P, CHAGNES A. XPS, XRD and SEM characterization of a thin ceria layer deposited onto graphite electrode for application in lithium-ion batteries[J]. Appl Surf Sci, 2011, 257(21): 9110-9119. doi: 10.1016/j.apsusc.2011.05.108
-
[1]
-
表 1 Ce-M复合氧化物催化剂的ICP检测
Table 1. ICP analysis results of various Ce-M mixed oxides

表 2 CeO2及Ce-M复合氧化物催化剂的比表面积和XRD分析
Table 2. Surface area and XRD results of CeO2 and Ce-M mixed oxides with different dopants

表 3 CeO2及Ce-M复合氧化物催化剂的拉曼光谱和XPS分析
Table 3. Raman and XPS analysis results of CeO2 and Ce-M mixed oxides with different dopants

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 14
- 文章访问数: 3283
- HTML全文浏览量: 514


 下载:
下载:





 下载:
下载:

