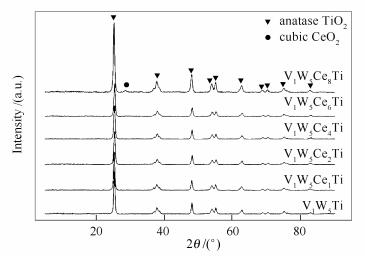
 图 3
不同催化剂的XRD谱图
Figure 3.
XRD patterns of different catalysts
图 3
不同催化剂的XRD谱图
Figure 3.
XRD patterns of different catalysts

Citation: YANG Jian, LIN Fan, CHEN Kui, KONG Ming, ZHAO Dong, MENG Fei. Activity and SO2 deactivation mechanism of vanadium series catalyst containing cerium[J]. Journal of Fuel Chemistry and Technology, 2016, 44(11): 1394-1400.

含铈钒基SCR催化剂脱硝性能及SO2失活机理研究
-
关键词:
- 选择性催化还原
- / V2O5-WO3/TiO2
- / 铈掺杂
- / SO2失活
English
Activity and SO2 deactivation mechanism of vanadium series catalyst containing cerium
-
Key words:
- selective catalytic reduction
- / V2O5-WO3/TiO2
- / cerium doped
- / SO2 deactivation
-
氮氧化物(NOx) 是造成大气污染的主要污染源之一,不仅对环境产生污染,形成酸雨、酸雾和光化学烟雾,还会严重危害人体健康[1]。目前,SCR脱硝技术是脱除燃煤烟气中氮氧化物最有效的技术[2]。V2O5-WO3/TiO2含1.0%-2.0% V2O5和(5%-8%) WO3,是目前应用最广泛的商业催化剂,因为它在300-400 ℃具有很高的脱硝活性和N2选择性[3, 4]。为了保证脱硝反应的温度,SCR工艺被放置在脱硫和除尘工艺之前。V2O5-WO3/TiO2具有一定的抗硫中毒能力,然而, 长时间在含硫烟气中还是会导致催化剂中毒,从而缩短催化剂的寿命[5]。因此,提高催化剂的低温脱硝活性。有必要随着钒负载量的增加,催化剂无论是低温还是高温活性都会得到提升,但同时催化剂对SO2的氧化也增强了,SO2被氧化成SO3与NH3生成NH4HSO4和(NH4)2SO4。NH4HSO4和(NH4)2SO4会沉积在催化剂的表面,堵塞催化剂的孔结构造成催化剂失活。因此,研究如何在提高催化剂活性的同时,又抑制其对SO2的氧化能力是十分必要的[6]。
金属铈作为一种性质活泼的稀土元素已受到研究者的广泛关注,而催化剂引入氧化铈后,也展现出了良好的脱硝性能。因为CeO2有良好的还原能力和氧储存性能,在氧化和还原条件下,Ce3+和Ce4+之间的氧化-还原转换可以在氧化铈上分别形成不稳定的氧空位和流动性好的晶格氧物种,促进非均相反应的发生[7]。CeO2还能使烟气中的NO氧化成NO2,从而增强催化剂的脱硝活性[8]。有研究表明,添加10%Ce到Sb-V2O5/TiO2中,催化剂在较宽的温度区间内表现出很好的脱硝活性,通过一系列表征发现,Ce掺杂增强Brønsted酸位,化学吸附氧的峰强度也明显增强[9]。Chen等[7]研究了含Ce低V催化剂,结果发现,10%的Ce掺杂到0.1% V2O5-6% WO3/TiO2中,催化剂在200-500 ℃有很好的脱硝活性,DRIFTS结果表明,Ce掺杂明显加强Brønsted酸位。Kwon等[10]发现,Ce4+的比例越大,催化剂的脱硝活性越强。CeO2与烟气中的SO2和O2反应生成Ce2(SO4)3,从而减少了硫酸铵的形成,但脱硝活性也会降低。
大量研究表明,Ce掺杂能增强催化剂的Brønsted酸位,从而提升催化剂的脱硝性能。CeO2能优先与烟气中SO2和O2反应,从而抑制硫酸铵盐的生成[11-13]。然而,Ce掺杂对V2O5-WO3/TiO2催化剂表面元素的影响以及SO2对表面Ce元素价态的影响有待进一步研究,从而明确含Ce催化剂的SO2失活机理。研究用硝酸铈盐引入Ce,针对不同的添加量,制备出不同Ce含量的催化剂。用活性评价装置对脱硝性能进行测试,通过XRD、BET、FT-IR、XPS、TG-DSC对催化剂进行表征。
1 实验部分
1.1 催化剂的制备
实验采用一步浸渍法实现活性组分V2O5、CeO2以及助剂WO3的负载,其中,钒负载量为1%、钨负载量为5%、铈的负载量为1%-8%(均为质量分数)。按质量分数计算并称取一定量的钨酸铵、偏钒酸铵、硝酸铈和草酸,用去离子水搅拌混合形成前驱体溶液,然后在60 ℃水浴锅中充分溶解,搅拌均匀。采用一步浸渍法将一定量的TiO2粉末浸渍于配置好的前驱体溶液中,将得到的混合浆液超声浸渍60 min后再进行70 ℃电磁加热搅拌12 h,在110 ℃条件下恒温干燥12 h,干燥后得到的固体样品在马弗炉中500 ℃煅烧5 h,冷却后筛分得到20-40目的新鲜催化剂样品,记为V1W5Ti和V1W5CexTi (x=1、2、4、6、8)。将新鲜样品在250 ℃,5.0×10-4 SO2和10% H2O的条件下进行脱硝活性测试10 h,得到使用后样品,记为V1W5Ti (U)、V1W5Ce6Ti (U)。
1.2 催化剂的表征
采用美国ASAP2010比表面积仪,测量催化剂比表面积,吸附介质为液氮,吸附温度为77K, 通过测定不同吸附压力下的吸附体积,利用BET方程计算样品比表面积,测试前样品在300 ℃下脱气处理2 h;利用Rigaku D / max-1200 X射线衍射仪完成催化剂物相结构的检测,以Cu Kα为激发源,10°-90°扫描;样品官能团变化采用Nicolet 5DXC傅里叶变换红外光谱仪进行检测,波长4 000-400 cm-1,取吸附NH3后样品1 mg与100 mgKBr混合压片制样;催化剂的原子价态、表面原子浓度等相关分析检测在ESCALAB 250型X射线光电子能谱仪上进行。采用位置灵敏度检测器(PDS),选用Al /Mg双阳极靶,能量分辨率0.45 eV,灵敏度80 kCPS,角分辨率为45°,分析室真空度为2×10-8 Pa;采用德国耐驰(Netzsch) 公司生产的STA449F3综合热重分析仪进行热重燃烧实验,采用非等温程序进行升温。
1.3 催化剂的活性评价
采用连续流动固定床微型反应装置进行SCR反应。反应器入口含有5.0×10-4 NO,5.0×10-4 NH3,3% O2以及5.0×10-4 SO2(当使用时) 和10% H2O (当使用时),其余为N2。气体总流量1 000 mL/min,催化剂质量0.3 g,空速200 000 mL/(g·h),反应温度200-500 ℃。反应器出口的NO和O2浓度采用OPTIMA7型烟气分析仪(德国MRU) 实时检测。催化剂活性以NO转化率表示,用如下公式计算:
2 结果与讨论
2.1 催化剂的活性测试
2.2 XRD表征
图 3为不同催化剂的XRD谱图。
由图 3可知,六种催化剂都检测出明显的锐钛矿型TiO2,未检测钒和钨的特征峰,说明钒和钨在TiO2形成晶体颗粒较小或者呈现高度分散。当Ce的负载量低于8%时,未检测到CeO2的特征峰,当Ce负载量达到8%时,检测出CeO2的特征峰,说明此时的负载量已超过单分子层分布理论极限[7]。
2.3 BET分析
表 1为不同催化剂的比表面积、孔容、孔径。由表 1可知,负载Ce后,催化剂的比表面积和总孔容都减小,且随着负载量的增加而呈现递减的趋势。平均孔径虽然也有所变化,但仍然保持介孔结构。与V1W5Ti相比,虽然V1W5Ce6Ti的比表面积明显减小,但仍然有较大的比表面积(72.3 m2/g),V1W5Ce6Ti仍然表现出优异的脱硝性能。
 表 1
不同催化剂的比表面积、总孔容和平均孔径
Table 1.
BET surface area, total pore volume, average pore diameter of different catalysts
表 1
不同催化剂的比表面积、总孔容和平均孔径
Table 1.
BET surface area, total pore volume, average pore diameter of different catalysts
Sample BET surface area A/(m2·g-1) Total pore volume v/(cm3·g-1) Average pore diameter d/nm V1W5Ti 86.1 0.315 12.9 V1W5Ce2Ti 76.8 0.312 9.8 V1W5Ce6Ti 72.3 0.282 9.9 V1W5Ce8Ti 70.4 0.276 9.9 表 1 不同催化剂的比表面积、总孔容和平均孔径
Table 1. BET surface area, total pore volume, average pore diameter of different catalysts2.4 FT-IR分析
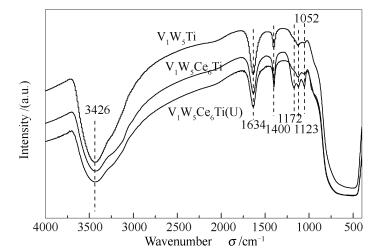
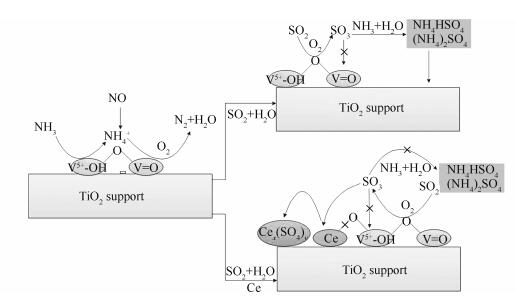
图 4为三种催化剂吸附NH3后的FT-IR谱图,其中,V1W5Ce6Ti (U) 为V1W5Ce6Ti在250 ℃时且通入5.0×10-4的SO2和10%的H2O条件下,进行脱硝反应10 h后的催化剂样品。已有研究表明,在1 052 cm-1处的吸附峰为V=O的伸缩振动峰[14]。由图 4可知,V1W5Ce6Ti (U) 仍然有明显的V=O的伸缩振动峰,所以脱硝反应中,SO2和H2O存在并没有破坏V=O结构。3 426 cm-1吸收峰为表面O-H的振动峰,1 634和1 123 cm-1吸收峰归属于氨物种在Lewis酸位上的非对称和对称振动,1 400 cm-1吸收峰归属于NH4+在Brønsted酸位上的非对振动[15, 16]。与V1W5Ti相比,V1W5Ce6Ti的Lewis酸位没有明显的变化,但Brønsted酸位(1 400 cm-1) 明显增强,Chen等[7]也得出了相同的结论。根据Topsøe等[17]提出的V2O5/TiO2催化剂NH3-SCR“双位机理”可知,催化反应的循环是催化剂的表面酸性和氧化还原性能共同作用的结果,NH3在V5+-OH位(Brønsted酸性) 的吸附形成NH4+是反应的起始步骤,而V5+=O是反应的活性位。当氧气的浓度较高时,催化反应的控制因素是Brønsted酸位的浓度,这是Ce负载提升催化剂的催化性能的原因之一。V1W5Ce6Ti (U) 在1 172 cm-1有一个新的吸附峰,归属于NH4+吸附在由SO42-提供的Brønsted酸位上,SO42-存在可能是因为催化剂的表面生成了一些的硫酸盐。Guo等[18]也提出催化剂的表面硫酸化能产生更多的Brønsted增强NH3的吸附,而对Lewis酸位没有明显的影响。
2.5 TG-DSC分析
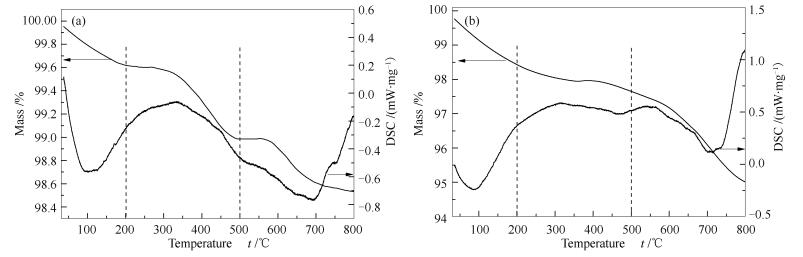
图 5为两种催化剂使用后的TG-DSC曲线。
由图 5可知,催化剂的质量损失可以分为三个阶段。第一阶段(30-200 ℃) 为催化里面少量吸附水的分解。研究表明,(NH4)2SO4和NH4HSO4的分解温度分别为280和390 ℃[13]。因此,第二阶段(200-500 ℃) 主要为(NH4)2SO4和NH4HSO4受热分解。第三阶段(500-800 ℃) 主要是V2O5和一些硫酸盐的分解。Ziran等[19]通过SO2-TPD得出Ce (SO4)2和Ce2(SO4)3在催化剂上的分解温度在700 ℃以上。通过对比发现,图 5(a)中的质量损失主要集中在第二阶段,图 5(b)的质量损失主要集中在第三阶段。因此可以得出,V1W5Ti催化剂上沉积了更多的硫酸铵盐,而负载Ce后,SO2和H2O与Ce的氧化物生成了Ce (SO4)2和Ce2(SO4)3,从而抑制了硫酸铵盐的形成。
2.6 XPS分析
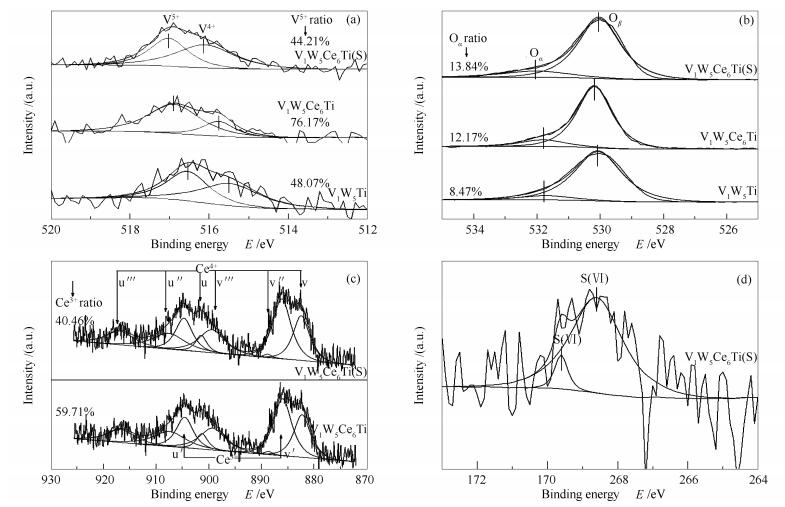
为了研究催化剂表面原子浓度和化学状态,对催化剂进行了XPS分析。各元素的原子浓度如表 2所示,XPS谱图见图 6。当V1W5Ce6Ti催化剂在有SO2和H2O的条件下使用后,催化剂表面有硫元素的沉积,这是由于在催化剂表面生成了一些硫酸盐的缘故。
Sample Surface atom concentration wmol/% V W Ti O Ce S V1W5Ti 1.98 5.78 20.78 71.46 - - V1W5Ce6Ti 1.67 5.35 18.82 73.79 0.36 - V1W5Ce6Ti (S) 1.74 2.53 20.33 74.11 0.21 1.08 表 2 不同催化剂的表面原子浓度
Table 2. Surface atom percentages of different catalysts determined by XPS图 6(a)为三种催化剂的V 2p3/2 XPS谱图。根据文献[20],结合能在516.4-517.2 eV和515.7-516.3 eV处的分别为V5+和V4+。因此,三种催化剂中的V元素都是以V5+和V4+存在。当V1W5Ti催化剂中掺杂Ce元素,V的结合能更高,这可能是由于Ce元素和V元素之间存在相互作用生成了V-O-Ce结构,这与Ziran等[19]研究结果相符合。Ce元素的掺杂还使催化剂表面V5+的比例从48.07%升高到76.17%,而V1W5Ce6Ti (U) 中V5+的比例又下降到44.21%,这表明使用后的催化剂含有更多的V4+,而V4+可能是VO2或者VOSO4。Kohiki等[21]研究发现,VOSO4的结合能为516.2 eV,而V1W5Ce6Ti (U) 中V4+的结合能为516.27 eV,由此可推断,VOSO4并不存在于V1W5Ce6Ti (U) 中,Guo等[18]也得出了相同的结论。
图 6(b)为O 1s谱图。结合能在529.2-530.3 eV为晶格氧(Oβ),在531.1-532.5 eV为化学吸附氧(Oα)[7, 13]。与V1W5Ti催化剂相比,负载6%Ce后Oα比从8.47%上升到12.17%,这是由于Ce3+的存在,在催化剂的表面造成电子失衡、空缺、不饱和,从而增加化学吸附氧削弱晶格氧。化学吸附氧(Oα) 比晶格氧(Oβ) 更具有活性,在催化反应中扮演重要的角色。这意味着V1W5Ce6Ti更易将NO氧化成NO2,更有利于NH3-SCR进行,脱硝活性测试结果也验证了这个结论[8]。使用后的催化剂比使用前的有更多的化学吸附氧,这与生成表面硫酸有关。
图 6(c)为Ce 3d谱图。Ce3+的XPS峰用u′、v′表示,Ce4+的峰用u、u″、u'''、v、v″、v'''表示,Ce是以两种价态形式存于催化剂中[22]。根据热重分析的结果可知,V1W5Ce6Ti (U) 表面生成了Ce (SO4)2和Ce2(SO4)3两种硫酸铈盐。根据峰的面积计算Ce3+的百分比,新鲜V1W5Ce6Ti催化剂中Ce3+达到了59.71%,比使用后的样品(40.46%) 高19.25%。这是因为SO2和O2与Ce3+主要生成了Ce (SO4)2。硫酸铈盐的形成,阻断了Ce3+与Ce4+氧化还原循环,同时也破坏V-O-Ce结构,这可能是造成催化剂反应活性降低的一个原因。
图 6(d)为S 2p谱图。根据文献[18]可知,168.5-170.1 eV为S (Ⅵ),这是由于在催化剂表面生成的硫酸盐类物质。Kohiki等[21]报道VOSO4中的S (Ⅵ) 的结合能为168.2 eV,而V1W5Ce6Ti (S) 表面硫酸盐在168.7-169.7 eV。所以,V1W5Ce6Ti (S) 上并没有VOSO4生成,V元素没有被硫酸化。
2.7 讨论
研究表明[19, 22],Brønsted酸位影响NH3-SCR的性能。根据FT-IR表征,掺杂Ce后催化剂的Brønsted酸位数量增加,这是由于Ce4+与Ce3+之间的相互转换提供了Brønsted酸位,可用式(2)、式(3) 表达。
当烟气中存在SO2和H2O时,TG-DSC结果表明,在V1W5Ti生成的硫酸铵盐比V1W5Ce6Ti多,Ce优先与SO2结合,在氧气的作用下生成了以Ce (SO4)2为主的盐,从而抑制了硫酸铵盐的生成,有效避免硫酸铵盐堵塞催化剂的孔结构。硫酸铈盐的形成,阻断了Ce3+与Ce4+氧化还原循环,同时也破坏V-O-Ce结构,造成催化剂反应活性降低。在此过程中,V2O5是催化SO2转化成SO3,而不会有VOSO4的生成。由此可得出,V1W5Ti的硫失活是由于硫酸铵盐的生成所致,V1W5Ce6Ti硫失活是由于硫酸铈盐的形成,阻断了Ce3+与Ce4+氧化还原循环所致。综上所述,可得到如图 7所示的催化剂硫失活机理示意图。
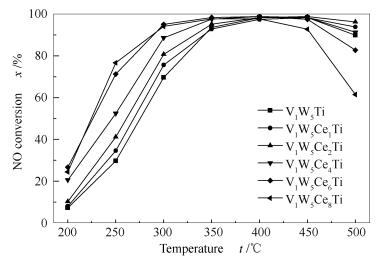
2.1.1 NH3-SCR活性
图 1为不同催化剂的脱硝活性曲线。由图 1可知,在300-450 ℃,催化剂展示出良好的脱硝活性,在400 ℃活性最好。当V1W5Ti负载铈后,催化剂的低温活性得到显著提升。在250 ℃时,随着铈的负载量从0-8%,催化剂的脱硝活性从29.7%提升到71.29%。值得注意的是,当Ce的负载量为8%时,催化剂在350 ℃以下活性也得到显著提升,但在400 ℃以上活性出现明显的下降。当Ce的负载量为6%时,催化剂在250 ℃活性超过70%,在300-450 ℃,脱硝活性保持在95%以上。因此,V1W5Ce6Ti催化剂具有最宽的温度区间和最好的脱硝活性。
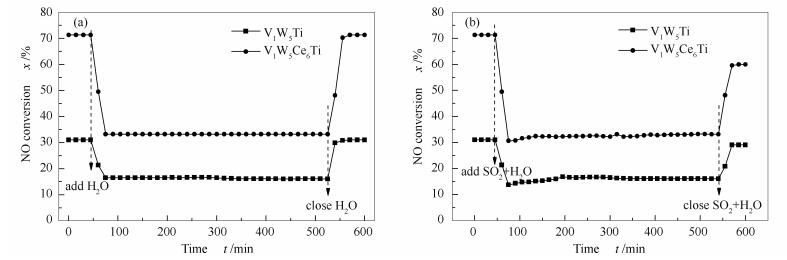
2.1.2 SO2和H2O对活性的影响
图 2为250 ℃时SO2和H2O对催化剂脱硝活性的影响。由图 2可知,在250 ℃时,当通入H2O和SO2之前,V1W5Ti和V1W5Ce6Ti脱硝活性分别为30.2%和71.3%。当气体中通入10%的H2O后,两种催化剂的活性都出现明显的下降,分别下降到16.5%和33.7%,且较长时间内保持稳定。当关闭H2O之后,两种催化剂的活性都能恢复到初始活性。当气体中同时通入5.0×10-4的SO2和10%的H2O后,两种催化剂的活性也都出现明显的下降。虽然V1W5Ce6Ti的活性受SO2和H2O的影响明显,然而其活性仍然与V1W5Ti的初始活性相当。当关闭SO2和H2O之后,两种催化剂的活性都得以恢复,但与初始活性相比都有所下降。由此可得出,烟气中的H2O对催化剂活性的影响是可逆的,而SO2会对催化剂的性能产生部分不可逆影响。
3 结论
Ce掺杂对V1W5Ti催化剂的脱硝活性、抗硫抗水性都有明显提升。负载量为6%时,V1W5Ce6Ti催化剂表现出最好的脱硝活性和最宽的温度区间。Ce掺杂会降低催化剂的比表面积和孔容,且随掺杂量的增加而减小得越多。当负载8%的Ce时,负载量已超过单分子层分布理论极限,有明显的CeO2的特征峰。Ce掺杂会增强催化剂的Brønsted酸位,Lewis酸位没有明显的变化。SO2和H2O不会破坏催化剂V=O结构,表面硫酸盐还会形成新的Brønsted酸位。与V1W5Ti相比,V1W5Ce6Ti中的Ce的氧化物与SO2和H2O生成了Ce (SO4)2和Ce2(SO4)3,从而抑制了硫酸铵盐的形成。Ce掺杂会提高催化剂表面化学吸附氧(Oα) 和V5+的百分比,且Ce元素和V元素之间存在相互作用形成了V-O-Ce结构,从而提高催化剂脱硝活性。SO2和O2与Ce3+主要生成了Ce (SO4)2为主的硫酸铈盐,也阻断Ce3+与Ce4+氧化还原循环,破坏V-O-Ce结构,造成催化剂反应活性下降。在此过程中,V2O5是催化SO2转化成SO3,而不会有VOSO4生成。
-
-
[1]
ZHANG L, LI L, CAO Y, YAO X, GE C, GAO F, DENG Y, TANG C, DONG L. Getting insight into the influence of SO2 on TiO2/CeO2 for the selective catalytic reduction of NO by NH3[J]. Appl Catal B:Environ, 2015, 165: 589-598. doi: 10.1016/j.apcatb.2014.10.029
-
[2]
KONG M, LIU Q C, ZHU B H, YANG J, LI L, ZHOU Q, REN S. Synergy of KCl and Hg-el on selective catalytic reduction of NO with NH3 over V2O5-WO3/TiO2 catalysts[J]. Chem Eng J, 2015, 264: 815-823. doi: 10.1016/j.cej.2014.12.038
-
[3]
JIN R, LIU Y, WANG Y, CEN W, WU Z, WANG H, WENG X. The role of cerium in the improved SO2 tolerance for NO reduction with NH3 over Mn-Ce/TiO2 catalyst at low temperature[J]. Appl Catal B:Environ, 2014, 148: 582-588.
-
[4]
BUSCA G, LIETTI L, RAMIS G, BERTI F. Chemical and mechanistic aspects of the selective catalytic reduction of NOx by ammonia over oxide catalysts:A review[J]. Appl Catal B:Environ, 1998, 18(1): 1-36.
-
[5]
OLIVERI G, BUSCA G, LORENZELLI V. Structure and surface-area evolution of vanadia-on-titania powders upon heat-treatment[J]. Mater Chem Phys, 1989, 22(5): 511-521. doi: 10.1016/0254-0584(89)90063-1
-
[6]
AMORES J M G, ESCRIBANO V S, BUSCA G. Anatase crystal-growth and phase-transformation to rutile in high-area TiO2, MoO3-TiO2 and other TiO2-supported oxide catalytic-systems[J]. J Mater Chem, 1995, 5(8): 1245-1249. doi: 10.1039/JM9950501245
-
[7]
CHEN J P, BUZANOWSKI M A, YANG R.T, CICHANOWICZ J E. Deactivation of the vanadia catalyst in the selective catalytic reduction process[J]. J Air Waste Manage, 1990, 40(10): 1403-1409. doi: 10.1080/10473289.1990.10466793
-
[8]
JIANG Y, XING Z, WANG X, ET A L. Activity and characterization of a Ce-W-Ti oxide catalyst prepared by a single step sol-gel method for selective catalytic reduction of NO with NH3[J]. Fuel, 2015, 151: 124-129. doi: 10.1016/j.fuel.2015.01.061
-
[9]
LEE K J, KUMAR P A, MAQBOOL M S. Ceria added Sb-V2O5/TiO2 catalysts for low temperature NH3 SCR:Physico-chemical properties and catalytic activity[J]. Appl Catal B:Environ, 2013, 142: 705-717.
-
[10]
KWON D W, NAM K B, HONG S C. The role of ceria on the activity and SO2 resistance of catalysts for the selective catalytic reduction of NOx by NH3[J]. Appl Catal B:Environ, 2015, 166-167: 37-44. doi: 10.1016/j.apcatb.2014.11.004
-
[11]
刘昕, 宁平, 李昊, 宋忠贤, 王燕彩, 张金辉, 唐小苏, 王明智, 张秋林. 水相法制备Ce-W@TiO2催化剂的氨选择性催化还原NO (NH3-SCR) 活性和抗SO2性能研究[J]. 燃料化学学报, 2016,44,(2): 225-231. doi: 10.1016/S1872-5813(16)30010-XLIU Xin, NING Ping, LI Hao, SONG Zhong-xian, WANG Yan-cai, ZHANG Jin-hui, TANG Xiao-su, WANG Ming-zhi, ZHANG Qiu-lin. Probing NH3-SCR catalytic activity and SO2 resistance over aqueous-phase synthesized Ce-W@TiO2 catalyst[J]. J Fuel Chem Technol, 2016, 44(2): 225-231. doi: 10.1016/S1872-5813(16)30010-X
-
[12]
KWON D W, PARK K H, HONG S C. Enhancement of SCR activity and SO2 resistance on VOx/TiO2 catalyst by addition of molybdenum[J]. Chem Eng J, 2016, 284: 315-324. doi: 10.1016/j.cej.2015.08.152
-
[13]
ZHANG L, LI L, CAO Y. Getting insight into the influence of SO2 on TiO2/CeO2 for the selective catalytic reduction of NO by NH3[J]. Appl Catal B:Environ, 2015, 165: 589-598. doi: 10.1016/j.apcatb.2014.10.029
-
[14]
KONG M, LIU Q, WANG X, REN S, YANG J, ZHAO D, XI W, YAO L. Performance impact and poisoning mechanism of arsenic over commercial V2O5-WO3/TiO2 SCR catalyst[J]. Catal Commun, 2015, 72: 121-126. doi: 10.1016/j.catcom.2015.09.029
-
[15]
ZHAO H, BENNICI S, SHEN J, AUROUX A. The influence of the preparation method on the structural, acidic and redox properties of V2O5-TiO2/SO42- catalysts[J]. Appl Catal A:Gen, 2009, 356(2): 121-128. doi: 10.1016/j.apcata.2008.12.037
-
[16]
STOILOVA D, GEORGIEV M, MARINOVA D. Infrared study of the vibrational behavior of CrO42- guest ions matrix-isolated in metal (Ⅱ) sulfates (Me=Ca, Sr, Ba, Pb)[J]. J Mol Struct, 2005, 738(1): 211-215.
-
[17]
TOPSØE N Y, DUMESIC J A, TOPSØE H. Vanadia/titania catalysts for selective catalytic reduction (SCR) of nitric oxide by ammonia. Ⅱ. Studies of active sites and formulation of catalytic cycles[J]. J Catal, 1995, 151(1): 241-252. doi: 10.1006/jcat.1995.1025
-
[18]
GUO XY, BARTHOLOMEW C, HECKER W, BAXTER LL. Effects of sulfate species on V2O5/TiO2 SCR catalysts in coal and biomass-fired systems[J]. Appl Catal B:Environ, 2009, 92(1): 30-40.
-
[19]
MA Z, WU XD, FENG Y, SI ZC, WENG D, SHI L. Low-temperature SCR activity and SO2 deactivation mechanism of Ce-modified V2O5-WO3/TiO2 catalyst[J]. Prog Nat Sci Mater, 2015, 25(4): 342-352. doi: 10.1016/j.pnsc.2015.07.002
-
[20]
YANG J, YANG Q, SUN J. Effects of mercury oxidation on V2O5-WO3/TiO2 catalyst properties in NH3-SCR process[J]. Catal Commun, 2015, 59: 78-82. doi: 10.1016/j.catcom.2014.09.049
-
[21]
KOHIKI S, SHIMOOKA H, TAKADA S, SHIMIZU A, HIRAKAWA T, TAKAHASHI S. Synthesis and magnetic properties of mesoporous vanadium oxide sulphate[J]. Chem Lett, 2002, 7: 670-671.
-
[22]
LIU CX, CHEN L, LI JH, MA L, ARANDIYAN H, DU Y. Enhancement of activity and sulfur resistance of CeO2 supported on TiO2-SiO2 for the selective catalytic reduction of NO by NH3[J]. Environ Sci Technol, 2012, 46(11): 6182-6189. doi: 10.1021/es3001773
-
[1]
-
表 1 不同催化剂的比表面积、总孔容和平均孔径
Table 1. BET surface area, total pore volume, average pore diameter of different catalysts
Sample BET surface area A/(m2·g-1) Total pore volume v/(cm3·g-1) Average pore diameter d/nm V1W5Ti 86.1 0.315 12.9 V1W5Ce2Ti 76.8 0.312 9.8 V1W5Ce6Ti 72.3 0.282 9.9 V1W5Ce8Ti 70.4 0.276 9.9 表 2 不同催化剂的表面原子浓度
Table 2. Surface atom percentages of different catalysts determined by XPS
Sample Surface atom concentration wmol/% V W Ti O Ce S V1W5Ti 1.98 5.78 20.78 71.46 - - V1W5Ce6Ti 1.67 5.35 18.82 73.79 0.36 - V1W5Ce6Ti (S) 1.74 2.53 20.33 74.11 0.21 1.08 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 2754
- HTML全文浏览量: 1152


 下载:
下载:






 下载:
下载:

