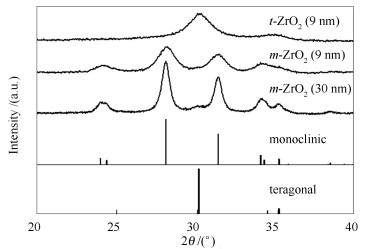
 图 1
不同方法制备的氧化锆X射线粉末衍射谱图
Figure 1.
XRD patterns of ZrO2 synthesized by different methods
图 1
不同方法制备的氧化锆X射线粉末衍射谱图
Figure 1.
XRD patterns of ZrO2 synthesized by different methods

Citation: YANG Cheng, ZHANG Cheng-hua, XU Jian, WU Bao-Shan, YANG Yong, LI Yong-wang. One-step catalytic conversion of syngas to aromatics over ZrO2 catalyst[J]. Journal of Fuel Chemistry and Technology, 2016, 44(7): 837-844.

氧化锆催化合成气直接转化制芳烃
English
One-step catalytic conversion of syngas to aromatics over ZrO2 catalyst
-
Key words:
- zirconia
- / isosynthesis
- / syngas
- / one-step
- / aromatics
-
石油消耗殆尽和严重的环境问题引发了世界范围内关于新能源的研究,以期替代目前的能源载体-石油[1, 2]。在目前富煤少油缺气的能源结构下,中国的煤制油研究地位凸显,而且在成熟的脱硫、脱氮技术下以煤基合成气为原料生产的油品对环境完全友好,是石油基燃料的理想替代品[3, 4]。煤制油主要有三种路径:费托合成(F-T合成);煤炭直接液化;甲醇制汽油(MTG)。费托合成产物分布服从Anderson-Schulz-Flory (ASF) 聚合动力学模型[5-8],且主要为辛烷值低的长直链烷烃,为获得高辛烷值汽油馏分须进一步加工精制[9]。煤直接液化产物富含稠环芳烃及沥青质,且产物中硫、氮含量超标,也不适合生产汽油。而甲醇合成受热力学平衡限制导致单程转化率低、循环比高,后续芳构化等工艺过程亦造成大量的能量耗散[3]。如果将甲醇合成与甲醇芳构化催化剂复合,则两种活性组分又存在活性位和催化工艺不匹配等问题,并无实际应用案例。如何由合成气一步催化转化高选择性地生产高辛烷值汽油成为下一代合成气转化催化剂研发的关键。
长久以来,氧化锆一直用于异构合成研究。异构合成是将合成气高选择性地转化为异丁烯和异丁烷(i-C4) 的过程,主要以氧化锆、氧化钍、氧化铈等金属氧化物为活性组分[10-13]。自Pichler等[14]第一次研究了异构合成之后,氧化锆以其较高的i-C4选择性、无放射性成为了异构合成催化研究的核心[15]。这种高选择性地生成i-C4的现象一直被归因于氧化锆表面兼具酸、碱性和氧化、还原性。Maruya等[16]通过掺杂金属助剂调变氧化锆表面酸碱性,发现酸性增强导致甲烷增多而减少异丁烯的生成,而碱性增强有利于i-C4的生成。Nancy等[17]通过酸处理进一步肯定了酸碱性对产物分布的影响,并提出酸-碱平衡有利于i-C4的生成。Su等[18-21]研究认为,酸碱性位点与氧空位的协同作用能促进生成i-C4,酸性位点促进反应物的解离, 提高CO的转化率并促使生成n-C4。氧化锆有三种晶相:单斜相、四方相和立方相,其晶相随制备方法的改变而不同,不同晶相的氧化锆表面性质完全不同,从而影响催化活性及异构合成的产物分布。催化剂组成中单斜相比例较高有助于提高催化活性及烯烃选择性[22-24]。
近年来,由于氧化锆上异构合成催化剂活性低、异丁烯及异丁烷收率低、机理复杂,异构合成研究报道较少。关于氧化锆上合成气催化转化的研究报道虽多,但可能由于液态烃收集困难且产物分布极宽、组成复杂,研究主要集中于C4而非C5+组成,极少有研究报道提及氧化锆上能够直接合成芳烃[25]。如果单一的氧化锆催化剂能够将合成气一步催化转化为芳烃或高辛烷值产物,就可以规避由金属、分子筛掺杂催化体系中活性中心不匹配的问题,对未来能源的发展具有极深远的意义。
通过制备不同晶相的纳米氧化锆,研究氧化锆上合成气一步催化转化制芳烃,利用固定床评价其催化性能,并运用XRD、TEM、Raman光谱、XPS、NH3-TPD研究所制备样品的物理性质及化学性质,初步分析了合成气一步合成芳烃的内在催化机理。
1 实验部分
1.1 催化剂的制备
实验制备了三种不同的纳米氧化锆,其制备方式如下:
m-ZrO2 (30 nm):采用连续共沉淀的方式制备。将ZrO (NO3)2·xH2O (AR, 99.5%, 阿拉丁试剂公司) 加入去离子水中在水浴70 ℃下连续搅拌30 min配制成Zr4+为0.4 mol/L的水溶液,将Zr4+溶液与氨水溶液(3 mol/L) 并流加入至烧杯中,溶液pH值调至10左右,室温下老化6 h,沉淀物经过滤、洗涤后在120 ℃下过夜干燥,随后在500 ℃下焙烧4 h。
m-ZrO2 (9 nm) 和t-ZrO2 (9 nm):采用溶剂热法制备,详细制备方法如文献所述[26, 27]。将ZrO (NO3)2·xH2O (AR, 99.5%, 阿拉丁试剂公司) 和尿素(AR, 99.9%, 北京化学试剂公司) 加入去离子水或无水甲醇(AR, 99.7%, 北京化学试剂公司) 中在水浴70 ℃下连续搅拌30 min配制成Zr4+为0.4 mol/L的溶液,脲/Zr4+为10:1。在以聚四氟乙烯为内衬的100 mL不锈钢水热釜中加入80 mL上述溶液,180 ℃晶化12 h,所得沉淀分别经水和甲醇洗涤后置于120 ℃烘箱中过夜干燥,再分别于空气和氦气中500 ℃焙烧4 h。
1.2 催化剂的表征
催化剂的结构性质由Micromeritics-ASAP 2420表征,所有样品先在350 ℃、1.3 Pa条件下脱气8 h,随后在-196 ℃采集氮气等温吸脱附曲线,进而计算得到样品的比表面积及孔道结构数据。样品物相结构由Bruker AX-D8 X射线粉末衍射仪表征(Cu Kα,λ=0.154 nm,管电压30 kV,管电流10 mA,狭缝宽0.6 mm,数据采集角度10°-50°,步长0.02°,停留时间0.5 s),氧化锆晶粒平均粒径采用Scherrer公式算出。拉曼光谱利用配备了氩离子激光器(λ=325 nm) 的UV-vis Raman 1 000(Renishaw) 测得。样品的栅格条纹及形貌通过透射电子显微镜(TEM) 来表征,Tecnai G2 F30 electron microscope,工作电压300 kV。
催化剂的X射线光电子能谱(XPS) 采用Thermal XPS ESCALAB 250Xi spectrometer (Al Kα,多通道检测器) 获得,原始数据以C 1s结合能为284.6 eV作为基准校正,通过分峰拟合得出不同物种的相对含量。在动态化学吸附仪(Micromeritics, AutoChem Ⅱ 2920) 上通过NH3程序升温脱附(NH3-TPD) 来表征催化剂的酸性。170 mg左右的样品在500 ℃下He吹扫2 h,在100 ℃下吸附NH3,平衡吸附30 min后再用He吹扫1 h以移除多余的物理吸附的气体,10 ℃/min升温至700 ℃并以质谱MSC200,AMETEK) 检测NH3信号。同理,利用CO-TPD来表征催化剂的活性位数量,CO的吸附在50 ℃下进行。催化剂的表面酸类型利用红外光谱(Bruker VERTEX 70) 测试吡啶的吸附行为。
1.3 催化剂的评价
氧化锆上合成气催化转化反应性能的评价在带冷阱的固定床反应器上进行。6 g 20-40目的催化剂颗粒被装入反应管恒温区,反应温度400 ℃,反应压力3 MPa,空速500 mL/(gcat·h),进料组成为H2/CO/Ar (体积比)=5:5:1。温度恒定3 h后开始收集液相。气相产物通过在线气相色谱定量,所收集的液相产物先通过GC-MS定性再通过气相色谱定量。
2 结果与讨论
2.1 催化剂的结构表征
图 1为三种氧化锆样品的X射线粉末衍射(XRD) 谱图。由图 1可知,m-ZrO2 (30 nm) 与m-ZrO2 (9 nm) 均在24.1°、24.4°、28.2°、31.5°、34.2°、35.3°附近出现较强的X射线衍射峰,将之归属为单斜相氧化锆(JCPDS card No. 37-1484),上述衍射峰分别对应单斜相氧化锆的(110)、(011)、(-111)、(111)、(200)、(020)、(002) 面。t-ZrO2 (9 nm) 在30.2°、35.2°出现衍射峰,将之归属为四方相氧化锆(JCPDS card No. 80-0965),衍射峰分别对应(101)、(110) 面。XRD结果表明,三种催化剂均为晶相较纯净的氧化锆。XRD衍射峰的宽化表明所合成的样品晶粒粒径的不同。采用Scherrer公式计算其平均粒径分别为30、9、9 nm。
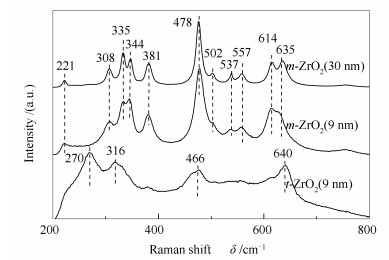
图 2为三种氧化锆的拉曼光谱谱图,由图 2可知,m-ZrO2 (30 nm) 与m-ZrO2 (9 nm) 分别在单斜相氧化锆特征峰位出现了相应的谱峰,而t-ZrO2 (9 nm) 亦在270、316、466、640 cm-1出现了归属于四方相氧化锆的特征峰[26, 28]。紫外拉曼光谱结合XRD表征结果进一步确认了其晶相结构。
通过高分辨透射电子显微镜(HRTEM) 表征了不同催化剂的形貌尺寸和晶相结构,其TEM照片见图 3。由图 3可知,三种氧化锆的平均晶粒粒径分别是30、9、9 nm,与XRD结果吻合。图 3中,m-ZrO2 (30 nm) 和m-ZrO2 (9 nm) 晶格条纹间距与单斜相氧化锆的(-111) 晶面间距一致,t-ZrO2 (9 nm) 的晶格条纹间距则与四方相氧化锆(101)、(110) 晶面间距一致。
不同方法合成的三种纳米氧化锆的物理化学性质见表 1。由BET结果可知,三种纳米氧化锆中,共沉淀法制备的氧化锆m-ZrO2 (30 nm) 粒径最大,比表面积只有53 m2/g,而溶剂热法合成的两种样品粒径较小,同为9 nm左右,比表面积分别为134和109 m2/g。
Catalyst Phase Crystal sizea/nm ABETb/(m2·g-1) Acidityc/(μmol·g-1) Acid surface density/(μmol·m-2) m-ZrO2 (30 nm) m 30 53 61.3 1.156 m-ZrO2(9 nm) m 9 134 118.5 0.884 t-ZrO2(9 nm) t 9 109 64.4 0.591 a: crystal size was calculated by Scherrer equation using XRD patterns and confirmed by TEM; b: BET surface area was calculated using N2 sorption; c: acidity was measured from ammonia temperature programmed desorption 表 1 不同氧化锆的物理化学性质
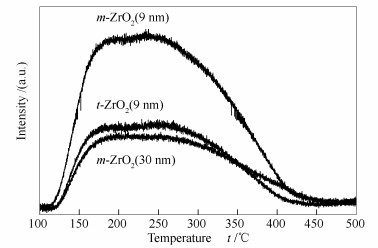
Table 1. Physico-chemical properties of ZrO2 prepared by different methods表面酸性位被认为是活性中心,且能显著影响催化剂产物分布[18-21]。使用NH3-TPD研究了不同方法制备的氧化锆表面酸性,NH3程序升温脱附谱图见图 4,表面酸量和酸性位密度见表 1。由图 4可知,三种不同样品的NH3脱附曲线峰形几乎完全相同,与酸强度相关的脱附温度无明显区别,但总酸量随制备方法的不同而变化,水热合成的m-ZrO2 (9 nm) 具有最多的酸性位,m-ZrO2 (30 nm) 与t-ZrO2 (9 nm) 酸量相当。结合催化剂BET结果,m-ZrO2 (30 nm) 具有最高的表面酸性位密度:1.156 μmol/m2,其次是m-ZrO2 (9 nm):0.884 μmol/m2,而t-ZrO2 (9 nm) 具有最低的表面酸性位密度:0.591 μmol/m2。
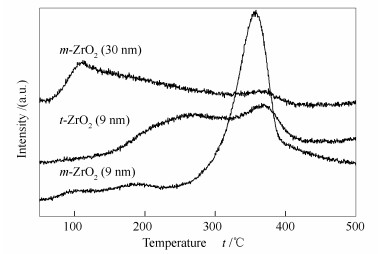
图 5为催化剂的CO-TPD谱图,三种催化剂呈现完全不同的CO脱附行为。由图 5可知,m-ZrO2 (30 nm) 催化剂的CO脱附主要发生在100-200 ℃,t-ZrO2 (9 nm) 催化剂的CO脱附温度为200-300 ℃,而m-ZrO2 (9 nm) 催化剂的CO脱附主要发生在400 ℃。这表明m-ZrO2 (9 nm) 对CO的吸附作用最强,而m-ZrO2 (30 nm) 对CO的吸附最弱。通过对CO-TPD曲线积分可得到三种催化剂对CO的相对吸附量信息,其中,m-ZrO2 (9 nm):1.97×10-8,t-ZrO2 (9 nm):1.28×10-8,m-ZrO2 (30 nm):1.11×10-8。m-ZrO2 (9 nm) 表面CO吸附量最高,而t-ZrO2 (9 nm) 与m-ZrO2 (30 nm) 对CO的吸附量相当并且较低。CO吸附量与NH3吸附量数据基本一致。
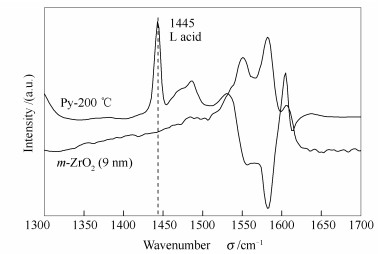
通过吡啶吸附红外光谱研究了氧化锆表面的酸类型,典型的红外光谱谱图见图 6。由图 6可知,吡啶在氧化锆表面经30 ℃吸附200 ℃真空脱附后仍在1 445 cm-1左右出现典型的L酸性位特征峰,在1 500-1 650 cm-1氧化锆本体存在强的红外吸收峰,谱图上未观察到明显的B酸性位特征峰(1 540 cm-1)。
2.2 催化剂的电子性质
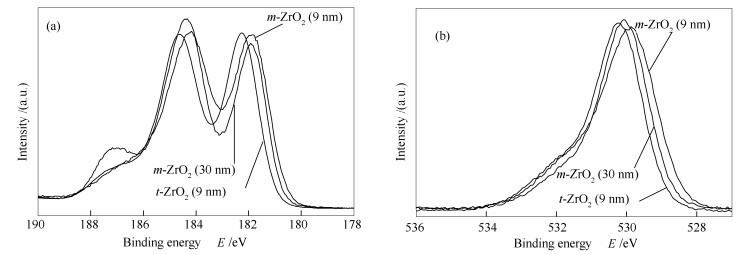
表面酸性根源于氧化锆表面吸附位的电子性质和化学环境。利用XPS研究了氧化锆表面的电子性质,Zr 3d轨道与O 1s轨道XPS谱图分别见图 7(a)、图 7(b)。据文献将Zr 3d轨道分峰拟合,按3d5/2结合能的高低分别将之归属为低结合能的低价Zrδ+物种及高结合能的晶格Zr4+物种[29, 30],其拟合结果见表 2。
Sample Zr 3d5/2E/eV ZrⅠspecies ZrⅡspecies m-ZrO2(30 nm) 181.9 (58.4)a 184.6 (41.6)a m-ZrO2 (9 nm) 181.8 (66.5) 183.9 (33.5) t-ZrO2(9 nm) 182.1 (82.7) 184.5 (17.3) a:percentage of Zr species respectively 表 2 不同氧化锆XPS谱图Zr 3d轨道拟合结果
Table 2. XPS parameters of different ZrO2 samplesZrδ+为表面暴露的或吸附有其他基团的锆物种,氧空位的出现导致其结合能向较低方向偏移。由于m-ZrO2 (9 nm) 颗粒粒径较小,表面缺陷位较多,暴露的锆原子多于m-ZrO2 (30 nm),所以Zrδ+物种的量m-ZrO2 (9 nm) > m-ZrO2 (30 nm),可能正是由于氧空位较多导致其Zr4+物种结合能低于m-ZrO2 (30 nm)。虽然四方相氧化锆t-ZrO2 (9 nm) 表面Zrδ+物种相对含量最大,但其结合能要略高于单斜相氧化锆,说明四方相中表面Zrδ+物种与单斜相所处的环境略有不同,这可能是四方相氧化锆低表面酸性位密度的原因。
2.3 催化剂的合成气催化转化性能
三种氧化锆催化剂分别在固定床反应器进行催化反应性能的评价,反应温度400 ℃,压力3 MPa,空速500 mL/(gcat·h),合成气组成H2/CO/Ar (体积比) 为5:5:1,为收集足够用于分析的液相产物,评价时间大于240 h,反应结果见表 3,水相与油相产物的GC-MS结果见图 8和图 9。在此反应条件下,反应主要产物为烃类与副产物CO2,以及一定量的含氧化合物,主要包含甲醇、二甲醚、异丁醇等高附加值的油品添加剂。除C1-3的常规烃类外,C4+产物均为高度异构、环化的烯烃及双烯,并有相当含量的芳烃生成,C5+不饱和烃选择性高达98%以上。
 表 3
不同方法制备的氧化锆的催化反应性能
Table 3.
Catalytic performances of ZrO2 catalysts prepared by different methods
表 3
不同方法制备的氧化锆的催化反应性能
Table 3.
Catalytic performances of ZrO2 catalysts prepared by different methods
Catalyst CO conv. x/% Yield w/% Selectivitys/% Distribution of HC /% Aro. in C5+ /% HC CO2 CHO HC CO2 CHO C1 C2-4 C5+ m-ZrO2 (30 nm) 17.7 9.7 8.0 0.003 5 54.7 45.3 0.020 20.3 31.5 48.2 52.3 m-ZrO2(9 nm) 26.2 13.6 12.5 0.013 0 52.0 47.9 0.048 24.5 38.2 37.4 40.7 t-ZrO2 (9 nm) 16.1 8.1 8.0 0.008 9 50.1 49.8 0.055 35.4 39.8 24.9 29.2 reaction conditions: t=400 ℃, p=3 MPa, GHSV=500 mL/(gcat·h), H2/CO/Ar=5:5:1,steady state of reaction was reach at 3 h 表 3 不同方法制备的氧化锆的催化反应性能
Table 3. Catalytic performances of ZrO2 catalysts prepared by different methods由表 3可知,水热合成的氧化锆m-ZrO2(9 nm) 具有最高的CO转化活性,转化率达到26.2%,而共沉淀法制备的单斜相氧化锆m-ZrO2(30 nm) 催化CO转化活性较低(17.7%),此结果与Zhang等[24]的研究一致。m-ZrO2(9 nm) 表现出较高的反应活性,一方面,是由于粒径小、比表面积大、吸附点位多;另一方面,氧化锆的表面酸性位能够吸附活化CO[18],表面酸性位多则活性位数量高(见NH3-TPD和CO-TPD结果),而m-ZrO2(9 nm) 表面活性位总量明显高于m-ZrO2 (30 nm)。CO-TPD同时表明,m-ZrO2 (9 nm) 表面具有较强的CO吸附作用,而m-ZrO2 (30 nm) 则相对较弱。但在CO-TPD中,CO的吸附在50 ℃下进行,其对CO的吸附能力不足以解释三种催化剂在400 ℃反应条件下的活性差异。大晶粒的单斜相氧化锆m-ZrO2 (30 nm) 产物中C5+及C5+中芳烃的选择性较高,而小粒径单斜相氧化锆m-ZrO2 (9 nm) 产物中轻质烃选择性高,这可能与m-ZrO2 (30 nm) 表面相对较高的酸性位密度有关,高密度的反应活性位有利于碳碳耦合从而促进C5+产物的生成,尤其是芳烃的生成。对于产物收率而言,高酸量的m-ZrO2 (9 nm) 由于活性较高以至各个馏分段产物收率均高于低酸量的m-ZrO2 (30 nm),但由于酸性位密度较低、碳碳耦合能力较弱导致生成的C5+中多为未成环的轻质烯烃,C5+中芳烃的收率较低。
氧化锆表面的氧物种包含晶格氧、羟基氧、化学吸附的水、化学吸附的氧气以及表面碳酸盐中的氧等,由于多种不同电子状态的氧的重叠使其定量困难[29, 30],且其高、低结合能的物种归属亦存在争议。
四方相氧化锆t-ZrO2 (9 nm) 的CO催化转化性能与单斜相氧化锆有很大差别,虽其具有较高的比表面积(109 m2/g),但表面酸性位总量与m-ZrO2 (30 nm) 相当,CO转化率也与之相近,进一步证明了表面酸性位总量对催化剂活性的影响。然而,t-ZrO2 (9 nm) 的烃类产物分布更趋于轻质化,CH4的选择性明显高于单斜相氧化锆。由于t-ZrO2 (9 nm) 与m-ZrO2 (9 nm) 粒径相同,可以排除尺寸效应的影响。如文献所述[22-24],晶相对氧化锆催化性能有显著影响,而且四方相氧化锆倾向于生成CH4。结合上文表征结果,四方相氧化锆表面锆物种所处的化学环境与单斜相完全不同,酸性位密度明显低于与单斜相氧化锆,稀疏的表面活性密度不利于表面碳物种聚合生成大分子产物,从而导致产物中以甲烷等轻质气态产物为主。低酸量、低酸性位密度所导致的低活性、低链增长因子造成了t-ZrO2 (9 nm) 产物中C5+及C5+中芳烃收率均为最低。
3 结论
制备方法对氧化锆的晶相、晶粒粒径及表面性质有很大影响,进而决定其催化性能。合成气(CO+H2) 能在氧化锆表面直接催化转化生成芳烃,而芳烃的选择性及收率受制于表面酸性质。单斜相氧化锆较四方相具有更高的表面酸性位密度,同时,大粒径又比小粒径单斜相表面酸性位密度更高,但小粒径具有更大的比表面积及更多的酸量。氧化锆表面的酸性位是CO转化的催化活性位,提高酸量有利于提高转化率,而表面酸性位密度高有利于C5+及芳烃等分子量较大产物的生成。
-
-
[1]
SARTIPI S, MAKKEE M, KAPTEIJN F, GASCON J. Catalysis engineering of bifunctional solids for the one-step synthesis of liquid fuels from syngas: A review[J]. Catal Sci Technol, 2014, 4(4): 893-907. doi: 10.1039/c3cy01021j
-
[2]
SARTIPI S, ALBERTS M, SANTOS V P, NASALEVICH M, GASCON J, KAPTEIJN F. Insights into the catalytic performance of mesoporous H-ZSM-5-supported cobalt in Fischer-Tropsch synthesis[J]. ChemCatChem, 2014, 6(1): 142-151. doi: 10.1002/cctc.v6.1
-
[3]
DE SMIT E, WECKHUYSEN B M. The renaissance of iron-based Fischer-Tropsch synthesis: on the multifaceted catalyst deactivation behaviour[J]. Chem Soc Rev, 2008, 37(12): 2758-2781. doi: 10.1039/b805427d
-
[4]
DRY M E. Fischer-Tropsch reactions and the environment[J]. Appl Catal A: Gen, 1999, 189(2): 185-190. doi: 10.1016/S0926-860X(99)00275-6
-
[5]
ANDERSON R B. Catalysts for the Fischer-Tropsch synthesis[C]. New York: Van Nostrand Reinhold, 1956.
-
[6]
UDAYA V, RAO S, GORMLEY R J. Bifunctional catalysis in syngas conversions[J]. Catal Today, 1990, 6(3): 207-234. doi: 10.1016/0920-5861(90)85003-7
-
[7]
VAN Der LAAN G P, BEENACKERS A. Kinetics and selectivity of the Fischer-Tropsch synthesis: A literature review[J]. Catal Rev, 1999, 41(3/4): 255-318.
-
[8]
相宏伟, 杨勇, 李永旺. 煤炭间接液化:从基础到工业化[J]. 中国科学:化学, 2014,12,1876-1892. XIANG Hong-wei, YANG Yong, LI Yong-wang. Indirect coal liquefaction: from base to industrialization[J]. Sci China Chem, 2014, 12: 1876-1892.
-
[9]
SUN B, QIAO M H, FAN K N A, ULRICH J, TAO F. Fischer-Tropsch synthesis over molecular sieve supported catalysts[J]. ChemCatChem, 2011, 3(3): 542-550. doi: 10.1002/cctc.v3.3
-
[10]
TOEMEN S, ABU BAKAR W A W, ALI R. Investigation of Ru/Mn/Ce/Al2O3 catalyst for carbon dioxide methanation: Catalytic optimization, physicochemical studies and RSM[J]. J Taiwan Inst Chem E, 2014, 45(5): 2370-2378. doi: 10.1016/j.jtice.2014.07.009
-
[11]
FAN J, WENG D, WU X D, RAN R. Modification of CeO2-ZrO2 mixed oxides by coprecipitated/impregnated Sr: Effect on the microstructure and oxygen storage capacity[J]. J Catal, 2008, 258(1): 177-186. doi: 10.1016/j.jcat.2008.06.009
-
[12]
GE S, HE D, LI Z. A mesoporous Ce0.5Zr0.5O2 solid solution catalyst for CO hydrogenation to iso-C4 hydrocarbons[J]. Catal Lett, 2008, 126(1/2): 193-199.
-
[13]
ZHU Z, HE D. CO hydrogenation to iso-C4 hydrocarbons over CeO2-TiO2 catalysts[J]. Fuel, 2008, 87(10/11): 2229-2235.
-
[14]
PICHLER H, ZIESECKE K H. Isosynthesis by reduced oxide catalysts[J]. Brennst Chem, 1949, 30: 13-80.
-
[15]
MAEHASHI T, MARUYA K, DOMEN K, AIKA K, ONISHI T. Selective formation of iso-butene from carbon-monoxide and hydrogen over zirconium-oxide catalyst[J]. Chem Lett, 1984, 5: 747-748.
-
[16]
MARUYA K, MAEHASHI T, HARAOKA T, NARUI S, ASAKAWA Y, DOMEN K, ONISHI T. The CO-H2 reaction over ZrO2 to form isobutene selectively[J]. Bull Chem Soc Jpn, 1988, 61(3): 667-671. doi: 10.1246/bcsj.61.667
-
[17]
NANCY B, JACKSON J G E. The surface characteristics required for isosynthesis over zirconium dioxide and modified zirconium dioxide[J]. J Catal, 1990, 126(1): 31-45. doi: 10.1016/0021-9517(90)90044-K
-
[18]
SU C L, HE D H, LI J R, CHEN Z X, ZHU Q M. Synthesis of isobutene from synthesis gas over nanosize zirconia catalysts[J]. Appl Catal A: Gen, 2000, 202(1): 81-89. doi: 10.1016/S0926-860X(00)00461-0
-
[19]
LI Y W, HE D H, YUAN Y B, CHEN Z X, ZHU Q M. Selective formation of isobutene from CO hydrogenation over zirconium dioxide based catalysts[J]. Energy Fuels, 2001, 15(6): 1434-1440. doi: 10.1021/ef010064a
-
[20]
LI Y W, HE D H, CHENG Z X, SU C L, LI R J, ZHU Q M. Effect of calcium salts on isosynthesis over ZrO2 catalysts[J]. J Mol Catal A: Chem, 2001, 175(1/2): 267-275.
-
[21]
LI Y W, HE D H, ZHU Q M, ZHANG X, XU B Q. Effects of redox properties and acid-base properties on isosynthesis over ZrO2-based catalysts[J]. J Catal, 2004, 221(2): 584-593. doi: 10.1016/j.jcat.2003.09.023
-
[22]
ZHANG R J, HE D H. Effect of alcohol solvents treated ZrO (OH)2 hydrogel on properties of ZrO2 and its catalytic performance in isosynthesis[J]. J Nat Gas Chem, 2012, 21(1): 1-6. doi: 10.1016/S1003-9953(11)60324-1
-
[23]
MARUYA K, KOMIYA T, HAYAKAWA T, LU L H, YASHIMA M. Active sites on ZrO2 for the formation of isobutene from CO and H2[J]. J Mol Catal A: Chem, 2000, 159(1): 97-102. doi: 10.1016/S1381-1169(00)00176-X
-
[24]
ZHANG R, LIU H, HE D. Pure monoclinic ZrO2 prepared by hydrothermal method for isosynthesis[J]. Catal Commun, 2012, 26: 244-247. doi: 10.1016/j.catcom.2012.06.005
-
[25]
CHANG C D, LANG W H, SILÜESTRI A J. Synthesis gas conversion to aromatic-hydrocarbon[J]. J Catal, 1979, 56(2): 268-273. doi: 10.1016/0021-9517(79)90113-1
-
[26]
LI W Z, HUANG H, LI H J, ZHANG W, LIU H C. Facile synthesis of pure monoclinic and tetragonal zirconia nanoparticles and their phase effects on the behavior of supported molybdena catalysts for methanol-selective oxidation[J]. Langmuir, 2008, 24(15): 8358-8366. doi: 10.1021/la800370r
-
[27]
李为臻, 刘海超. 溶剂热法合成纯单斜和四方晶相氧化锆中的溶剂效应[J]. 物理化学学报, 2008,24,(12): 2172-2178. LI Wei-zhen, LIU Hai-chao. Solvent effects on the solvothermal synthesis of pure monoclinic and tetragonal zirconia nanoparticles[J]. Acta Phys-Chim Sin, 2008, 24(12): 2172-2178.
-
[28]
李美俊, 冯兆池, 张静, 应品良, 辛勤, 李灿. 紫外拉曼光谱研究焙烧气氛对氧化锆相变的影响[J]. 催化学报, 2003,11,861-866. LI Mei-jun, FENG Zhao-chi, ZHANG Jing, YING Pin-liang, XIN qin, LI Can. Study of influence of calcination atmosphere on phase transformation of zirconia by UV raman spectroscopy[J]. Chin J Catal, 2003, 11: 861-866.
-
[29]
ZHANG W, TAN Y Y, GAO Y L, WU J X, TANG B. Ultrafine nano zirconia as electrochemical pseudocapacitor material[J]. Ceram Int, 2015, 41(2): 2626-2630. doi: 10.1016/j.ceramint.2014.10.047
-
[30]
ARDIZZONE S, BIANCHI C L. XPS characterization of sulphated zirconia catalysts: The role of iron[J]. Surf Interface Anal, 2000, 30(1): 77-80. doi: 10.1002/(ISSN)1096-9918
-
[1]
-
表 1 不同氧化锆的物理化学性质
Table 1. Physico-chemical properties of ZrO2 prepared by different methods
Catalyst Phase Crystal sizea/nm ABETb/(m2·g-1) Acidityc/(μmol·g-1) Acid surface density/(μmol·m-2) m-ZrO2 (30 nm) m 30 53 61.3 1.156 m-ZrO2(9 nm) m 9 134 118.5 0.884 t-ZrO2(9 nm) t 9 109 64.4 0.591 a: crystal size was calculated by Scherrer equation using XRD patterns and confirmed by TEM; b: BET surface area was calculated using N2 sorption; c: acidity was measured from ammonia temperature programmed desorption 表 2 不同氧化锆XPS谱图Zr 3d轨道拟合结果
Table 2. XPS parameters of different ZrO2 samples
Sample Zr 3d5/2E/eV ZrⅠspecies ZrⅡspecies m-ZrO2(30 nm) 181.9 (58.4)a 184.6 (41.6)a m-ZrO2 (9 nm) 181.8 (66.5) 183.9 (33.5) t-ZrO2(9 nm) 182.1 (82.7) 184.5 (17.3) a:percentage of Zr species respectively 表 3 不同方法制备的氧化锆的催化反应性能
Table 3. Catalytic performances of ZrO2 catalysts prepared by different methods
Catalyst CO conv. x/% Yield w/% Selectivitys/% Distribution of HC /% Aro. in C5+ /% HC CO2 CHO HC CO2 CHO C1 C2-4 C5+ m-ZrO2 (30 nm) 17.7 9.7 8.0 0.003 5 54.7 45.3 0.020 20.3 31.5 48.2 52.3 m-ZrO2(9 nm) 26.2 13.6 12.5 0.013 0 52.0 47.9 0.048 24.5 38.2 37.4 40.7 t-ZrO2 (9 nm) 16.1 8.1 8.0 0.008 9 50.1 49.8 0.055 35.4 39.8 24.9 29.2 reaction conditions: t=400 ℃, p=3 MPa, GHSV=500 mL/(gcat·h), H2/CO/Ar=5:5:1,steady state of reaction was reach at 3 h -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 4
- 文章访问数: 2816
- HTML全文浏览量: 622



 下载:
下载:








 下载:
下载:

