 图1
微生物燃料电池装置示意图
Figure1.
Diagram of microbial fuel cell device
图1
微生物燃料电池装置示意图
Figure1.
Diagram of microbial fuel cell device

Citation: WANG Mei-cong, LIU Ting-ting, ZHANG Xue-jun, WU Dan, FAN Li-ping. Effect of anode modification on the performance of microbial fuel cell for dealing with the straw hydrolysate[J]. Journal of Fuel Chemistry and Technology, 2017, 45(9): 1146-1152.

阳极改性对微生物燃料电池处理秸秆水解物性能影响
English
Effect of anode modification on the performance of microbial fuel cell for dealing with the straw hydrolysate
-
Key words:
- microbial fuel cell
- / straw hydrolysate
- / carbon felt
- / anode modification
-
秸秆在中国产量丰富,在2010年时产量即达到了8.4×108 t,数量庞大[1]。目前, 处理秸秆的方式主要包括:秸秆还田、秸秆气化、燃烧发电、秸秆发酵制沼气或乙醇、秸秆糖化或打碎后作为牲畜的饲料,以及新开发出的具有相对高附加值的产品:秸秆煤、全降解餐盒、秸秆种菇、保温建筑材料等[2-4]。已有的多样化处理方式如秸秆煤化技术,属于对秸秆的物理处理,在燃烧过程中仍然会释放出大量的PM2.5污染环境,无法达到绿色环保的目的,其他制沼气、乙醇等亦成本较高,导致盈利困难。因此,开发出利用秸秆的生物燃料系统,实现从秸秆生物质向能源的高效绿色转化,一直是科学家们的重点研究方向。
微生物燃料电池(MFC)是以微生物为阳极催化剂,将有机质的化学能直接转化成电能的装置,MFC在能量转化过程中省略了燃烧步骤,使能量转化效率提高[5],是一种高效、清洁的可再生能源[6]。但是较低的输出功率制约着MFC的实际应用。阳极是MFC的重要组成部分,直接影响着产电微生物的生长以及电子的传递速率,改性阳极材料可以有效提高微生物燃料电池的产电性能。使用氧化剂技术修饰阳极,可以使电极表面附着更多的亲水官能团,有效的改变电极表面的的化学环境,提高电极的比表面积和孔隙率,有助于电子从细菌转移到电极[7, 8],提高MFC的产电性能。Erableb等[9]使用浓硝酸改性石墨颗粒,经改性后MFC的开路电位+200 mV增加至+600 mV,同时使用浓硝酸活化后的石墨颗粒作为阴极,与未经处理的石墨颗粒相比,电压从660 mV提高到1 050 mV。表面涂层法受到广泛研究,金属或非金属催化剂以及导电聚合物涂层电极表面,使电极比表面增大,产电量提高。2002年,Park等[10]使用中性红(NR)修饰石墨电极,发现经中性红改性的电极,可以加强微生物在其表面黏附、生长,可以加快微生物和阳极之间电子的转移,提高MFC的产电功率。2003年,Park等[11]又使用Mn(VI)和Fe(III)修饰石墨电极,发现金属协助产电微生物氧化代谢,促进电子传递速率,提高微生物燃料电池产电性能。Li等[12]分别用聚苯胺(PANI)和聚(苯胺-邻氨基苯酚)修饰碳毡阳极,探究其微生物燃料电池的产电性能,得出结果MFC的最大产电功率分别为27.4 mW/m2和23.8 mW/m2,与未改性的阳极碳毡相比提高了35%和18%。近年来,层层自组装技术也应用在了MFC对电极改性上。其中,大多数研究者以纳米材料为层层组装的重要组成部分,纳米材料是一种高性能的功能材料,当纳米分子粒径为1-100 nm,具有较高的比表面积,使其应用在阳极材料改性上可以有效的提高MFC的产电性能。2010年,Sun等[13]采用层层自组装技术在阳极碳布上修饰相反电荷的多壁碳纳米管(MWNT)和聚电解质聚乙烯亚胺(PEI)。经电化学阻抗谱(EIS)测量,得出界面电荷转移电阻从1 163 Ω降低到258 Ω,以及MFC的功率密度提高了20%相比于未修饰的碳布。根据上述的研究结果可知,化学氧化法、表面涂层法、层层自组装法都可以提高MFC的产电量,但很少以此对比来比较其不同的改性方法的产电性能。
经研究表明,浓硝酸(HNO3)是一种强氧化剂,对阳极进行改性,可以使其电极表面上形成亲水性含氧的官能团,有利于微生物在电极表面吸附生长,从而使输出功率得到提高。壳聚糖大分子中有游离的氨基,对碳毡进行改性,可使其碳毡阳离子增多,增加阳极表面的粗糙程度,同时壳聚糖有良好的生物相容性,高的电导率,低廉的成本,适用于阳极改性。Fe2O3纳米粒子具有抗腐蚀性强,成本小,化学稳定好,化学性能高等优点,其与导电微生物表面“导线”相互作用利于电子向微生物外的传递[14]。PDADMAC为强阳离子聚电解质,与带相反电荷的Fe2O3纳米粒子层层组装,可促进Fe2O3纳米粒子在电极表面的吸附,且其正电荷有利于带负电的微生物的黏附,使MFC电极产电性能有望提高。因此本文拟以碱中和后的秸秆酸性水解液为底物构建双室型MFC,以污水处理厂活性污泥为微生物源,研究碳毡为电极时,以浓硝酸氧化改性、壳聚糖表面修饰、PADAMAC/α-Fe2O3纳米粒子层层自组装进行改性,研究经改性前后双室型MFC的产电量、电流密度、功率密度、CV曲线等理化性质来判断三种不同改性方法的产电性能,期望获取能提高其产电量的阳极改性方法。
1 实验部分
1.1 实验方法
1.1.1 常压稀酸水解玉米秸秆方法
将干燥的玉米秸秆打粉,筛选出粒径为20-40目的颗粒备用。配制1%稀硫酸,选定酸固比为15:1, 将秸秆溶于稀酸中配制原液,然后将原液在80 ℃水浴锅中持续搅拌反应2 h获得酸解产物。将酸解产物用1% NaOH中和,将pH值调至7.0-7.2,得到玉米秸秆水解液。
1.1.2 电压采集方法
本实验采用莫非电子公司的MPS-010602多通道数据采集卡记录电路电压,将多通道电压信号采集器(MPS-010602) 的两个输入端口与MFC的阴阳极相连,单口输出终端通过USB接口连接到计算机上对MFC产生的电压进行在线采集并自动记录。
1.1.3 极化曲线及功率密度曲线测试方法
极化曲线是评估性能和燃料电池运行过程中的电流之间的关系[15],是分析和描述燃料电池能量输出的工具。采用外阻递减法测量MFC的极化曲线。将外接电阻在9 000-500 Ω逐渐减小(9 000-8 000-7 000-6 000-5 000-4 000-3 000-2 000-1 000-500 Ω),记录相应电压变化,电压数据稳定10 min后记录[16]。极化曲线用来考察电流或电流密度对电压参数的变化情况,并根据公式P=U×I计算出某一数据采集点对应的功率或功率密度[17]。依据极化曲线线性范围数据计算MFC内阻。
1.1.4 电化学工作站测试方法
MFC阳极生物膜电化学活性高低是影响MFC性能的关键因素之一。EIS对于在MFC的生物电化学过程中是一种重要的、有效的电化学测试技术。本文采用电化学工作站(上海辰华650E)通过循环伏安法来测量不同产电微生物的MFC阳极生物膜的电化学活性及通过交流阻抗法测量不同产电微生物的MFC阳极生物膜的阻抗。本研究采用三电极体系。在厌氧条件下三电极体系中以阳极为工作电极,放置在阳极附近的Ag/AgCl电极为参比电极,阴极为对电极[17, 18]。循环伏安扫描为-1.1-+0.5 V vs.Ag/AgCl,扫描速率为10 mV/s。交流阻抗(EIS)扫描频率为1-1e+6 Hz。
1.1.5 阳极生物膜形貌观测方法
将阳极碳毡从反应液中取出,PBS润洗三次后,固定、梯度脱水,放-20 ℃冰箱中冷冻后冻干(冷冻干燥机:FD-1A-50,北京博医康实验仪器有限公司),利用扫描电镜对电极放入MFC前后的形貌进行观察[14],采用的放大比例均为10 000倍。
1.1.6 COD的去除率及pH值测试方法
COD去除率的测定:采用重铬酸钾法测定(国际GB/T11914—1989)。MFC阳极微生物对COD的去除率和有机废水处理工艺中COD去除率的计算方法相同,即
阳极液与阴极液的pH值用梅特勒-托利多仪器(上海)有限公司的FE20型pH计测量。
1.1.7 秸秆液组分的测量方法
还原糖的测定:采用3, 5-二硝基水杨酸比色皿法[19]。
纤维素、半纤维素、木质素的测量:取质量为W1(g)的秸秆样品使用酸洗纤维分析方法(aciddetergentfiber, ADF)测定纤维素和木质素总质量为W2(g)。采用Klasson方法测定(AOAC, 1995) 木质素的质量为W3(g)。半纤维素的质量为WH=W1-W2,纤维素的质量为WC=W2-W3[20]。
1.2 双室型MFC的构建
本实验采用双室微生物燃料电池(见图 1),腔室尺寸为8 cm×8 cm×8 cm,阴阳两室中间N117质子交换膜(杜邦公司)有效尺寸为8 cm×8 cm,电池系统的电极均采用碳毡电极,电极尺寸为4 cm×4 cm,在使用之前要经过预处理,每个盖板上有两个通孔用来引出电极材料,构成回路。阳极室加入秸秆水解液200 mL、微生物驯化液300 mL、10 mL活性污泥源微生物的悬浮液,将阳极的pH值调节到7.0-7.2。阴极室加入500 mL浓度为50 mmol/L的铁氰化钾溶液作为电子受体。实验过程中阳极保持好氧状态,外接电阻为1 000 Ω。本实验中环境温度均为室温。
1.3 阳极碳毡的改性
氧化法改性:使用65%的浓硝酸浸入碳毡,用水浴加热至75 ℃,处理1 h。
壳聚糖表面改性:称取2 g壳聚糖,在容积为200 mL的容量瓶中用超纯水定容,待其完全溶解,使其在搅拌条件下慢慢溶解。将酸解后碳毡浸入壳聚糖溶液中浸泡20 min,然后在超纯水中浸泡20 min,反复三次,冻干机冻干保存使用。
层层自组装:量取1 mL PDADMAC(聚二甲基二烯丙基氯化铵)于200 mL容量瓶中用微生物驯化液定容,摇匀。以及准确称取0.01 g α-Fe2O3纳米粒子在100 mL的容量瓶中用超纯水定容,浓度为0.1 mg/L,室温保存。本研究使用层层自组装的方法如下:将酸解后碳毡浸入配好的PDADMAC溶液中,放置20 min,使其吸附;将碳毡放入超纯水中静置3 min,除去表面物理吸附的PDADMAC;将碳毡浸入α-Fe2O3纳米溶液中,放置20 min,发生层层自组装反应;将碳毡再次放入超纯水中洗涤3 min,除去表面物理吸附的α-Fe2O3;这样完成一层组装,重复上述步骤,重复组装四层。
2 结果与讨论
2.1 不同阳极表面的扫描电镜图
不同阳极碳毡表面的扫描电镜照片见图 2。通过扫描电镜观察到改性前后阳极碳毡表面的形态。空白的(图 2(a))碳毡表面比较光滑,纹路比较浅,从而致使其比表面积较小。HNO3/CC(图 2(b))的表面相较未改性的阳极表面其纹路加深。壳聚糖/CC(图 2(c))表面有大量的壳聚糖附着在阳极表面,使其阳极表面得不平整。PDADMAC/α-Fe2O3/CC(图 2(d))的表面形成了均匀的PDADMAC/α-Fe2O3的薄膜,碳毡表面的物理化学性质发生了变化,这通过作者之前在导电玻璃上进行二维组装并拍摄的原子力扫描电镜图谱得到了证明[21]。
2.2 不同阳极秸秆成分的分析
经过12 d的运行,测得秸秆水解物各组分的降解率,具体见表 1。
 表 1
不同阳极时秸秆各组分的降解率
Table 1.
Degradation rates of various straw components of MFC with different anodes
表 1
不同阳极时秸秆各组分的降解率
Table 1.
Degradation rates of various straw components of MFC with different anodes
Sample w/% total sugar yield total quality cellulose hemicellulose lignin Blank CC 54.2 37.9 48.9 10.6 1.7 HNO3/CC 52.7 39.3 52.7 13.1 1.9 Chitosan/CC 55.9 41.9 57.4 11.7 1.9 PDADMAC/α-Fe2O3/CC 58.3 44.2 59.7 13.8 1.8 由表 1可知,三种不同改性方法的总质量降解率相较于未改性都有所提升,表明阳极改性可以有效的提高秸秆的降解率。对秸秆水解物各组分分析得到纤维素的降解率最高,木质素降解率极低,说明秸秆主要是通过降解纤维素得到产电量的。从秸秆的还原糖的测定可以发现总糖收率都在50%以上,且变化不大,说明改性碳毡对总糖收率的影响不大。
2.3 不同阳极的产电性能
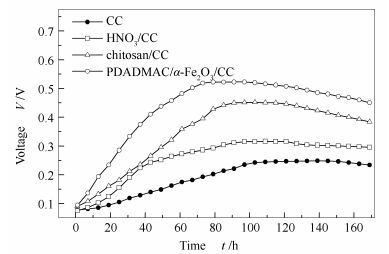
不同阳极MFC的电压随时间变化见图 3。由图 3可知,空白碳毡阳极在MFC运行了约98 h完成启动过程,其稳定电压值为248 mV;HNO3/CC阳极在MFC中运行84 h完成启动过程,其稳定电压值为315 mV;壳聚糖/CC阳极在67 h完成启动过程,其稳定电压值为452 mV;PDADMAC/α-Fe2O3/CC阳极在MFC中运行63 h完成启动过程,其稳定电压值为522 mV。三种改性方法都有效的提高了MFC的产电量,同时缩短了启动时间,其中, 三种改性方法中PDADMAC/α-Fe2O3/CC阳极的产电量最大。
2.4 不同阳极的极化曲线及功率密度曲线
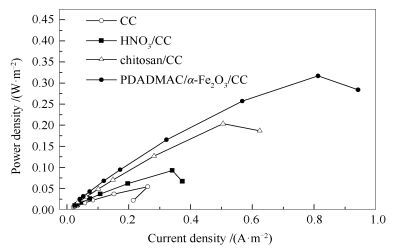
不同阳极MFC的电流密度-功率密度(C-P)曲线见图 4。
由图 4可知,功率密度随电流密度的增大而增大,增至最大值后,功率密度降低,电流密度还在平缓增加,这说明电池的阻力越来越小[22]。由图 4还可知,空白CC最大功率密度为54.6 mW/m2,电流密度为261.1 mA/m2;HNO3/CC阳极的最大功率密度为92.7 mW/m2,电流密度为373 mW/m2;壳聚糖/CC阳极的最大功率密度为203.8 mW/m2, 电流密度为623.8 mA/m2。PDADMAC/α-Fe2O3/CC阳极的最大功率密度为248.1 mW/m2, 电流密度为942 mW/m2;经硝酸、壳聚糖、PDADMAC/α-Fe2O3层层自组装改性的碳毡功率密度分别是空白的1.7、3.7、4.5倍,因此, 可得PDADMAC/α-Fe2O3/CC阳极的MFC输出功率最大。
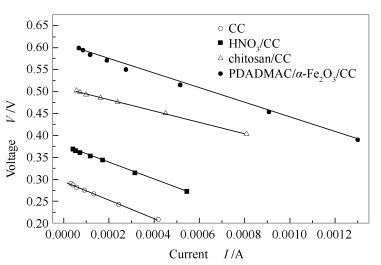
不同阳极MFC的电流-电压(C-V)极化曲线见图 5。由图 5可知,未改性及三种改性方法的MFC的内阻及开路电压,空白碳毡的电池内阻为496.4 Ω,开路电压为0.321 7 V;HNO3/CC阳极的电池内阻为321.7 Ω,开路电压为0.395 6 V;壳聚糖/CC阳极的电池内阻227.9 Ω,开路电压为0.517 2 V;PDADMAC/α-Fe2O3/CC阳极的电池内阻为183.7 Ω,开路电压为0.609 5 V。由此可知,PDADMAC/α-Fe2O3/CC阳极的电池内阻最小,功率密度最大,功率密度的大小和内阻相关。
2.5 不同阳极的COD去除率及pH值
本研究中测得空白CC、HNO3/CC、壳聚糖/CC、PDADMAC/α-Fe2O3/CC为阳极时MFC的COD去除率分别为82.21%、81.46%、82.53%、86.44%,都达到80%以上,因此, 可知改性前后COD去除率都较高,其中, PDADMAC/α-Fe2O3/CC阳极的COD去除率最高,由此说明PDADMAC/α-Fe2O3/CC阳极对底物的代谢能力最强。
本研究中测得空白CC、HNO3/CC、壳聚糖/CC、PDADMAC/α-Fe2O3/CC为阳极材料时,MFC阳极液的pH值在反应前为7.03,反应后分别为6.14、6.18、6.35、6.61,呈下降趋势;阴极pH值在反应前为6.42,反应后分别为6.54、6.58、6.63、6.75,呈上升趋势。这表明阳极产生的H+有积累,所以阳极pH值降低,而阴极消耗了H+,所以阴极pH值升高。PDADMAC/α-Fe2O3/CC的阳极相较于未改性及其他两种改性方法的阳极酸化程度最低,说明其更有利于质子的向外传输[23, 24]。
2.6 不同阳极的生物膜活性及电化学阻抗谱图
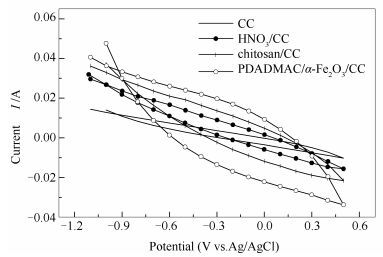
改性阳极生物膜活性见图 6。由图 6可知,经改性后,电极的氧化还原电位相较于空白CC都明显提高。说明HNO3/CC、壳聚糖/CC、PDADMAC/α-Fe2O3/CC几种电极材料都增加了电极的电容,促进了阳极的电子传递。其中, 经PADAMAC/α-Fe2O3层层自组装改性的氧化还原电位最高,对于提高MFC的产电性能的影响最大。
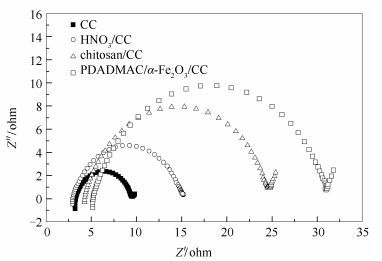
不同阳极的交流阻抗见图 7。由图 7可知,空白及经过三种不同方法改性的阳极的阻抗谱图都是由一个圆弧和一直线组成;直线比较短,这可能是测试高频区域限制没有显示完全[25]。由阻抗谱图可知空白CC为阳极时MFC的极化内阻值为27 Ω,HNO3/CC为阳极时MFC的极化内阻为21 Ω,壳聚糖/CC为阳极时MFC的极化内阻为14 Ω,PDADMAC/α-Fe2O3/CC为阳极时MFC的极化内阻为7 Ω。相较于空白CC,改性后的MFC的极化内阻都减小,这是由于改性后的生物膜的导电接触面变大,致使极化内阻减小,更利于电子转移。PDADMAC/α-Fe2O3/CC阳极的MFC极化内阻比其他两种方法明显降低了更多,由此可知,PDADMAC/α-Fe2O3/CC阳极相较于HNO3/CC、壳聚糖/CC是最优的阳极修饰方法。
3 结论
本研究以玉米秸秆稀酸水解物为MFC底物,以污水处理厂活性污泥为微生物源,以空白CC、HNO3/CC、壳聚糖/CC、PDADMAC/α-Fe2O3/CC为阳极,考察了MFC性能。其最大开路电压分别是0.321 7、0.395 6、0.517 2和0.609 5 V;改性后电极的氧化还原电位相较于空白CC都明显提高,其中, PDADMAC/α-Fe2O3/CC阳极的电化学的活性最高;三种改性方法都提高了MFC的产电能力,PDADMAC/α-Fe2O3/CC阳极的MFC产电量最高,最大输出电压为522 mV, 最大输出功率为248.1 mW/m2,电流密度942 mA/m2,内阻为183.7 Ω,COD的去除率为86.44%,且其极化内阻最小,为7Ω。由此可知, 四种改性材料为阳极的MFC性能依次为:PDADMAC/α-Fe2O3/CC、壳聚糖/CC、HNO3/CC及空白CC。
-
-
[1]
彭春艳, 罗怀良, 孔静. 中国作物秸秆资源量估算与利用状况研究进展[J]. 中国农业资源与区划, 2014,35,(3): 14-20. doi: 10.7621/cjarrp.1005-9121.20140303PENG Chun-yan, LUO Huai-liang, KONG Jing. Advance in estimation and utilization of crop residues resources in China[J]. J Chin Agricul Res Plan, 2014, 35(3): 14-20. doi: 10.7621/cjarrp.1005-9121.20140303
-
[2]
EISENHUBER K, KRENNHUBER K, STEINMULLER V, JAGER A. Comparison of Different Pre-treatment Methods for Separating from Straw During Lignocellulose Bioethanol Production[J]. Energy Procedia, 2013, 40: 172-81. doi: 10.1016/j.egypro.2013.08.021
-
[3]
HONG J L, REN L J, HONG J M, XU C Q. Environmental impact assessment of corn straw utilization in China[J]. J Cleaner Production, 2016, 112(12): 1700-8.
-
[4]
BULENS A, BEIRENDONCK S V, THIELEN J V, BUYS N, DRIESSRN B. Straw applications in growing pigs:Effects on behavior, straw use and growth[J]. App Anim Behav Sci, 2015, 169(30): 26-32.
-
[5]
LOGAN B E. Exoelectrogenic bacteria that power microbial fuel cells[J]. Nat Rev Microbial, 2009, 7: 375-381. doi: 10.1038/nrmicro2113
-
[6]
HAOYU E, CHENG S, SCOTT K, LOGAN B. Microbial fuel cell performance with non-Pt cathode catalysts[J]. Power Sources, 2007, 171(2): 275-281. doi: 10.1016/j.jpowsour.2007.07.010
-
[7]
樊立萍, 徐丹丹. 电化学法改性阳极对MFC性能的影响[J]. 燃料化学学报, 2016,44,(5): 628-633. FAN Li-ping, XU Dan-dan. Effect of electrochemically modified anode on the performance of MFC[J]. J Fuel Chem Technol, 2016, 44(5): 628-633.
-
[8]
CRITTENDEN S R, SUND C J, SUMNER J J. Mediating electron transfer from bacteria to a gold electrode via a self-assembled monolayer[J]. Langmuir, 2006, 22: 9473-9476. doi: 10.1021/la061869j
-
[9]
ERABLE B, DUTEANU N, KUMAR S M S, FENG Y, GHANGREKAR M M, SCOTT K. Nitric acid activation of graphite granules to increase the performance of the non-catalyzed oxygen reduction reaction (ORR) for MFC applications[J]. Electrochem Commun, 2009, 7(11): 1547-1549.
-
[10]
PARK D H, ZEIKUS J G. Impact of electrode composition on electricity generation in a single-compartment fuel cell using Shewanella putrefaciens[J]. Appl Microbiol Biotechnol, 2002, 59(1): 58-61. doi: 10.1007/s00253-002-0972-1
-
[11]
PARK D H, ZEIKUS J G. Improved fuel cell and electrode designs for producing electricity from microbial degradation[J]. Biotechnol Bioengin, 2003, 81(3): 348-355. doi: 10.1002/(ISSN)1097-0290
-
[12]
LI C, ZHANG L, DING L, REN H, CUI H. Effect of conductive polymers coated anode on the performance of microbial fuel cells (MFCs) and its biodiversity analysis[J]. Biosens Bioelectron, 2011, 26(10): 4169-4176. doi: 10.1016/j.bios.2011.04.018
-
[13]
SUN J J, ZHAO H Z, YANG Q Z, SONG J, XUE A. A novel layer-by-layer self-assembled carbon nanotube-based anode:Preparation, characterization, and application in microbial fuel cell[J]. Electrochim Acta, 2010, 55: 3041-3047. doi: 10.1016/j.electacta.2009.12.103
-
[14]
PARK H, AYALA P, DESHUSSES M A, MULCHANDANI A, CHOI H, MYUNG N V. Electrodeposition of maghemite (α-Fe2O3) nanoparticles[J]. Chem Eng J, 2008, 139(1): 208-212. doi: 10.1016/j.cej.2007.10.025
-
[15]
SHARMA Y, PARNAS R, LI B. Bioenergy production from glycerol in hydrogen producing bioreactors (HPBs) and microbial fuel cells (MFCs)[J]. Int J Hydrogen Energy, 2011, 36: 3853-3861. doi: 10.1016/j.ijhydene.2010.12.040
-
[16]
LIU R, GAO C Y, ZHAO Y G, WANG A J, LU S S, WANG M, MAQBOOL F, HUANG Q. Biological treatment of steroidal drug industrial effluent and electricity generation in the microbial fuel cells[J]. Bioresour Technol, 2012, 123: 86-91. doi: 10.1016/j.biortech.2012.07.094
-
[17]
VELVIZHI G, GOUD R K, MOHAN S V. Anoxic bio-electrochemical system for treatment of complex chemical wastewater with simultaneous bioelectricity generation[J]. Bioresour Technol, 2014, 115(1): 214-220.
-
[18]
QUAN X C, SUN B, XU H D. Anode decoration with biogenic Pd nanoparticles improved power generation in microbial fuel cells[J]. Electrochimica Acta, 2015, 182: 815-820. doi: 10.1016/j.electacta.2015.09.157
-
[19]
王欢, 郭瓦力, 王洪发, 孙素荣, 张建军. 玉米秸秆酸水解制糖新工艺[J]. 安徽农业科学, 2007,35,(35): 11603-11605. doi: 10.3969/j.issn.0517-6611.2007.35.125WANG Huan, GUO Wa-li, WANG Hong-fa, SUN Su-rong, ZHANG Jian-jun. New technology of producing sugar by acid hydrolysis of corn straw[J]. J Anhui Agri Sci, 2007, 35(35): 11603-11605. doi: 10.3969/j.issn.0517-6611.2007.35.125
-
[20]
冯玉杰, 王鑫, 王赫名, 于艳玲, 李冬梅. 以玉米秸秆为底物的纤维素降解菌与产电菌联合产电的可行性[J]. 环境科学学报, 2009,29,(11): 2295-2299. FENG Yu-jie, WANG Xin, WANG He-ming, YU Yan-ling, Li Dong-mei. Electricity generation from corn stover by cellulose degradation bacteria and exoelectrogenic bacteria[J]. J Environ Sci, 2009, 29(11): 2295-2299.
-
[21]
WANG M C, YANG Z Z, XIA M C, FAN L P, ZHANG X J, Wei S H, ZOU T. Performance Improvement of Microbial Fuel Cells by Lactic Acid Bacteria and Anode Modification[J]. Environ Eng Sci, 2017, 34(4): 251-257. doi: 10.1089/ees.2016.0110
-
[22]
刘春梅. 阳极结构对微生物燃料电池性能影响及阳极传质特性研究[D]. 重庆: 重庆大学, 2013. http://www.doc88.com/p-1156560990082.htmlLIU Chun-mei. Research on the effect of anode structures on the performance of microbial fuel cells and mass transfer characteristics of anodes[D]. Chongqing:Chongqing University, 2013. http://www.doc88.com/p-1156560990082.html
-
[23]
TORRES C I, MARCUS A K, RITTMANN B E. Proton transport inside the biofilm limits electrical current generation by anode-respiring bacteria[J]. Biotechnol Bioeng, 2008, 100(5): 872-881. doi: 10.1002/bit.v100:5
-
[24]
ROZENDAL R A, HAMELERS H V, BUISMAN C J. Effects of membrane cation transport on pH and microbial fuel cell performance[J]. Environ Sci Technol, 2006, 40(1): 5206-5211.
-
[25]
曲有鹏, 高珊珊, 吕江维, 李达, 刘俊峰, 田家宇. 电化学阻抗技术在微生物燃料电池阻抗测试中的应用[J]. 实验技术与管理, 2015,32,(7): 68-64. QU You-peng, GAO Shan-shan, LÜ Jiang-wei, LI Da, LIU Jiu-feng, TIAN Jia-yu. Application of electrochemical impedance spectroscopy in impedane test of microbial fuel cell impedance[J]. Experiment Technol Manage, 2015, 32(7): 68-64.
-
[1]
-
表 1 不同阳极时秸秆各组分的降解率
Table 1. Degradation rates of various straw components of MFC with different anodes
Sample w/% total sugar yield total quality cellulose hemicellulose lignin Blank CC 54.2 37.9 48.9 10.6 1.7 HNO3/CC 52.7 39.3 52.7 13.1 1.9 Chitosan/CC 55.9 41.9 57.4 11.7 1.9 PDADMAC/α-Fe2O3/CC 58.3 44.2 59.7 13.8 1.8 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 2925
- HTML全文浏览量: 1324



 下载:
下载:






 下载:
下载:

