 图式 1
三嵌段共聚物PDEAEMA-b-PPOA-b-PDEAEMA的合成
Scheme1.
Synthesis of triblock copolymer PDEAEMA-b-PPOA-b-PDEAEMA
图式 1
三嵌段共聚物PDEAEMA-b-PPOA-b-PDEAEMA的合成
Scheme1.
Synthesis of triblock copolymer PDEAEMA-b-PPOA-b-PDEAEMA

Citation: Jiang Youhao, Lu Guolin, Peng Wen. Synthesis of Phenoxyallene-Based Amphiphilic Block Copolymer[J]. Chinese Journal of Organic Chemistry, 2017, 37(12): 3248-3256. doi: 10.6023/cjoc201710037

基于苯氧基联烯的两亲性嵌段共聚物的合成
English
Synthesis of Phenoxyallene-Based Amphiphilic Block Copolymer
-
Key words:
- polyallene
- / block copolymer
- / bifunctional initiator
- / ATRP
-
聚联烯是联烯通过适当的聚合方法得到的聚合物, 由于联烯单体含有1, 2-丙二烯官能团, 所以聚合时会选择性地在1, 2位或2, 3位聚合, 从而得到亚甲基或取代的亚甲基直接以双键的形式连在聚合物主链上的这种独特结构[1~3].这种独特的结构, 一方面赋予了聚合物一些特殊的性能, 另一方面双键的存在使其可以作为反应性聚合物, 进而可以制备出各种功能性高分子材料.可用于联烯单体聚合的方法包括自由基聚合方法[4~6]、阳离子聚合方法[7~9]和活性配位聚合方法[10~15]等, 特别是Endo小组发展的用[(η3-allyl)-NiOCOCF3]2催化剂进行联烯单体的活性配位聚合, 运用聚合方法可以得到含有不同取代基团的分子量可控、分散度窄的结构明确的联烯聚合物[10~20].并且, 由于聚合物末端的引发基团的活性物种足够稳定, 用顺序投料的方法可以合成一系列嵌段共聚物[21~24].但是这种方法存在一定的限制:适用的单体范围相对比较窄, 所得到的共聚物仅局限于不同联烯的嵌段, 或联烯与丁二烯、联烯与异氰基化合物、联烯与噻吩类化合物的嵌段共聚物.究其原因还是该聚合方法适用的单体种类太少, 从而限制了联烯聚合物更大范围的应用.相关科学家也一直致力于开展含聚联烯链段的共聚物研究, 2006年, Zhang等[25]首次报道了聚联烯为主链、聚丙烯酸叔丁酯为侧链的接枝共聚物, 接着该课题组陆续发表了一系列聚联烯为主链的接枝共聚物, 包括两亲性接枝共聚物, 其在水溶液中自组装出独特的形貌[26~29].
嵌段共聚物是结构有序的聚合物中研究最多、应用最广的一类聚合物, 由不同单体形成的具有不同序列结构的嵌段共聚物有许多独特的性能, 它们不仅在聚合物改性等方面有特殊的用途, 在新型聚合物材料开发方面, 也具有重要意义, 同时也为高分子物理学的研究提供了许多不可或缺的模型.嵌段共聚物的微观相分离行为往往赋予其宏观上独特的两亲性, 并且两亲性嵌段共聚物在稀溶液中将形成类似于表面活性剂胶束的核壳结构.这种在稀溶液中基于选择性溶剂形成的胶束结构含有一个不溶性嵌段组成的内核和可溶性嵌段组成的外壳.得益于其独特的结构及良好的稳定性, 这类聚合物胶束在药物运输和靶向载体[30~35]、纳米反应器[36, 37]及环境净化[38~40]等领域的应用显示出光明的前景.
对于嵌段共聚物的合成研究已经相当成熟, 目前主要采取两种策略: (1)顺序投料法, (2)机理转换.顺序加料法指在同一活性聚合机理下, 依次加入不同单体进行聚合得到嵌段共聚物[41~46].用顺序投料法合成嵌段共聚物, 首先要考虑单体的投料顺序, 第一单体聚合后的活性链要能够有效地引发第二单体的聚合.另外, 为了达到控制聚合物的分子量和化学结构, 第一单体必须有定量的转化率.机理转换是指通过多种机理的结合来合成嵌段共聚物, 即先用一种机理聚合得到大分子物质, 它含有另一种聚合机理的引发单元或者通过官能团转化引入另一机理的引发单元, 然后进行其它单体的聚合, 从而得到嵌段共聚物.它可以集多种聚合机理的特点于一身, 弥补单一机理之不足, 使不同聚合性质的单体能相互结合, 得到单一聚合方法难于合成的嵌段共聚物[47~55].
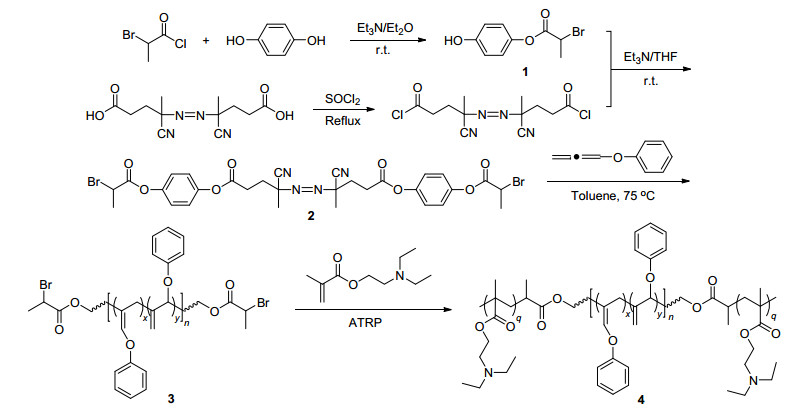
考虑到联烯单体的聚合特性, 我们采用机理转换策略来合成含聚联烯链段的嵌段共聚物.本文中我们首先合成了偶氮-ATRP类的双官能团引发剂, 先用此引发剂中的偶氮基团引发联烯单体-苯氧基联烯(POA)的自由基聚合, 制备了端基为ATRP引发基团的聚联烯链(PPOA)结构的大分子引发剂, 然后用ATRP引发基团引发N, N-二乙基胺乙基甲基丙烯酸酯(DEAEMA)的原子转移自由基聚合(ATRP)制备了三嵌段共聚物:聚N, N-二乙基胺乙基甲基丙烯酸酯-聚联烯-聚N, N-二乙基胺乙基甲基丙烯酸酯(PDEAEMA-b-PPOA-b-PDEAEMA).
1 结果与讨论
1.1 双官能团引发剂1的制备
我们通过三步反应制备了含有偶氮和ATRP引发基团的双官能团引发剂2, 如Scheme 1所示.首先, 分别通过偶氮酸的酰氯化反应和氢醌与α-溴代丙酰氯的酯化反应, 得到两个中间体偶氮酰氯和2-溴丙酸-4-羟基苯酯, 最后通过这两个中间体的酯化反应得到双官能团引发剂2.
 图式 1
三嵌段共聚物PDEAEMA-b-PPOA-b-PDEAEMA的合成
Scheme1.
Synthesis of triblock copolymer PDEAEMA-b-PPOA-b-PDEAEMA
图式 1
三嵌段共聚物PDEAEMA-b-PPOA-b-PDEAEMA的合成
Scheme1.
Synthesis of triblock copolymer PDEAEMA-b-PPOA-b-PDEAEMA
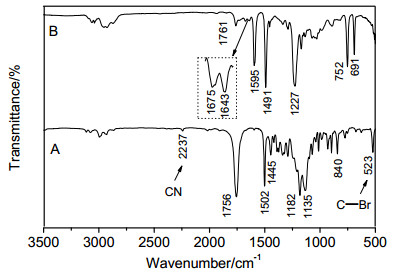
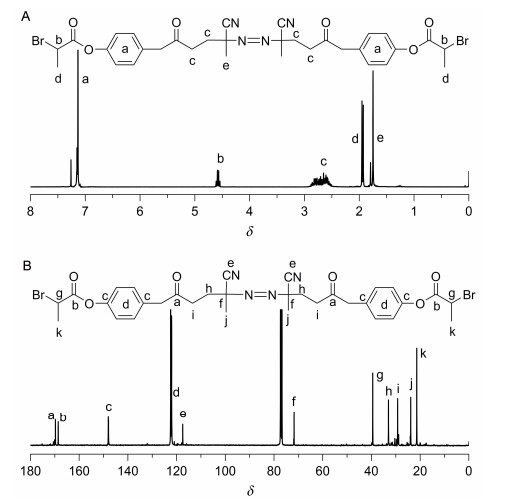
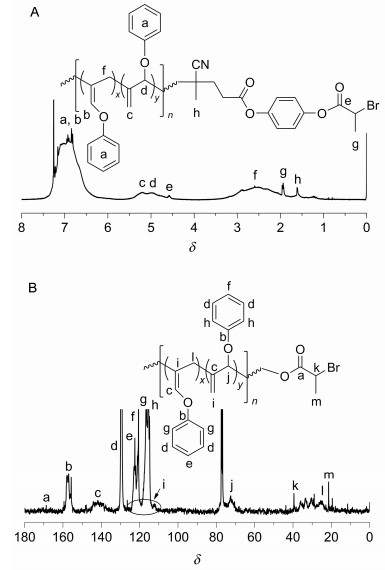
产物2的结构通过FT-IR, 1H NMR, MS和元素分析进行了表征.在其红外谱图(图 1A)中, 2237和523 cm-1处信号分别对应于氰基(CN)和碳溴键的特征峰, 1756 cm-1处信号对应于羰基的特征峰, 初步证实了化合物2的合成.在其氢谱(图 2A)中, 可以看到偶氮和ATRP基团相关的特征峰, δ 4.59“b”处的四重峰和1.95“d”处的两重峰分别为ATRP引发基团[CO2CH(CH3)Br]中次甲基和甲基的特征信号, 而δ 2.61“c”和1.75“e”处的峰分别对应于与偶氮相连的基团[CH2CH2C(CH3)(CN)]中的亚甲基氢和甲基氢.在其碳谱(图 2B)上, δ 21.4, 39.4, 168.5处为ATRP引发基团的特征峰, δ 71.7, 117.4, 169.7处为偶氮片段的特征峰, 其它的信号也得到一一归属.并且, 化合物2的元素分析结果与理论值很接近.以上结果表明双官能团引发剂2的成功制备.
1.2 含聚联烯链段的大分子引发剂3的制备
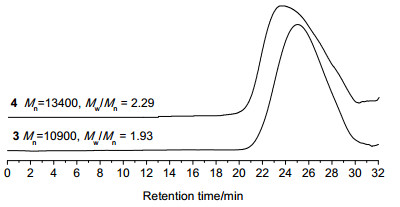
双官能团引发剂2将传统自由基类引发基团与ATRP引发基团相结合, 通过两种引发体系对不同单体的聚合, 可以制备含有不同链段结构的嵌段共聚物.考虑到偶氮基团会诱发ATRP过程中自由基的链转移反应, 我们首先进行联烯单体的传统自由基聚合.我们利用该引发剂引发苯氧基联烯(POA)的溶液聚合, 制备了含聚联烯结构的大分子引发剂3.由凝胶渗透色谱(GPC)测得的聚合物流出曲线(图 3A)为对称的单峰, Mn=10900, Mw/Mn=1.93, 说明该聚合的终止方式单一, 可能原因是空间位阻导致活性自由基夺氢的歧化终止反应较难发生, 甲苯的链转移常数很低, 链转移反应也较难发生, 因此我们认为这个联烯的传统自由基聚合主要以偶合终止方式终止聚合, 得到两端含ATRP引发基团的大分子引发剂.这个结果跟文献报道的一致[56].
聚合物的结构进一步通过FT-IR, 1H NMR得到确认.从聚合物3的红外谱图(图 1B), 我们可以看到1643和1675 cm-1处出现聚联烯链段两种结构单元的碳碳双键的特征信号, 在1761 cm-1处的羰基峰表明聚合物中双官能团引发剂的残基存在.从聚合物3的氢谱(图 4A)上, 可以看到ATRP引发基团[CO2CH(CH3)Br]中次甲基和甲基的特征峰分别在δ 1.93, 4.57处出现, δ 4.60~5.48处为1, 2-聚合结构单元中两种氢的信号(标为c和d), δ 6.50~7.50处为苯环上的氢(标为a)以及2, 3-聚合结构单元中双键上氢的信号(标为b).同时, 在聚合物3的碳谱(图 4B)上, 也可以看到在δ 21.3, 39.4和169.0处分别出现了ATRP引发基团[CO2CH(CH3)Br]中相应碳的特征峰, 聚苯氧基联烯的特征碳信号一一得到归属.以上结果表明我们通过双官能团引发剂2引发苯氧基联烯的聚合, 成功制备了两端含有ATRP引发基团的聚联烯大分子引发剂3.
1.3 PDEAEMA-b-PPOA-b-PDEAEMA三嵌段共聚物的合成
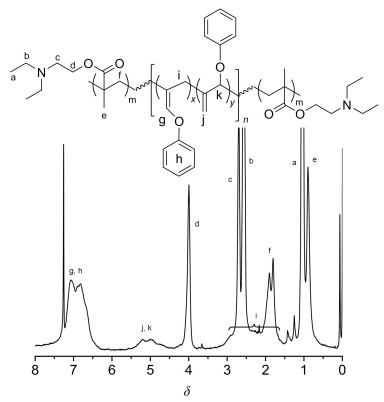
我们以两端含有ATRP引发基团的大分子引发剂3为引发剂, CuBr/PMDETA为催化体系, 在N, N-二甲基甲酰胺(DMF)中进行DEAEMA的溶液聚合.由GPC我们测得所得聚合物4的分子量和分子量分布分别为: Mn=13400, Mw/Mn=2.29, 聚合物4的流出曲线(图 3B)呈单峰, 与大分子引发剂3相比, 分子量明显增大, 说明3确实引发DEAEMA的聚合得到嵌段共聚物.聚合物4的结构通过核磁氢谱得到表征, 在其氢谱(图 5)中, 看到在δ 0.88, 1.04, 2.57, 2.70和4.00处出现了PDEAEMA链段的特征峰, 而且δ 4.5至5.5处聚联烯链含亚甲基双键结构单元的两个氢的信号峰得以保留, 说明聚合过程中聚联烯链并没有被破坏.以上结果表明我们成功利用大分子引发剂3引发DEAEMA的聚合, 制得三嵌段共聚物聚N, N-二乙基胺乙基甲基丙烯酸酯-聚联烯-聚N, N-二乙基胺乙基甲基丙烯酸酯(PDEAEMA-b-PPOA-b-PDEAEMA).
1.4 PDEAEMA-b-PPOA-b-PDEAEMA的水溶液自组装行为
首先, 我们采用荧光探针法测定三嵌段共聚物PDEAEMA-b-PPOA-b-PDEAEMA (4)在水溶液中的临界胶束浓度cmc, 选用的荧光探针为N-苯基-1-萘胺(PNA)[57~59]. PNA在非极性溶液或疏水环境中会发射出强烈的荧光, 但是在极性介质如水中荧光会被淬灭.以PNA为荧光探针测定两亲性共聚物在水中的临界胶束浓度即是基于胶束形成前后PNA分子周围微环境极性的变化这一原理而实现的.当聚合物浓度小于临界胶束浓度时, PNA分子溶解于水中, 微环境极性大, PNA的荧光发射被淬灭或非常弱, 当聚合物浓度达到临界胶束浓度时, 聚合物中疏水性链段塌缩聚集形成胶束的核, 而PNA分子由于具有强的疏水性而倾向于“溶解”在疏水性链段形成的核内, 此时, PNA分子周围的微环境变成一个极性小的疏水性环境, PNA便会发射出强烈的荧光, 这个突变点对应的聚合物浓度即是临界胶束浓度.
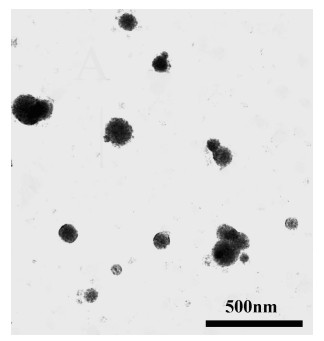
图 6A是PNA在不同浓度的PDEAEMA-b-PPOA-b-PDEAEMA (4)水溶液中的荧光发射光谱.从图中可以看出当聚合物浓度较低时, PNA的荧光发射光谱很弱, 当聚合物的浓度增大到某个特定值时, PNA的荧光发射突然增强, 同时最大发射波长产生蓝移.此后, 随着聚合物浓度的增大, 荧光发射逐渐增强.以相对荧光强度I/I0对聚合物的浓度的常用对数作图(其中I0和I分别是是未加聚合物时及不同聚合物浓度时PNA在418 nm处的荧光发射强度), 如图 6B所示.当聚合物的浓度低于某个特定值时, 相对荧光强度I/I0是一个基本不变的常数, 当聚合物浓度大于这个值时, 相对荧光强度I/I0随着浓度的增加呈线性增加, 表明PNA此时已经在聚合物胶束的疏水核中富集, 求得这两条直线的交点即可求出两亲性嵌段共聚物PDEAEMA-b-PPOA-b-PDEAEMA (4)的临界胶束浓度cmc=4.94×10-3 g/L.接着, 我们用透射电子显微镜(TEM)对两亲性嵌段共聚物在水溶液中的聚集形貌进行了观察. 图 7为三嵌段共聚物PDEA-EMA-b-PPOA-b-PDEAEMA (4)在水溶液中聚集形貌的TEM照片, 可以看到嵌段共聚物4在水溶液中形成的是直径为几十个纳米的球形小胶束.
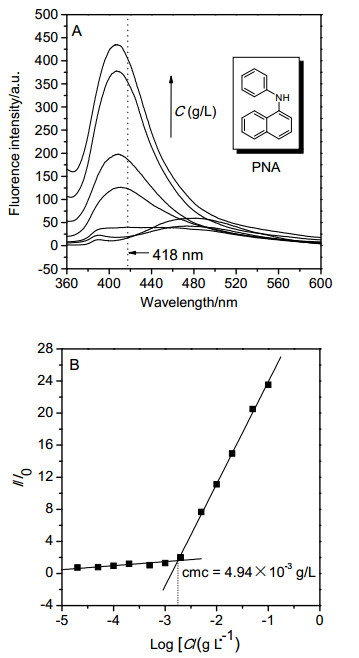 图6
(A) PNA (2.0×10-6 mo/L)在不同浓度的PDEAEMA-b-PPOA-b-PDEAEMA (4)水溶液中的荧光发射光谱(激发波长λex=340 nm)和(B) PNA荧光发射光谱的荧光强度比(I/I0)与PDEAEMA-b-PPOA-b-PDEAEMA (4)浓度的关系图
Figure6.
(A) Fluorescence emission spectra of PNA (2.0×10-6 mo/L) in aqueous solutions of PDEAEMA-b-PPOA-b-PDEAEMA (4) with different concentrations (λex=340 nm), and (B) dependence of fluorescence intensity ratio I/I0 of PNA fluorescence emission spectra on the concentration of PDEAEMA-b-PPOA-b-PDEAEMA (4)
图6
(A) PNA (2.0×10-6 mo/L)在不同浓度的PDEAEMA-b-PPOA-b-PDEAEMA (4)水溶液中的荧光发射光谱(激发波长λex=340 nm)和(B) PNA荧光发射光谱的荧光强度比(I/I0)与PDEAEMA-b-PPOA-b-PDEAEMA (4)浓度的关系图
Figure6.
(A) Fluorescence emission spectra of PNA (2.0×10-6 mo/L) in aqueous solutions of PDEAEMA-b-PPOA-b-PDEAEMA (4) with different concentrations (λex=340 nm), and (B) dependence of fluorescence intensity ratio I/I0 of PNA fluorescence emission spectra on the concentration of PDEAEMA-b-PPOA-b-PDEAEMA (4)
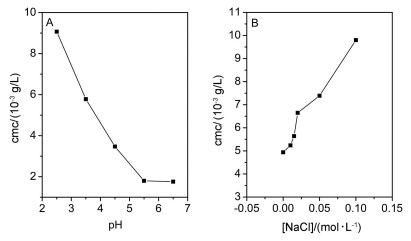
PDEAEMA是一个弱碱, 随着pH值的增大, 它会由亲水性变成疏水性, 所以pH值会对其在水溶液中的自组装行为产生影响.我们用HCl和NaOH调节水的pH值, 以PNA为荧光探针测定了它们在不同pH值水溶液中的cmc.由图 8A可以看出, 相对于纯水(pH=5.5), 当水溶液的pH值减小时两亲性嵌段共聚物4的cmc逐渐增大, 这是因为随着pH值的减小, 有更多的PDEAEMA链段与质子发生络合, 从而导致该链段亲水性增加, 这就使得两亲性嵌段共聚物的聚集能力变差, 宏观上就表现为cmc的增大.另外, 我们也研究了盐浓度对cmc的影响, 由图 8B可以看出, 其cmc随着盐浓度增加而增大.可能原因是, 聚联烯链段的特殊性可能会对阳离子产生络合作用, 产生盐溶效应, 导致聚合物的亲水性增加, 进而使嵌段共聚物的cmc随盐浓度的增加而增大.
2 结论
通过三步反应方便地合成了一种含有偶氮和ATRP引发基团的双官能团引发剂, 该引发剂依次引发苯氧基联烯的自由基聚合和DEAEMA的原子转移自由基聚合, 可以制得含有聚联烯和亲水链段PDEAEMA的两亲性三嵌段共聚物PDEAEMA-b-PPOA-b-PDEAEMA.以N-苯基-1-萘胺(PNA)为荧光探针分别测定了它们在不同离子浓度、不同pH值条件下的临界胶束浓度, 发现该聚合物胶束的cmc随着pH值增大而减小, 随着离子浓度的增大而增大. TEM显示了PDEAEMA-b-PPOA-b-PDEAEMA在水溶液中自组装形成球形胶束.因此, PDEAEMA-b-PPOA-b-PDEAEMA形成的聚合物胶束可望用于药物的负载, 在药物传输和控释方面有潜在的应用.
3 实验部分
3.1 仪器与试剂
核磁共振导用超导核磁共振仪, 在Varian MERCURY 300, Bruker AM-300上完成, 氘代氯仿为溶剂, 四甲基硅(TMS)为内标.红外光谱用傅立叶变换红外光谱仪, Nicolet AVATAR-360, KBr压片法.所有红外谱图累加32次, 分辨率为4.0 cm-1.元素分析导用元素分析仪, Elemantar VARIOEL, Heraeus 1106, Carlo-erbo 1108.质谱用Agilent 5973低分辨质谱仪和Ion Spec 4.7 Tesla FTMS高分辨质谱仪.凝胶色谱法(GPC)测定聚合物分子量及分子量分布:仪器为Waters 1515凝胶色谱仪(HR3, HR4, HR5), Waters 2410示差折光检测器.用四氢呋喃(THF)将聚合物配成1 mg/mL的溶液, 淋洗剂为THF, 流速为1 mL/min, 采用线性聚苯乙烯标样对分子量进行校正.荧光光谱法测定临界胶束浓度:在Hitachi F-4500荧光分光光度计上完成, 以PNA为荧光探针, 激发狭缝、发射狭缝均为5 nm, 激发波长为340 nm. Cary 100紫外分光光度计, JEOL公司的JEM-1230型透射电子显微镜(加速电压80 kV).
甲苯和四氢呋喃(THF)经钠丝在二苯甲酮存在下回流除水至呈紫色后蒸出, 现蒸现用. N, N-二甲基甲酰胺(DMF)先经NaOH处理0.5 h, 然后在无水CaSO4存在下减压蒸出备用.三乙胺先经KOH干燥数天, 在CaH2存在下回流蒸出, 现蒸现用. N, N-二乙基胺乙基甲基丙烯酸酯(DEAEMA, Aldrich, 99%)减压蒸馏后低温保存备用.偶氮二异丁腈(AIBN)用甲醇重结晶, 真空烘箱干燥后备用.溴化亚铜(CuBr)经乙酸搅拌过夜后, 再经乙醇, 丙酮, 乙醚等顺次洗涤数次至淡黄色, 真空烘箱40 ℃减压干燥24 h, 避光保存备用.偶氮酸(Acros, 98%)甲醇重结晶后避光保存.五甲基二亚乙基三胺(PMDETA, Acros, 99%)减压蒸馏后低温保存. N-苯基-1-萘胺(PNA, Alfa Aesar, 99%)用甲醇/水重结晶后避光保存备用. α-溴代丙酰氯(Acros), 未经纯化, 直接使用.其它国产试剂未注明的均未经处理直接使用.苯氧基联烯(phenoxyal-lene, POA)根据文献方法[60]制备.
3.2 实验方法
3.2.1 双官能团引发剂2的制备
称取2.3 g (20.91 mmol)对苯二酚加入到250 mL蛋形瓶中, 加入150 mL乙醚, 搅拌使固体完全溶解, 加入4 mL三乙胺, 将2 mL (19.83 mmol) α-溴代丙酰氯溶于50 mL乙醚中, 用恒压漏斗将其滴加到反应体系中, 反应过程中不断有白色固体析出, 薄层色谱(TLC)跟踪反应至结束.除去固体及溶剂, 将产物快速柱层析, 得无色油状液体, 静置, 变为白色结晶状固体, 油泵抽干得3.426 g产物1, 产率70.5%.
向干燥的100 mL蛋形瓶中加入4.2 g (15 mmol)偶氮酸, 30 mL氯化亚砜, 75 ℃油浴回流1 h, 冷却至室温, 40 ℃油浴下用油泵抽去未反应的氯化亚砜, 得淡黄色固体, 未经纯化直接使用.将7.915 g 1溶于100 mL四氢呋喃中, 加入4.2 mL三乙胺, 将制得的酰氯溶于50 mL四氢呋喃中, 用恒压滴液漏斗将其缓慢加入到反应体系中.反应结束后, 过滤除去生成的盐, 除去溶剂后快速柱层析, 得淡黄色结晶状固体, 经甲醇重结晶得3.469 g白色晶体产物2, 产率31.5%. 1H NMR (400 MHz, CDCl3) δ: 1.75 (s, 6H, CH3C(CN)CH2CH2CO2), 1.95 (d, J=6.9 Hz, 6H, CH3CHBr), 2.61 (m, 8H, CH3-C(CN)CH2CH2CO2), 4.59 (q, J=6.9 Hz, 2H, CH3CHBr), 7.13 (m, 8H, C6H4); 13C NMR (100 MHz, CDCl3) δ: 21.4, 24.0, 29.1, 33.0, 39.4, 117.4, 122.2, 148.0, 168.5, 169.7; FT-IR (KBr) ν: 3116, 3075, 2995, 2925, 2237 (C≡N), 1756 (C=O), 1502, 1445, 1339, 1182, 1135, 930, 897, 840, 523 (C—Br) cm-1. Anal. calcd for C30H30Br2N4O8: C 49.06, H 4.12, N 7.63, Br 21.76; found C 49.40, H 4.02, N 7.36, Br 21.49.
3.2.2 大分子引发剂3的制备
100 mL Schlenk瓶抽真空状态下火烤三次除水, 待瓶子恢复室温后, 加入0.3694 g (0.50 mmol) 2, 抽换气三次, 氩气保护下加入12 mL (101.8 mmol)苯氧基联烯(POA), 12 mL甲苯, 经三次充氩气-冷冻-抽真空-充氩气-融解循环来除去反应液中的氧气.室温下搅拌20 min.溶液基本呈均相, 放入预先加热至75 ℃的油浴中反应2 d.加入适量THF稀释, 滴加到正己烷中沉淀, 并反复溶解沉淀三次, 过滤, 产品40 ℃真空干燥至恒重, 得6.3852 g白色粉末状聚合物3, 收率49.9%. GPC: Mn=10, 900 g/mol, Mw/Mn=1.93. Element analysis: Br 1.52%. 1H NMR (400 MHz, CDCl3) δ: 1.61 (s, 6H, CH3CCN), 1.93 (d, J=6.9 Hz, 6H, CH3CHBr), 2.55 (br s, 2H×x, =CCH2), 4.57 (q, J=6.9 Hz, 2H, CH3CHBr), 5.00 (br s, 1H×y, CH2=CCHO), 5.21 ((br s, 2H×y, CH2=CCHO), 6.50~7.20 (br s, 1H×x, C=CHOC6H5 and 5H, C6H5); 13C NMR (100 MHz, CDCl3) δ: 19.4, 21.3, 25.5, 28.9, 30.4, 33.5, 35.9, 39.4, 72.6, 112.5, 115.7, 116.6, 120.8, 122.7, 141.8, 158.3, 169.0; FT-IR (KBr) ν: 3070, 3039, 2952, 2926, 1761 (C=O), 1675, 1643 (C=C), 1595, 1491, 1456, 1337, 1290, 1227, 1171, 1135, 1030, 892, 752, 691 cm-1.
3.2.3 N, N-二乙基胺乙基甲基丙烯酸酯的嵌段共聚
Schlenk瓶抽真空火烤-充氮三次后, 将催化剂CuBr (0.007 g, 0.049 mmol), 大分子引发剂3 (0.109 g, 0.01 mmol, Mn=10, 900 g/mol, Mw/Mn=1.93)加入预置搅拌子的Schlenk瓶中, 经过三次抽换气后, 用针筒加入PMDETA (0.02 mL, 0.096 mmol), DEAEMA (1 mL, 5 mmol), DMF (1 mL).经三次充氩气-冷冻-抽真空-充氩气-融解循环来除去反应液中的氧气.室温下搅拌10 min.溶液基本呈均相, 淡绿色透明.放入预先加热至50 ℃的油浴中反应6 h, 液氮淬灭, 反应液用四氢呋喃稀释, 过中性氧化铝柱子以除去催化剂.滤液浓缩后在40 ℃的油浴下用油泵抽干, 再用THF溶解, 在冷的正己烷中沉淀, 并反复溶解沉淀三次, 过滤, 产品真空干燥(40 ℃)至恒重, 得0.114 g聚合物4. GPC: Mn=13, 400 g/mol, Mw/Mn=2.29. 1H NMR (300 MHz, CDCl3) δ: 0.88 (s, 6H×m, CH2C(CH3)), 1.04 (s, 12H×m, CH3CH2N), 1.81 and 1.89 (s, 4H×m, CH2C(CH3)), 2.33 (br s, 2H×x, =CCH2), 2.57 (s, 8H×m, CH3CH2N), 2.70 (s, 4H×m, NCH2CH2O), 4.00 (s, 4H×m, NCH2CH2O), 4.99 (br s, 1H×y, CH2=CCHO), 5.18 (br s, 2H×y, CH2=CCHO), 6.82 and 7.07 (br s, 1H×x, =CHOPh and 5H×n, ArH); FT-IR (KBr) ν: 2966, 2927, 2810, 1730, 1596, 1492, 1455, 1383, 1235, 1151, 1069, 1025, 752, 691 m-1.
3.2.4 荧光探针法研究接枝共聚物的溶液性质
PNA探针水溶液的配制:称取PNA 21.9 mg, 加入100 mL容量瓶, 用适量丙酮溶解, 再稀释至刻度, 配成浓度为1×10-3 mol·L-1的母液.取0.5 mL母液到250 mL容量瓶, 用高纯水稀释, 配制2×10-6 mol·L-1的PNA的水溶液.
不同浓度聚合物溶液的配制:准确称取嵌段共聚物, 溶于一定体积的四氢呋喃, 配制成浓度为2 mg/mL的聚合物溶液, 准确移取一定体积的该溶液用THF稀释至溶液浓度为0.2~0.01 mg/mL的聚合物溶液.移取一定体积的上述探针水溶液, 在搅拌下用移液枪取一系列体积的共聚物母液, 加入到上述探针水溶液中, 得到浓度范围为2.0~10-5~0.1 g/L的聚合物水溶液.持续搅拌8 h, 使溶液均匀, 并使微量有机溶剂挥发.
聚合物探针水溶液的荧光发射光谱测试:本实验采用Hitachi F-4500型荧光分光光度计测定共聚物的cmc, 采用激发波长为340 nm, 设定激发狭缝为5 nm, 发射狭缝为5 nm, 发射波长测量范围为360 nm至600 nm.记录不同共聚物浓度下的待测液在418 nm处的荧光强度, 并以浓度的对数为X轴, 以相对荧光强度I/I0为Y轴作图, 求突变前后两条直线的交点, 即为两亲性嵌段共聚物的临界胶束浓度cmc.其中I0是未加聚合物时PNA在418 nm处的荧光发射强度, I是在不同聚合物浓度时PNA在418 nm处的荧光发射强度.用这一方法, 测定了不同离子强度和不同pH值条件下两亲性嵌段共聚物P DEAEMA-b-PPOA-b-PDEAEMA (4)的cmc, 以pH值或盐浓度为X轴, 不同条件下的cmc值为Y轴, 则可以得到聚合物胶束的pH和盐响应情况.
3.2.5 胶束的制备及形态表征
嵌段共聚物溶于THF, 配成浓度为2 mg/mL的母液.在磁子搅拌下, 取一定体积的母液缓慢滴加于双蒸水中, 得到胶束溶液.溶液充分搅拌平衡, 并使微量四氢呋喃充分挥发.取少量胶束溶液滴于铜网(镀有碳膜)上, 室温下使水分自然挥发.干燥后铜网在JEM-1230型透射电镜仪上观察, 加速电压为80 kV.
辅助材料(Supporting Information) 提供了产物的原始谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
McGrath, M. P.; Sall, E. D.; Tremont, S. J. Chem. Rev. 1995, 95, 381. doi: 10.1021/cr00034a004
-
[2]
Otsuka, S.; Mori, K.; Imaizumi, F. J. Am. Chem. Soc. 1965, 13, 3017. doi: 10.1021/ja01091a048
-
[3]
Okuyama, T.; Izawa, K.; Fueno, T. J. Am. Chem. Soc. 1973, 95, 6749. doi: 10.1021/ja00801a036
-
[4]
Yokozawa, T.; Tanaka, M.; Endo, T. Chem. Lett. 1987, 1831. http://ci.nii.ac.jp/naid/130003520503
-
[5]
Yokozawa, T.; Ito, N.; Endo, T. Chem. Lett. 1988, 1955. http://ci.nii.ac.jp/naid/130003520640
-
[6]
Ito, N.; Yokozawa, T; Endo, T. Polym. Prepr. Jpn. 1988, 37, 346.
-
[7]
Okuyama, T.; Izawa and, K.; Fueno, T. J. Am. Chem. Soc. 1973, 95, 6749. doi: 10.1021/ja00801a036
-
[8]
Takahashi, T.; Yokozawa, T.; Endo, T. J. Polym. Sci., Polym. Chem. 1992, 30, 583. doi: 10.1002/pola.1992.080300409
-
[9]
Takahashi, T.; Yokozawa, T.; Endo, T. Macromolecules 1995, 28, 866. doi: 10.1021/ma00108a010
-
[10]
Tomita, I.; Kondo, Y.; Takagi, K.; Endo, T. Macromolecules 1994, 27, 4413. doi: 10.1021/ma00093a052
-
[11]
Takagi, K.; Tomita, I.; Endo, T. Macromolecules 1997, 30, 7386. doi: 10.1021/ma9708959
-
[12]
Endo, T.; Takagi, K.; Tomita, I. Tetrahedron 1997, 53, 15187. doi: 10.1016/S0040-4020(97)00956-3
-
[13]
Takagi, K.; Tomita, I.; Endo, T. Macromolecules 1998, 31, 6741. doi: 10.1021/ma9800921
-
[14]
Takagi, K.; Tomita, I.; Nakamura, Y.; Endo, T. Macromolecules 1998, 31, 2779. doi: 10.1021/ma9717404
-
[15]
Taguchi, M.; Tomita, I.; Endo, T. Angew. Chem., Int. Ed. 2000, 39, 3667. doi: 10.1002/(ISSN)1521-3773
-
[16]
Takagi, K.; Tomita, I. Polym. Bull. 2005, 55, 251. doi: 10.1007/s00289-005-0435-9
-
[17]
Kyohei, M.; Tomita, I. Macromolecules 2006, 39, 6336. doi: 10.1021/ma052374o
-
[18]
Mochizuki, K.; Tomita, I. Macromolecules 2006, 39, 7474. doi: 10.1021/ma052492b
-
[19]
Takagi, K.; Tomita, I.; Endo, T. Chem. Commun. 1998, 681. http://pubs.rsc.org/en/Content/ArticleLanding/1998/CC/A708786A#!divAbstract
-
[20]
Taguchi, M.; Tomita, I.; Endo, T. Macromol. Chem. Phys. 2000, 201, 2322. doi: 10.1002/(ISSN)1521-3935
-
[21]
Taguchi, M.; Tomita, I.; Yoshida, Y.; Endo, T. J. Polym. Sci., Polym. Chem. 1999, 37, 3916. doi: 10.1002/(ISSN)1099-0518
-
[22]
Tomita, I.; Taguchi, M.; Takagi, K.; Endo, T.; J. Polym. Sci., Polym. Chem. 1997, 35, 431. http://adsabs.harvard.edu/abs/1997JPoSA..35..431T
-
[23]
Hu, Y. Y.; Su, M.; Ma, C. H.; Yu, Z. P.; Liu, N.; Yin, J.; Ding, Y. S.; Wu, Z. Q. Macromolecules 2015, 48, 5204. doi: 10.1021/acs.macromol.5b01120
-
[24]
Yu, Z. P.; Ma, C. H.; Wang, Q.; Liu, N.; Yin, J.; Wu, Z. Q. Macromolecules 2016, 49, 1180. doi: 10.1021/acs.macromol.5b02759
-
[25]
Zhang, X. H.; Peng, D.; Lu, G. L.; Gu, L. N.; Huang, X. Y. J. Polym. Sci., Polym. Chem. 2006, 44, 6888. doi: 10.1002/(ISSN)1099-0518
-
[26]
Zhang, X. H.; Shen, Z.; Li, L. T.; Zhang, S.; Lu, G. L.; Huang, X. Y. J. Polym. Sci., Polym. Chem. 2007, 45, 5509. doi: 10.1002/(ISSN)1099-0518
-
[27]
Zhang, X. H.; Shen, Z.; Li, L. T.; Lu, G. L.; Gu, L. N.; Huang, X. Y. Polymer 2007, 48, 5507. doi: 10.1016/j.polymer.2007.07.037
-
[28]
Zhang, X. H.; Shen, Z.; Feng, C.; Yang, D.; Li, Y. G.; Hu, J. H.; Lu, G. L.; Huang, X. Y. Macromolecules 2009, 42, 4249. doi: 10.1021/ma900343z
-
[29]
Ding, A. S.; Lu, G. L.; Guo, H.; Zheng, X. L.; Huang, X. Y. J. Polym. Sci., Polym. Chem. 2013, 51, 1091. doi: 10.1002/pola.26469
-
[30]
Harada, A.; Kataoka, K. Macromolecules 1995, 28, 5294. doi: 10.1021/ma00119a019
-
[31]
Meier, W. Chem. Soc. Rev. 2000, 29, 295. doi: 10.1039/a809106d
-
[32]
Kim, S. Y.; Ha, J. C.; Lee, Y. M. J. Controlled Release 2000, 65, 345. doi: 10.1016/S0168-3659(99)00207-2
-
[33]
胡晓霞, 董乾, 郝红, 高分子材料科学与工程, 2017, 33, 32. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gfzc201708007&dbname=CJFD&dbcode=CJFQHu, X. X.; Dong, Q.; Hao, H. Polym. Mater. Sci. Eng. 2017, 33, 32(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gfzc201708007&dbname=CJFD&dbcode=CJFQ
-
[34]
韩雅楠, 刘守信, 毛虹光, 田蕾, 宁文燕, 化学学报, 2016, 74, 744. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxxb201609005&dbname=CJFD&dbcode=CJFQHan, Y. N.; Liu, S. X.; Mao, H. G.; Tian, Y.; Yu, W. Y. Acta Chim. Sinica 2016, 74, 744(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxxb201609005&dbname=CJFD&dbcode=CJFQ
-
[35]
柳阳, 朱艳华, 孙佳琳, 刘霜琪, 孟莹, 刘剑桥, 中国药房, 2017, 28, 2274. doi: 10.6039/j.issn.1001-0408.2017.16.31Liu, Y.; Zhu, Y. H.; Sun, J. L.; Liu, S. Q.; Men, Y.; Liu, J. Q. China Pharm. 2017, 28, 2274(in Chinese). doi: 10.6039/j.issn.1001-0408.2017.16.31
-
[36]
Moffitt, M.; Eisenberg, A. Macromolecules 1997, 30, 4363. doi: 10.1021/ma961577x
-
[37]
魏渊, 郑成, 毛桃嫣, 林璟, 凌慧, 化学通报, 2017, 80, 925. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxtb201710005&dbname=CJFD&dbcode=CJFQWei, Y.; Zheng, C.; Mao, T. Y.; Lin, J.; Lin, H. Chemistry 2016, 80, 925(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxtb201710005&dbname=CJFD&dbcode=CJFQ
-
[38]
何天白, 胡汉杰, 海外高分子科学的新进展, 化学工业出版社, 北京, 1997, p. 39.He, T. B.; Hu, H. J. New Development of Overseas Macromolecular Science, Chemical Industry Press, Beijing, 1997, p. 39(in Chinese).
-
[39]
翁斌, 商丹, 金鹿江, 孙小英, 杭建忠, 高分子学报, 2017, 6, 990. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gfxb201706013&dbname=CJFD&dbcode=CJFQWen, B.; Shang, D.; Jin, L. J.; Sun, X. Y.; Hang, J. Z. Acta Polym. Sinica 2017, 6, 990(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gfxb201706013&dbname=CJFD&dbcode=CJFQ
-
[40]
孙坤, 陈芳, 马晓燕, 张杰, 张帆, 管兴华, 高分子材料科学与工程, 2017, 33, 128. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gfzc201703023&dbname=CJFD&dbcode=CJFQSun, K.; Chen, F.; Ma, X. Y.; Zhang, J.; Zhang, F.; Guan, X. H. Polym. Mater. Sci. Eng. 2017, 33, 128(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gfzc201703023&dbname=CJFD&dbcode=CJFQ
-
[41]
Wang, J.; Matyjaszewski, K. J. Am. Chem. Soc. 1995, 117, 5614. doi: 10.1021/ja00125a035
-
[42]
Muehlebach, A.; Gaynor, S. G.; Matyjaszewski, K. Macromolecules 1998, 31, 6046. doi: 10.1021/ma9804747
-
[43]
Sedjo, R. A.; Mirous, B. K.; Brittain, W. J. Macromolecules 2000, 33, 1492. doi: 10.1021/ma991549p
-
[44]
Li, Y. J.; Zhang, S.; Liu, H, ; Li, Q. N.; Li, W. X.; Huang, X. Y. J. Polym. Sci., Polym. Chem. 2010, 48, 5419. doi: 10.1002/pola.v48:23
-
[45]
严永新, 尹婷婷, 刘登峰, 刘娜, 殷俊, 朱元元, 吴宗铨, 高分子学报, 2015, 3, 319. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gfxb201503011&dbname=CJFD&dbcode=CJFQYan, Y. X.; Yin, T. T.; Liu, D. F.; Liu, N.; Yin, J.; Zhu, Y. Y.; Wu, Z. Q. Acta Polym. Sinica 2015, 3, 319(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=gfxb201503011&dbname=CJFD&dbcode=CJFQ
-
[46]
张康, 秦明林, 刘百花, 余帆, 滕翠青, 余木火, 合成纤维, 2017, 46, 22. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hcxw201702008&dbname=CJFD&dbcode=CJFQZhang, K.; Qin, M. L.; Liu, B. H.; Yu, F.; Teng, C. Q.; Yu, M. H. Synth. Fiber China 2017, 46, 22(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hcxw201702008&dbname=CJFD&dbcode=CJFQ
-
[47]
Miller, P. J.; Matyjaszewski, K. Macromolecules 1999, 32, 8760. doi: 10.1021/ma991077e
-
[48]
Kajiwara, A.; Matyjaszewski, K. Macromolecules 1998, 31, 3489. doi: 10.1021/ma971445j
-
[49]
Bielawski, C. W.; Morita, T.; Grubbs, R. H. Macromolecules 2000, 33, 678. doi: 10.1021/ma990625l
-
[50]
Xu, F. J.; Song, Y.; Cheng, Z. P.; Zhu, X. L.; Zhu, C. X.; Kang, E. T.; Neoh, K. G. Macromolecules 2005, 38, 6254. doi: 10.1021/ma050581i
-
[51]
Huang, X. Y.; Lu, G. L.; Peng, D.; Zhang, S.; Qing, F. L. Macromolecules 2005, 38, 7299. doi: 10.1021/ma0504062
-
[52]
Leiston-Belanger, J. M.; Penelle, J.; Russell, T. P. Macromolecules 2006, 39, 1766. doi: 10.1021/ma0522920
-
[53]
Lu, G. L.; Zhang, S.; Huang, X. Y. J. Polym. Sci., Polym. Chem. 2006, 44, 5438. doi: 10.1002/(ISSN)1099-0518
-
[54]
Myers, S. B.; Register, R. A. Macromolecules 2008, 41, 5283. doi: 10.1021/ma800844g
-
[55]
Tong, L.; Shen, Z.; Yang, D.; Chen, S.; Li, Y. J.; Hu, J. H.; Lu, G. L.; Huang, X. Y. Polymer 2009, 50, 2341. doi: 10.1016/j.polymer.2009.03.041
-
[56]
Destarac, M.; Boutevin, B. Makromol. Rapid Commun. 1999, 20, 641. doi: 10.1002/(ISSN)1521-3927
-
[57]
Akiyoshi, K.; Deguchi, S.; Moriguchi, N.; Yamaguchi S.; Sunamoto, J. Macromolecules 1993, 26, 3062. doi: 10.1021/ma00064a011
-
[58]
You, L.; Lu, F.; Li, Z. Zhang, W.; Li, F. Macromolecules 2003, 36, 1. doi: 10.1021/ma025641o
-
[59]
Xu, P. Tang, H.; Li, S.; Ren, J.; Van Kirk, E.; Murdoch, W. J.; Radosz, M.; Shen, Y. Biomacromolecules 2004, 5, 1736. doi: 10.1021/bm049874u
-
[60]
Boerresen, S.; Crandall, J. K. J. Org. Chem. 1976, 41, 678. doi: 10.1021/jo00866a019
-
[1]
-
图 6 (A) PNA (2.0×10-6 mo/L)在不同浓度的PDEAEMA-b-PPOA-b-PDEAEMA (4)水溶液中的荧光发射光谱(激发波长λex=340 nm)和(B) PNA荧光发射光谱的荧光强度比(I/I0)与PDEAEMA-b-PPOA-b-PDEAEMA (4)浓度的关系图
Figure 6 (A) Fluorescence emission spectra of PNA (2.0×10-6 mo/L) in aqueous solutions of PDEAEMA-b-PPOA-b-PDEAEMA (4) with different concentrations (λex=340 nm), and (B) dependence of fluorescence intensity ratio I/I0 of PNA fluorescence emission spectra on the concentration of PDEAEMA-b-PPOA-b-PDEAEMA (4)
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 12
- 文章访问数: 2482
- HTML全文浏览量: 543


 下载:
下载:








 下载:
下载:

