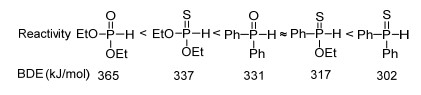
 图1
膦-氢化合物的反应活性
Figure1.
Order of reactivity of phosphorus hydrides
图1
膦-氢化合物的反应活性
Figure1.
Order of reactivity of phosphorus hydrides

Citation: Gao Yuzhen, Tang Guo, Zhao Yufen. Recent Advances of Phosphorus-Centered Radical Promoted Difunctionalization of Unsaturated Carbon-Carbon Bonds[J]. Chinese Journal of Organic Chemistry, 2018, 38(1): 62-74. doi: 10.6023/cjoc201708023

磷自由基对不饱和键的双官能化反应的研究进展
English
Recent Advances of Phosphorus-Centered Radical Promoted Difunctionalization of Unsaturated Carbon-Carbon Bonds
-
Key words:
- phosphorus-centered radical
- / difunctionalization
- / unsaturated compounds
-
有机膦化合物在有机合成、光电材料、阻燃材料以及药物化学等研究领域都具有广泛的应用[1].通过碳-磷键的成键反应是合成有机膦化合物最主要的方法之一, 采用过渡金属催化的偶联反应是实现碳-磷键成键的传统方法, 该方法具有高效性、高选择性等优点, 然而对于复杂结构的含磷化合物的合成却存在一定的局限性[2].近年来, 磷自由基促进的双官能团化反应取得了很大的进展, 通过磷自由基与不饱和化合物的串联反应可以在一步反应中实现含磷杂环以及多环化合物的构建[3].所以, 相比较过渡金属催化的偶联反应的途径, 通过磷自由基与不饱和化合物的双官能团化反应不仅具有步骤经济的优点, 还可以实现复杂有机膦化合物的合成.
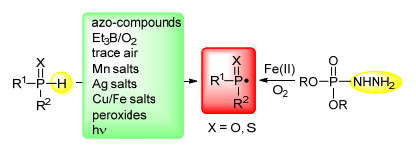
通常地, P—H键的均裂是生成磷自由基最主要的方式之一, 而绿色稳定的四配位磷化合物R1R2P(X)—H (X=O, S)可以在多种自由基引发剂的作用下生成磷自由基, 图 1列举了几种常见的四配位磷化合物P—H键的键能以及反应活性, 实验表明P—H键的键能越低, 越容易生成相应的磷自由基, 与不饱和化合物的反应速率也就越快[4b].在引发四配位磷化合物生成磷自由基方面, 早期多使用高毒的三乙基硼作为磷自由基引发剂[4], 也有使用催化量的空气作为磷自由基引发剂的报道[5], 但操作比较困难.正是受限于磷自由基引发剂, 使得早期磷自由基化学的发展受到限制.近几年来, 磷自由基引发剂得到了很大的发展, 不仅可以使用低毒甚至是无毒的化合物作为引发剂, 而且引发的条件也日趋温和[3a, 3b](Scheme 1).本文将分别从三价锰盐、银盐、铜/铁盐、过氧化合物以及光引发剂等几种常见的磷自由基引发剂进行归纳总结, 对近年来基于四配位磷化合物产生的磷自由基与不饱和化合物的双官能团化反应进行综述, 并对部分反应的机理做扼要说明.
1 三价锰盐作为磷自由基引发剂
三价锰盐作为单电子氧化剂, 在自由基化学领域被广泛应用[6].三价锰盐在引发膦-氢化合物产生磷自由基方面也有突出表现, 通常在此反应条件下, 三价锰盐不仅作为磷自由基引发剂, 同时还是体系的氧化剂, 因此使用的当量比较大.
2010年, 邹建平课题组[7]报道三价醋酸锰引发的磷自由基和二芳基炔酮类化合物的双官能团化反应, 实现了膦酰化茚酮衍生物的合成, 该方法主要适用于二烷氧基膦氧类底物的合成(Eq. 1).随后, 他们又将此方法应用到硫自由基和二芳基炔酮类化合物的反应中[8].
在此研究基础上, 邹建平课题组[9]发展了三价醋酸锰引发的磷自由基和1, 4-二取代-1-丁炔化合物的反应(Eq. 2).该反应的底物适用性受限, 当底物中X=CH2时, 可以得到单一的双官能团化产物; 当X=O时, 得到双官能团化产物和加成产物; 当X=NMe时, 并没有得到预期产物, 而是得到β-羰基膦化合物.
磷自由基不仅可以和内炔底物反应, 同样也可以和内烯底物反应得到双官能团化产物. 2011年, 邹建平课题组[10]在他们的研究基础上, 成功发展了磷自由基和1, 4-二取代-1-丁烯类化合物的反应, 实现了膦酰化四氢萘衍生物的合成(Eq. 3).该方法收率中等, 并且当选择1, 4-二芳基取代物为反应底物时, 得到的产物为混合物.
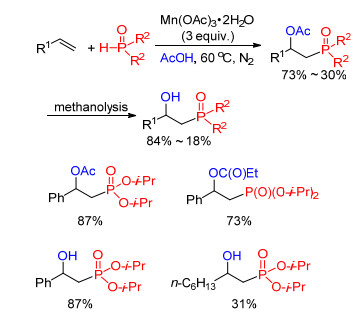
此外, 我们课题组[11]和邹建平课题组[12]分别报道了三价醋酸锰引发的磷自由基和端烯烃的双官能团化反应(Eq. 4).体系使用醋酸为溶剂, 可以得到膦酰化-乙酰氧基化的产物; 值得提出的是, 当选择丙酸为溶剂时, 也可以得到膦酰化-丙酰氧基化的产物.该双官能团化产物经过醇解过程, 可以以定量的产率得到最终产物β-羟基膦化合物.该方法对烯烃底物有较好的兼容性, 但对于苯环上有强吸电子基取代的芳基烯烃以及烷基烯烃的适用性相对较差, 部分原因是和自由基中间体的稳定性有关.
在此研究基础上, 我们课题组[13]在烯烃、H-亚磷酸酯和三价醋酸锰的体系中引入TMSN3, 成功地实现了在一步反应中同时引入两个官能团, 在温和的条件下实现了β-叠氮膦酸酯的合成(Eq. 4).该方法对大部分的烯烃底物都有较好的兼容性, 并且叠氮官能团的反应多样性为产物的进一步衍生化提供了更多的可能性和更大的空间.
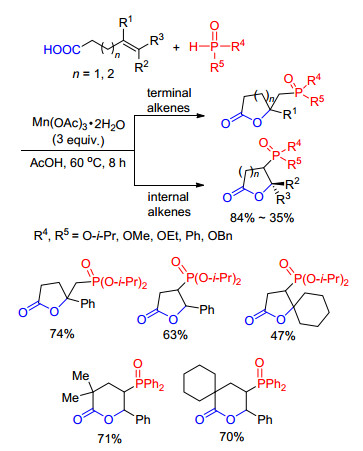
若特定结构的烯烃底物中存在羧基官能团, 那么磷自由基与烯烃加成后的碳自由基中间体则会和羧基发生进一步反应.我们课题组[14]发展了三价醋酸锰引发的磷自由基和含有羧基的烯烃底物的双官能团化反应制备膦酰化内脂衍生物(Scheme 3).该方法收率优良, 对不同的含有羧基的烯烃底物以及膦-氢化合物都具有很好的适用性, 不仅可以构建五元环骨架, 也可以实现六元环骨架的构建.
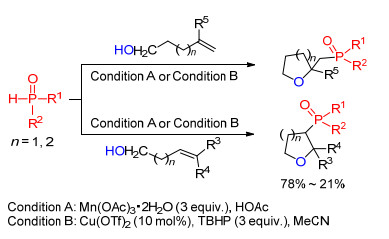
在此基础上, 我们课题组[15]将含有羧基的烯烃底物换成含羟基的烯烃类化合物时, 磷自由基同样可以和含羟基的烯烃底物发生双官能团化反应, 从而实现膦酰化内醚衍生物的合成(Scheme 4).对于该反应, 使用3 equiv.的三价醋酸锰, 或者使用催化量的铜盐并配合使用氧化剂作为磷自由基引发剂, 都可以以较高的产率得到目标产物.
异氰官能团以其独特的电子结构, 很容易被各种自由基进攻.多个课题组[16]对磷自由基和异氰底物的双官能团化反应制备膦酰化菲啶进行研究(Eq. 5), 为了方便说明, 在这里对这类反应做统一介绍.多种不同的磷自由基引发方式都适用于该体系, 除了以上提到的三价醋酸锰引发剂[16a, 16b](Condition A), 通过银盐[16c, 16d](Condition B)以及光催化[16e](Condition C)作为磷自由基引发剂的途径都可以实现该反应的转化, 但这几种方法都需要当量氧化剂的参与才能顺利进行.
2 银锰盐作为磷自由基引发剂
相比较三价锰盐, 银盐在引发膦-氢化合物生成磷自由基方面的应用则更为广泛.当使用银盐作为磷自由基引发剂时, 可以使用当量的银盐同时作为自由基引发剂和体系的氧化剂, 也可以使用催化量的银盐并配合氧化剂的使用, 这为多种反应的顺利转化提供了更大的可能性.
2013年, 李超忠课题组[17]报道银催化下烯烃和氢亚磷酸酯的反应合成膦酰化-氟化的双官能团化产物(Eq. 6).该反应具有很好的官能团适应性, 对多种烯烃底物尤其是脂肪烯烃都能以良好的收率得到目标产物, 产率最高可达93%.值得提出的是, 体系中的Select-Fluor不仅提供反应所需要的氟源, 同时也作为体系的氧化剂.
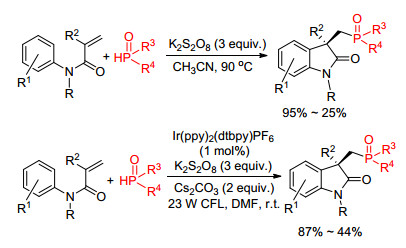
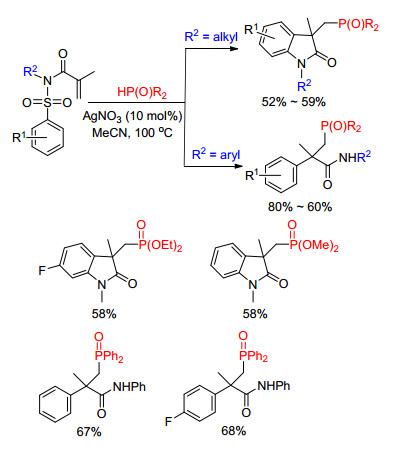
同年, 杨尚东课题组[18]报道银催化下氢亚磷酸酯和芳基丙烯酰胺的反应, 该反应以硝酸镁作为氧化剂, 经过磷自由基和烯酰胺的加成-环化串联过程, 最终得到膦酰化氧化吲哚衍生物(Eq. 7).需要指出的是, 该反应中的磷自由基选择性地加成到烯烃的β位.
这是首例磷自由基和烯基酰胺底物的双官能团化反应, 在这之后, 陆续有其他相关报道[19, 16e].杨尚东课题组[19]在他们的研究基础上发展了仅使用3 equiv. K2S2O8即可使反应顺利进行, 相比之前的方法绿色、廉价.虽然通过光催化的途径也可以实现该转化[16e], 但体系不仅需使用1 mol%的铱盐作为光催化剂, 同时还需要3 equiv. K2S2O8作为氧化剂(Scheme 5).
2016年, 朱成健课题组[20]选择芳基丙内烯酰胺为底物, 使用硝酸银为催化剂, 硝酸镁为氧化剂, 磷自由基可以选择性地加成到烯烃的α位, 从而实现了膦酰化2-羰基-3, 4-二氢喹啉衍生物的合成(Eq. 8).通过该反应, 可以实现含磷六元环化合物的有效构筑.
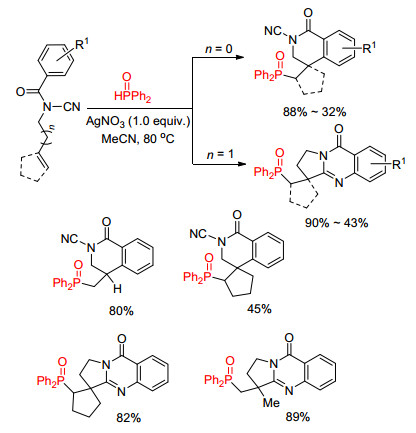
同年, 崔孙良课题组[21]对底物结构进行进一步改变, 在芳基烯酰胺的氮原子上引入氰基官能团, 利用氰基官能团的反应性并通过控制烯烃链的长度, 可以选择性地得到膦酰化喹唑啉酮与二氢异喹啉衍生物, 甚至是螺环产物(Scheme 6).该方法对大部分底物适用性良好, 无论是端烯还是内烯都可以参与反应, 并且反应的转化率高, 产率最高可达90%.
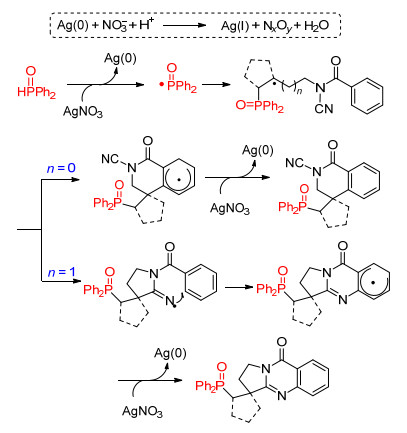
该工作的反应历程是:二苯基氧膦在硝酸银的作用下得到磷自由基, 磷自由基首先与烯烃发生加成反应得到碳自由基中间体.当n=0时, 碳自由基中间体则进攻到苯环上, 再发生氧化、脱质子过程, 得到膦酰化二氢异喹啉产物; 当n=1时, 碳自由基中间体选择性地进攻到分子内的氰基碳上, 形成一个新的五元环并得到亚胺氮自由基中间体, 该中间体继而发生分子内的环化加成、氧化脱质子过程得到膦酰化喹唑啉酮衍生物(Scheme 7).
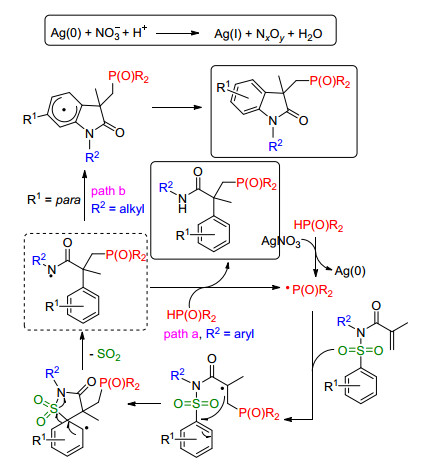
若在芳基丙烯酰胺的底物中引入磺酰基, 反应又会有新的变化. 2014年, Nevado课题组[22]报道了硝酸银催化的磷自由基与烯基磺酰胺类化合物的反应.由于磺酰基的引入, 在自由基反应的过程中会经历脱去一分子二氧化硫的历程.有意思的是, 当磺酰胺氮原子上的取代基团类型不同时, 可以得到结构完全不同的产物(Scheme 8).
作者对该反应也提出了一个可能的反应理(Scheme 9).二苯基膦氧在硝酸银的作用下得到磷自由基, 磷自由基首先与烯烃发生加成反应生成碳自由基中间体, 碳自由基中间体优先和芳基碳发生加成反应形成五元环中间体, 继而该中间体脱去一分子SO2形成氮自由基中间体.有意思的是, 氮原子上的取代基会直接影响最终产物的结构, 若氮原子上的取代基为芳基时, 氮自由基中间体直接被质子化得到膦酰化酰胺产物(path a); 若氮原子上的取代基为烷基时, 该氮自由基中间体会进一步发生分子内的加成环化-氧化过程最终得到膦酰化-2-吲哚酮产物(path b).
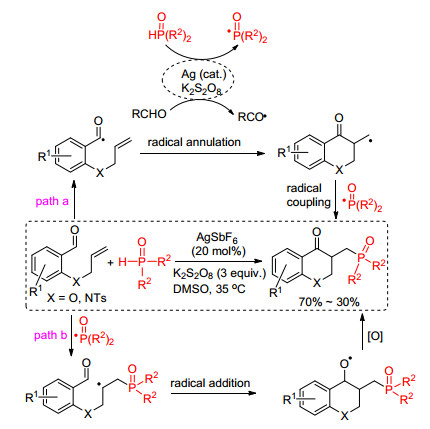
2016年, 李福伟课题组[23]发展了使用银盐作为催化剂, K2S2O8作为氧化剂, 在温和的条件下通过膦-氢化合物与2-烯基芳香醛的反应实现膦酰化-4-羰基二氢苯并哌喃的合成(Scheme 10).机理方面, 作者认为该反应可能有两种反应历程:膦-氢化合物在银盐的作用下生成磷自由基, 磷自由基可以引发醛基生成羰基自由基, 该自由基可以和分子内的双键发生加成反应生成碳自由基中间体, 碳自由基进而和磷自由基发生自由基猝灭反应得到目标产物(path a); 另外, 生成的磷自由基可以直接和烯基发生加成反应得到碳自由基中间体, 该中间体和分子内的醛基发生加成反应得到氧自由基中间体, 氧自由基再被氧化得到最终产物(path b).
之前报道的关于磷自由基参与的双官能团化反应, 多是使用活化的烯烃作为底物才能以较高的收率得到目标产物. 2016年, 刘心元课题组[24]报道了银催化的、远程氰基迁移的磷自由基和非活化烯烃的双官能团化反应(Scheme 11).二苯基膦氧在硝酸银的作用下生成磷自由基, 该自由基首先和末端双键发生加成反应, 得到碳自由基中间体; 由于氰基官能团的反应性, 碳自由基中间体可以和分子内的氰基发生加成反应生成亚胺氮自由基中间体, 该中间体经过β-裂变和SET过程, 最终得到膦酰化-氰基迁移的产物.虽然文献中报道的例子有限, 但该方法收率良好, 为磷自由基反应的多样性提供了借鉴的方向.
吲哚骨架广泛存在于天然产物中, 通过高效、简便的途径实现膦酰化吲哚的合成也具有十分重要的意义, 且吲哚的2位碳和3位碳的活性很高, 可以发生多种反应. 2017年, 刘建明课题组[25]发展了肉桂酰基取代的吲哚底物和膦-氢化合物的反应, 该反应利用吲哚的反应活性, 引发产生的磷自由基与双键加成后得到的中间体会进一步和吲哚的2位碳发生加成-氧化串联反应, 从而得到具有多环结构的膦酰化吲哚产物(Eq. 9).该方法使用银盐为催化剂, 硝酸镁为氧化剂, 底物适用性良好, 且具有较高的立体选择性.
随后, 宋秋玲课题组[26]也对此反应进行了报道, 反应条件与刘建明等类似(Eq. 10).此外, 宋秋玲等还进一步探索了丙炔酰胺基取代的吲哚和磷自由基的反应, 该反应使用银盐作为催化剂, 硝酸镁作为氧化剂, 磷自由基同样可以和叁键发生上述反应得到相应的目标产物, 遗憾的是, 该反应的转化率偏低(Eq. 11).
我们课题组[27]则使用丙炔基取代的吲哚为反应底物, 在当量醋酸银的作用下, 产生的磷自由基首先和叁键发生加成反应, 得到的烯基自由基中间体进一步和吲哚的2位碳发生加成反应, 并经过氧化、脱质子和异构化的一系列过程得到2-膦酰化-9H-吡咯[1, 2-a]吲哚及其衍生物(Eq. 12).随后, 朱成建课题组[28]也对此反应进行了报道, 他们则是通过使用硫酸铜为催化剂, K2S2O8为氧化剂来实现这一反应过程(Eq. 13).
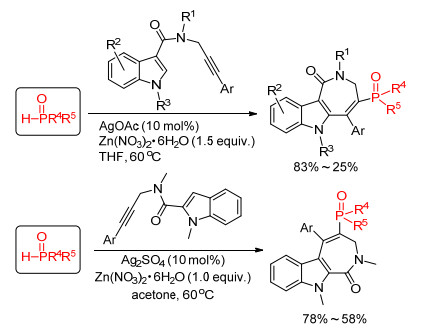
以上介绍了含磷的五元环和六元环化合物的合成, 而磷自由基也一样可以实现含磷七元环化合物的合成.梁永民课题组[29]分别在吲哚的2位碳和3位碳引入炔酰胺基团, 同时使用银盐为催化剂, 硝酸锌为氧化剂, 反应产生的磷自由基和炔酰胺基团上的叁键发生加成反应生成烯基自由基中间体, 该中间体会进一步和吲哚环上的碳发生加成环化-氧化过程, 最终得到膦酰化的吲哚并七元环的产物(Scheme 12).
此外, 我们课题组[30]发展了合成3-膦酰化吲哚衍生物的新方法(Eq. 14), 在醋酸银的作用下, 膦-氢化合物产生的磷自由基首先和底物的叁键发生加成反应, 得到的烯基自由基中间体再发生分子内的环化氧化反应并脱去Ts自由基, 最后得到氮原子无保护的3-膦酰化吲哚, 该方法在一步反应中同时实现P—C键、C—N键和吲哚环的构建, 具有步骤经济的优点.
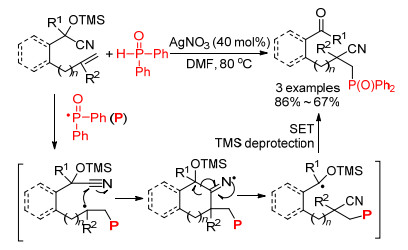
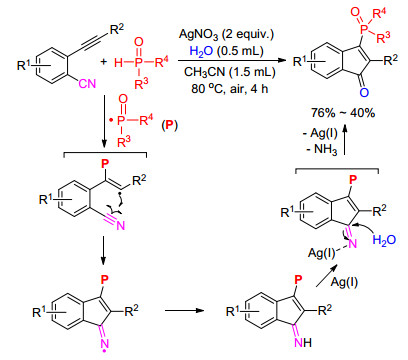
2017年, 屠树江等[31]报道了合成膦酰化二氢茚酮的新方法(Scheme 13), 膦-氢化合物在硝酸银的作用下生成磷自由基, 磷自由基和叁键发生加成反应后得到烯基自由基中间体; 同样地, 由于氰基官能团的反应性, 烯基自由基中间体进攻到分子内的氰基得到亚胺氮自由基中间体, 该中间体再被质子捕获并被水解得到目标产物.
2014年, 吴养洁课题组[32]报道了在银盐的催化下, 膦-氢化合物和炔酸酯的双官能团化反应, 从而实现一系列膦酰化香豆素衍生物的合成(Eq. 14).同年, 梁永民课题组[33]报道了硝酸银引发产生的磷自由基与对丙炔酰胺苯甲醚底物的反应, 从而实现一系列膦酰化氮杂螺环化合物的合成(Eq. 15), 文献中提出的机理显示产物苯醌中的氧原子来源于底物中的甲氧基. 2016年, 梁永民课题组[34]在此研究基础上, 在底物中引入磺酰基, 磷自由基同样可以和底物发生双官能团化反应并经历类似Scheme 7的过程脱去一分子SO2, 最终得到膦酰化氮杂螺环产物(Eq. 16).
若底物中同时含有双键和叁键, 磷自由基会选择性地和底物发生反应. 2014年, 梁永民课题组[35]报道了银催化生成的磷自由基与多不饱和底物的双官能团化反应, 一锅法合成了膦酰化芴衍生物(Eq. 17).膦-氢化合物在银盐的作用下生成磷自由基, 磷自由基选择性地与叁键发生加成反应生成烯基自由基中间体, 该中间体进一步与分子内的烯烃发生加成反应得到碳自由基中间体, 生成的中间体再与芳环发生加成-氧化脱质子过程得到最终产物.该方法虽然只适用于二芳基膦氧, 但在一步反应中同时实现了一个P—C键、两个C—C键以及两个新环的构筑, 步骤经济.
选择简单结构的内炔作为反应底物时, 磷自由基也可以和底物发生反应得到苯并膦杂环衍生物, 有多个课题组[36]对这方面的工作进行了系统的研究(Scheme 14), 为了方便说明, 在这部分对目前已经报道的方法做统一介绍.
2013年, Satoh课题组[36a]报道了醋酸银促进的磷自由基和1, 2-二取代乙炔的反应, 磷自由基首先和叁键发生加成反应生成烯基自由基中间体, 该中间体通过4-exo-trig的方式进攻到与磷原子相连的苯环上得到一个四元环中间体, 该中间体经过互变、氧化脱质子过程得到目标产物; 三价醋酸锰也可以引发该反应, 只是产率稍低, 在这个反应中, 无论醋酸银还是醋酸锰都是化学计量的(Condition A).几乎同时, 段伟良课题组[36b]报道了氧化银引发的磷自由基与1, 2-二取代乙炔的双官能团化反应实现苯并膦杂环化合物的构筑, 该方法底物适用性好, 产率优良(Condition B).
以上两种方法都需要较大当量的银盐或者锰盐, 操作起来不够经济、绿色. 2016年, 我们课题组在此基础上报道了仅使用2%的五水硫酸铜[36c](Condition C)或无金属参与的K2S2O8促进的途径[36d](Condition D)实现通过磷自由基与炔烃的反应合成苯并膦杂环化合物.除了使用传统的磷自由基引发剂, 也可以使用Eosin Y作为光催化剂, 通过光照的途径同样可以实现苯并膦杂环化合物的合成[36e](Condition E), 但在这个反应条件下, 需要使用2 equiv. N-乙氧基-2-甲基吡啶作为氧化剂; 同时, 作者还对该反应的反应机理进行了较全面的研究.
另外, 我们课题组[37]还发展了二芳基膦氧和芳基炔酸的反应, 从而实现膦酰化苯并膦杂环化合物的合成(Eq. 18).机理方面, 作者进行了一系列对照实验, 认为在此反应条件下, 二芳基膦氧首先和芳基炔酸发生脱二氧化碳-偶联反应生成膦炔中间体, 生成的膦炔进而被体系中生成的磷自由基进攻, 发生类似Scheme 13的过程得到目标产物.
3 铜/铁盐作为磷自由基引发剂
铜/铁盐具有化学性质温和、价格低廉和低毒性等优点, 所以使用铜/铁盐作为自由基引发剂也是非常热门的研究方向之一.目前, 铜/铁盐在作为磷自由基引发剂方面的应用也十分广泛, 前文也介绍了几例铜盐作为磷自由基引发剂的例子[15, 28, 36c].
β-羰基膦化合物是著名的Horner-Wadsworth-Em-mons (HWE)反应的底物, 因而实现β-羰基膦化合物的合成具有重要的意义.目前, 通过磷自由基的途径实现β-羰基膦化合物的合成多使用铜盐/铁盐为共催化剂体系.
2012年, 姬建新课题组[38]首次报道了在铜盐/铁盐/空气的反应体系下, 氢亚磷酸酯与烯烃的反应实现β-羰基膦化合物的合成, 该反应的底物适用性良好, 且便于大量合成(Eq. 19).值得提出的是, 空气中的氧气不仅作为反应所需的试剂, 同时也是反应所需的氧化剂, 具有较高的原子经济性.
2015年, 宋秋玲课题组[39]使用α, β-不饱和酯和α, β-不饱和酰胺为原料合成β-羰基膦化合物(Eq. 20), 该方法同样是使用铜/铁盐为共催化剂; 在对机理进行研究后, 他们认为产物羰基上的氧原子来自氧气.随后, 他们使用α, β-不饱和酮[40]作为反应底物通过自由基的途径实现β-羰基膦化合物的合成(Eq. 21), 在这个反应体系中, 产物羰基上的氧原子不是来自氧气, 而是来自底物中的羰基, 并且反应有副产物醛生成.
此外, 在氧气和自由基引发剂存在的条件下, 膦-氢化合物也可以和炔烃或炔酸底物反应生成β-羰基膦化合物, 多个课题组[41]对此进行了研究报道.
宋秋玲课题组[41a]通过使用铜盐/铁盐/氧气体系实现了膦-氢化合物和炔酸以及端炔的反应得到β-羰基膦化合物, 产率在70%~40%之间.该方法适用于氢亚磷酸酯作为反应底物的情况, 而二芳基膦氧在此反应条件下产率较低(Eq. 22).随后, 何卫民课题组[41b]同样使用铜盐/铁盐/氧气的反应体系实现β-羰基膦化合物的合成, 但转化率不高, 产率普遍在60%~40%之间(Eq. 23).值得提出的是, 这两个方法都使用氧气作为氧化剂, 无需氧化剂的额外添加, 符合绿色化学和原子经济性的要求.
我们课题组[41c]报道了二芳基膦氧和炔酸反应生成β-羰基膦化合物的工作(Eq. 24).该反应使用五水硫酸铜和TBHP作为磷自由基引发剂, 并且必须加入氨水才可以使反应的转化率达到满意的结果, 该方法底物适用良好, 转化率高, 产率最高可达95%.
以上的几个例子只适合芳基-β-羰基膦化合物的合成. 2015年, 陈晓岚课题组[41d]报道在铜盐、银盐和氧化剂的作用下, 膦-氢化合物和炔烃反应得到β-羰基膦化合物(Eq. 25).相比较之前的工作, 该反应的优点是不仅可以合成芳基-β-羰基膦化合物, 也同样适用于烷基-β-羰基膦化合物的合成.
2011年, Taniguchi小组[42]报道了铁催化下, 磷酰肼和端烯烃的双官能团化反应来合成β-羟基膦化合物(Eq. 26).该方法以二乙氧基磷酰肼作为磷自由基的前体, 在Fe(Pc)催化下, 通过氧化脱氮气产生磷自由基, 磷自由基进一步与双键反应得到膦β-羟基膦化合物, 值得提出的是, 当底物为1, 1-二取代烯烃时才能以满意的转化率得到目标产物.
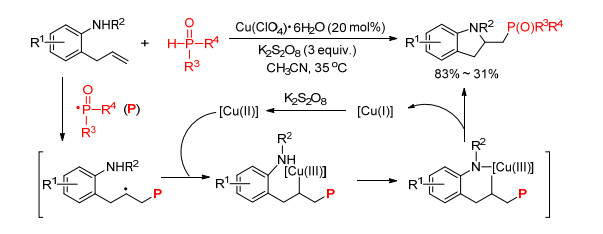
2015年, 杨尚东课题组[43]报道了使用铜盐为催化剂、K2S2O8为氧化剂通过磷自由基的双官能团化反应实现膦酰化吲哚啉的合成(Scheme 15).膦氢化合物在铜盐的作用下生成的磷自由基, 磷自由基首先和双键发生加成反应得到碳自由基中间体, 该中间体和二价铜发生偶联得到[Cu(Ⅲ)—C]中间体, 该中间体继而和分子内的氮原子配位后得到目标产物并脱去[Cu(Ⅰ)], [Cu(Ⅰ)]被氧化得到[Cu(Ⅱ)]继续参与体系循环.
2015年, 李亚民课题组[44]使用2-氰基取代的芳基丙烯酰胺为底物, 在Cu(Ⅱ)/Mg(NO3)2的协同作用下, 膦-氢化合物通过自由基的途径和底物发生双官能团化反应得到膦酰化-2, 4-二羰基喹啉衍生物(Eq. 27).该反应同样是利用氰基官能团可以被自由基进攻的特点, 经过类似Scheme 11的过程得到目标产物; 且该方法的底物适用性优良, 产率最高可达97%.
2016年, 我们课题组[45]实现了Cu(OTf)2催化的膦-氢化合物与N-丙烯酰基芳基甲酰胺类化合物的双官能团化反应, 实现了膦酰化异喹啉二酮衍生物的合成(Eq. 28).实验表明, 膦-氢化合物在Cu(Ⅱ)/TBHP协同作用下可以产生磷自由基, 该反应不需要碱的参与即可顺利转化; 当底物的对位为甲氧基取代时, 可以得到混合产物, 主要以膦酰化氮杂螺环产物为主, 这和反应Eqs. 24, 25类似.
4 过氧化合物作为磷自由基引发剂
除了金属催化剂的使用, 也可以单独使用过氧化合物作为磷自由基引发剂, 前文也有介绍[19, 36d]. 2016年, 屠树江课题组[46]发展了使用过氧化苯甲酰叔丁脂(TBPB)作为磷自由基引发剂, 膦-氢化合物和2-乙炔基取代的芳基丙烯酰胺类化合物发生双官能团化反应生成膦酰化二氢喹啉衍生物(Eq. 29).作者认为, 产物烯基上的氢原子来自于膦-氢化合物.
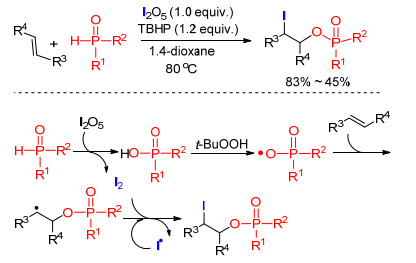
2015年, 王桦课题组[47]报道了β-碘代膦酸脂的合成方法(Scheme 16).膦-氢化合物在I2O5的氧化下生成磷酸, 磷酸和过氧化叔丁醇(TBHP)反应生成磷酸自由基, 该自由基和烯烃发生加成反应得到碳自由基中间体, 碳自由基再和体系中的碘单质反应得到双官能团化的产物; 该反应表明磷酸也可以在引发剂的作用下生成磷酸自由基, 为结构更为丰富的含磷底物的合成提供了借鉴.
2016年, 我们课题[48]报道了使用TBHP作为磷自由基引发剂, 膦-氢化合物和芳基丙炔胺的双官能团化反应得到3-膦酰化喹啉及其衍生物(Eq. 30), 虽然该方法的转化率相对较低, 但为膦酰化喹啉类化合物的合成提供了新的途径.
5 光引发剂作为磷自由基引发剂
近年来可见光催化作为一种新型高效的催化途径被广泛应用在自由基反应中.但遗憾的是, 光催化在引发的磷自由基与不饱和化合物的加成反应[49]、加成-脱氢反应[50]以及双官能团化反应[16e, 36e]方面的报道却相对比较有限, 目前还只是在起步阶段, 仍有很大的发展空间.芦昌盛课题组[16e]报道的光催化下磷自由基与不饱和化合物的反应, 除了上面介绍的两种底物(Eq. 5, Scheme 5), 还报道了膦-氢化合物与烯基异氰的双官能团化反应实现膦酰化异喹啉衍生物的合成(Eq. 31).
最近, 许鹏飞课题组[51]报道了在有机染料Eosin Y的存在下, 膦-氢化合物可以在光照的作用下生成磷自由基并和炔酸酯底物发生双官能团化反应实现一系列膦酰化香豆素衍生物的合成(Eq. 32).相比较之前的方法[32], 该反应在无金属参与、常温的条件下即可顺利发生, 更经济绿色.
6 结论与展望
综上所述, 膦-氢化合物在自由基引发剂的作用下对不饱和键的双官能团化反应在近几年中已经取得了快速的发展, 为一系列结构复杂的含磷化合物的合成提供了一条高效、经济的途径.但在该领域还有一部分工作值得有机化学家去深入探讨研究:首先, 部分体系的金属引发剂需要的当量比较大, 或者需要较多氧化剂的参与, 不符合绿色化学的理念; 其次, 过渡金属催化反应已取得巨大的发展, 若将金属催化反应与自由基反应两种途径结合起来, 将有巨大的发展空间, 目前已经有这方面的相关报道[52]; 最后, 可见光促进的自由基反应作为一种新型高效的催化途径具有催化效率高, 反应条件温和等优点, 但是可见光引发的磷自由基反应发展还比较有限, 目前还处于起步阶段, 因此将可见光催化应用在磷自由基反应中将具有远大的研究价值和应用前景.
-
-
[1]
(a) De Clercq, E. Med. Res. Rev. 2011, 31, 118.
(b) Queffélec, C. ; Petit, M. ; Janvier, P. ; Knight, D. A. ; Bujoli, B. Chem. Rev. 2012, 112, 3777.
(c) Zhao, Y. ; Xiao, Q. ; Ju, Y. ; Li, Y. Chin. J. Org. Chem. 2001, 21, 869(in Chinese).
(赵玉芬, 肖强, 巨勇, 李艳梅, 有机化学, 2001, 21, 869. )
(d) McManus, H. A. ; Guiry, P. J. Chem. Rev. 2004, 104, 4151. -
[2]
(a) Tappe, F. M. J. ; Trepohl, V. T. ; Oestreich, M. Synthesis 2010, 3037.
(b) Demmer, C. S. ; Krogsgaard-Larsen, N. ; Bunch, L. Chem. Rev. 2011, 111, 7981.
(c) Shao, C. ; Xu, W. ; Li, L. ; Zhang, X. Chin. J. Org. Chem. 2017, 37, 335(in Chinese).
(邵长伟, 徐炜刚, 李亮, 张兴华, 有机化学, 2017, 37, 335. )
(d) Yang, J. ; Xiao, J. ; Zhou, Y. ; Chen, T. ; Yin, S. ; Han, L. Chin. J. Org. Chem. 2017, 37, 1055(in Chinese).
(杨佳, 肖晶, 周永波, 陈铁桥, 尹双凤, 韩立彪, 有机化学, 2017, 37, 1055. ) -
[3]
For selected reviews on reactions involving P-center radical, see:
(a) Pan, X.-Q.; Zou, J.-P.; Yi, W.-B.; Zhang, W. Tetrahedron 2015, 71, 7481.
(b) Gao, Y.; Tang, G.; Zhao, Y. Phosphorus, Sulfur Silicon Relat. Elem. 2017, 192, 589.
(c) Leca, D.; Fensterbank, L.; Lac te, E.; Malacria, M. Chem. Soc. Rev. 2005, 34, 858. -
[4]
(a) Parsons, A. F.; Sharp, D. J.; Taylor, P. Synlett 2005, 2981.
(b) Jessop, C. M.; Parsons, A. F.; Routledge, A.; Irvine, D. J. Eur. J. Org. Chem. 2006, 1547. -
[5]
Hirai, T.; Han, L.-B. Org. Lett. 2007, 9, 53. doi: 10.1021/ol062505l
-
[6]
Mondal, M.; Bora, U. RSC Adv. 2013, 3, 18716. doi: 10.1039/c3ra42480d
-
[7]
Pan, X.-Q.; Zou, J.-P.; Zhang, G.-L.; Zhang, W. Chem. Commun. 2010, 46, 1721. doi: 10.1039/b925951a
-
[8]
Zhou, J.; Zhang, G.-L.; Zou, J.-P.; Zhang, W. Eur. J. Org. Chem. 2011, 3412.
-
[9]
Li, D.-P.; Pan, X.-Q.; An, L.-T.; Zou, J.-P.; Zhang, W. J. Org. Chem. 2014, 79, 1850. doi: 10.1021/jo402556a
-
[10]
Pan, X.-Q.; Wang, L.; Zou, J.-P.; Zhang, W. Chem. Commun. 2011, 47, 7875. doi: 10.1039/c1cc12343b
-
[11]
Gao, Y.; Wu, J.; Xu, J.; Zhang, P.; Tang, G.; Zhao, Y. RSC Adv. 2014, 4, 51776. doi: 10.1039/C4RA10593A
-
[12]
Zhou, S.-F.; Li, D.-P.; Liu, K.; Zou, J.-P.; Asekun, O. T. J. Org. Chem. 2015, 80, 1214. doi: 10.1021/jo5023298
-
[13]
Xu, J.; Li, X.; Gao, Y.; Zhang, L.; Chen, W.; Fang, H.; Tang, G.; Zhao, Y. Chem. Commun. 2015, 51, 11240. doi: 10.1039/C5CC03995A
-
[14]
Gao, Y.; Li, X.; Xu, J.; Wu, Y.; Chen, W.; Tang, G.; Zhao, Y. Chem. Commun. 2015, 51, 1605. doi: 10.1039/C4CC07978G
-
[15]
Gao, Y.; Li, X.; Chen, W.; Tang, G.; Zhao, Y. J. Org. Chem. 2015, 80, 11398. doi: 10.1021/acs.joc.5b02026
-
[16]
(a) Gao, Y.; Wu, J.; Xu, J.; Wang, X.; Tang, G.; Zhao, Y. Asian J. Org. Chem. 2014, 3, 691.
(b) Li, Y.; Qiu, G.; Ding, Q.; Wu, J. Tetrahedron 2014, 70, 4652.
(c) Zhang, B.; Daniliuc, C. G.; Studer, A. Org. Lett. 2014, 16, 250.
(d) Cao, J.-J.; Zhu, T.-H.; Gu, Z.-Y.; Hao, W.-J.; Wang, S.-Y.; Ji, S.-J. Tetrahedron 2014, 70, 6985.
(e) Li, C.-X.; Tu, D.-S.; Yao, R.; Yan, H.; Lu, C.-S. Org. Lett. 2016, 18, 4928. -
[17]
Zhang, C.; Li, Z.; Zhu, L.; Yu, L.; Wang, Z.; Li, C. J. Am. Chem. Soc. 2013, 135, 14082. doi: 10.1021/ja408031s
-
[18]
Li, Y.-M.; Sun, M.; Wang, H.-L.; Tian, Q.-P.; Yang, S.-D. Angew. Chem., Int. Ed. 2013, 52, 3972. doi: 10.1002/anie.v52.14
-
[19]
Li, Y.-M.; Shen, Y.; Chang, K.-J.; Yang, S.-D. Tetrahedron 2014, 70, 1991. doi: 10.1016/j.tet.2014.01.065
-
[20]
Zhang, H.; Gu, Z.; Li, Z.; Pan, C.; Li, W.; Hu, H.; Zhu, C. J. Org. Chem. 2016, 81, 2122. doi: 10.1021/acs.joc.5b01879
-
[21]
Zheng, J.; Zhang, Y.; Wang, D.; Cui, S. Org. Lett. 2016, 18, 1768. doi: 10.1021/acs.orglett.6b00481
-
[22]
Kong, W.; Merino, E.; Nevado, C. Angew. Chem., Int. Ed. 2014, 53, 5078. http://www.ncbi.nlm.nih.gov/pubmed/24174281
-
[23]
Zhao, J.; Li, P.; Li, X.; Xia, C.; Li, F. Chem. Commun. 2016, 52, 3661. doi: 10.1039/C5CC09730D
-
[24]
Wang, N.; Li, L.; Li, Z.-L.; Yang, N.-Y.; Guo, Z.; Zhang, H.-X.; Liu, X.-Y. Org. Lett. 2016, 18, 6026. doi: 10.1021/acs.orglett.6b02960
-
[25]
Liu, J.; Zhao, S.; Song, W.; Li, R.; Guo, X.; Zhuo, K.; Yue, Y. Adv. Synth. Catal. 2017, 359, 609. doi: 10.1002/adsc.v359.4
-
[26]
Xu, J.; Yu, X.; Song, Q. Org. Lett. 2017, 19, 980. doi: 10.1021/acs.orglett.6b03713
-
[27]
Chen, S.; Zhang, P.; Shu, W.; Gao, Y.; Tang, G.; Zhao, Y. Org. Lett. 2016, 18, 5712. doi: 10.1021/acs.orglett.6b02941
-
[28]
Zhang, H.; Li, W.; Zhu, C. J. Org. Chem. 2017, 82, 2199. doi: 10.1021/acs.joc.6b02673
-
[29]
Hua, H.-L.; Zhang, B.-S.; He, Y.-T.; Qiu, Y.-F.; Wu, X.-X.; Xu, P.-F.; Liang, Y.-M. Org. Lett. 2016, 18, 216. doi: 10.1021/acs.orglett.5b03329
-
[30]
Gao, Y.; Lu, G.; Zhang, P.; Zhang, L.; Tang, G.; Zhao, Y. Org. Lett. 2016, 18, 1242. doi: 10.1021/acs.orglett.6b00056
-
[31]
Zhu, X.-T.; Zhao, Q.; Liu, F.; Wang, A.-F.; Cai, P.-J.; Hao, W.-J.; Tu, S.-J.; Jiang, B. Chem. Commun. 2017, 53, 6828. doi: 10.1039/C7CC01666B
-
[32]
Mi, X.; Wang, C.; Huang, M.; Zhang, J.; Wu, Y.; Wu, Y. Org. Lett. 2014, 16, 3356. doi: 10.1021/ol5013839
-
[33]
Wang, L.-J.; Wang, A.-Q.; Xia, Y.; Wu, X.-X.; Liu, X.-Y.; Liang, Y.-M. Chem. Commun. 2014, 50, 13998. doi: 10.1039/C4CC06923D
-
[34]
Zhou, Z.-Z.; Zheng, L.; Yan, X.-B.; Jin, D.-P.; He. Y.-T.; Liang, Y.-M. Org. Biomol. Chem. 2016, 14, 4507. doi: 10.1039/C6OB00505E
-
[35]
Zhou, Z.-Z.; Jin, D.-P.; Li, L.-H.; He, Y.-T.; Zhou, P.-X.; Yan, X.-B.; Liu, X.-Y.; Liang, Y.-M. Org. Lett. 2014, 16, 5616. doi: 10.1021/ol502397f
-
[36]
(a) Unoh, Y.; Hirano, K.; Satoh, T.; Miura, M. Angew. Chem., Int. Ed., 2013, 52, 12975.
(b) Chen, Y.-R.; Duan, W.-L. J. Am. Chem. Soc. 2013, 135, 16754.
(c) Zhang, P.; Gao, Y.; Zhang, L.; Li, Z.; Liu, Y.; Tang, G.; Zhao, Y. Adv. Synth. Catal. 2016, 358, 138.
(d) Ma, D.; Chen, W.; Hu, G.; Zhang, Y.; Gao, Y.; Yin, Y.; Zhao, Y. Green Chem. 2016, 18, 3522.
(e) Quint, V.; Morlet-Savary, F.; Lohier, J.-F.; Lalevée, J.; Gaumont, A.-C.; Lakhdar, S. J. Am. Chem. Soc. 2016, 138, 7436. -
[37]
Hu, G.; Zhang, Y.; Su, J.; Li, Z.; Gao, Y.; Zhao, Y. Org. Biomol. Chem. 2015, 13, 8221. doi: 10.1039/C5OB00959F
-
[38]
Wei, W.; Ji, J.-X. Angew. Chem., Int. Ed. 2011, 50, 9097. doi: 10.1002/anie.201100219
-
[39]
Zhou, Y.; Zhou, M.; Chen, M.; Su, J.; Du, J.; Song, Q. RSC Adv. 2015, 5, 103977. doi: 10.1039/C5RA23950H
-
[40]
Zhou, Y.; Rao, C.; Mai, S.; Song, Q. J. Org. Chem. 2016, 81, 2027. doi: 10.1021/acs.joc.5b02887
-
[41]
(a) Zhou, M.; Chen, M.; Zhou, Y.; Yang, K.; Su, J.; Du, J.; Song, Q. Org. Lett. 2015, 17, 1786.
(b) Yi, N.; Wang, R.; Zou, H.; He, W.; Fu, W.; He, W. J. Org. Chem. 2015, 80, 5023.
(c) Zhang, P.; Zhang, L.; Gao, Y.; Xu, J.; Fang, H.; Tang, G.; Zhao, Y. Chem. Commun. 2015, 51, 7839.
(d) Chen, X.; Li, X.; Chen, X.-L.; Qu, L.-B.; Chen, J.-Y.; Sun, K.; Liu, Z.-D.; Bi, W.-Z.; Xia, Y.-Y.; Wu, H.-T.; Zhao, Y.-F. Chem. Commun. 2015, 51, 3846. -
[42]
Taniguchi, T.; Idota, A.; Yokoyama, S.; Ishibashi, H. Tetrahedron Lett. 2011, 52, 4768. doi: 10.1016/j.tetlet.2011.07.026
-
[43]
Zhang, H.-Y.; Mao, L.-L.; Yang, B.; Yang, S.-D. Chem. Commun. 2015, 51, 4101. doi: 10.1039/C4CC10267C
-
[44]
Li, Y.-M.; Wang, S.-S.; Yu, F.; Shen, Y.; Chang, K.-J. Org. Biomol. Chem. 2015, 13, 5376. doi: 10.1039/C5OB00617A
-
[45]
Wu, J.; Gao, Y.; Zhao, X.; Zhang, L.; Chen, W.; Tang, G.; Zhao, Y. RSC Adv. 2016, 6, 303. doi: 10.1039/C5RA22570A
-
[46]
Zhu, Y.-L.; Wang, D.-C.; Jiang, B.; Hao, W.-J.; Wei, P.; Wang, A.-F.; Qiu, J.-K.; Tu, S.-J. Org. Chem. Front. 2016, 3, 385. doi: 10.1039/C5QO00430F
-
[47]
Liu, C.; Zhu, M.; Wei, W.; Yang, D.; Cui, H.; Liu, X.; Wang, H. Org. Chem. Front. 2015, 2, 1356. doi: 10.1039/C5QO00208G
-
[48]
Zhang, P.; Zhang, L.; Gao, Y.; Tang, G.; Zhao, Y. RSC Adv. 2016, 6, 60922. doi: 10.1039/C6RA11426A
-
[49]
(a) Dondoni, A.; Staderini, S.; Marra, A. Eur. J. Org. Chem. 2013, 5370.
(b) Oparina, L. A.; Malysheva, S. F.; Gusarova, N. K.; Belogorlova, N. A.; Vysotskaya, O. V.; Stepanov, A. V.; Albanov, A. I.; Trofimov, B. A. Synthesis 2009, 3427.
(c) Daeffler, C. S.; Grubbs, R. H. Org. Lett. 2011, 13, 6429. -
[50]
(a) Peng, P.; Peng, L.; Wang, G.; Wang, F.; Luo, Y.; Lei, A. Org. Chem. Front. 2016, 3, 749.
(b) Luo, K.; Chen, Y.-Z.; Yang, W.-C.; Zhu, J.; Wu, L. Org. Lett. 2016, 18, 452. -
[51]
Liu, D.; Chen, J.-Q.; Wang, X.-Z.; Xu, P.-F. Adv. Synth. Catal. 2017, 359, 2773. doi: 10.1002/adsc.v359.16
-
[52]
(a) Johnston, C. P.; Smith, R. T.; Allmendinger, S.; MacMillan, D. W. C. Nature 2016, 536, 322.
(b) Zhang, W.; Wang, F.; McCann, S. D.; Wang, D.; Chen, P.; Stahl, S. S.; Liu, G. Science 2016, 353, 1014.
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 165
- 文章访问数: 7003
- HTML全文浏览量: 1218



 下载:
下载:
















 下载:
下载:

