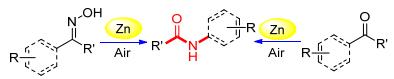
 图式 1
锌催化贝克曼重排反应
Scheme1.
Zinc-catalyzed Beckmann rearrangement
图式 1
锌催化贝克曼重排反应
Scheme1.
Zinc-catalyzed Beckmann rearrangement

Citation: Sun Chao, Yao Wubing, Zhang Bin, Huang Xiangyun, Yu Jiangjiang. Zn-Catalyzed Beckmann Rearrangement Reaction[J]. Chinese Journal of Organic Chemistry, 2018, 38(2): 457-463. doi: 10.6023/cjoc201708018

锌催化的贝克曼重排反应
English
Zn-Catalyzed Beckmann Rearrangement Reaction
-
Key words:
- Beckmann rearrangement
- / zinc-catalysis
- / oxime
- / ketone
- / amide
-
传统的贝克曼重排反应需要加入强酸作为促进剂或通过高温脱水得以顺利进行, 通过该类方法制备得到的酰胺产物选择性较高[1].然而, 传统方法的反应条件普遍非常苛刻, 一般需要在高温下方可顺利进行.此外, 强酸的使用对生产设备会造成很大的损耗, 增加生产成本.另外, 该方法会生成大量废弃物而造成环境污染, 与绿色化学理念相违背.因此, 发展绿色高效的方法体系以高效催化贝克曼重排反应具有非常重要的研究意义.
迄今, 液相贝克曼重排反应普遍具有条件温和、操作简便、产物选择性好等优势而具有广阔的应用前景, 成为科学界的重点研究目标[2].近年来, 三氯化铝[3]、三氟化硼[4]等强路易斯酸, 卤代烃[5]、磷酞氯[6]、酰氯[7]等有机小分子化合物, 临界水[8]、离子液体[9]被陆续应用于贝克曼重排反应研究.然而上述方法均存在一定局限:强路易斯酸毒性和腐蚀性很大, 不利于实际操作且会造成一定的环境污染; 有机小分子催化剂中一般需要加入过量添加剂才能使重排反应顺利进行, 原子经济性差; 临界水或离子液体溶剂或催化剂普遍价格昂贵, 产物难以分离, 不利于实际生产应用.
近些年, 具有催化活性高、热力学稳定性好、分子结构可调性强等优势的过渡金属催化剂为贝克曼重排反应提供了一种高效、环境友好的新方法体系.目前, Hg[10]、Rh[11]、Ir[12]、Ru[13]及Pd[14]贵金属催化体系被陆续用于催化酮肟发生贝克曼重排反应, 最终产物的收率及选择性均较理想.不足的是, 贵金属催化体系普遍价格昂贵或催化剂合成复杂, 从而影响进一步生产应用.
与此相反, 廉价金属具有地壳储量丰富、环境友好、毒性低等特点, 逐渐引起了科学家们的重视. Chen[15]、Gupta[16]、Yin[17]、Cook[18]和Yamamoto等[19]分别利用锌/苯磺酸、钴/锌、锌/磺酸、铁/银、钴盐/路易斯酸体系顺利实现酮肟贝克曼重排反应.另外, Sharghi[20]、Ka-poor[21]和Pathak等[22]巧妙地利用锌、铁和非均相锌催化体系分别实现酮和盐酸羟胺的一步法贝克曼重排反应, 反应操作简单, 无添加剂, 反应原子经济性较高.然而, 目前用于催化酮肟或酮的贝克曼重排反应的廉价金属催化体系非常有限, 大部分需要酸性添加剂或复杂的催化体系方可高效催化重排反应.
因此, 发展新型的、无酸性添加剂的锌催化体系高效地催化贝克曼重排反应具有非常重要的意义.本课题合成了绿色的金属锌催化体系, 并高效地实现酮肟和酮的贝克曼重排反应(Scheme 1).
1 结果与讨论
1.1 酮肟贝曼重排反应
1.1.1 反应条件优化
首先, 考察了一些商业化的金属化合物催化贝曼重排反应的活性高低(表 1).如表 1中Entries 1~8所示, 乙酸锌和硫酸锌没有任何催化活性(Entries 1, 2);氯化锌催化反应时产物收率仅51% (Entry 3).此外, 也考察了氟硼酸铜水合物的催化活性, 然而催化效率也不理想(Entry 4).有意义的是, 在100 ℃加热反应6 h, 廉价易得(阿里巴巴: 1 kg/25元)的氟硼酸锌水合物可非常高效地催化二苯甲酮肟发生重排反应, 最终收率为95% (Entry 5).当无金属催化剂存在, 该反应不能发生(Entry 6).此外, 也考察了反应时间对贝克曼重排反应的影响.将上述优化得到的氟硼酸锌水合物置于100 ℃中分别回流反应1, 3和6 h, 目标产物2a收率分别为82%、95%和95% (Entries 5, 7~8).时间过短不利于重排反应很好的进行.与3 h相比, 6 h后的产物收率并没有明显增长.可见, 氟硼酸锌催化二苯甲酮肟贝克曼重排反应3 h为最佳时间.此外, 当催化剂用量降为1 mol%或5 mol%时, 即使延长反应时间至48 h, 产物收率仍较低(Entries 9~11), 当催化剂用量为10或20 mol%时, 反应2a收率均为95%, 因此, 氟硼酸锌水合物10 mol%为最合适.反应溶剂中除了乙腈, 其它溶剂均不能促使反应发生(Entries 13~17).这可能由于乙腈富电子, 可与锌金属中心很好地发生配位而形成稳定的活性中间体, 利于重排反应进行.此外, 当反应温度60 ℃时, 2a收率只有30%;当温度为80 ℃时, 收率增加至60%.可见, 低温不利于该反应顺利进行.

Entry [Cat.] t/h Solvent Yield/% 1 Zn(OAc)2 6 MeCN N. R. 2 ZnSO4 6 MeCN N. R. 3 ZnCl2 6 MeCN 51 4 Cu(BF4)2•6H2O 6 MeCN N. R. 5 Zn(BF4)2•6H2O 6 MeCN 95 6 — 6 MeCN N. R. 7 Zn(BF4)2•6H2O 1 MeCN 82 8 Zn(BF4)2•6H2O 3 MeCN 95 9b Zn(BF4)2•6H2O 3 MeCN 59 10b, c Zn(BF4)2•6H2O 48 MeCN 81 11d Zn(BF4)2•6H2O 3 MeCN 76 12e Zn(BF4)2•6H2O 3 MeCN 95 (91) 13e Zn(BF4)2•6H2O 3 DMF N. R. 14e Zn(BF4)2•6H2O 3 THF N. R. 15e Zn(BF4)2•6H2O 3 DMSO N. R. 16e Zn(BF4)2•6H2O 3 DCM N. R. 17e Zn(BF4)2•6H2O 3 MeOH N. R. 18e, f Zn(BF4)2•6H2O 3 MeCN 30 19e, g Zn(BF4)2•6H2O 3 MeCN 60 a Reaction conditions: benzophenone oxime 0.5 mmol, [Cat.] 0.1 mmol (20 mol%) and MeCN 2 mL, in air, at 100 ℃; GC yield is the internal standard mesitylene as an internal standard, isolated yield is in parenthese. b [Zn] 1 mol%. c48 h.d [Zn] 5 mol%. e [Zn] 10 mol%. f At 60 ℃. g At 80 ℃. 综上所述, 10 mol%氟硼酸锌水合物在乙腈中100 ℃回流反应3 h即可最高效地制备目标产物2a, 产物气相色谱(GC)收率为95%, 分离收率为91% (Entry 12).
1.1.2 底物拓展
基于上述最优反应条件, 我们也尝试了氟硼酸锌水合物催化贝克曼重排反应的底物拓展(表 2). 1a经氟硼酸锌水合物催化后, 2a分离收率可达91%;苯环对位上含吸电子基底物1b, 产率相较于1a略有下降(2b, 66%); 苯环对位含推电子基底物1c, 反应进行较顺利(2c, 91%).含五元环刚性结构1d, 由于碳-碳键不易断裂而难以发生迁移, 使得反应不能进行.同时, 还进一步研究了苯乙酮肟衍生物的重排反应, 同样发现苯环含推电子基底物(1f和1g)比吸电子基底物(1h)更易发生重排反应.当底物为苯乙酮肟时, 该锌催化剂依然可高效地催化, 最终产物2i收率为79%.值得注意的是, 该锌水合物也能成功催化更惰性的环己酮肟发生重排反应(2j, 57%).可见, 该金属锌催化体系底物普适性较广, 无论底物含吸电子或推电子基均可顺利发生贝克曼重排反应, 收率也较理想.
与文献报道的锌催化体系相比[15, 17, 24], 本反应体系无需路易斯酸性添加剂、催化剂廉价易得, 为金属催化酮肟的贝克曼重排反应提供了一种新方法.此外, 底物的普适性及官能团兼容性也较好.
1.1.3 10 g级贝克曼重排反应
为了进一步考察氟硼酸锌催化体系实用性, 我们尝试了10 g级二苯甲酮肟的重排反应(Eq. 1).以1a (10 g, 50.7 mmol)作底物, 氟硼酸锌水合物(1.7 g, 5.0 mmol, 10 mol%)为催化剂, 乙腈(100 mL)作为溶剂, 100 ℃回流反应24 h后, 最终目标产物的GC和分离收率分别为80%和73%.
1.1.4 锌催化酮肟贝克曼重排反应机理
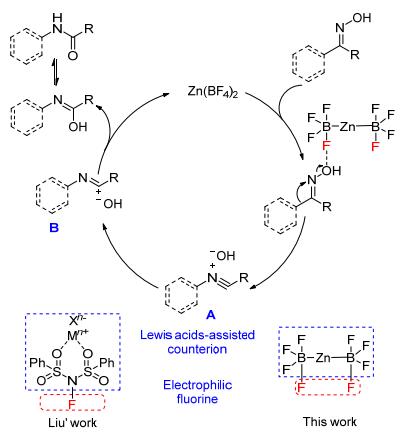
此外, 我们也提出了氟硼酸锌催化酮肟衍生物贝克曼重排反应可能的机理.最近, Liu等[25]报道了N-氟代双苯磺酰胺(NFSI)/路易斯酸体系催化酮肟的贝克曼重排反应, 并提出了可能的反应机理(Scheme 2).基于Liu的工作, 氟硼酸锌中可能存在与Liu催化体系中类似的、亲电性的氟取代基, 进而与酮肟发生作用生成化合物A, A则通过电子转移进而生成亚胺衍生物B, 最后, 随着酰胺产物的生成而完成整个催化循环.
1.2 酮和盐酸羟胺的一步法贝克曼重排反应
1.2.1 反应条件优化
此外, 我们也尝试了氟硼酸锌水合物催化酮和盐酸羟胺的一步法贝克曼重排反应.首先, 我们对该催化体系进行了条件优化(表 3).除了氟硼酸锌水合物外, 其余商业化的金属锌化合物均不能催化二苯甲酮与盐酸羟胺发生一步法重排反应(Entries 1~3).值得注意的是, 该反应在无金属催化剂存在不能进行(Entry 4).当使用10 mol%的氟硼酸锌水合物在130 ℃催化二苯甲酮反应1 h, 即可以96%收率得到目标产物(Entry 5).当该反应时间延长至2 h, 产物2a收率与1 h几乎一样(Entry 6).然而把盐酸羟胺量由1.5 equiv.降为1 equiv.时, 最终收率仅77% (Entry 7), 可见盐酸羟胺用量对该反应影响很大.当氟硼酸锌水合物用量降为5 mol%, 依然可以95%的GC收率得到目标产物(Entry 8).然而, 当该反应温度降为100 ℃时, 该重排反应不能很好的发生(Entry 9).此外, 在该体系中加入不同类型的溶剂时, 该一步法贝克曼重排反应也不能顺利进行(Entries 10~13).可见, 该一步法重排反应中加入5 mol%的氟硼酸锌水合物和1.5 equiv.的盐酸羟胺, 并在130 ℃和无溶剂下加热搅拌反应1 h最为合适(Entry 8).

Entry [Zn] Solvent t/h Yield/% 1 Zn(OAc)2 — 1 N. R. 2 ZnSO4 — 1 N. R. 3 ZnCl2 — 1 N. R. 4 — — 1 N. R. 5 Zn(BF4)2•6H2O — 1 96 6 Zn(BF4)2•6H2O — 2 97 7b Zn(BF4)2•6H2O — 1 77 8c Zn(BF4)2•6H2O — 1 95 (94) 9c, d Zn(BF4)2•6H2O — 1 7 10c Zn(BF4)2•6H2O PhMe 1 N. R. 11c Zn(BF4)2•6H2O MeCN 1 N. R. 12c Zn(BF4)2•6H2O MeOH 1 N. R. 13c Zn(BF4)2•6H2O THF 1 N. R. a Reaction conditions: [Zn] 50 μmol (10 mol%), benzophenone 0.5 mmol and hydroxylamine hydrochloride 0.75 mmol (1.5 equiv.), in air at 130 ℃, 1 h; GC yield is the internal standard with mesitylene as an internal standard, and isolated yield is in parenthese. b Hydroxylamine hydrochloride 0.5 mmol (1.0 equiv.). c [Zn] 25 μmol (5 mol%). d At 100 ℃. 1.2.2 底物拓展
基于上述最佳反应条件, 进行了一步法贝克曼重排反应的底物拓展.如表 4所示, 二苯甲酮衍生物均可与盐酸羟胺顺利发生一步法重排反应, 其中含推电子基团(甲氧基)的二苯甲酮底物分离收率为98%.此外, 该氟硼酸锌水合物也可顺利催化苯乙酮衍生物发生一步法重排反应, 无论是含推电子基底物还是吸电子基底物均可顺利发生反应, 产物收率为81%~96%.当底物为苯丙酮时, 该锌催化体系也可高效地催化, 最终产物收率为88%.值得注意的是, 该锌催化体系也可高效催化脂肪环酮衍生物与盐酸羟胺发生一步法重排反应.可见, 该锌催化体系催化酮与盐酸羟胺一步法重排反应底物普适性较广, 底物官能团兼容性也较好.
与已报道的锌催化酮与盐酸羟胺的一步法反应体系相比[20, 22], 本体系反应条件较温和、催化剂廉价易得、产物收率高, 为酮与盐酸羟胺的一步法贝克曼重排反应提供了一种“锌”方法.
2 结论
利用廉价易得的氟硼酸锌水合物, 在无酸性添加剂及催化剂配体下, 实现酮肟衍生物的绿色贝克曼重排反应.反应条件温和、底物普适性广、官能团兼容性良好, 酰胺收率最高可达96%.同时, 在该锌水合物的催化下, 还顺利实现酮和盐酸羟胺的一步法贝克曼重排反应, 反应中无需酸性添加剂、催化剂配体、溶剂, 可见该反应的原子经济性非常高, 具有一定应用价值.整体而言, 该廉价易得的氟硼酸锌水合物为贝克曼重排反应提供了一种绿色高效的“锌”方法.
3 实验部分
3.1 仪器与试剂
气相谱图采用2010Plus型岛津气相色谱仪测定, 质谱采用QP2010Plus型气质联用仪测定, 核磁共振谱图采用Bruker AV400型核磁共振仪测定.除特别说明外, 反应中所使用的试剂都直接从商业途径购买并直接使用, 未经任何处理.
3.2 实验方法
3.2.1 二苯甲酮肟衍生物的制备及表征
在100 mL的圆底烧瓶中依次加入二苯甲酮衍生物(11 mmol)、40 mL体积比为1:1的乙醇和水混合溶液, 将该反应瓶置于80 ℃油浴锅加热搅拌反应, 分三批共加入盐酸羟胺(17 mol, 1.5 equiv.)和氢氧化钠(22 mmol, 2.0 equiv.).通过薄层色谱(TLC)点板跟踪反应, 当反应结束停止加热并将反应瓶冷却至室温, 旋蒸除去乙醇, 过滤粗产物, 用蒸馏水多次洗涤除去多余的盐酸羟胺.最后, 用乙醇将粗产物重结晶, 过滤抽干即可得到酮肟产物.经核磁分析及文献对照, 酮肟1a[23]、1b[25]、1c[25]、1d[26]、1e[23]、1f[23]、1g[23]、1h[23]、1i[23]、1j[27]均与文献报道中核磁数据相符.
二苯甲酮肟(1a):白色固体, 1.3 g, 产率60%. m.p. 142~146 ℃ (140~144 ℃)[23]; 1H NMR (400 MHz, CDCl3) δ: 8.55 (s, 1H), 7.47 (d, J=8.0 Hz, 4H), 7.42 (t, J=8.0 Hz, 2H), 7.38~7.33 (m, 3H); 13C NMR (101 MHz, CDCl3) δ: 158.0, 136.3, 132.8, 129.6, 129.4, 129.3, 128.5 128.4, 128.0.
4, 4'-二氟二苯甲酮肟(1b):白色固体, 2.2 g, 产率84%. m.p. 141~143 ℃ (143~147 ℃)[25]; 1H NMR (400 MHz, CDCl3) δ: 8.59 (s, 1H), 7.45~7.37 (m, 3H), 7.19~7.13 (m, 3H), 7.03 (t, J=9.0 Hz, 2H); 13C NMR (101 MHz, CDCl3) δ: 166.8, 164.7 (d, J=68.7 Hz), 162.2 (d, J=67.7 Hz), 156.4, 132.7 (d, J=9.1 Hz), 131.6 (d, J=8.1 Hz), 129.9 (d, J=8.1 Hz), 115.8 (d, J=22.2 Hz), 115.6 (q, J=22.2, 4.0 Hz).
4, 4'-二甲氧基二苯甲酮肟(1c):白色固体, 2.3 g, 产率80%. m.p. 131~133 ℃ (129~130 ℃)[25]; 1H NMR (400 MHz, CDCl3) δ: 7.79 (d, J=8.0 Hz, 2H), 7.41~7.38 (m, 2H), 6.99~6.94 (m, 2H), 6.85 (d, J=8.0 Hz, 2H), 3.89 (s, 3H), 3.81 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 163.0, 132.4, 131.8, 131.2, 130.9, 129.6, 113.8, 113.7, 113.6, 55.6, 55.5.
9-芴酮肟(1d):浅黄色固体, 1.7 g, 产率80%. m.p. 189~229 ℃ (193~194 ℃)[26]; 1H NMR (400 MHz, DMSO-d6) δ: 12.55 (s, 1H), 8.35 (d, J=4.0 Hz, 1H), 7.87 (q, J=8.0 Hz, 2H), 7.72 (d, J=8.0 Hz, 1H), 7.51 (t, J=8.0 Hz, 1H), 7.44 (t, J=8.0 Hz, 1H), 7.39 (t, J=8.0 Hz, 1H), 7.35 (t, J=8.0 Hz, 1H); 13C NMR (101 MHz, DMSO-d6) δ: 151.0, 140.2, 139.3, 135.3, 130.8, 129.7, 129.6, 128.5, 128.4, 128.0, 120.8, 120.4, 120.3.
苯乙酮肟(1e):白色固体, 1.2 g, 产率78%. m.p. 54~60 ℃ (55~60 ℃)[23]; 1H NMR (400 MHz, CDCl3) δ: 7.65~7.61 (m, 2H), 7.41~7.38 (m, 3H), 2.31 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 156.2, 136.7, 129.4, 128.7, 126.2, 12.4.
对甲基苯乙酮肟(1f):白色固体, 1.2 g, 产率72%. m.p. 87~90 ℃ (85~87 ℃)[23]; 1H NMR (400 MHz, CDCl3) δ: 7.53 (d, J=8.0 Hz, 2H), 7.20 (d, J=8.0 Hz, 2H), 2.37 (s, 3H), 2.30 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 156.1, 139.4, 133.8, 129.3, 126.1, 21.4, 12.4.
对甲氧基苯乙酮肟(1g):白色固体, 1.4 g, 产率75%. m.p. 85~88 ℃ (86~87 ℃)[23]; 1H NMR (400 MHz, CDCl3) δ: 7.58 (d, J=8.0 Hz, 2H), 6.91 (d, J=8.0 Hz, 2H), 3.83 (s, 3H), 2.28 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 160.6, 155.7, 129.2, 127.5, 114.0, 55.5, 12.3.
对氯苯乙酮肟(1h):白色固体, 1.5 g, 产率82%. m.p. 97~99 ℃ (96~98 ℃)[23]; 1H NMR (400 MHz, CDCl3) δ: 7.56 (d, J=8.0 Hz, 2H), 7.35 (d, J=8.0 Hz, 2H), 2.27 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 155.3, 135.4, 135.1, 128.9, 127.5, 12.2.
苯丙酮肟(1i):白色固体, 1.3 g, 产率77%. m.p. 51~54 ℃ (56~58 ℃) [23]; 1H NMR (400 MHz, DMSO-d6) δ: 11.14 (s, 1H), 7.65~7.62 (m, 2H), 7.41~7.35 (m, 3H), 2.71 (q, J=8.0 Hz, 2H), 1.04 (t, J=8.0 Hz, 3H); 13C NMR (101 MHz, DMSO-d6) δ: 157.7, 135.9, 128.6, 128.5, 125.7, 18.4, 10.9.
环己酮肟(1j):白色固体, 1.0 g, 产率78%. m.p. 86~90 ℃ (88~92 ℃)[27]; 1H NMR (400 MHz, CDCl3) δ: 2.50 (t, J=6.0 Hz, 2H), 2.21 (t, J=6.0 Hz, 2H), 1.69~1.57 (m, 6H); 13C NMR (101 MHz, CDCl3) δ: 160.8, 32.2, 27.0, 25.9, 25.7, 24.6.
3.2.2 酰胺的制备及表征
酮肟贝克曼重排反应:在10 mL封管中依次加入二苯甲酮肟(0.5 mmol)、氟硼酸锌水合物10 mol%、乙腈2 mL, 随后将该封管置于100 ℃油浴中加热搅拌3 h.反应结束后, 停止加热并将封管冷却至室温, 柱层析分离粗产物, 采用乙酸乙酯/石油醚淋洗剂即可方便地分离得到产物, 并取样进行熔点及核磁测试.
一步法贝克曼重排反应:往10 mL封管中依次加入酮衍生物0.5 mmol、氟硼酸锌水合物25 μmol (5 mol%), 随后将该封管置于130 ℃油浴中加热搅拌1 h, 反应结束后, 停止加热并将反应瓶冷却至室温, 柱层析分离粗产物, 采用乙酸乙酯/石油醚淋洗剂即可方便地得到产物, 并取样进行熔点及核磁测试.经核磁分析及文献对照, 酰胺2a[28]、2b[25]、2c[25]、2e[29]、2f[30]、2g[30]、2h[30]、2i[31]、2j[32]均与文献报道中核磁数据相符.
苯甲酰苯胺(2a):淡黄色固体, m.p. 136~139 ℃ (文献值[28]: 134~135 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 10.24 (s, 1H), 7.95 (t, J=4.0 Hz, 2H), 7.78 (d, J=8.0 Hz, 2H), 7.61~7.58 (m, 1H), 7.53 (t, J=6.0 Hz, 2H), 7.35 (t, J=8.0 Hz, 2H), 7.10 (t, J=8.0 Hz, 1H); 13C NMR (101 MHz, DMSO-d6) δ: 131.5, 128.6, 128.4, 127.6, 123.6, 120.4.
4-氟-N-(4-氟苯基)苯甲酰胺(2b):淡黄色固体, m.p. 141~150 ℃(文献值[25]: 141~145 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 10.31 (s, 1H), 8.05~8.02 (m, 2H), 7.80~7.77 (m, 2H), 7.37 (t, J=8.0 Hz, 2H), 7.20 (t, J=8.0 Hz, 2H); 13C NMR (101 MHz, DMSO-d6) δ: 164.1 (d, J=250.5 Hz), 164.3, 158.3 (d, J=241.4 Hz), 135.4, 131.2, 130.4 (d, J=11.1 Hz), 122.2 (d, J=8.1 Hz), 115.2 (dd, J=22.2, 16.2 Hz).
4-甲氧基-N-(4-甲氧基苯基)苯甲酰胺(2c):白色固体, m.p. 194~196 ℃(文献值[25]: 195~198 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 9.96 (s, 1H), 7.94 (d, J=12.0 Hz, 2H), 7.66 (d, J=12.0 Hz, 2H), 7.05 (d, J=8.0 Hz, 2H), 6.91 (d, J=12.0 Hz, 2H); 13C NMR (101 MHz, DMSO-d6) δ: 164.5, 161.7, 155.4, 132.4, 129.4, 127.1, 121.9, 113.7, 113.5, 55.4, 55.2.
乙酰苯胺(2e):白色固体, m.p. 115~118 ℃(文献值[29]: 113~115 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 9.91 (s, 1H), 7.58 (d, J=8.0 Hz, 2H), 7.28 (t, J=8.0 Hz, 2H), 7.02 (t, J=8.0 Hz, 1H), 2.04 (s, 3H); 13C NMR (101 MHz, DMSO-d6) δ: 168.3, 139.3, 128.6, 122.9, 119.0, 24.0.
对甲基乙酰苯胺(2f):白色固体, m.p. 148~149 ℃(文献值[30]: 148~151 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 9.81 (s, 1H), 7.45 (d, J=12.0 Hz, 2H), 7.08 (d, J=8.0 Hz, 2H), 2.23 (s, 3H), 2.01 (s, 3H); 13C NMR (101 MHz, DMSO-d6) δ: 168.0, 136.8, 131.8, 129.0, 119.0, 23.9, 20.4.
对甲氧基乙酰苯胺(2g):白色固体, m.p. 131~136 ℃(文献值[30]: 128~130 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 9.76 (s, 1H), 7.47 (d, J=8.0 Hz, 2H), 6.86 (d, J=12.0 Hz, 2H), 3.71 (s, 3H), 2.00 (s, 3H); 13C NMR (101 MHz, DMSO-d6) δ: 167.7, 155.0, 132.5, 120.5, 113.8, 55.1, 23.8.
对氯乙酰苯胺(2h):白色固体, m.p. 168~176 ℃ (文献值[30]: 176~178 ℃); 1H NMR (400 MHz, DMSO-d6, 20℃) δ: 10.06 (s, 1H), 7.60 (d, J=12.0 Hz, 2H), 7.34 (d, J=8.0 Hz, 2H), 2.04 (s, 3H); 13C NMR (101 MHz, DMSO-d6) δ: 168.4, 138.3, 128.5, 126.5, 120.4, 24.0.
丙酰苯胺(2i), 白色固体, m.p. 102~106 ℃(文献值[31]: 104~107 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 9.84 (s, 1H), 7.59 (d, J=8.0 Hz, 2H), 7.28 (t, J=8.0 Hz, 2H), 7.01 (t, J=8.0 Hz, 1H), 2.32 (q, J=8.0 Hz, 2H), 1.08 (t, J=8.0 Hz, 3H); 13C NMR (101 MHz, DMSO-d6) δ: 171.9, 139.4, 128.6, 122.9, 119.0, 29.5, 9.7.
己内酰胺(2j):白色固体, m.p. 53~67 ℃(文献值[32]: 62~65 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 7.40 (s, 1H), 3.05~3.02 (m, 2H), 2.29~2.26 (m, 2H), 1.68~1.62 (m, 2H), 1.54~1.46 (m, 4H); 13C NMR (101 MHz, DMSO-d6) δ: 177.0, 41.5, 36.4, 30.0, 29.8, 23.0.
戊内酰胺(4j):无水透明液固混合物. 1H NMR (400 MHz, CDCl3) δ: 3.25~3.24 (m, 2H), 2.27 (t, J=6.0 Hz, 2H), 1.76~1.65 (m, 4H); 13C NMR (101 MHz, CDCl3) δ: 172.8, 42.1, 31.5, 22.2, 20.8.
辅助材料(Supporting Information) 化合物1a~1j、2a~2j和4j的核磁共振谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Song, D. ; Wang, L. ; Xu, X. Chin. J. Org. Chem. 1991, 11, 276(in Chinese).
(宋丹青, 王丽, 徐秀娟, 有机化学, 1991, 11, 276. )
(b) Xu, X. ; Wei, Z. ; Bai, X. Chin. J. Org. Chem. 2006, 26, 354(in Chinese).
(徐显秀, 魏忠林, 柏旭, 有机化学, 2006, 26, 354. )
(c) Donaruma, L. G. ; Heldt, W. Z. Org. React. 1960, 11, 1.
(d) Li, Q. ; Yan, L. ; Xia, D. ; Shen, Y. Chin. J. Org. Chem. 2011, 31, 2034(in Chinese).
(李倩, 严罗一, 夏定, 申永存, 有机化学, 2011, 31, 2034. )
(e) Chen, X. ; Ye, J. ; Hu, A. Chin. J. Org. Chem. 2012, 32, 520(in Chinese).
(陈晓东, 叶姣, 胡艾希, 有机化学, 2012, 32, 520. )(f) Li, J. ; Cheng, C. ; Zhang, X. ; Li, Z. ; Cai, F. ; Xue, Y. ; Liu, W. Chin. J. Chem. 2012, 30, 1687. -
[2]
For examples, see: (a) An, N. ; Tian, B. -X. ; Pi, H. -J. ; Eriksson, L. A. ; Deng, W. -P. J. Org. Chem. 2013, 78, 4297.
(b) Li, H. ; Qin, J. ; Yang, Z. ; Guan, X. ; Zhang, L. ; Liao, P. ; Li, X. Chem. Commun. 2015, 51, 8637.
(c) Mahajan, P. S. ; Humne, V. T. ; Tanpure, S. D. ; Mhaske, S. B. Org. Lett. 2016, 18, 3450.
(d) Linares, M. ; Vargas, C. ; García, A. ; Ochoa-Hernández, C. ; Čekja, J. ; García-Muñ oz, R. A. ; Serrano, D. P. Catal. Sci. Technol. 2017, 7, 181.
(e) Chu, Y. ; Li, G. ; Huang, L. ; Yi, X. ; Xia, H. ; Zheng, A. ; Deng, F. Catal. Sci. Technol. 2017, 7, 2512. -
[3]
Lee, B. S.; Chi, D. Y. Bull. Korean Chem. Soc. 1998, 19, 1373.
-
[4]
An, N.; Pi, H.; Liu, L.; Du, W.; Deng, W. Chin. J. Chem. 2011, 29, 947. doi: 10.1002/cjoc.201190193
-
[5]
Furuya, Y.; Ishihara, K.; Yamamoto, H. J. Am. Chem. Soc. 2005, 127, 11240. doi: 10.1021/ja053441x
-
[6]
Zhu, M.; Cha, C. -T.; Deng, W. -P.; Shi, X. -X. Tetrahedron Lett. 2006, 47, 4861. doi: 10.1016/j.tetlet.2006.05.029
-
[7]
Srinivasa, R. N.; Buchi, R. R.; Mukkanti, K. Tetrahedron Lett. 2011, 52, 4888. doi: 10.1016/j.tetlet.2011.07.045
-
[8]
Ikushima, Y.; Hatakeda, K.; Sato, O.; Yokoyama, T.; Arai, M. J. Am. Chem. Soc. 2000, 122, 1908. doi: 10.1021/ja9925251
-
[9]
Guo, S.; Du, Z.; Zhang, S.; Li, D.; Li, Z.; Deng, Y. Green Chem. 2006, 8, 296. doi: 10.1039/B513139A
-
[10]
Ramalingan, C.; Park, Y. T. J. Org. Chem. 2007, 72, 4536. doi: 10.1021/jo070297k
-
[11]
Arisawa, M.; Yamaguchi, M. Org. Lett. 2001, 3, 311. doi: 10.1021/ol006951z
-
[12]
Owston, N. A.; Parker, A. J.; Williams, J. M. Org. Lett. 2007, 9, 73. doi: 10.1021/ol062549u
-
[13]
(a) Surya, K. D. Synth. Commun. 2004, 34, 3431.
(b) Owston, N. A. ; Parker, A. J. ; Williams, J. M. Org. Lett. 2007, 9, 3599. -
[14]
Raju, G.; Guguloth, V.; Satyanarayana, B. RSC Adv. 2016, 6, 45036. doi: 10.1039/C6RA07423E
-
[15]
Xiao, L. -F.; Xia, C. -G.; Chen, J. Tetrahedron Lett. 2007, 48, 7218. doi: 10.1016/j.tetlet.2007.07.171
-
[16]
Mishra, A.; Ali, A.; Upreti, S.; Gupta, R. Inorg. Chem. 2008, 47, 154. doi: 10.1021/ic7016424
-
[17]
Li, J. -T.; Meng, X. -T.; Yin, Y. Synth. Commun. 2010, 40, 1445. doi: 10.1080/00397910903097286
-
[18]
Jefferies, L. R.; Weber, S. R.; Cook, S. P. Synlett 2015, 26, 331.
-
[19]
(a) Komeda, M. ; Ozaki, A. ; Hayashi, K. ; Sumimoto, M. ; Hori, K. ; Sugimoto, T. ; Yamamoto, H. Int. J. Org. Chem. 2015, 5, 57.
(b) Yamamoto, H. ; Komeda, M. ; Ozaki, A. ; Sumimoto, M. ; Hori, K. ; Sugimoto, T. Int. J. Org. Chem. 2015, 5, 147. -
[20]
Sharghi, H.; Hosseini, M. Synthesis-Stuttgart 2002, 8, 1057.
-
[21]
Mahajan, S.; Sharma, B.; Kapoor, K. K. Tetrahedron Lett. 2015, 56, 1915. doi: 10.1016/j.tetlet.2015.02.110
-
[22]
Anuradha, S.; Kumari, S.; Layek, D.; Pathak, D. J. Mol. Struct. 2017, 1130, 368. doi: 10.1016/j.molstruc.2016.10.053
-
[23]
Zhu, Z.; Tang, X.; Li, J.; Li, X.; Wu, W.; Deng, G.; Jiang, H. Org. Lett. 2017, 19, 1370. doi: 10.1021/acs.orglett.7b00203
-
[24]
Liu, X.; Xiao, L.; Wu, H.; Li, Z.; Xia, C. Catal. Commun. 2009, 10, 424. doi: 10.1016/j.catcom.2008.09.007
-
[25]
Xie, F.; Du, C.; Pang, Y.; Lian, X.; Xue, C.; Chen, Y.; Wang, X.; Cheng, M.; Guo, C.; Lin, B.; Liu, Y. Tetrahedron Lett. 2016, 57, 5820. doi: 10.1016/j.tetlet.2016.11.054
-
[26]
Yu, J.; Lu, M. Org. Biomol. Chem. 2015, 13, 7397. doi: 10.1039/C5OB00923E
-
[27]
Zhang, Q. -Q.; Dong, J.; Liu, Y. -M.; Cao, Y.; He, H. -Y.; Wang, Y. -D. Chem. Commun. 2017, 53, 2930. doi: 10.1039/C6CC10267K
-
[28]
Teders, M.; Pitzer, L.; Buss, S.; Glorius, F. ACS Catal. 2017, 7, 4053. doi: 10.1021/acscatal.7b01025
-
[29]
Chen, M.; Yu, L.; Ren, Z. -H.; Wang, Y. -Y.; Guan, Z. -H. Chem. Commun. 2017, 53, 6243. doi: 10.1039/C7CC02852K
-
[30]
Liang, D.; Li, Y.; Gao, S.; Li, R.; Li, X.; Wang, B.; Yang, H. Green Chem. 2017, 19, 3344. doi: 10.1039/C7GC00356K
-
[31]
Patel, P.; Borah, G. Chem. Commun. 2017, 53, 443. doi: 10.1039/C6CC08788D
-
[32]
Jin, X.; Kataoka, K.; Yatabe, T.; Yamaguchi, K.; Mizuno, N. Angew. Chem., Int. Ed. 2016, 55, 7212. doi: 10.1002/anie.201602695
-
[1]
-
表 1 反应条件优化a
Table 1. Reaction conditions screening

Entry [Cat.] t/h Solvent Yield/% 1 Zn(OAc)2 6 MeCN N. R. 2 ZnSO4 6 MeCN N. R. 3 ZnCl2 6 MeCN 51 4 Cu(BF4)2•6H2O 6 MeCN N. R. 5 Zn(BF4)2•6H2O 6 MeCN 95 6 — 6 MeCN N. R. 7 Zn(BF4)2•6H2O 1 MeCN 82 8 Zn(BF4)2•6H2O 3 MeCN 95 9b Zn(BF4)2•6H2O 3 MeCN 59 10b, c Zn(BF4)2•6H2O 48 MeCN 81 11d Zn(BF4)2•6H2O 3 MeCN 76 12e Zn(BF4)2•6H2O 3 MeCN 95 (91) 13e Zn(BF4)2•6H2O 3 DMF N. R. 14e Zn(BF4)2•6H2O 3 THF N. R. 15e Zn(BF4)2•6H2O 3 DMSO N. R. 16e Zn(BF4)2•6H2O 3 DCM N. R. 17e Zn(BF4)2•6H2O 3 MeOH N. R. 18e, f Zn(BF4)2•6H2O 3 MeCN 30 19e, g Zn(BF4)2•6H2O 3 MeCN 60 a Reaction conditions: benzophenone oxime 0.5 mmol, [Cat.] 0.1 mmol (20 mol%) and MeCN 2 mL, in air, at 100 ℃; GC yield is the internal standard mesitylene as an internal standard, isolated yield is in parenthese. b [Zn] 1 mol%. c48 h.d [Zn] 5 mol%. e [Zn] 10 mol%. f At 60 ℃. g At 80 ℃. 表 2 锌催化酮肟贝克曼重排反应a
Table 2. Zn-catalyzed Beckmann rearrangement of ketoxime

表 3 反应条件优化a
Table 3. Reaction conditions screeninga

Entry [Zn] Solvent t/h Yield/% 1 Zn(OAc)2 — 1 N. R. 2 ZnSO4 — 1 N. R. 3 ZnCl2 — 1 N. R. 4 — — 1 N. R. 5 Zn(BF4)2•6H2O — 1 96 6 Zn(BF4)2•6H2O — 2 97 7b Zn(BF4)2•6H2O — 1 77 8c Zn(BF4)2•6H2O — 1 95 (94) 9c, d Zn(BF4)2•6H2O — 1 7 10c Zn(BF4)2•6H2O PhMe 1 N. R. 11c Zn(BF4)2•6H2O MeCN 1 N. R. 12c Zn(BF4)2•6H2O MeOH 1 N. R. 13c Zn(BF4)2•6H2O THF 1 N. R. a Reaction conditions: [Zn] 50 μmol (10 mol%), benzophenone 0.5 mmol and hydroxylamine hydrochloride 0.75 mmol (1.5 equiv.), in air at 130 ℃, 1 h; GC yield is the internal standard with mesitylene as an internal standard, and isolated yield is in parenthese. b Hydroxylamine hydrochloride 0.5 mmol (1.0 equiv.). c [Zn] 25 μmol (5 mol%). d At 100 ℃. 表 4 锌催化一步法贝克曼重排反应a
Table 4. Zn-catalyzed one-pot Beckmann rearrangementa

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 39
- 文章访问数: 4692
- HTML全文浏览量: 1239


 下载:
下载:

 下载:
下载:

