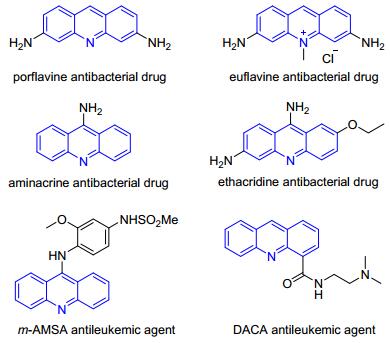
 图1
几种具有代表性的生物活性吖啶
Figure1.
Several representative bioactive acridines
图1
几种具有代表性的生物活性吖啶
Figure1.
Several representative bioactive acridines

Citation: Dong Kun, Li Qiuyun, An Kang, Ma Junyi, Bai Zhongsheng, Liu Qiancai. Palladium-Catalyzed Syntheses of C3-Symmetric 9-Aryl Acridine Derivatives[J]. Chinese Journal of Organic Chemistry, 2018, 38(2): 416-424. doi: 10.6023/cjoc201707007

钯催化C3-对称9-芳基吖啶类衍生物的合成
-
关键词:
- Buchwald-Hartwig反应
- / 吖啶
- / Pd-132
- / Suzuki偶联
English
Palladium-Catalyzed Syntheses of C3-Symmetric 9-Aryl Acridine Derivatives
-
Key words:
- Buchwald-Hartwig reaction
- / acridine
- / Pd-132
- / Suzuki coupling
-
具备芳香刚性平面中心和外围柔性取代基的π-共轭体系分子, 由于其在分子级的能量和电荷传导研究中的重要性, 已被广泛应用于有机发光二极管(OLEDs)、有机场效应晶体管(OFETs)、光伏二极管(PVD)、有机太阳能电池(OPVs)和液晶材料等领域[1, 2].在这些芳香共轭体系中, C3-对称的共轭芳香体系显得尤为重要[1a, 1d].
吖啶是一种具有可堆叠大表面和可质子化的氮原子的重要生物活性化合物.早在19世纪人们就发现吖啶衍生物能与活细胞中的核酸优先结合[3], 可通过插入而抑制DNA相关酶(如拓扑异构酶[4])的作用.生物活性吖啶如二氨基吖啶(Porflavine)[5, 6]、欧黄嘌呤(Eufla-vine)[6, 7]、氨基吖啶(Aminacrine)[8]、依沙吖啶(Etha-cridine)[9, 10]已被批准为抗菌药物, 而m-AMSA[11, 12]和DACA[13~16]则是基于吖啶两种代表性的抗癌药物, 已在临床上用于白血病治疗试验(图 1).
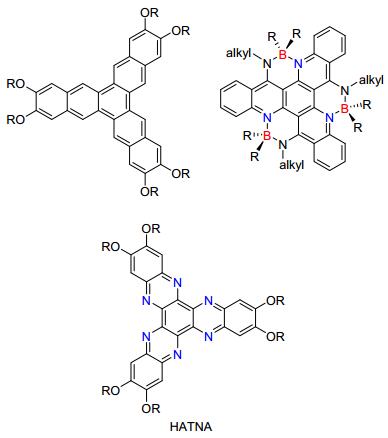
2016年Bunz等[2]报道了一系列溶解性良好易于修饰的苯并三萘化合物.这类化合物可作为有机发光二极管(OLEDs)优秀的发射源, 同时也是极佳的光伏二极管(PVD)给体材料; Lehmann[17]和Ong等[18]先后报道了烷硫基和烷氧基取代苯并三喹喔啉衍生物(HATNA)的合成, 随后Lemaur等[19]报道了苯并三喹喔啉衍生物(HATNA)的性质及在盘状液晶材料中的应用; Zhang等[20]完成两种具有三重硼原子中心的苯并三喹啉类化合物, 硼原子拥挤的空间构架与大平面刚性共轭体系相连接使得该类化合物表现出较大斯托克司频移和可调电化学行为, 其LUMO轨道能量低至-3.18 eV(图 2).
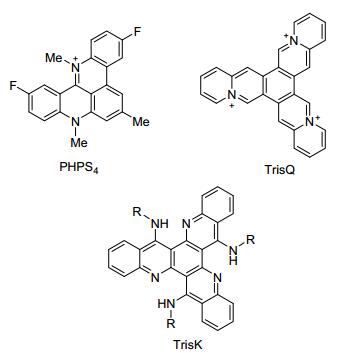
此外, 基于喹啉的C3-对称平面芳香体系在生物有机化学中的应用也逐渐引起人们的重视.其大π-共轭体系使它们可通过与G-四联体DNA的π-π堆积作用实现对DNA特异性识别, 因此有望靶向癌细胞. Searle等[21a]发现PHPS4可作为端粒酶抑制剂降低乳腺癌细胞的增殖; Teulade-Fichou等[21b]合成了TrisQ和TrisK两类化合物, 以期四联体出于对自身结构的稳定从而它们进行锚定, 使得功能性DNA变为非功能性DNA(图 3).
我们设想通过简单的合成策略得到既具有类似于图 2的C3-对称芳香共轭结构, 又含有吖啶结构基元的新型化合物C3-对称9-芳基吖啶类衍生物, 为该类化合物在有机功能材料或生物有机化学中的应用奠定基础.
1 结果与讨论
1.1 化合物1~3的合成
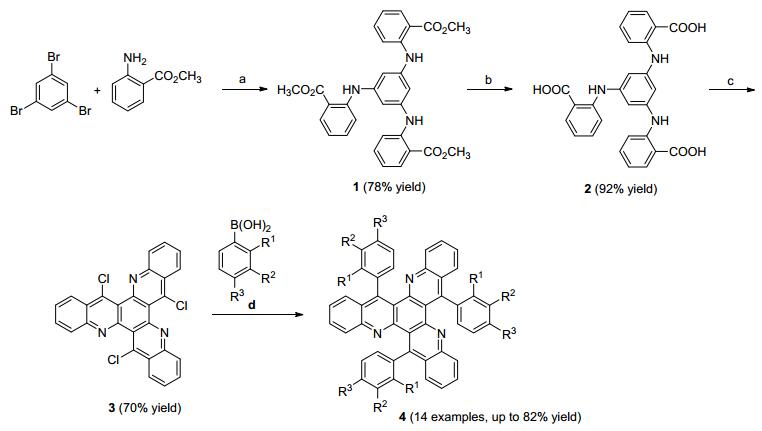
为合成关键中间体6, 12, 18-三氯二苯并[b, j]喹啉并[2, 3-f][1, 7]菲罗啉(3), 我们首先尝试以均三苯酚与邻氨基苯甲酸甲酯为原料[22], 通过浓盐酸催化直接缩合来制备1, 薄层色谱(TLC)分析跟踪反应时无主点产生, 通过改变浓盐酸的用量和温度均无主点出现.因此我们参照文献方法[23], 以均三溴苯与邻氨基苯甲酸为原料一步制备2, 仍存在反应体系混乱且无主点的问题.原因可能是文献中原料2-氨基-4-甲基苯甲酸与使用的邻氨基苯甲酸在电子效应上的差异所致.最终, 我们参照文献[21b]以均三溴苯与邻氨基苯甲酸甲酯为原料, 经Buchwald-Hartwig反应、脱酯基、三氯氧磷关环三步成功得到关键中间体6, 12, 18-三氯二苯并[b, j]喹啉并[2, 3-f][1, 7]菲罗啉(3).
1.2 目标化合物4的合成
拟采用钯催化Suzuki偶联反应完成目标化合物的合成.在已有基础上, 我们以关键中间体3与对甲基苯硼酸为底物进行简单的条件筛选(表 1)[24].首先选用芳氯与芳基硼酸常用的反应条件(Entry 1)进行尝试, 取得61%的收率.考虑到催化剂和配体对Suzuki偶联的影响最为关键, 选用toluene/H2O (V:V=4:1)为溶剂体系, 对催化剂和配体进行筛选.首先选用芳基氯与芳基硼酸Suzuki偶联比较常用的催化剂Pd(PPh3)4进行尝试, 但是当选用催化剂Pd(PPh3)4与配体PCy3或PPh3体系时, 反应产率均没有提高.结合我们已有经验[24], 选用催化剂二氯双[二叔丁基-(4-二甲基氨基苯基)膦]钯(Ⅱ) (Pd-132)对反应进行尝试, 结果发现该催化剂对所研究的底物适配性很好, 产率有了较大的提高(由61%提高到75%).接着以Pd-132为催化剂对碱、溶剂进行考察.当选用Cs2CO3 (Entry 10)为碱时, 产率较K3PO4•3H2O (Entry 6)没有提高, 但TLC显示杂质点的个数变少, 使得柱层析更加简便.最后, 我们对催化剂用量进行考察.当催化剂用量降低至0.1 mol%时仍可取得高的产率, 但是当用量降至0.05 mol%时, 反应出现额外的杂质点且较多, 延长反应时间杂质点仍然存在, 其原因可能是降低催化剂用量后导致偶联中的某个过渡态在反应温度下不能及时转化而变坏的结果.于是, 我们确定了该偶联反应的最佳条件:以Pd-132为催化剂, 0.1 mol%的用量, Cs2CO3为碱, toluene/H2O (V:V=4:1)为溶剂体系.

Entry Cat. (mol%) Ligandb Base Solvent Yieldc/% 1 Pd(OAc)2 (22.5) PCy3 K3PO4 Toluene/H2O (V:V=4:1) 61 2 Pd(OAc)2 (22.5) PCy3 K3PO4•3H2O Toluene/H2O (V:V=4:1) 60 3 Pd(OAc)2 (22.5) PCy3 K3PO4•3H2O DME/H2O (V:V=20:1) 45 4 Pd(PPh3)4 (22.5) PCy3 K3PO4•3H2O Toluene/H2O (V:V=4:1) 25 5 Pd(PPh3)4 (22.5) PPh3 K3PO4•3H2O Toluene/H2O (V:V=4:1) 20 6 Pd-132 (5) — K3PO4•3H2O Toluene/H2O (V:V=4:1) 75 7 Pd-132 (5) — K3PO4•3H2O DME/H2O (V:V=20:1) 40 8 Pd-132 (5) — K2CO3 Toluene/H2O (V:V=4:1) 26 9 Pd-132 (5) — t-BuOK Toluene/H2O (V:V=4:1) 44 10d Pd-132 (5) — Cs2CO3 Toluene/H2O (V:V=4:1) 75 11 Pd-132 (2) — Cs2CO3 Toluene/H2O (V:V=4:1) 75 12 Pd-132 (0.5) — Cs2CO3 Toluene/H2O (V:V=4:1) 73 13e Pd-132 (0.1) — Cs2CO3 Toluene/H2O (V:V=4:1) 75 14f Pd-132 (0.05) — Cs2CO3 Toluene/H2O (V:V=4:1) — a Reaction time: 24 h; b PCy3 (45 mol%), PPh3 (45 mol%); c isolated yields; dless impurities and simple reprocessing when Cs2CO3 used as base; e 36 h; f the reaction of impurities generated, and the impurity point is thick, the reaction 48 h still exists. 随后, 在上述最优条件下对底物进行拓展, 选取14种芳香硼酸与中间体3的偶联均能顺利完成, 收率在19%~82%之间(表 2).
对取代基效应进行分析, 发现4a与4f, 4b与4g相比, 直链烷基取代比含支链烷基取代的苯硼酸偶联产率高, 4c与4n相比, 对位取代比邻位取代的苯硼酸偶联产率高, 表明取代基的空间位阻对偶联产率有一定影响; 此外, 当我们选用对溴苯硼酸或对甲酰基苯硼酸时均未分离得到目标产物, 结合成功偶联的14种芳基硼酸, 可知给电子取代基比吸电子取代基对应的芳基硼酸偶联效果好.
1.3 光谱学性质研究
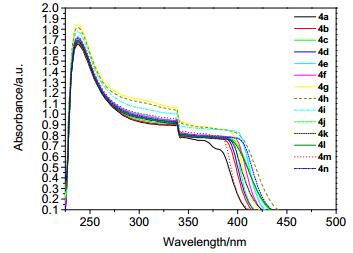
图 4为4a~4n在二氯甲烷中的紫外-可见吸收光谱.由于结构的相似性, 导致其紫外-可见光谱也相似, 其主要吸收带在225~450 nm之间, 其中在240 nm左右的这个吸收带应该为芳香核-三聚喹啉的π-π*跃迁与苯环及吡啶环的振动重叠引起的, 这与苯环在230~270 nm处有较弱的一系列吸收带(亦称B吸收带), 当苯环上有取代基时, 复杂的B吸收带简单化(在此体现为一个简单的单峰)并且发生深色移动相吻合.根据溶液中化合物的吸收边缘估计出HOMO-LOMO的能隙带[25], 由Eg=1240/λ得到4i的Eg低至2.19 eV.
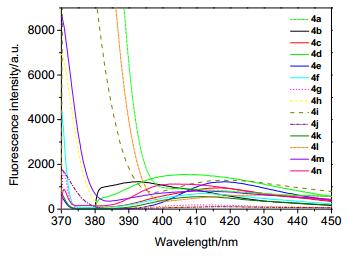
图 5为4a~4n在二氯甲烷溶液中的荧光发射光谱.溶液浓度为10-5 mol/L, 该类化合物在谱图上的峰形相似, 在360~395 nm范围内均出现较强的发射峰, 其中4a, 4i, 4l, 4m发射峰较强, 且除4g, 4h, 4j外, 在可见光区均有一定的吸收, 吸收峰在410 nm左右, 为典型的蓝紫光发射, 其中4i在420 nm附近有较强吸收, 发生了约10 nm的红移, 表明4a, 4i, 4l, 4m有望应用于有机光电功能材料.探究4g, 4h, 4j在372, 370, 371 nm有较强的尖峰, 但在可见光范围均无发射峰的原因, 结合这3种化合物与另外11种化合物在取代基上的差别, 从电子效应的角度分析, 并无规律可循.因此, 这个结果说明取代基效应对该类化合物的发射波长影响不具有明显的规律性.
1.4 X射线衍射分析
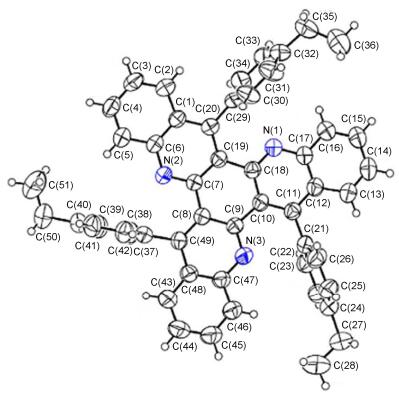
由于化合物4a~4n在常见的有机溶剂中均有较好的溶解性, 而且在柱层析提纯时观察到4a~4n均易得到针状结晶, 这为我们培养单晶创造了条件.选取在荧光发射光谱测试中结果较好的化合物4i进行了单晶培养, 其晶体结构图见图 6.
通过化合物4i的单晶结构可以看出, 该类化合物由一个刚性平面中心和三个取代的芳环成一定夹角连结而成, 同时, 化合物4i的单晶结构也进一步验证了我们通过核磁氢谱、碳谱以及质谱对其结构的推断.
2 结论
成功合成了一类新型C3-对称芳香共轭化合物, 该类化合物由一个刚性共轭平面中心核与三个芳基取代基连接构成一类大的共轭体系.通过核磁氢谱、碳谱, 高分辨质谱, X-ray单晶衍射对其结构进行了表征.经紫外-可见吸收光谱、荧光发射光谱对其应用性进行分析, 发现化合物4a, 4i, 4l, 4m在近紫外区有很强的荧光发射峰, 且在可见光区也有一定的发射强度, 其中4i的禁带宽度低至2.19 eV.较宽的波长吸收范围和较低的HOMO-LOMO能隙为其在有机光电功能材料中的应用奠定了基础.此外本方法具有如下优点: (1)催化剂稳定且用量低: 0.1 mol%, 平均到每一个位点仅为0.03 mol%; (2)原料易得, 适合推广应用.
3 实验部分
3.1 仪器与试剂
1H NMR、13C NMR用Bruker DR×500型核磁共振仪(1H NMR 500 MHz, 13C NMR 125 MHz)测定, TMS作内标, CDCl3或d6-DMSO作溶剂; 质谱用Waters GCT Premier测定; 熔点用X-4显微熔点仪测定.其余试剂均为国产分析纯试剂, POCl3现蒸现用, 其余试剂未经纯化直接使用.
3.2 实验方法
3.2.1 4i的单晶培养
室温下, 在10 mL的圆底烧瓶中加入20 mg 6, 12, 18-三(对乙苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4i), 将其溶解在6 mL乙酸乙酯和正己烷的混合溶剂(V:V=2:1)中, 瓶口用扎有小孔的滤纸封住, 溶剂自然挥发得到浅黄色针状结晶.
3.2.2 2, 2', 2''-(1, 3, 5-苯三基三亚氨基)三苯甲酸-1, 1', 1''-三甲酯(1)的合成
室温下, 在反应容器中依次加入均三溴苯(1.0 equiv.)、氨茴酸甲酯(3.5 equiv.)、碳酸铯(6.0 equiv.)和甲苯, 氮气环境下加入三叔丁基膦四氟硼酸盐(0.18 equiv.)和醋酸钯(0.06 equiv.), 氮气氛围下搅拌回流72 h, 冷却至室温, 过滤, 旋转蒸发仪旋除溶剂, 加入二氯甲烷和氯化铵(1 mol•L-1)的混合溶液(体积比为2:1).分液, 有机相用无水硫酸钠干燥, 旋转蒸发仪旋除溶剂得粗产品, 乙酸乙酯和石油醚重结晶, 柱层析得目标化合物2, 2', 2''-(1, 3, 5-苯三基三亚氨基)三苯甲酸-1, 1', 1''-三甲酯, 白色固体, 收率为87%. m.p. 96~98 ℃ (lit.[21b] m.p. 95~100 ℃); 1H NMR (500 MHz, CDCl3) δ: 9.45 (s, 3H), 7.96 (d, J=8.0 Hz, 3H), 7.36 (d, J=3.6 Hz, 6H), 6.84 (s, 3H), 6.78~6.73 (m, 3H), 3.90 (s, 9H).
3.2.3 2, 2', 2''-(1, 3, 5-苯三基三亚氨基)三苯甲酸(2)的合成
室温下, 在反应容器中加入2, 2', 2''-(1, 3, 5-苯三基三亚氨基)三苯甲酸-1, 1', 1''-三甲酯(1) (1.0 equiv.), 将其溶解于丙酮中, 接着加入5%的氢氧化钠(12.0 equiv.)水溶液, 氮气氛围下搅拌回流16 h, 体系为澄清透明液体, 冷却至室温, 加入二氯甲烷和水(体积比为1:1), 留取水相, 用稀盐酸(1 mol•L-1)酸化至pH=1, 过滤, 所得固体在100 ℃下真空干燥2 h得到粗产品, 乙醇重结晶得到目标化合物2, 2', 2''-(1, 3, 5-苯三基三亚氨基)三苯甲酸, 白色固体, 收率为92%. m.p.>300 ℃ (lit.[21b] m.p.>260 ℃); 1H NMR (500 MHz, d6-DMSO) δ: 13.09 (s, 3H), 9.57 (s, 3H), 7.89 (d, J=7.7 Hz, 3H), 7.45 (t, J=7.7 Hz, 3H), 7.38 (d, J=8.4 Hz, 3H), 6.81 (t, J=7.5 Hz, 3H), 6.76 (s, 3H).
3.2.4 6, 12, 18-三氯二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(3)的合成
室温下, 在反应容器中加入2, 2', 2''-(1, 3, 5-苯三基三亚氨基)三苯甲酸(2) (1.0 equiv.), 110 ℃下真空干燥4 h, 然后加入过量的三氯氧磷, 氮气氛围下搅拌回流16 h, 旋转蒸发仪旋除未反应的三氯氧磷, 冷却至室温, 加入二氯甲烷, 缓慢加入到冰水冷却的15%的氨水中, 过滤, 二氯甲烷多次洗涤, 然后用乙醚洗涤一次, 50 ℃下真空干燥得目标化合物6, 12, 18-三氯二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉, 棕黄色固体, 收率为70%. m.p.>300 ℃ (lit.[21b] m.p.>360 ℃); 1H NMR (500 MHz, CDCl3) δ: 8.69 (d, J=8.5 Hz, 3H), 8.34 (d, J=8.3 Hz, 3H), 7.92~7.87 (m, 3H), 7.80~7.75 (m, 3H).
3.2.5 6, 12, 18-三芳基二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4)的合成
在25 mL反应瓶中依次加入6, 12, 18-三氯二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(3) (0.2 mmol), 芳硼酸(1.2 mmol), 碳酸铯(1.2 mmol), 混合溶剂甲苯和水(5 mL, 体积比为4:1), 氮气氛围下加入催化剂Pd-132 (0.1 mol%), 搅拌回流36 h, TLC监测原料基本上反应完全, 冷却至室温, 用二氯甲烷萃取(15 mL×3), 无水硫酸钠干燥, 柱层析[硅胶, 除特别说明外, 淋洗剂均为V(石油醚)/V(乙酸乙酯)=200/1]得目标化合物4.
6, 12, 18-三(对叔丁基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4a):白色固体, 收率为34%, Rf=0.64 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 238~240 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.69 (d, J=8.0 Hz, 3H), 7.59 (d, J=8.3 Hz, 6H), 7.50 (t, J=6.9 Hz, 3H), 7.37~7.34 (m, 3H), 7.28 (d, J=8.3 Hz, 6H), 7.15 (d, J=8.2 Hz, 3H), 1.55 (s, 27H); 13C NMR (125 MHz, CDCl3) δ: 149.75, 149.20, 148.57, 146.31, 139.09, 129.70, 129.37, 128.91, 127.82, 127.48, 126.35, 124.96, 123.28, 34.89, 31.82; HRMS (ESI) calcd for C57H52N3 [M+H]+: 778.4156, found 778.4147.
6, 12, 18-三(对异丙基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4b):浅绿色固体, 收率为44%, Rf=0.64 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 298~300 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.67 (d, J=8.5 Hz, 3H), 7.50 (t, J=7.5 Hz, 3H), 7.42 (d, J=8.0 Hz, 6H), 7.34 (t, J=7.6 Hz, 3H), 7.25 (t, J=4.2 Hz, 6H), 7.16 (d, J=8.3 Hz, 3H), 3.15 (dt, J=13.8, 6.9 Hz, 3H), 1.48 (d, J=6.9 Hz, 18H); 13C NMR (125 MHz, CDCl3) δ: 149.65, 148.47, 146.87, 146.22, 139.38, 129.58, 129.30, 129.07, 127.72, 127.34, 126.25, 126.01, 123.15, 34.25, 24.40; HRMS (ESI) calcd for C54H46N3 [M+H]+: 736.3686, found 736.3680.
6, 12, 18-三(对甲氧基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4c):柱层析[V(石油醚)/V(乙酸乙酯)=200/1~100/1]得产品4c, 浅绿色固体, 收率为82%, Rf=0.13 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 284~286 ℃; 1H NMR (500 MHz, d6-DMSO) δ: 7.72~7.64 (m, 3H), 7.55 (d, J=8.1 Hz, 3H), 7.51~7.44 (m, 3H), 7.22 (d, J=7.8 Hz, 6H), 7.14 (dd, J=15.0, 8.3 Hz, 9H), 3.92 (s, 9H); 13C NMR (125 MHz, d6-DMSO) δ: 158.66, 149.54, 148.28, 146.06, 133.62, 130.62, 130.48, 129.32, 127.74, 127.38, 127.20, 123.12, 113.98, 55.80; HRMS (ESI) calcd for C48H34N3O3 [M+H]+: 700.2595, found 700.2614.
6, 12, 18-三(对甲苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4d):白色固体, 收率为75%, Rf=0.60 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 277~279 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.65 (d, J=8.5 Hz, 3H), 7.56 (t, J=7.4 Hz, 3H), 7.39 (d, J=8.0 Hz, 6H), 7.35 (d, J=7.6 Hz, 3H), 7.24 (d, J=7.8 Hz, 6H), 7.17 (d, J=8.4 Hz, 3H), 2.61 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 149.68, 148.41, 146.26, 138.96, 135.66, 129.61, 129.32, 129.05, 128.62, 127.78, 127.29, 126.30, 123.09, 21.49; HRMS (ESI) calcd for C48H34N3 [M+H]+: 652.2747, found 652.2749.
6, 12, 18-三(对正戊基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4e):浅绿色固体, 收率为60%, Rf=0.65 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 142~144 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.64 (d, J=8.5 Hz, 3H), 7.52 (t, J=7.5 Hz, 3H), 7.39 (d, J=7.9 Hz, 6H), 7.37~7.33 (m, 3H), 7.24 (s, 6H), 7.19 (d, J=8.3 Hz, 3H), 2.89~2.81 (m, 6H), 1.92~1.83 (m, 6H), 1.49 (dt, J=14.0, 4.8 Hz, 12H), 1.01 (t, J=7.0 Hz, 9H); 13C NMR (125 MHz, CDCl3) δ: 149.67, 148.46, 146.21, 140.89, 139.21, 129.48, 129.42, 129.00, 128.05, 127.78, 127.32, 126.30, 123.09, 36.08, 31.89, 31.76, 22.80, 14.19; HRMS (ESI) calcd for C60H58N3 [M+H]+: 820.4625, found 820.4627.
6, 12, 18-三(对正丁基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4f):浅绿色固体, 收率为46%, Rf=0.66 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 207~208 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.64 (d, J=8.4 Hz, 3H), 7.52 (t, J=8.1 Hz, 3H), 7.38 (d, J=7.9 Hz, 6H), 7.35 (t, J=8.1 Hz, 3H), 7.26~7.23 (m, 6H), 7.20 (d, J=8.3 Hz, 3H), 2.86 (t, J=7.6 Hz, 6H), 1.89~1.83 (m, 6H), 1.59 (dt, J=14.9, 7.4 Hz, 6H), 1.08 (t, J=7.4 Hz, 9H); 13C NMR (125 MHz, CDCl3) δ: 149.68, 148.45, 146.25, 140.82, 139.22, 129.51, 129.36, 129.04, 128.04, 127.80, 127.30, 126.26, 123.10, 35.75, 34.29, 22.54, 14.16; HRMS (ESI) calcd for C57H52N3 [M+H]+: 778.4156, found 778.4150.
6, 12, 18-三(对丙基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4g):浅绿色固体, 收率为70%, Rf=0.58 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 226~227 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.65 (d, J=8.6 Hz, 3H), 7.52 (t, J=7.5 Hz, 3H), 7.39 (d, J=6.8 Hz, 6H), 7.37~7.34 (m, 3H), 7.26 (dd, J=7.8, 1.7 Hz, 6H), 7.19 (d, J=9.2 Hz, 3H), 2.84 (t, J=7.5 Hz, 6H), 1.95~1.86 (m, 6H), 1.16 (t, J=7.3 Hz, 9H); 13C NMR (125 MHz, CDCl3) δ: 149.67, 148.45, 146.21, 140.62, 139.27, 129.49, 129.44, 128.99, 128.13, 127.77, 127.30, 126.30, 123.10, 38.18, 25.13, 14.07; HRMS (ESI) calcd for C54H46N3 [M+H]+: 736.3686, found 736.3681.
6, 12, 18-三(对己氧基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4h):柱层析[V(石油醚)/V(乙酸乙酯)=200/1~100/1]得产品4h为浅绿色固体, 收率为41%, Rf=0.44 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 104~106 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.67 (d, J=8.4 Hz, 3H), 7.55 (t, J=7.5 Hz, 3H), 7.36 (t, J=7.6 Hz, 3H), 7.29 (d, J=8.3 Hz, 3H), 7.24 (d, J=8.6 Hz, 6H), 7.11 (d, J=8.6 Hz, 6H), 4.16 (t, J=6.6 Hz, 6H), 1.96~1.88 (m, 6H), 1.59 (dd, J=14.7, 7.6 Hz, 6H), 1.47~1.38 (m, 12H), 0.96 (t, J=7.0 Hz, 9H); 13C NMR (125 MHz, CDCl3) δ: 158.01, 149.82, 148.15, 146.31, 134.01, 130.28, 129.59, 129.51, 128.01, 127.27, 126.31, 123.30, 114.24, 68.34, 31.70, 29.42, 25.86, 22.71, 14.12; HRMS (ESI) calcd for C63H64N3O3 [M+H]+: 910.4942, found 910.4941.
6, 12, 18-三(对乙苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4i):浅绿色固体, 收率为72%, Rf=0.66 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 222~224 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.66 (d, J=8.5 Hz, 3H), 7.53 (t, J=6.9 Hz, 3H), 7.40 (d, J=8.0 Hz, 6H), 7.35 (t, J=7.0 Hz, 3H), 7.25 (d, J=3.6 Hz, 6H), 7.17 (d, J=7.8 Hz, 3H), 2.90 (q, J=7.5 Hz, 6H), 1.48 (t, J=7.6 Hz, 9H); 13C NMR (125 MHz, CDCl3) δ: 149.65, 148.45, 146.20, 142.29, 139.25, 129.50, 129.46, 129.08, 127.73, 127.53, 127.32, 126.30, 123.12, 29.05, 16.37; HRMS (ESI) calcd for C51H40N3 [M+H]+: 694.3217, found 694.3218.
6, 12, 18-三(间甲基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4j):白色固体, 收率为39%, Rf=0.65 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p.>300 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.64 (d, J=8.5 Hz, 3H), 7.58 (t, J=7.5 Hz, 3H), 7.47 (t, J=7.5 Hz, 3H), 7.39 (dd, J=16.5, 8.3 Hz, 6H), 7.19 (d, J=8.8 Hz, 6H), 7.15 (d, J=7.4 Hz, 3H), 2.48 (s, 9H); 13C NMR (125 MHz, CDCl3) δ: 149.55, 148.46, 146.16, 142.01, 137.50, 129.70, 129.48, 127.70, 127.35, 126.84, 126.35, 126.12, 122.88, 21.73; HRMS (ESI) calcd for C48H34N3 [M+H]+: 652.2747, found 652.2747.
6, 12, 18-三(对苯氧基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4k):柱层析[V(石油醚)/V(乙酸乙酯)=200/1~100/1]得产品4k, 浅黄色固体, 收率为61%, Rf=0.42 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 250~251 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.70 (d, J=8.5 Hz, 3H), 7.66 (t, J=7.5 Hz, 3H), 7.46 (dd, J=7.8, 5.2 Hz, 6H), 7.43 (d, J=8.3 Hz, 6H), 7.34 (d, J=8.4 Hz, 6H), 7.25 (d, J=2.1 Hz, 12H), 7.16 (t, J=7.3 Hz, 3H); 13C NMR (125 MHz, CDCl3) δ: 157.73, 155.91, 149.64, 147.74, 146.35, 136.87, 130.62, 129.84, 129.80, 129.49, 127.83, 127.21, 126.67, 123.19, 118.85, 118.80; HRMS (ESI) calcd for C63H40N3O3 [M+H]+: 886.3064, found 886.3070.
6, 12, 18-三(对苄氧基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4l):柱层析[V(石油醚)/V(乙酸乙酯)=200/1~100/1]得产品4l, 黄色固体, 收率为52%, Rf=0.42 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 224~225 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.65 (d, J=8.4 Hz, 3H), 7.58 (t, J=7.2 Hz, 6H), 7.54 (d, J=7.4 Hz, 3H), 7.46 (t, J=7.3 Hz, 6H), 7.38 (dd, J=13.0, 6.7 Hz, 6H), 7.25 (s, 9H), 7.19 (d, J=8.1 Hz, 6H), 5.27 (s, 6H); 13C NMR (125 MHz, CDCl3) δ: 157.66, 149.74, 148.01, 146.29, 137.42, 134.51, 130.33, 129.70, 129.48, 128.69, 127.99, 127.48, 127.24, 126.37, 123.25, 114.56, 70.25; HRMS (ESI) calcd for C66H46N3O3 [M+H]+: 928.3534, found 928.3555.
6, 12, 18-三(2, 3-二甲基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4m):浅绿色固体, 收率为41%, Rf=0.70 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p.>300 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.57 (t, J=6.7 Hz, 3H), 7.48 (t, J=7.1 Hz, 3H), 7.43~7.31 (m, 6H), 7.26~7.11 (m, 6H), 6.99~6.77 (m, 3H), 2.65~2.41 (m, 9H), 2.05~1.77 (m, 9H); 13C NMR (125 MHz, CDCl3) δ: 149.68, 148.55, 146.69, 141.91, 135.92, 135.31, 134.61, 129.77, 129.36, 128.01, 127.35, 127.11, 126.45, 125.85, 125.35, 125.19, 122.95, 20.65, 16.97; HRMS (ESI) calcd for C51H40N3 [M+H]+: 694.3217 found 694.3240.
6, 12, 18-三(2, 3-二甲基苯基)二苯并[b, j]喹啉并[2, 3-f][1, 7]菲咯啉(4n):浅绿色固体, 收率为19%, Rf=0.15 [V(石油醚)/V(乙酸乙酯)=20/1]. m.p. 334~336 ℃; 1H NMR (500 MHz, CDCl3) δ: 7.61~7.51 (m, 9H), 7.35 (t, J=7.6 Hz, 3H), 7.21 (dt, J=18.2, 6.2 Hz, 6H), 7.07 (ddd, J=42.1, 9.8, 8.1 Hz, 6H), 3.68~3.54 (m, 9H); 13C NMR (125 MHz, CDCl3) δ: 158.15, 158.10, 157.71, 157.74, 149.91, 149.81, 149.74, 146.74, 146.57, 149.74, 146.74, 146.57, 146.49, 145.20, 145.05, 131.86, 131.80, 131.77, 129.49, 129.46, 129.40, 129.33, 129.02, 128.98, 127.88, 126.96, 126.20, 123.53, 120.71, 120.63, 120.52, 110.63, 110.60, 55.92, 55.90, 55.83; HRMS (ESI) calcd for C48H43N3O3 [M+H]+: 700.2595 found 700.2576.
辅助材料(Supporting Information) 产物和中间体的核磁共振、质谱图谱, 以及单晶衍射数据.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Feng, X. ; Wu, J. ; Ai, M. ; Pisula, W. ; Zhi, L. ; Rabe, J. P. ; Mllen, K. Angew. Chem., Int. Ed. 2007, 46, 3033.
(b) Piot, L. ; Marie, C. ; Feng, X. L. ; Müllen, K. ; Fichou, D. Adv. Mater. 2008, 20, 3854.
(c) Simpson, C. D. ; Wu, J. S. ; Watson, M. D. ; Mullen, K. J. Mater. Chem. 2004, 14, 494.
(d) Bertrand, H. ; Guillot, R. ; Teulade-Fichou, M. -P. ; Fichou, D. Chem. -Eur. J. 2013, 19, 14654.
(e) Piot, L. ; Marie, C. ; Dou, X. ; Feng, X. L. ; Mullen, K. ; Fichou, D. J. Am. Chem. Soc. 2009, 131, 1378. -
[2]
Rüdiger, E. C.; Rominger, F.; Steuer, L.; Bunz. U. H. F. J. Org. Chem. 2016, 81, 193. doi: 10.1021/acs.joc.5b02481
-
[3]
(a) Serroni, S. ; Campagna, S. ; Puntoriero, F. ; Cinzia, D. P. ; McClenaghan, N. D. ; Loiseau, F. Chem. Soc. Rev. 2001, 30, 367.
(b) Song, P. ; Wang, C. Y. ; Wang, P. ; Liu, X. Y. ; Xu, K. X. J. Org. Chem. 2016, 36, 782(in Chinese).
(宋盼, 王超玉, 王鹏, 刘晓燕, 徐括喜, 有机化学, 2016, 36, 782. ) -
[4]
Goodell, J. R.; Ougolkov, A. V.; Hiasa, H.; Kaur, H.; Remmel, R.; Billadeau, D. D.; Ferguson, D. M. J. Med. Chem. 2008, 51, 179. doi: 10.1021/jm701228e
-
[5]
Horowitz, E. D.; Hud, N. V. J. Am. Chem. Soc. 2006, 128, 15380. doi: 10.1021/ja065339l
-
[6]
Hassan, S.; Laryea, D.; Mahteme, H.; Felth, J.; Fryknäs, M.; Fayad, W.; Linder, S.; Rickardson, L.; Gullbo, J.; Graf, W.; Påhlman, L.; Glimelius, B.; Larsson R.; Nygren, P. Cancer Sci. 2011, 102, 2206. doi: 10.1111/cas.2011.102.issue-12
-
[7]
Ephrussi, B.; Hottinguer, H. Nature 1950, 166, 956.
-
[8]
Musdal, Y.; Hegazy, U. M.; Aksoy Y.; Mannervik, B. Chem. Biol. Interact. 2013, 205, 53. doi: 10.1016/j.cbi.2013.06.003
-
[9]
Mei, Q.; Li, X. L.; Liu, H. J.; Zhou, H. B. Eur. J. Obstet. Gynecol. Reprod. Biol. 2014, 178, 12. doi: 10.1016/j.ejogrb.2014.04.041
-
[10]
Kumar, R.; Kaur M.; Kumari, M. Acta Pol. Pharm. 2012, 69, 3.
-
[11]
Galdino-Pitta, M. R.; Pitta, M. G. R.; Lima, M. C. A.; Galdino S. L.; Pitta, I. R. Mini-Rev. Med. Chem. 2013, 13, 1256. doi: 10.2174/1389557511313090002
-
[12]
Cain, B. F.; Atwell, G. J.; Denny, W. A. J. Med. Chem. 1975, 18, 1110. doi: 10.1021/jm00245a013
-
[13]
Atwell, G. J.; Rewcastle, G. W.; Baguley, B. C.; Denny, W. A. J. Med. Chem. 1987, 30, 664. doi: 10.1021/jm00387a014
-
[14]
Spicer, J. A.; Gamage, S. A.; Atwell, G. J.; Finlay, G. J.; Baguley, B. C.; Denny, W. A. J. Med. Chem. 1997, 40, 1919. doi: 10.1021/jm970004n
-
[15]
Gamage, S. A.; Spicer, J. A.; Rewcastle G. W.; Denny, W. A. Tetrahedron Lett. 1997, 38, 699. doi: 10.1016/S0040-4039(96)02396-9
-
[16]
Dittrich, C.; Dieras, V.; Kerbrat, P.; Punt, C.; Sorio, R.; Caponigro, F. Invest. New Drugs 2003, 21, 347. doi: 10.1023/A:1025476813365
-
[17]
Kestemont, G.; de Halleux, V.; Lehmann, M.; Ivanov, D. A.; Watson, M.; Geerts, Y. H. Chem. Commun. 2001, 2074.
-
[18]
Ong, C. W.; Liao, S. C.; Chang, T. H.; Hsu, H. F. Tetrahedron Lett. 2003, 44, 1477. doi: 10.1016/S0040-4039(02)02862-9
-
[19]
Lemaur, V.; Filho, D. A. S.; Coropceanu, V.; Lehmann, M.; Geerts, Y.; Piris, J.; Debije, M. G.; van de Craats, A. M.; Senthilkumar, K.; Siebbeles, L. D. A.; Warman, J. M.; Brdas, J. L.; Cornil, J. J. Am. Chem. Soc. 2004, 126, 3271. doi: 10.1021/ja0390956
-
[20]
Qiu, F.; Zhang, F.; Tang, R. Z.; Fu, Y. B.; Wang, X. Y.; Han, S.; Zhuang, X. D.; Feng, X. L. Org. Lett. 2016, 18, 1398. doi: 10.1021/acs.orglett.6b00335
-
[21]
(a) Gavathiotis, E. ; Heald, R. A. ; Stevens, M. F. G. ; Searle, M. S. J. Mol. Biol. 2003, 334, 25.
(b) Bertrand, H. ; Granzhan, A. ; Monchaud, D. ; Saettel, N. ; Guillot, R. ; Clifford, S. ; Guedin, A. ; Mergny, J. L. ; Teulade-Fichou, M. P. Chem. -Eur. J. 2011, 17, 4529. -
[22]
Plater, M. J.; McKay, M.; Jackson, T. J. Chem. Soc., Perkin Trans. 1 2000, 2695.
-
[23]
(a) Saettel, N. ; Katsonis, N. ; Marchenko, A. ; Teulade-Fichou, M. -P. ; Fichou, D. J. Mater. Chem. 2005, 15, 3175.
(b) Jacquelin, C. ; Saettel, N. ; Hounsou, C. ; Teulade-Fichou, M. P. Tetrahedron Lett. 2005, 46, 2589. -
[24]
(a) Ge, H. M. ; Liu, Q. C. Heterocycles 2015, 91, 1001.
(b) Ye, P. J. ; Li, Q. Y. ; Bai, Z. S. ; Dong, K. ; Liu, Q. C. Heterocycles 2015, 91, 1986.
(c) Zhang, J. ; Ye, P. J. ; He, L. ; Yuan, T. ; Liu, Q. C. Heterocycles 2015, 91, 2190. -
[25]
黄春辉, 李富友, 黄维, 有机电致发光材料与器件导论, 复旦大学出版社, 上海, 2005, p. 110.Huang, C. H. ; Li, F. Y. ; Huang, W. Introduction to Organic Light-Emitting Materials and Devices, Fudan University Press, Shanghai, 2005, p. 110(in Chinese).
-
[1]
-
图式 1 C3-对称9-芳基吖啶类衍生物的合成路线
Scheme 1 Synthetic route of C3-symmetric 9-aryl acridine derivatives
Reagents and conditions: (a) Pd(OAc)2 (6 mol%), HP(t-Bu)3BF4 (18 mol%), Cs2CO3 (6.0 equiv.), toluene, reflux, 72 h; (b) 5% NaOH (aq.), acetone, reflux, 16 h; (c) POCl3 (large excess), reflux, 16 h; (d) Pd-132 (0.1 mol%), Cs2CO3 (6.0 equiv.), toluene/H2O (V/V=4/1), 24 h
表 1 反应条件的优化a
Table 1. Optimization of reaction conditions

Entry Cat. (mol%) Ligandb Base Solvent Yieldc/% 1 Pd(OAc)2 (22.5) PCy3 K3PO4 Toluene/H2O (V:V=4:1) 61 2 Pd(OAc)2 (22.5) PCy3 K3PO4•3H2O Toluene/H2O (V:V=4:1) 60 3 Pd(OAc)2 (22.5) PCy3 K3PO4•3H2O DME/H2O (V:V=20:1) 45 4 Pd(PPh3)4 (22.5) PCy3 K3PO4•3H2O Toluene/H2O (V:V=4:1) 25 5 Pd(PPh3)4 (22.5) PPh3 K3PO4•3H2O Toluene/H2O (V:V=4:1) 20 6 Pd-132 (5) — K3PO4•3H2O Toluene/H2O (V:V=4:1) 75 7 Pd-132 (5) — K3PO4•3H2O DME/H2O (V:V=20:1) 40 8 Pd-132 (5) — K2CO3 Toluene/H2O (V:V=4:1) 26 9 Pd-132 (5) — t-BuOK Toluene/H2O (V:V=4:1) 44 10d Pd-132 (5) — Cs2CO3 Toluene/H2O (V:V=4:1) 75 11 Pd-132 (2) — Cs2CO3 Toluene/H2O (V:V=4:1) 75 12 Pd-132 (0.5) — Cs2CO3 Toluene/H2O (V:V=4:1) 73 13e Pd-132 (0.1) — Cs2CO3 Toluene/H2O (V:V=4:1) 75 14f Pd-132 (0.05) — Cs2CO3 Toluene/H2O (V:V=4:1) — a Reaction time: 24 h; b PCy3 (45 mol%), PPh3 (45 mol%); c isolated yields; dless impurities and simple reprocessing when Cs2CO3 used as base; e 36 h; f the reaction of impurities generated, and the impurity point is thick, the reaction 48 h still exists. 表 2 底物范围拓展a
Table 2. Exploration of the substrate scope

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 9
- 文章访问数: 2560
- HTML全文浏览量: 995


 下载:
下载:






 下载:
下载:

