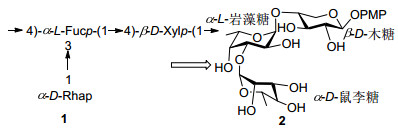
 图式 1
巴西固氮螺菌SP7型菌株中的LPS三糖结构重复单元
Scheme1.
Repeating unit of LPS (1) from Azospirillum brasilense type strain SP7
图式 1
巴西固氮螺菌SP7型菌株中的LPS三糖结构重复单元
Scheme1.
Repeating unit of LPS (1) from Azospirillum brasilense type strain SP7

Citation: Xu Yiren, Zhang Jianjun, Dong Yanhong, Tan Weiming. Synthesis of the Trisaccharide Repeating Unit from Azospirillum brasilense Type Strain Sp7 and Its Effect on Plant Growth[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2929-2939. doi: 10.6023/cjoc201706036

固氮螺菌重复三糖片段的化学合成及其对植物生长的影响
English
Synthesis of the Trisaccharide Repeating Unit from Azospirillum brasilense Type Strain Sp7 and Its Effect on Plant Growth
-
化肥和化学农药的使用在保障农作物丰产的同时, 也对我国的环境和食品安全构成威胁, 降低化肥和农药的使用, 并寻求高效、低毒、环境相容性好的农用化学品已经成为我国科研工作者关注的重要目标之一.在自然界, 一些植物通过与根瘤菌间的共生作用, 将空气中的氮及其他元素组合形成含氮营养物, 因此激发利用植物的生物固氮能力, 能够促进植物的生长并降低化肥使用[1].在固氮过程中, 根瘤菌表面脂多糖(Lipopolysa Ccharides, LPSs)对细菌的生长以及根瘤结节的形成至关重要, 这些LPSs一般是由含鼠李糖、木糖、岩藻糖、脱氧塔罗糖等脱氧稀有糖组成的寡糖重复单元聚合而成.研究表明根瘤菌通过LPSs远端的O-抗原多糖(O-antigenic polysaccharides, OPSs)与环境接触并完成与寄主植物间的识别与信号传递[2], 当根瘤菌表面的LPS结构存在缺陷时, 其与寄主植物的共生及根瘤形成都会受到影响, 有研究表明, 那些LPSs结构中缺乏OPSs或OPSs核心结构发生改变的根瘤菌突变体, 往往难以完成对寄主的感染过程[3~5].这些现象一直吸引着人们对LPSs的结构与生物学功能的关注, 尤其是LPSs重复单元的结构与活性研究一直是科学家研究的热点[6~11].
固氮螺菌SP7型菌株是寄生在植物根际的一种共生型细菌, 该菌最早从热带禾本科植物盘固草(Digitaria decumbens)的根际提取分离得到[12], 1991年研究发现该细菌与寄主植物通过细胞壁上的LPS脂多糖能够实现不可逆结合[13]; 2005年、2009年研究者相继报道了固氮菌细胞壁上的脂多糖是与植物相互作用的关键特异性识别结构[14]; 2011年有研究报道[15]了SP7型固氮螺菌具有分泌植物生长素如吲哚乙酸的功能, 这些生长素能够与细胞壁上LPS脂多糖形成复合物, 再转运到植物体内, 从而促进植物生长.在前期研究中, 我们合成了一系列固氮菌LPSs重复单元的寡糖结构, 并发现了三叶草根瘤菌Rhizobium trifokii 4s中氨基五糖片段对小麦的促进生长活性[16]. 2013年, Elena课题组[17]报道了SP7型固氮螺菌(Azospirillum brasilense type strain Sp7)细胞壁上LPS脂多糖结构是由D-鼠李糖、D-木糖、L-岩藻糖三个稀有单糖所构成三糖重复单元组成(Scheme 1, 1).为研究固氮菌LPS脂多糖重复单元的结构与活性关系, 在本工作中我们首次完成SP7型固氮螺菌细胞壁上脂多糖三糖重复结构即α-D-鼠李糖-(1→3)-α-L-岩藻糖-(1→4)-α-D-木糖(Scheme 1, 2)的合成工作, 并初步研究了该三糖的植物生长调节活性.
 图式 1
巴西固氮螺菌SP7型菌株中的LPS三糖结构重复单元
Scheme1.
Repeating unit of LPS (1) from Azospirillum brasilense type strain SP7
图式 1
巴西固氮螺菌SP7型菌株中的LPS三糖结构重复单元
Scheme1.
Repeating unit of LPS (1) from Azospirillum brasilense type strain SP7
1 结果与讨论
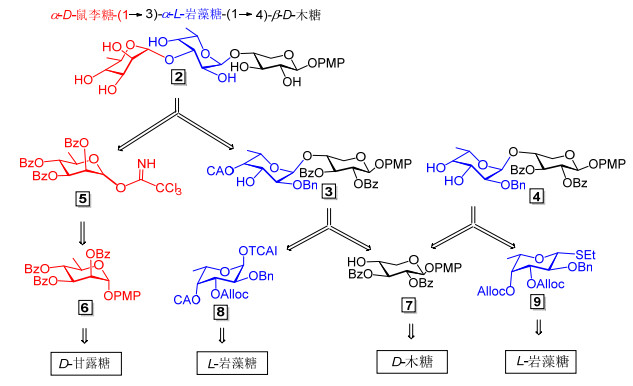
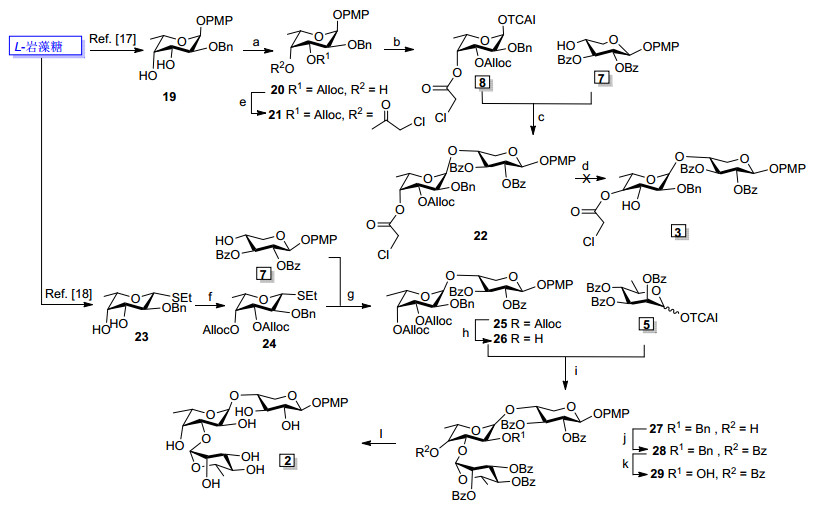
一个三糖的合成往往需要完成多个偶联反应, 由于每个单糖含有多个羟基, 在特定位点进行偶联反应, 往往要求对其它位点的羟基进行选择性保护与脱保护, 因此, 合成策略的选择与保护基团的合理运用成为寡糖合成的一个研究重点和难点.考察目标三糖的化学结构, 可以发现它是由L-岩藻糖, D-木糖和D-鼠李糖三个不同的稀有单糖组成, Scheme 2为目标分子的逆合成分析:我们拟采用[2+1]策略, 即过D-鼠李糖三氯乙酰亚胺酯供体(5)与双糖受体汇聚偶联完成三糖骨架的构建.最初设计的双糖受体为含一个羟基的双糖受体3, 它可以通过图中所示岩藻糖三氯乙酰亚胺酯8和木糖受体7偶联后, 选择性脱除所得产物中的保护基烯丙氧羰基(Alloc)获得, 但是后来的研究发现, 由于脱除保护基Alloc时, 分子中的另外一个保护基氯乙酰基(CA)非常不稳定, 反应结果得到一无法分离的复杂产物, 使得这一策略宣告失败.因此我们将合成策略调整为合成双羟基双糖受体4, 通过4与供体5的选择性偶联来获得全保护三糖, 双糖4可以通过Scheme 2中所示岩藻糖乙硫苷供体9和7偶联后, 高效率脱除两个Alloc获得, 这一方法在研究中被证明是非常成功的.在以上合成过程中, 关键的单糖合成子5和7可以分别由D-甘露糖和D-木糖合成, 而合成子8和9则通过一系列反应从L-岩藻糖制备.
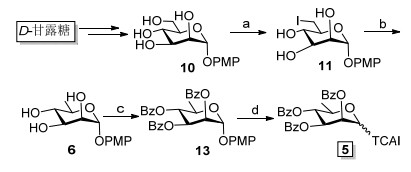
D-鼠李糖是自然界广泛存在的一种稀有糖, 由于目前市场上没有商品化来源, 其获得依赖主要从D-甘露糖制备[18].本课题组在前期研究中, 对甘露糖及相关寡糖的合成开展了大量的研究工作[19~22], 以此为基础, 我们首先合成了2, 3, 4-三-O-苯甲酰基-α-D-鼠李糖三氯乙酰亚胺酯(5), 用于后续的偶联反应.如Scheme 3所示.以D-甘露糖为原料, 经全乙酰化后与对甲氧基苯酚在三氟化硼乙醚络合物作用下糖苷化形成对甲氧基苯苷、脱乙酰基化三步反应, 得到对甲氧基苯α-D-甘露糖苷(10)[16, 21, 22], 这三步反应可以连续操作, 产物通过结晶纯化, 全程不需柱色谱纯化, 从而大大简化了操作过程, 适宜于大量制备.以化合物10为原料, 参考文献报道的方法[18], 以93%的产率得到6-碘代-6-脱氧-α-D-甘露糖对甲氧基苯苷(11).化合物11在钯碳催化下, 氢化还原脱除6位碘原子, 以90%的收率得到α-D-鼠李糖对甲氧基苯基苷(6).之后6再经由全苯甲酰化(→13)、脱除化合物13异头碳的对甲氧基苯基及三氯乙酰亚胺酯活化三步反应得到供体5.
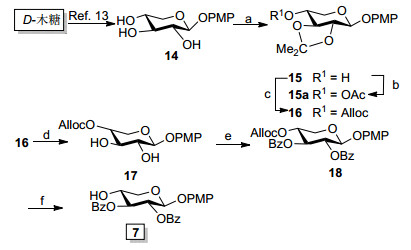
与此同时, 以D-木糖为起始原料, 经一系列保护-去保护步骤合成木糖受体2, 3-二-O-苯甲酰基-β-D-吡喃木糖对甲氧基苯基苷(7).如Scheme 4所示, 参考甘露糖对甲氧基苯苷的合成方法, D-木糖经乙酰化、异头碳对甲氧基苯基糖苷化、脱乙酰基三步连续操作反应, 得到对甲氧基苯基木糖糖苷(14)[23].化合物14在混旋樟脑磺酸的催化下, 与2-甲氧基丙烯反应[24], 以60%的收率得到2, 3-O-异丙叉基-β-D-吡喃木糖对甲氧基苯基苷(15), 随后, 化合物15在0 ℃, 吡啶作缚酸剂下与氯甲酸烯丙酯反应, 以90%的收率得到4-O-烯丙氧羰基-2, 3-O-异丙叉基-β-D-吡喃木糖对甲氧基苯基苷(16).在酸性条件下脱除化合物16的异丙叉基, 硅胶柱纯化后以80%的收率得到4-O-烯丙氧羰基-β-D-吡喃木糖对甲氧基苯基苷(17), 而后化合物17经过苯甲酰基化(→18)、高效脱除烯丙氧羰基化反应[25]得到4位游离羟基的木糖受体7.
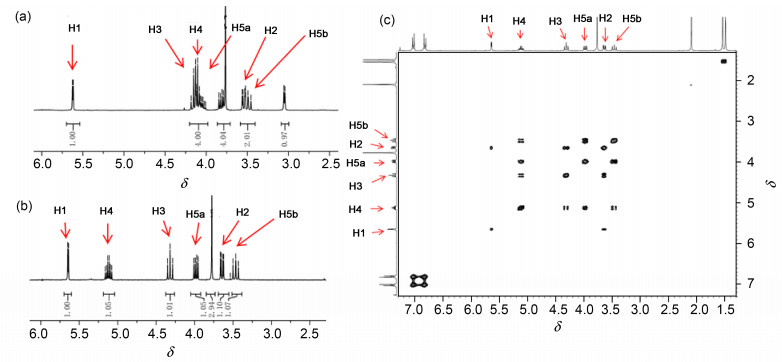
化合物14的异丙叉基化反应中, 文献报道的产物有2, 3-O-叉基化和3, 4-O-叉基化两种[26], 结构需要通过产物15的酰化反应中, 分析与游离羟基相连的糖环上氢在酰化反应发生前后的化学位移变化来确定.由于15烯丙氧羰基酰化后, 得到产物16糖环上相应氢特征峰与烯丙基峰重叠而无法判断, 为确保15结构的正确性, 对其游离羟基另外进行了乙酰化衍生, 即在吡啶、乙酸酐中对化合物15进行乙酰化, 得到化合物15a.化合物15、15a的核磁氢谱以及15a的氢氢相关谱如图 1所示.通过1H-1H COSY相关谱图可以清晰确定15a中木糖C-4位H-4的化学位移为低场δ5.1附近的ddd峰.不难发现, 酰化反应发生前, 原料15中只有H-1处于低场, 而H-2、H-3和H-4均处于高场, 乙酰化反应后得到产物15a中只有H-4化学位移向核磁低场移动的事实, 间接证明了实验中获得的2, 3-O-叉基化产物, 有力地说明了结构的正确性.
完成木糖受体7的制备后, 我们着手开展L-岩藻糖中间体的合成研究.由于目标分子中L-岩藻糖与D-木糖之间的连接为1, 2-顺式糖苷键, 在设计岩藻糖合成子时需要同时考虑保护基之间的相容性和保护基在糖苷化反应中对糖苷键构型的影响.在初期研究中, 选择以易脱除且稳定的对甲氧基苯基保护L-岩藻糖异头碳羟基、无邻基参与效应的苄基保护C-2位-OH来构建岩藻糖合成子, 同时考虑合成三糖时L-岩藻糖C-3位-OH为糖基化偶联位点, 可以用烯丙氧羰基区分, 因此, 我们设计了L-岩藻糖三氯乙酰亚胺酯供体8, 其合成过程如下:以L-岩藻糖为原料, 参考文献报道的合成方法[27], 首先得到2-O-苄基保护的化合物19, 19在二氯甲烷中-25 ℃, 吡啶存在下与氯甲酸烯丙酯反应, 区域选择性得到3-O-烯丙氧羰基-2-O-苄基-α-L-岩藻糖对甲氧基苯基苷(20), 然后化合物20在吡啶存在下与氯乙酰氯反应, 得到4-O-氯乙酰基-3-O-烯丙氧羰基-2-O-苄基-α-L-岩藻糖对甲氧基苯基苷(21).脱除化合物21的对甲氧基苯基, 以三氯乙酰亚胺酯活化, 即得到L-岩藻糖供体8.化合物8在无水二氯甲烷溶剂中, 三氟甲磺酸三甲基硅酯(TMSOTf)催化在较低温度下与木糖受体7偶联, 顺利获得双糖化合物22, 如Scheme 5所示.但是, 在后续脱除22烯丙氧羰基反应中, 产物为难以分离的复杂混合物, 可能是因为氯乙酰基在该反应条件稳定性差引起.
获得上述经验后, 在研究中及时调整合成策略, 设计了L-岩藻糖乙硫基苷供体24用于后续合成并获得成功.参考文献报道的合成方法[28], 首先以L-岩藻糖为原料合成得到2-O-苄基-3, 4-二-O-羟基的乙基硫苷化合物23, 随后在0 ℃下, 以吡啶作缚酸剂, 23与2 equiv.氯甲酸烯丙酯反应, 得到3, 4-二-O-烯丙氧羰基-2-O-苄基-β-L-岩藻糖乙硫基苷(24).供体24可直接用于糖苷化反应, 相对于三氯乙酰亚胺酯供体8的合成, 24的合成减少1-位的脱保护、活化等反应步骤, 提高了全程合成收率.之后24在-25 ℃, N-碘代丁二酰亚胺(NIS), TMSOTf存在下, 与受体化合物7偶联得到了双糖产物25(收率90%). 25在Pd[P(C6H5)3]4和NaBH4反应条件下, 同时脱除3位和4位的两个烯丙氧羰基, 较高收率(93%)得到双羟基受体2-O-苄基-α-L-岩藻糖-(1→3)-2, 3-二-O-苯甲酰基-β-L-木糖对甲氧基苯基苷(26).化合物26的岩藻糖部分H-1偶合常数为J=3.4 Hz (δ 4.98), 证明得到的双糖结构糖苷键为α连接.
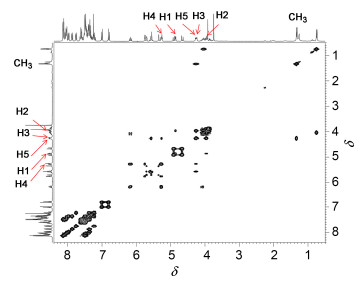
在完成D-鼠李糖糖苷供体5和双糖受体26的合成后, 最后通过[2+1]偶联反应、脱保护步骤获得目标三糖.首先, 在-20 ℃, 路易斯酸TMSOTf催化下, 受体26中岩藻糖基3、4位的两个游离羟基与5偶联, 顺利实现了选择性糖苷化反应, 得到化合物27.反应的选择性可以通过三糖产物27中游离羟基的酰化反应鉴定:在0 ℃, 吡啶作缚酸剂, 二氯甲烷为溶剂, 4-二甲氨基吡啶(DMAP)催化下与苯甲酰氯反应得到苯甲酰产物28.化合物28核磁1H-1H COSY谱图表明(图 2), 由于受到酰基的影响, 岩藻糖的H-4的化学位移处于核磁谱图低场(δ 5.25, 1H, dd), 而岩藻糖的H-3位于核磁谱图中高场(δ 4.26, 1H, dd), 由此确定苯甲酰产物27中新增的苯甲酰基团位于岩藻糖的H-4位置, 间接证明前一步的选择性糖苷化反应中, 化合物5是选择性与双糖受体26中岩藻糖上H-3位置的羟基偶联.由于岩藻糖3-OH处于平伏键位置, 而4-OH羟基为直立键, 一般平伏键位阻比直立键小, 因此3-OH优先参与偶联反应是可以预见的.在氢气和钯碳催化的条件下, 脱除三糖27的苄基(→28), 最后28在饱和甲醇-胺溶液中, 脱除所有酰基即得到目标三糖化合物2.
植物生长调节活性的测定生物活性测定结果表明(表 1), 低温处理严重影响玉米的萌发出苗和幼苗生长, 表现在出苗率、株高和叶面积的大幅下降, 分别降低17.5%, 19.01%和58.46%.合成的三糖(100 mg/L)能显著增加10 ℃低温条件下玉米种子的发芽率, 与空白对照(CK)相比, 100 mg/L浸种处理能提高出苗率11.0%;所合成的三糖能增加低温条件下玉米幼苗株高, 增加叶面积87.8%, 而赤霉酸GA3 50 mg/L所处理的幼苗增加叶面积为49.6%;从玉米幼苗地上部和地上部的鲜、干重结果来看, 合成三糖在提高玉米幼苗鲜重较赤霉素处理效果显著, 尤其表现在对根系的生长, 通过以上数据表明, 该三糖确实具有一定的植物生长调节活性.
 表 1
合成的三糖对低温条件下玉米萌发和出苗的影响a
Table 1.
Effects on the germination and growth of maize under low temperature treated with synthesized trisaccharide
表 1
合成的三糖对低温条件下玉米萌发和出苗的影响a
Table 1.
Effects on the germination and growth of maize under low temperature treated with synthesized trisaccharide
对照 赤霉素GA3(50 mg/L) 三糖(100 mg/L) ST LT ST LT ST LT 出苗率/% 85.5 68.0 87.0 77.5 85.0 79.0 株高/cm 24.27 19.90 28.45 25.08 26.63 22.51 叶面积/cm2 23.69 9.84 24.06 14.72 26.55 18.48 地上部 鲜重/mg 653 361 702 575 787 592 干重/mg 59.8 34.4 60.7 51.2 71.5 52.0 地下部 鲜重/mg 625 348 589 471 713 540 干重/mg 34.2 16.9 28.5 22.4 37.8 30.1 aST为适温处理条件25 ℃; LT为低温处理条件10 ℃. 3 实验部分
3.1 仪器与试剂
质谱采用Bruker Daltonics Bio-TOF-Q Ⅲ型质谱仪(ESIMS)测定; 核磁共振波谱使用Bruker Avance600型核磁共振仪测定, 四甲基硅烷(TMS)为内标物.所有试剂为国产市售分析纯, 无水溶剂按标准方法处理.
3.2 实验方法
3.2.1 2, 3, 4-四-O-苯甲酰基-α-D-鼠李糖对甲氧基苯基苷(13)的合成
α-D-鼠李糖对甲氧基苯基苷(10) (1.5 g, 5.6 mmol), 吡啶(4.4 mL, 55 mmol)溶于50 mL二氯甲烷中, 0 ℃, 氮气保护下, 用滴液漏斗滴加苯甲酰氯(2.8 mL, 10.4 mmol)的二氯甲烷溶液(5 mL), 15 min滴完, 反应3 h.薄层色谱(TLC)检测反应完全后, 加入碎冰淬灭, 转移到分液漏斗中, 用水(50 mL×2)洗涤有机相, 再用饱和食盐水(50 mL×2)洗涤后, 无水硫酸钠干燥.旋干溶剂, 用柱层析分离[V(石油醚):V(乙酸乙酯)=12:1], 得到2.5 g无色油状液体2, 3, 4-四-O-苯甲酰基-α-D-鼠李糖对甲氧基苯基苷(13), 产率77%. [α]D25+15 (c 0.1, CHCl3).1H NMR (CDCl3, 300 MHz) δ: 1.40 (d, J=6.3 Hz, 3H, H-6), 3.84 (s, 3H, OCH3), 4.34~4.40 (m, 1H, H-5), 5.66 (d, J=1.7 Hz, 1H, H-1), 5.79 (t, J=9.9 Hz, 1H, H-4), 5.88 (dd, J=1.85, 3.4 Hz, 1H, H-2), 6.08 (dd, J=3.4, 10.1 Hz, 1H, H-3), 6.88~6.90 (m, 2H, Ar-H), 7.13~7.10 (m, 2H, Ar-H); HRMS (ESI) for C34H30KO14 (M+K)+ 621.1521, found 621.1506.
3.2.2 2, 3-O-异丙叉基-β-D-木糖对甲氧基苯基苷(15)的合成
β-D-木糖对甲氧基苯基苷(14) (5 g, 19.51 mmol), 2-甲氧基丙烯(3.75 mL, 39.02 mmol)溶于150 mL N, N-二甲基酰胺(DMF)中, 0 ℃, 氮气保护下, 加入催化量的DL-樟脑磺酸, 搅拌0.5 h后, 将反应升至常温, 继续反应过夜, TLC检测反应完全后, 加入碎冰淬灭, 转移至分液漏斗中, 用乙酸乙酯(100 mL×2)萃取, 合并有机相, 再用饱和食盐水(100 mL×2)洗涤, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=3:1], 得到3.6 g无色透明液体, 2, 3-O-异丙叉基-β-D-木糖对甲氧基苯基苷(15), 产率62%. [α]D25 -10 (c 0.1, CHCl3); 1H NMR (CDCl3, 300 MHz) δ: 1.48, 1.53 (2s, 6H, C(CH3)2), 3.48 (t, J=9.9 Hz, 1H, H-5b), 3.54 (dd, J=3.0, 9.3 Hz, 1H, H-2), 3.77 (s, 3H, OCH3), 4.00~4.08 (m, 1H, H-5a), 4.12~4.18 (m, 1H, H-3), 5.61 (d, J=3.0 Hz, 1H, H-1), 6.80~6.85 (m, 2H, Ar-H), 7.00~7.04 (m, 2H, Ar-H); HRMS (ESI) for C15H21O6 (M+H)+ 297.3236, found 297.3338.
3.2.3 4-O-乙酰基-2, 3-O-异丙叉基-β-D-木糖对甲氧基苯基苷(15a)的合成
2, 3-O-异丙叉基-β-D-木糖对甲氧基苯基苷(15) (3.6, g 12.2 mmol), 溶于30 mL吡啶中, 0 ℃, 氮气保护下加入15 mL醋酸酐, 反应24 h. TLC检测反应完全后, 加入100 mL甲苯稀释后, 旋干溶剂, 用柱层析分离[V(石油醚):V(乙酸乙酯)=15:1], 得到3.6 g无色油状液体, 4-O-乙酰基-2, 3-O-异丙叉基-β-D-木糖对甲氧基苯基苷(15a), 产率97%. 1H NMR (CDCl3, 300 MHz) δ: 1.49, 1.53 (2s, 6H, C(CH3)2), 2.09 (s, 3H, CH3CO), 3.48 (t, J=9.9 Hz, 1H, H-5b), 3.64 (dd, J=3.0, 9.3 Hz, 1H, H-2), 3.77 (s, 3H, OCH3), 3.95~4.00 (m, 1H, H-5a), 4.31 (t, J=9.7 Hz, 1H, H-3), 5.07~5.16 (m, 1H, H-4), 5.63 (d, J=3.0 Hz, 1H, H-1), 6.81~8.85 (m, 2H, Ar-H), 6.98~7.08 (m, 2H, Ar-H). HRMS (ESI) for C17H23O7 (M+H)+ 339.1403, found 339.1446.
3.2.4 4-O-烯丙氧羰基-2, 3-O-异丙叉基-β-D-木糖对甲氧基苯基苷(16)的合成
2, 3-O-异丙叉基-β-D-木糖对甲氧基苯基苷(15) (3 g, 10.12 mmol), 吡啶(3.2 mL, 40.5 mmol)溶于100 mL二氯甲烷中, 0 ℃, 氮气保护下, 用滴液漏斗滴加氯甲酸烯丙酯(0.74 mL, 12.1 mmol)的二氯甲烷(5 mL)溶液, 15 min滴完, 反应2 h. TLC检测反应完全后, 加入碎冰淬灭, 转移到分液漏斗中, 用水(100 mL×2)洗涤有机相, 再用饱和食盐水(100 mL×2)洗涤后, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=10:1], 得到2.4 g无色油状液体, 4-O-烯丙氧羰基-2, 3-O-异丙叉基-β-D-木糖对甲氧基苯基苷(16), 产率63%. [α]D25+223 (c 0.1, CHCl3); 1H NMR (CDCl3, 300 MHz) δ: 1.49, 1.53 (2s, 6H, C(CH3)2), 3.56 (t, J=10.6 Hz, 1H, H-3), 3.63 (dd, J=2.9, 9.5 Hz, 1H, H-2), 3.78 (s, 3H, OCH3), 4.01 (dd, J=5.4, 11.1 Hz, 1H, H-5a), 4.63 (d, J=5.5 Hz, 2H, OCH2CHCH2), 5.0 (ddd, J=5.5, 9.9, 10.1 Hz, H-4), 5.25~5.39 (m, 2H, OCH2CHCH2), 5.64 (d, J=2.9 Hz, 1H, H-1), 5.83~6.02 (m, 1H, OCH2CHCH2); 13C NMR (CDCl3, 75 MHz) δ: 26.1, 26.5 (C(CH3)2), 55.2 (OCH3), 59.8 (C-5), 68.6 (OCH2CHCH2), 73.2 (C-2), 73.9 (C-3), 75.3 (C-4), 95.7 (C-1), 111.1 (C(CH3)2), 114.0 (Ar-CH), 118.1 (Ar-CH), 118.9 (OCH2CHCH2), 130.8 (OCH2CHCH2), 150.0 (Ar-C), 153.6 (Ar-C), 155.1 (CO). HRMS (ESI) for C19H24NaO8 (M+Na)+ 403.1358, found 403.1365.
3.2.5 4-O-烯丙氧羰基-β-D-木糖对甲氧基苯基苷(17)的合成
4-O-烯丙氧羰基-2, 3-O-异丙叉基-β-D-木糖对甲氧基苯基苷(16) (2 g, 5.25 mmol)溶于25 mL 60%乙酸水溶液中, 用油浴加热至60 ℃, 反应2 h. TLC检测反应完全后, 冷却至室温, 加入150 mL二氯甲烷稀释, 转移到分液漏斗中, 用水(100 mL×2)洗涤有机相, 再用饱和食盐水(100 mL×2)洗涤后, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=1:1], 得到1.7 g浅黄色油状液体, 4-O-烯丙氧羰基-β-D-木糖对甲氧基苯基苷(17), 产率94%. [α]D25+58 (c 0.1, CHCl3). 1H NMR (CDCl3, 300 MHz):δ 3.66~3.73 (m, 1H, H-5b), 3.83 (dd, J=5.8, 10.7 Hz, 1H, H-2), 4.06~4.13 (m, 2H, H-5a, H-3), 4.60~4.63 (m, 2H, OCH2CHCH2), 4.71~4.74 (m, 1H, H-4), 5.23~5.37 (m, 2H, OCH2CHCH2), 5.38 (d, J=3.7 Hz, 1H, H-1), 5.84~5.97 (m, 1H, OCH2-CHCH2), 6.80~6.98 (m, 2H, Ar-H),7.13~7.10 (m, 2H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 55.6 (OCH3), 59.2 (C-5), 68.9 (OCH2CHCH2), 71.9 (C-2), 72.2 (C-3), 74.7 (C-4), 97.9 (C-1), 114.6, 118.1 (Ar-CH), 119.3 (OCH2CH-CH2), 131.2 (OCH2CHCH2), 150.3 (Ar-C), 154.4 (Ar-C), 155.4 (Ar-C); HRMS (ESI) for C16H20NaO8 (M+Na)+ 363.1050, found 363.1041.
3.2.6 4-O-烯丙氧羰基-2, 3-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(18)的合成
4-O-烯丙氧羰基-β-D-木糖对甲氧基苯基苷(17) (1.5 g, 4.4 mmol), 吡啶(4.8 mL, 60 mmol)溶于100 mL二氯甲烷中, 0 ℃, 氮气保护下, 用滴液漏斗滴加苯甲酰氯(1.2 mL, 10.4 mmol)的二氯甲烷(5 mL)溶液, 15 min滴完, 反应2 h. TLC检测反应完全后, 加入碎冰淬灭, 转移到分液漏斗中, 用水(100 mL×2)洗涤有机相, 再用100 mL×2饱和食盐水洗涤后, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=8:1], 得到2.3 g无色油状液体, 4-O-烯丙氧羰基-2, 3-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(18), 产率95%. [α]D25+136 (c 0.1, CHCl3); 1H NMR (CDCl3, 300 MHz) δ: 3.74 (s, 3H, OCH3), 3.95~4.07 (m, 2H, H-5a, H-5b), 4.52~4.54 (m, 2H, OCH2CHCH2), 5.1~5.25 (m, 3H, OCH2CHCH2, H-4), 5.30 (m, 1H, H-2), 5.77 (d, J=3.7 Hz, 1H, H-1), 5.71~5.84 (m, 1H, OCH2CHCH2), 6.18 (t, J=9.9 Hz, 1H, H-3), 6.80~6.98 (2m, 4H, Ar-H), 7.25~8.01 (m, 10H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 56.9 (OCH3), 60.3 (C-5), 70.1 (OCH2CHCH2), 71.3 (C-3), 72.9 (C-2), 73.8 (C-4), 96.9 (C-1), 115.9 (Ar-CH), 119.4 (Ar-CH), 120.3 (OCH2CHCH2), 129.6 (Ar-CH), 129.7 (Ar-CH), 130.6 (Ar-CH), 131.1 (Ar-CH), 131.2, 132.2 (Ar-CH), 134.5, 134.7 (Ar-CH), 151.6 (CO), 155.3, 156.7 (Ar-C), 166.8, 167.1 (CO); HRMS (ESI) for C30H28NaO10: (M+Na)+ 571.1575, found 571.1566.
3.2.7 2, 3-二-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(7)的合成
4-O-烯丙氧羰基-2, 3-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(18) (2 g, 3.5 mmol)溶于30 mL [V(四氢呋喃):V(甲醇)=1:1]混合溶剂中, 0 ℃下依次加入NaBH4 (0.26 g, 7.0 mmol)、Pd[P(C6H5)3]4 (0.4 g, 0.35 mmol)、NaBH4 (0.26 g, 7.0 mmol), 继续反应15 min, TLC检测反应完全后, 加入碎冰淬灭, 40 mL二氯甲烷稀释, 旋出有机溶剂, 转移到分液漏斗中, 用水(50 mL×2)洗涤有机相, 再用饱和食盐水(50 mL×2)洗涤后, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=3:1], 得到1.5 g无色油状液体, 2, 3-二-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(7), 产率93%. [α]D25+26 (c 0.1, CHCl3); 1H NMR (CDCl3, 300 MHz) δ: 3.73 (s, 3H, OCH3), 3.93~3.96 (m, 2H, H-5a, H-5b), 4.09~4.18 (m, 1H, H-4), 5.38 (dd, J=3.6, 10.1 Hz, 1H, H-2), 5.75 (d, J=3.6 Hz, 1H, H-1), 5.91 (t, J=10.1 Hz, 1H, H-3), 6.78~6.82 (m, 2H, Ar-H), 6.90~7.05 (m, 2H, Ar-H), 7.36~8.02 (m, 10H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 55.3 (OCH3), 61.9 (C-5), 69.2 (C-4), 70.7 (C-2), 74.5 (C-3), 95.6 (C-1), 117.4 (Ar-CH), 117.9 (Ar-CH), 128.1 (Ar-CH), 129.6 (Ar-CH), 133.1 (Ar-C), 133.2 (Ar-C), 150.2 (Ar-C), 155.1 (Ar-C); HRMS (ESI) for C26H24NaO8 (M+Na)+ 487.1363, found 487.1357.
3.2.8 3-O-烯丙氧羰基-2-O-苄基-α-L-岩藻糖对甲氧基苯基苷(20)的合成
2-O-苄基-β-L-岩藻糖对甲氧基苯基苷(19) (5 g 13.9 mmol)溶于200 mL无水二氯甲烷中, -25 ℃, 氮气保护下, 用滴液漏斗滴加氯甲酸烯丙酯(0.84 mL, 13.9 mmol)的10 mL二氯甲烷溶液, 20 min滴完, 反应4 h. TLC检测反应完全后, 加入碎冰淬灭, 转移到分液漏斗中, 用水(100 mL×2)洗涤有机相, 再用饱和食盐水(100 mL×2)洗涤后, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=8:1], 得到5.0 g无色油状液体, 3-O-烯丙氧羰基-2-O-苄基-β-L-岩藻糖对甲氧基苯基苷(20), 产率80%. 1H NMR (CDCl3, 300 MHz) δ: 1.23 (d, J=6.6 Hz, 3H), 3.77 (s, 3H, OMe), 4.01~4.06 (m, 2H, H-2, H-4), 4.18 (dd, J=6.5, 13.1 Hz, H-5), 4.52 (d, J=12.2 Hz, 1H, CH2Ph), 4.66~4.69 (m, 2H, CH2CH-CH2), 4.71 (d, J=12.2 Hz, 1H, CH2Ph), 5.31~5.42 (m, 4H, H-1, H-3, CH2CHCH2), 5.91~5.97 (m, 1H, CH2CH-CH2), 6.79~6.85 (m, 2H, Ar-H), 6.96~7.03 (m, 2H, Ar-H), 7.24~7.32 (m, 5H, Ar-H); HRMS (ESI) for C24H28NaO8 (M+Na)+ 467.1676, found 467.1666.
3.2.9 4-O-氯乙酰基-3-O-烯丙氧羰基-2-O-苄基-α-L-岩藻糖对甲氧基苯基苷(21)的合成
3-O-烯丙氧羰基-2-O-苄基-α-L-岩藻糖对甲氧基苯基苷(20) (5 g, 11.24 mmol)溶于75 mL无水二氯甲烷中, 0 ℃, 氮气保护下, 用滴液漏斗滴加氯乙酰氯(0.95 mL, 12 mmol)的3 mL二氯甲烷溶液, 5 min滴完, 反应5 h. TLC检测反应完全后, 加入碎冰淬灭, 转移到分液漏斗中, 用水(50 mL×2)洗涤有机相, 再用饱和食盐水(100 mL×2)洗涤后, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=10:1], 得到4.0 g无色油状液体, 4-O-氯乙酰基-3-O-烯丙氧羰基-2-O-苄基-α-L-岩藻糖对甲氧基苯基苷(21), 产率68%.1H NMR (CDCl3, 300 MHz) δ: 1.12 (d, J=6.6 Hz, 3H), 3.78 (s, 3H, OCH3), 3.96 (dd, J=3.8, 10.6 Hz, H-2), 4.17 (s, 2H, CH2Cl), 4.21~4.37 (m, 1H, H-5), 4.61 (d, J=12.1 Hz, 1H, CH2Ph), 4.65~4.67 (m, 2H, OCH2CHCH2), 4.73~4.77 (d, J=12.1 Hz, 1H, CH2Ph), 5.29~5.49 (m, 4H, H-3, H-4, OCH2CHCH2), 5.48 (d, J=3.3 Hz, 1H, H-1), 6.81~6.85 (m, 2H, Ar-H), 6.95~7.0 (m, 2H, Ar-H), 7.25~7.3 (m, 5H, Ar-H); 13C NMR (75 MHz, CDCl3) δ: 15.9 (CH3), 40.6 (CH2Cl), 55.6 (OCH3), 64.9, 68.9, 73.2, 73.2, 73.3, 73.7, 96.8 (C-1), 114.6, 117.9, 119.0, 127.8, 127.9, 128.4, 131.4, 137.7, 150.9, 154.1, 155.2, 167.1; HRMS (ESI) for C24H28NaO8 (M+Na)+ 467.1682; found 467.1605; HRMS (ESI) for C26H29ClKO9 (M+K)+ 559.1132, found 559.1124.
3.3.10 4-O-氯乙酰基-3-O-烯丙氧羰基-2-O-苄基-α-L-岩藻糖三氯乙酰亚胺酯(8)的合成
4-O-氯乙酰基-3-O-烯丙氧羰基-2-O-苄基-α-L-岩藻糖对甲氧基苯基苷(21) (3.5 g, 6.2 mmol)溶于50 mL乙腈中, 加入12 mL水, 搅拌5 min后继续加入硝酸铈铵(14.5 g, 24.8 mmol), 室温下反应2 h. TLC检测反应完全后, 用100 mL乙酸乙酯稀释反应液, 倒入100 mL 10%硫代硫酸钠水溶液中, 转移至分液漏斗中, 洗涤分液后, 有机相用水(50 mL×2)洗涤有机相, 再用饱和食盐水(50 mL×2)洗涤后, 无水硫酸钠干燥, 溶剂旋干后, 真空干燥3 h后得到2.2 g淡黄色固体, 之后溶于30 mL无水二氯甲烷中, 加入三氯乙腈(1.7 mL, 17 mmol), 氮气保护下, 加入催化量的DBU (1, 8-二氮杂二环十一碳-7-烯), 反应2 h, TLC检测反应完全后, 旋干溶剂, 用柱层析分离[V(石油醚):V(乙酸乙酯)=15:1), 得到2.4 g无色油状液体4-O-氯乙酰基-3-O-烯丙氧羰基-2-O-苄基-α-L-岩藻糖三氯乙酰亚胺酯(8), 产率63%.1H NMR (CDCl3, 300 MHz) δ: 1.18 (d, J=6.6 Hz, 3H), 4.02 (dd, J=3.8, 10.6 Hz, 1H, H-2), 4.16 (s, 3H, OCH3), 4.33~4.40 (m, 1H, H-5), 4.62~4.64 (m, 2H, CH2Ph), 4.68 (s, 2H, CH2Cl), 5.24~5.39 (m, 3H, H-3, OCH2CHCH2), 5.51~5.2 (m, 1H, H-4), 5.84~5.96 (m, 1H, OCH2CHCH2), 6.49 (d, J=3.6 Hz, H-1), 7.29~7.33 (m, 5H, Ar-H), 8.61 (s, 1H, NHCCCl3); HRMS (ESI) for C21H23Cl4NNaO8 (M+Na)+ 580.0075, found 580.0106.
3.3.11 2-O-苄基-3, 4-O-二-烯丙氧羰基-β-L-岩藻糖乙硫基苷(24)的合成
2-O-苄基-β-L-岩藻糖乙硫基苷(23) (2.0 g, 6.71 mmol), 吡啶(5.3 mL, 67.1 mmol)溶于100 mL二氯甲烷中, 0 ℃, 氮气保护下, 用滴液漏斗滴加氯甲酸烯丙酯(1.02 mL, 16.8 mmol)的二氯甲烷(5 mL)溶液, 15 min滴完, 反应2 h. TLC检测反应完全后, 加入碎冰淬灭, 转移到分液漏斗中, 用水(100 mL×2)洗涤有机相, 再用饱和食盐水(100 mL×2)洗涤后, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=4:1], 得到2.7 g浅黄色油状液体, 2-O-苄基-3, 4-二-O烯丙氧羰基-β-L-岩藻糖乙基苷(24)产率86%. [α]D25-132.4 (c 0.1, CHCl3); 1H NMR (CDCl3, 300 MHz) δ: 1.28 (t, J=7.4 Hz, 3H, SCH2CH3), 1.31 (d, J=6.6 Hz, 3H, H-6), 2.67~2.80 (m, 2H, SCH2CH3), 3.73 (t, J=9.8 Hz, 1H, H-2), 3.69~3.81 (m, 1H, H-5), 4.46 (d, J=9.8 Hz, 1H, H-1), 4.65 (d, J=11.4 Hz, 1H, CH2Ph), 4.61~4.63 (m, 2H, OCH2CHCH2), 4.63~4.67 (m, 2H, OCH2CH-CH2), 4.86 (d, J=11.4 Hz, 1H, CH2Ph), 4.85~4.89 (m, 1H, H-3), 5.16 (d, J=4.1 Hz, 1H, H-4), 5.25~5.30 (m, 2H, OCH2CHCH2), 5.35~5.41 (m, 2H, OCH2CHCH2), 5.85~6.01 (m, 2H, OCH2CHCH2), 7.25~7.37 (m, 5H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 14.6 (SCH2CH3), 16.1 (C-6), 24.5 (SCH2CH3), 68.6 (OCH2CHCH2), 74.4 (C-5), 75.3 (C-4), 75.4(CH2Ph), 75.6 (C-3), 78.2 (C-2), 84.6 (C-1), 118.5 (OCH2CHCH2), 118.5 (OCH2CHCH2), 127.4, 121.5, 121.7, 121.9, 131.0 (OCH2CHCH2), 131.1 (OCH2CHCH2), 137.4 (Ar-C), 153.8 (CO), 154.8 (CO), 127.4 (Ar-C); HRMS (ESI) for C23H34NO8S: (M+NH4)+ 538.1838, found 538.1825.
3.3.12 2-O-苄基-3, 4-二-O-烯丙氧羰基-α-L-岩藻糖苷-(1→4)-2, 3-二-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(25)的合成
岩藻糖供体24 (1 g, 2.1 mmol)、木糖受体7 (1.06 g, 2.3 mmol)、N-碘代丁二酰亚胺(0.36 g, 3.4 mmol)和分子筛溶于30 mL无水二氯甲烷中, 0 ℃, 氮气保护下搅拌30 min, 将反应降温至-25 ℃, 加入10 μL三氟甲基磺酸三甲基硅酯(TMSOTf), 继续反应3 h, TLC检测反应完全后, 0℃下加入30 mL饱和硫代硫酸钠水溶液淬灭, 转移到分液漏斗中, 加入20 mL二氯甲烷稀释, 用水(50 mL×2)洗涤有机相, 再用饱和食盐水(50 mL×2)洗涤后, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=3:1], 得到1.8 g无色油状液体, 2-O-苄基-3, 4-二-O-烯丙氧羰基-α-L-岩藻糖苷-(1→4)-2, 3-二-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(25), 产率90%. [α]D25+17 (c 0.1, CHCl3); 1H NMR (CDCl3, 300 MHz) δ: 0.83 (d, J=6.5 Hz, 3H, H-6), 3.87 (s, 3H, OCH3), 3.90~3.94 (m, 2H, Hx-5a, Hx-5b), 4.01~4.17 (m, 3H, Hf-2, Hf-5, Hx-4), 4.62 (d, J=12.0 Hz, 1H, CH2Ph), 4.69 (d, J=5.6 Hz, 2H, OCH2CHCH2), 4.74 (d, J=5.6 Hz, 2H, OCH2CHCH2), 4.86 (d, J=12.0 Hz, 1H, CH2Ph), 4.91 (d, J=3.6 Hz, 1H, Hf-1), 5.04~5.05 (m, 1H, Hf-4), 5.16 (dd, J=3.2, 10.5 Hz, 1H, Hf-3), 5.37~5.43 (m, 2H, OCH2CHCH2), 5.43~5.49 (m, 2H, OCH2CHCH2), 5.38 (dd, J=3.6, 10.3 Hz, 1H, Hx-2), 5.91~6.07 (2m, 2H, OCH2CHCH2), 5.83 (d, J=3.6 Hz, 1H, Hx-1), 6.24 (t, J=9.7 Hz, 1H, Hx-3), 6.92~7.10 (2m, 4H, Ar-H), 7.34~8.12 (m, 15H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 15.3 (C-6), 55.4 (OCH3), 68.5, 68.6 (OCH2CHCH2), 59.9, 64.9, 70.9, 71.7, 73.4, 73.7, 73.9, 75.0, 75.5, 95.5 (Cx-1), 98.2 (Cf-1), 114.5 (Ar-CH), 118.1 (Ar-CH), 118.6 (Ar-CH), 127.6, 127.8, 131.4, 131.4, 132.9 (OCH2CHCH2), 133.2 (OCH2CHCH2), 137.9 (Ar-C), 153.8 (CO), 154.7 (CO), 150.1 (Ar-C), 155.2 (Ar-C), 165.3 (CO), 165.8 (CO); HRMS (ESI) for C47H48NaO16 (M+Na)+ 891.2835, found 891.2837.
3.3.13 2-O-苄基-α-L-岩藻糖苷-(1→4)-2, 3-二-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(26)的合成
化合物25 (1.7 g, 1.96 mmol)溶于20 mL [V(四氢呋喃):V(甲醇)=1:1]混合溶剂中, 0 ℃下依次加入NaBH4 (0.15 g 4.0 mmol)、Pd[P(C6H5)3]4 (0.22 g 0.0.196 mmol)、NaBH4 (0.15 g, 4.0 mmol), 反应15 min, TLC检测反应完全后, 加入碎冰淬灭, 旋出有机溶剂, 转移到分液漏斗中, 二氯甲烷(30 mL)稀释, 用水(25 mL×2)洗涤有机相, 再用饱和食盐水(30 mL×2)洗涤后, 无水硫酸钠干燥.溶剂旋干后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=1:1], 得到1.5 g无色油状液体, 2-O-苄基-α-L-岩藻糖苷-(1→4)-2, 3-二-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(26), 产率93%. [α]D25+60 (c 0.1, CHCl3).1H NMR (CDCl3, 300 MHz) δ: 0.98 (d, J=6.6 Hz, 3H, Hf-6), 3.55 (s, 1H, Hf-4), 3.75 (dd, J=9.9, 3.4 Hz, 1H, Hf-3), 3.87 (s, 1H, OCH3), 3.89~3.91 (m, 2H, Hf-2, Hf-5), 3.95~4.02 (m, 2H, Hx-5a, Hx-5b), 4.17~4.25 (m, 1H, Hx-4), 4.68, 4.75 (2d, J=12 Hz, 2H, CH2Ph), 4.98 (d, J=3.4 Hz, 1H, Hf-1), 5.36 (dd, J=3.6, 10.2 Hz, 1H, Hx-2), 5.86 (d, J=3.6 Hz, 1H, Hx-1), 6.25 (t, J=9.8 Hz, 1H, Hx-3), 6.91~6.95 (m, 2H, Ar-H), 7.08~7.15 (m, 2H, Ar-H), 7.38~7.64 (m, 9H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 15.4 (Cf-6), 55.5 (OCH3), 59.6, 65.9, 68.8, 70.8, 71.2, 71.7, 72.9, 73.2, 76.2 (CH2Ph), 95.61 (Cx-1), 95.92 (Cf-1), 114.49 (Ar-CH), 117.97 (Ar-CH), 118.10 (Ar-CH), 127.92, 128.02, 128.24, 128.51, 129.4, 129.5, 129.7, 133.1 (Ar-C), 133.2 (Ar-C), 137.8 (Ar-C), 150.1 (Ar-C), 155.2 (Ar-C), 165.4 (CO), 165.8 (CO); HRMS (ESI) for C39H40NaO12 (M+Na)+ 723.2412, found 723.2414.
3.3.14 2, 3, 4-三-O-苯甲酰基-α-D-鼠李糖苷-(1→3)-2-O-苄基-α-L-岩藻糖苷-(1→4)-2, 3-二-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(27)的合成
化合物26(1 g, 1.43 mmol), 化合物5 (0.93 g 1.5 mmol)和分子筛溶于30 mL无水二氯甲烷中, -25 ℃, 氮气保护下加入10 μL三氟甲基磺酸三甲基硅酯(TMSOTf), 继续在该温度下搅拌4 h, TLC检测反应完全后, 加入1滴三乙胺淬灭反应, 抽滤除去分子筛, 旋干溶剂, 用柱层析分离[V(石油醚):V(甲苯):V(乙酸乙酯)=3:1:1], 得到1.0 g无色油状液体, 即2, 3, 4-三-O-苯甲酰基-α-D-鼠李糖苷-(1→3)-2-O-苄基-α-L-岩藻糖苷-(1→4)-2, 3-二-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(27), 产率55%. [α]D25 -179 (c 0.1, CHCl3).1H NMR (CDCl3, 300 MHz) δ: 0.8 (d, J=6.5 Hz, 3H, Hf-6), 1.25 (d, J=6.2 Hz, 3H, Hr-6), 3.62~3.67 (m, 1H, Hf-4), 3.86 (s, 3H, OCH3), 3.90~3.99 (m, 4H, Hx-4, Hx-5a, Hx-5B, Hf-2), 4.13~4.17 (m, 2H, Hf-3, Hf-5), 4.20~4.30 (m, 1H, Hr-5), 4.70 (d, J=11.94 Hz, 1H, CH2Ph), 4.85 (d, J=3.5 Hz, 1H, Hf-1), 4.95 (d, J=11.9 Hz, 1H, CH2Ph), 5.35 (dd, J=3.6, 10.6 Hz, 1H, Hx-2), 5.54 (s, 1H, Hr-1), 5.77 (t, J=9.9 Hz, 1H, Hr-4), 5.84 (d, J=3.6 Hz, 1H, Hx-1), 5.89~5.92 (m, 2H, Hr-2, Hr-3), 6.24 (t, J=9.8 Hz, 1H, Hx-3), 6.89~6.94 (m, 2H, Ar-H), 7.09~7.12 (m, 2H, Ar-H), 7.35~8.20 (m, 30H, Ar-H); 13C NMR (CDCl3, 75 MHz) δ: 16.7 (CH3), 18.9 (CH3), 56.8 (OCH3), 67.4, 68.6, 71.2, 71.7, 72.4, 72.9, 73.2, 73.3, 75.2, 75.6, 77.8, 95.9 (Cx-1), 98.7 (Cf-1), 100.4 (Cr-1), 115.9 (Ar-CH), 119.5 (Ar-CH), 129.3, 129.5, 129.6, 129.6, 129.8, 129.8, 130.2, 130.4, 130.5, 130.7, 130.9, 130.9, 130.9, 131.2, 134.4, 134.6, 134.6, 139.2 (Ar-C), 151.7 (Ar-C), 156.6 (Ar-C), 166.5 (CO), 166.8 (CO), 166.8 (CO), 166.9 (CO) 167.2 (CO); HRMS (ESI) for C66H62NaO19 (M+Na)+ 1181.3777, found 1181.3778.
3.3.15 2, 3, 4-三-O-苯甲酰基-α-D-鼠李糖苷-(1→3)-2-O-苄基-4-O-苯甲酰基-α-L-岩藻糖苷-(1→4)-2, 3-二-O-苯甲酰基-β-D-木糖对甲氧基苯基苷(28)的合成
化合物27(1.0 g, 0.72 mmol)吡啶(0.6 mL, 7.2 mmol)溶于20 mL二氯甲烷中, 0 ℃, 氮气保护下, 加入苯甲酰氯(0.34 mL, 2.88 mmol), 反应3 h. TLC检测反应完全后, 用柱层析分离[V(石油醚):V(乙酸乙酯)=2:1), 得到1.0 g无色油状液体即化合物28, 产率90%. [α]D25-256 (c 0.1, CHCl3).1H NMR (CDCl3, 300 MHz) δ: 0.74 (d, J=6.5 Hz, 3H, Hf-6), 1.32 (d, J=6.2 Hz, 3H, Hr-6), 3.75 (s, 3H, OCH3), 3.81~3.84 (m, 1H, Hx-4), 3.92~4.05 (m, 4H, Hf-2, Hx-5a, Hx-5b, Hf-5), 4.23~4.27 (m, 2H, Hf-3, Hr-5), 4.65 (d, J=10.8 Hz, 1H, CH2Ph), 4.85 (d, J=3.5 Hz, 1H, Hf-1), 4.90 (d, J=10.8 Hz, 1H, CH2Ph), 5.25 (t, J=3.4 Hz, 1H, Hf-4), 5.26 (dd, J=3.6, 8.2 Hz, 1H, Hx-2), 5.34 (d, J=1.5 Hz, 1H, Hr-1), 5.51~5.61 (m, 2H, Hr-2, Hr-4), 5.69 (m, 1H, Hx-3), 5.74 (d, J=3.6 Hz, 1H, Hx-1), 6.17 (t, J=9.8 Hz, 1H, Hr-3), 6.78~6.82 (m, 2H, Ar-H), 6.97~7.03 (m, 2H, Ar-H), 7.2~8.14 (m, 35H, Ar-H); 13C NMR (CDCl3, 75 MHz)δ: 15.6 (Cf-6), 17.5 (Cr-6), 51.9, 55.5 (OCH3), 59.8, 65.7, 66.9, 69.7, 70.2, 70.9, 71.5, 71.7, 73.6, 73.8, 74.4, 74.8, 75.5, 77.0, 95.5 (Cf-1), 97.8 (Cr-1), 99.1 (Cx-1), 114.5 (Ar-CH), 118.1 (Ar-CH), 127.9~133.3 (Ar-CH), 137.7 (Ar-C), 150.2 (Ar-C), 155.2 (Ar-C), 164.9 (CO), 165.1 (CO), 165.4 (CO), 165.5 (CO), 165.8 (CO), 166.4 (CO). HRMS (ESI) for C73H66NaO20 (M+Na)+ 1285.4040, found 1285.4038.
3.3.16 α-D-鼠李糖苷-(1→3)-α-L-岩藻糖苷-(1→4)-β-D-木糖对甲氧基苯基苷(2)的合成
化合物28 (1 g, 0.72 mmol)溶于50 mL甲醇中, 加入钯/碳(10%), 氢气加压下反应2 d, TLC检测反应完全后, 旋干溶剂, 加入甲醇胺溶液(40%)反应5 d后, 直接旋干溶剂[V(甲醇):V(石油醚)=1:10]条件下析出0.36 g化合物2, 产率70%.1H NMR (CDCl3, 300 MHz) δ: 1.20 (d, J=6.5 Hz, 3H, Hf-6), 1.24 (d, J=6.2 Hz, 3H, Hr-6), 4.84 (Hf-1), 5.05 (d, J=1.5 Hz, 1H, Hr-1), 5.31 (d, J=3.6 Hz, 1H, Hx-1), 6.80~6.84 (m, 2H, Ar-H), 6.99~7.05 (m, 2H, Ar-H); 13C NMR (CDCl3, 75 MHz)δ: 14.9 (Cf-6), 16.4 (Cr-6), 97.1 (Cf-1), 98.1 (Cr-1), 101.6 (Cx-1), 113.9 (Ar-CH), 117.7 (Ar-CH), 150.6 (Ar-C), 154.9 (Ar-C); HRMS (ESI) for C24H36NaO14 (M+Na)+ 571.1997, found 571.2003.
3.3 植物生长调节活性
试验材料为先玉335玉米种子, 采用砂培培养.种子经1%次氯酸钠溶液消毒10 min, 蒸馏水冲洗干净并用吸水纸吸干.室温下用100 mg/L三糖的水溶液浸种24 h, 设50 mg/L赤霉素和清水为对照.砂培发芽床为标准发芽盒(19 cm×13 cm×12 cm), 装入洗净并经高温烘干的细砂3~4 cm, 每盒点播50粒种子, 种胚朝上, 盖1~2 cm厚湿砂, 4次重复.控制试验期间砂床含水量为饱和含水量的65%(试验用砂饱和含水量为25%).播种后将发芽盒置入400 mmol·m-2·s-1, 光周期为12/12 h(光/暗)的光照培养箱中, 控制温度为10 ℃, 对照温度为25 ℃.两种温度条件下都培养至不再出苗为止, 统计每天出苗数计算调查出苗率.在室温条件下培养至2叶1心期, 调查株高、叶面积、地上部和地下部的干鲜重(表 1).
辅助材料(Supporting Information) 所合成化合物的1H NMR和13C NMR图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)下载.
-
-
[1]
Truchet, G.; Roche, P.; Lerouge, P.; Vasse, J.; Camut, S.; De Billy, F.; Prome, J. C.; Denarie, J. Nature 1991, 86, 670.
-
[2]
Long, S. R. Plant Cell 1996, 8, 1885. doi: 10.1105/tpc.8.10.1885
-
[3]
Fedonenko, Y. P.; Egorenkova, I. V.; Konnova, S. A.; Ignatov, V. V. Microbiology 2001, 70, 329. doi: 10.1023/A%3A1010411629428
-
[4]
Jofre, E.; Lagares, A.; Mori, G. FEMS Microbiol. Lett. 2004, 231, 267. doi: 10.1016/S0378-1097(04)00003-5
-
[5]
Wang, Y.; Hollingsworth, R. I. Carbohydr. Res. 1994, 260, 305. doi: 10.1016/0008-6215(94)84048-2
-
[6]
Russa, R.; Bruneteau, M.; Shashkov, A. S.; Urbanik-Sypniewska, T.; Mayer, H. Arch. Microbiol. 1996, 165, 26. doi: 10.1007/s002030050292
-
[7]
Learemans, T.; Vanderleyden, J. World J. Microbiol. Biotechnol. 1998, 14, 787. doi: 10.1023/A:1008830809457
-
[8]
Forsberg, L. S.; Carlson, R. W. J. Biol. Chem. 1998, 273, 2747. doi: 10.1074/jbc.273.5.2747
-
[9]
Zabotina, O. A.; Gurjanov, O. P.; Ibragimova, N. N.; Ayupova, D. A.; Lozovaya, V. V Plant Sci. 1998, 135, 195. doi: 10.1016/S0168-9452(98)00022-3
-
[10]
Zhang, J.; Kong, F. J. Carbohydr. Chem.2002, 21, 579. doi: 10.1081/CAR-120016856
-
[11]
Liu, H.; Cheng, S.; Liu, J.; Du, Y.; Bai, Z. J. Agric. Food Chem. 2008, 56, 5634. doi: 10.1021/jf800326r
-
[12]
Tarrand, J. J.; Krieg, N. R.; Dobereiner, J. Can. J. Microbiol. 1978, 24, 967. doi: 10.1139/m78-160
-
[13]
Michiels, K.; Croes, C.; Vanderleyden, J. J. Gen. Microbiol. 1991, 137, 2241. doi: 10.1099/00221287-137-9-2241
-
[14]
Lerner, A.; Castro-Sowinski, S.; Valverde, A.; Lerner, H.; Dror, R.; Okon, Y.; Burdman, S. Microbiol-Sgm. 2009, 155, 4058. doi: 10.1099/mic.0.031807-0
-
[15]
Van Puyvelde, S; Cloots, L; Engelen; K. Microb. Ecol. 2011, 61, 723. doi: 10.1007/s00248-011-9819-6
-
[16]
Zong, G.; Feng, Y.; Liang, X.; Chen, L.; Zhang, J.; Wang, D. Carbohydr. Res. 2010, 345, 2067. doi: 10.1016/j.carres.2010.07.023
-
[17]
Sigida, E. N.; Fedonenko, Y. P.; Shashkov, A. S.; Zdorovenko, E. L.; Konnova, S. A.; Ignatov, V. V.; Knirel, Y. A. Carbohydr. Res. 2013, 380, 76. doi: 10.1016/j.carres.2013.07.013
-
[18]
Zunk, M.; Kiefel, M. J. Tetrahedron Lett. 2011, 52, 1296. doi: 10.1016/j.tetlet.2011.01.064
-
[19]
(a) Jiang, R.; Zong, G.; Liang, X.; Jin, S.; Zhang, J.; Wang, D. Molecules 2014, 19, 6683. doi: 10.3390/molecules19056683
-
[20]
王家尧, 姜锐, 梁晓梅, 王道全, 张建军, 有机化学, 2007, 37, 375. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345788.shtmlWang, J. Y.; Jiang, R.; Liang, X. M.; Wang, D. Q.; Zhang, J. J. Chin. J. Org. Chem. 2017, 37, 375(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345788.shtml
-
[21]
姜锐, 梁晓梅, 孙晋, 张建军, 王道全, 有机化学, 2014, 34, 926. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344252.shtmlJiang, R.; Liang, X. M.; Sun, J.; Zhang, J. J.; Wang, D. Q. Chin. J. Org. Chem. 2014, 34, 926(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344252.shtml
-
[22]
Zong, G.; Yu, N.; Xu, Y.; Zhang, J.; Wang, D.; Liang, X. Synthesis-Stuttgart 2010, 10, 1666. doi: 10.1002/chin.201032201/full
-
[23]
Ishiwata, A.; Sakurai, A.; Nishimiya, Y.; Tsuda, S.; Ito, Y. J. Am. Chem. Soc. 2011, 133, 19524. doi: 10.1021/ja208528c
-
[24]
Helm, R. F.; Ralph, J.; Anderson, L. J. Org. Chem. 1991, 56, 7015. doi: 10.1021/jo00025a013
-
[25]
Zong, G. H.; Yan, S. Q.; Mei, X.; Liang, J.; Zhang, J.; Quan, D.; Fan, W.; Kong, Z. Chin. Chem. Lett. 2009, 20, 127. doi: 10.1016/j.cclet.2008.11.002
-
[26]
Morishima, N.; Koto, S.; Kusuhara, C.; Zen, S. Bull. Chem. Soc. Jpn. 1982, 55, 631. doi: 10.1246/bcsj.55.631
-
[27]
Mandal, P. K.; Dhara, D.; Misra, A. K. Synthesis-Stuttgart 2014, 46, 1947. doi: 10.1055/s-00000084
-
[28]
Patro, B.; Schmidt, R. R. Synthesis-Stuttgart 1998, 12, 1731. doi: 10.1055/s-1998-4503
-
[1]
-
图式 3 D-鼠李糖供体5的合成
Scheme 3 Synthesis of D-rhamnose donor 5
Reaction conditions: (a) I2, Ph3P, imidazole, THF, 65 ℃, 2 h, 93%; (b) H2, Pd/C, Trolamine, MeOH, 70%; (c) BzCl, pyridine, CH2Cl2, 0 ℃, 6 h, 77%; (d) (1) (NH4)2, Ce(NO3)6, MeCN/H2O (V: V=4: 1), r.t., 2.5 h, 70%; (2) CCl3CN, DBU, CH2Cl2, 1.5 h, 0 ℃, 90%
图式 4 D-木糖受体7的合成
Scheme 4 Synthesis of D-xylose receptor 7
Reaction conditions: (a) 2-methoxypropene, camphorsulfonic acid, DMF, r.t., 8 h, 62%; (b) acetic anhydride, pyridine, r.t., 12 h, 97%; (c) allyl chloroformate, pyridine, CH2Cl2, 0℃, 8 h, 94%; (d) 60% AcOH/H2O, 2.5 h, 60 oC, 94%; (e) BzCl, pyridine, CH2Cl2, 0℃, 6 h, 95%; (f) Pd[P(C6H5)3]4, NaBH4, THF/MeOH (V: V=1: 1), 0 ℃, 10 min, 93%
图式 5 岩藻糖供体及三糖的合成
Scheme 5 Synthesis of fucose donor and trisaccharide
Reaction conditions: (a) allyl chloroformate, pyridine, CH2Cl2, -25 ℃, 5 h, 80%; (b) (ⅰ) (NH4)2Ce(NO3)6, MeCN/H2O (V: V = 4: 1), r.t., 2.5 h; (ⅱ) CCl3CN, DBU, CH2Cl2, 1.5 h, 0 ℃, 63%; (c) TMSOTf, N2, CH2Cl2, 0 ℃, 36 h; (d) Pd[P(C6H5)3]4, NaBH4, THF/MeOH (V: V = 1: 1), 0 ℃, 10 min; (e) Chloroacetyl chloride, pyridine, CH2Cl2, 0℃, 5 h, 68%; (f) allyl chloroformate, pyridine, CH2Cl2, 0℃, 5 h, 86%; (g) NIS, TMSOTf, N2, CH2Cl2, -25 ℃, 2 h, 90%; (h) Pd[P(C6H5)3]4, NaBH4, THF/MeOH (V: V = 1: 1), 0 ℃, 10 min, 93%; (i) TMSOTf, N2, CH2Cl2, 0 ℃, 4 h, 55%; (j) BzCl, pyridine, CH2Cl2, 0℃, 8 h, 90%; (k) H2 ,Pd/C, MeOH; (l) MeONH4, MeOH, 5 d, 70%
表 1 合成的三糖对低温条件下玉米萌发和出苗的影响a
Table 1. Effects on the germination and growth of maize under low temperature treated with synthesized trisaccharide
对照 赤霉素GA3(50 mg/L) 三糖(100 mg/L) ST LT ST LT ST LT 出苗率/% 85.5 68.0 87.0 77.5 85.0 79.0 株高/cm 24.27 19.90 28.45 25.08 26.63 22.51 叶面积/cm2 23.69 9.84 24.06 14.72 26.55 18.48 地上部 鲜重/mg 653 361 702 575 787 592 干重/mg 59.8 34.4 60.7 51.2 71.5 52.0 地下部 鲜重/mg 625 348 589 471 713 540 干重/mg 34.2 16.9 28.5 22.4 37.8 30.1 aST为适温处理条件25 ℃; LT为低温处理条件10 ℃. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 9
- 文章访问数: 2884
- HTML全文浏览量: 157


 下载:
下载:






 下载:
下载:

