 图式 1
Hoveyda课题组报道的氮杂环卡宾催化α, β-不饱和羰基化合物的不对称硼化反应机理
Scheme1.
Mechanism reported by Hoveyda's group for NHC-catalyzed asymmetric boration of α, β-unsaturated carbonyl compound
图式 1
Hoveyda课题组报道的氮杂环卡宾催化α, β-不饱和羰基化合物的不对称硼化反应机理
Scheme1.
Mechanism reported by Hoveyda's group for NHC-catalyzed asymmetric boration of α, β-unsaturated carbonyl compound

Citation: Ye Meng, Shen Panpan, Duan Wenzeng, Song Chun, Ma Yudao. Asymmetric Boration of Chalcones Catalyzed by Bifunctional[2.2]Paracyclophane-Based N-Heterocyclic Carbene[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2919-2928. doi: 10.6023/cjoc201706035

双功能[2.2]对环蕃基氮杂环卡宾催化查尔酮的不对称硼化反应的研究
English
Asymmetric Boration of Chalcones Catalyzed by Bifunctional[2.2]Paracyclophane-Based N-Heterocyclic Carbene
-
Key words:
- organocatalysis
- / asymmetric catalysis
- / carbenes
- / boron compounds
- / [2.2]paracyclophane
-
非过渡金属催化的不对称反应对于现代合成化学的发展有着重要的作用, 这种催化方式即使在那些金属催化的经典反应中也有优异的表现, 而且这两种反应类型在反应活性和对映选择性方面常常是互补的.由于有机硼化合物中的C—B键, 可以通过氧化反应、胺化反应、亲电取代反应或者是Suzuki偶联反应等方式转化成C—O、C—N和C—C键[1], 而且具有光学活性的硼化合物在转化的过程中, 能够保持绝对构型不变, 因此, 手性有机硼化合物的合成在有机合成领域占据着重要的地位[2].近年来, 为了合成这类有机硼化合物, 科研工作者们尝试了很多种方法[3].一般获得此类有机硼化合物最直接的方法就是利用过渡金属催化二硼试剂[4]、联硼酸频哪醇酯[5]、硼氢化物[6]对不饱和化合物的不对称共轭硼加成反应.已报道的有铑[7]、铂[8]、铜[9]和镍[10]等过渡金属配合物催化的联硼酸频哪醇酯对不饱和化合物的不对称硼加成反应, 并且都取得了不错的产率和对映选择性.但目前有机硼化学领域所面临的一个重要挑战是如何实现非过渡金属催化的不对称硼加成反应的高收率、高对映选择性[11]. Hoveyda课题组首次报道了卡宾催化环状和非环状的α, β-不饱和羰基化合物的不对称硼加成反应, 但查尔酮作为反应物时的对映选择性只达到87%[12].随后, Fernández课题组[13]报道了手性膦催化α, β-不饱和酯或酮的不对称硼加成反应, 但底物范围并不包括查尔酮类化合物.现有的研究结果表明, 非过渡金属催化的不对称硼加成反应的底物范围、收率和对映选择性仍不能令人满意, 还需要在配体设计、反应条件优化等方面进行深入细致的研究.
[2.2]对环蕃是两个苯环的对位通过亚乙基桥联构成的一种环状结构的分子, 由于两个苯环的电子效应可以通过空间传递——跨环电子效应, 所以, 它具有独特的电子效应和化学性质[14].作为一种面手性源, [2.2]对环蕃基化合物还具有高刚性、高稳定性以及易构建手性环境的特点, 这些特点使得面手性的[2.2]对环蕃衍生物吸引了许多化学家的注意[15].尤其是我国化学家侯雪龙、戴立信、姜标等在面手性[2.2]对环蕃衍生物的应用研究领域做了许多开创性的研究工作[15a~15f].近年来, 我们课题组[16]报道了由[2.2]对环蕃衍生的手性氮杂环卡宾(NHC)铜催化的α, β-不饱和羰基化合物的不对称硼加成反应, 发现含醇羟基的双功能[2.2]对环蕃基三氮唑卡宾铜在催化不饱和噁唑烷酮的不对称硼加成反应中, 取得了非常好的收率(99%)和对映选择性(97%~99%)[16b].随后, 我们[16d]发现双手性的[2.2]对环蕃基三氮唑卡宾也可以催化查尔酮的不对称硼加成反应, 但是, 仅取得了中等的收率和对映选择性.鉴于非过渡金属催化查尔酮类化合物的不对称硼加成反应的研究现状, 如何设计、合成手性氮杂环卡宾前驱体以提高有机催化查尔酮类化合物的不对称硼加成反应的收率和对映选择性是目前亟待解决的一个科学问题.
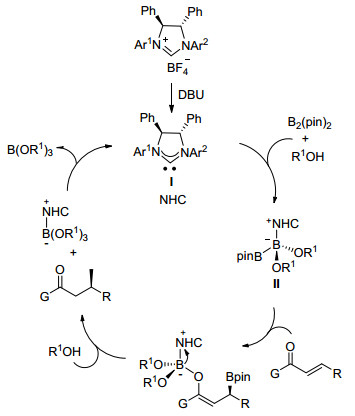
Hoveyda课题组[17]最近报道了利用手性咪唑啉盐衍生的氮杂环卡宾所催化的不对称硼加成反应的详细机理.机理研究表明, 氮杂环卡宾催化不对称硼加成反应必须是氮杂环卡宾与甲醇活化的硼试剂首先形成配合物Ⅱ, 配合物Ⅱ会促进Bpin对不饱和羰基化合物的不对称加成反应(Scheme 1).
 图式 1
Hoveyda课题组报道的氮杂环卡宾催化α, β-不饱和羰基化合物的不对称硼化反应机理
Scheme1.
Mechanism reported by Hoveyda's group for NHC-catalyzed asymmetric boration of α, β-unsaturated carbonyl compound
图式 1
Hoveyda课题组报道的氮杂环卡宾催化α, β-不饱和羰基化合物的不对称硼化反应机理
Scheme1.
Mechanism reported by Hoveyda's group for NHC-catalyzed asymmetric boration of α, β-unsaturated carbonyl compound
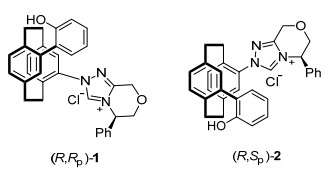
基于上述确定的催化机理, 我们设计了[2.2]对环蕃基双功能三氮唑卡宾前驱体(R, Rp)-1和(R, Sp)-2(图 1).我们设想, 这种双功能三氮唑卡宾在催化过程中能够利用自身的羟基氧原子和卡宾碳原子这两个活性位点和联硼酸频哪醇酯中具有路易斯酸性质的硼原子配位, 既限制连接卡宾和[2.2]对环蕃基骨架的C—N单键的自由旋转, 又固定苯酚取代基而形成具有更有效、更稳定手性环境的中间体配合物Ⅱ, 从而达到更好地控制硼化产物立体选择性的目的(Eq. 1).同时, 期望通过酚氧基和卡宾的协同活化硼试剂作用达到提高催化活性, 最终实现卡宾催化不对称硼化反应的高收率、高对映选择性的目标.
1 结果与讨论
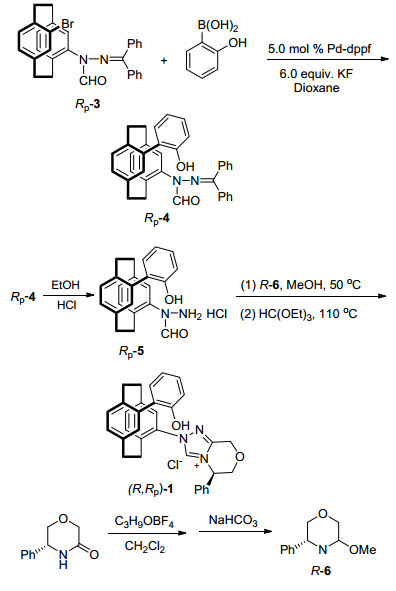
为了更好地了解所设计的[2.2]对环蕃基双功能三氮唑卡宾的催化效果, 我们准备在后续的催化反应中比较一些已知的手性三氮唑卡宾前驱体.在已有的手性[2.2]对环蕃基三氮唑卡宾前驱体合成工作的基础上, 我们合成了两种新型含酚羟基的[2.2]对环蕃基手性三氮唑卡宾前驱体(R, Rp)-1和(R, Sp)-2 (Scheme 2).以光学纯的4-溴-12-(N-甲酰基二苯酮腙基)[2.2]对环蕃[(Rp)-3]为原料[18], 经钯催化的Suzuki偶联反应得到4-(2-羟基苯基)-12-(N-甲酰基二苯酮腙基)[2.2]对环蕃[(Rp)-4]. (Rp)-4在四氢呋喃中酸解就能够得到光学纯的4-(2-羟基苯基)-12-(N-甲酰肼基)[2.2]对环蕃盐酸盐[(Rp)-5].另一方面, 光学纯的(R)-苯基吗啉酮和三甲基氧鎓氟硼酸盐在无水二氯甲烷为溶剂的条件下反应过夜, 再用碳酸氢钠中和可以得到亚胺醚R-6[19].未经纯化的甲酰基肼盐(Rp)-5先与亚胺醚在甲醇中50 ℃反应1 h得到中间产物, 再和原甲酸三乙酯在110 ℃反应30 min, 最终得到目标产物—含酚羟基双手性三氮唑盐酸盐(R, Rp)-1.采用与(R, Rp)-1相同的合成步骤, 以光学纯的4-溴-12-(N-甲酰基二苯酮腙基)[2.2]对环蕃[(Sp)-3]为原料, 同样可以合成(R, Rp)-1的非对映异构体(R, Sp)-2.
合成出目标[2.2]对环蕃基三氮唑卡宾前驱体后, 我们将研究的焦点集中在三氮唑卡宾催化查尔酮类化合物的不对称硼化反应上.以查尔酮为硼化反应的模型底物, 以[2.2]对环蕃基三氮唑盐(R, Rp)-1为催化剂前驱体对反应条件进行优化(表 1).虽然Hoveyda等[12]认为在卡宾催化的α, β-不饱和羰基化合物的不对称硼加成反应中甲醇的活化作用不可或缺, 但我们设想双功能[2.2]对环蕃基三氮唑卡宾可能通过酚氧基和卡宾的协同活化硼试剂作用而提高反应活性.因此, 前期我们选定的催化系统是无添加甲醇的体系, 希望通过调节水和四氢呋喃的比例来提高反应的收率和对映选择性.令人高兴的是实验结果符合预期, 以30 mol% 1, 8-二氮杂二环十一碳-7-烯(DBU)作为碱, 即使无甲醇活化, 双功能[2.2]对环蕃基三氮唑卡宾仍然可以催化该反应(表 1, Entries 1~6).水的比例过大(表 1, Entries 1~3, 8)或水的比例过小(表 1, Entries 6~7)都不利于该不对称硼化反应; 当V(H2O):V(THF)=1:6时, 可以得到50%收率和高达94%的对映选择性(表 1, Entry 5).然而, 美中不足的是反应收率不高, 即使增加联硼酸频哪醇酯的用量, 也不能明显提高反应的收率(表 1, Entries 1, 5).

Entry V(H2O):V(THF) Yieldc/% eed/% 1b 1:3 55 88 2 1:3 45 86 3 3:1 60 76 4 1:6 62 91 5b 1:6 50 94 6 1:20 67 86 7 1:50 Trace nd 8b 500:0 Trace nd aReaction conditions: (R, RP)-1 (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.11 mmol), and 11a (0.1 mmol) at 25 ℃ for 24 h. bB2(Pin)2 (0.20 mmol). c Isolated yield. dDetermined by chiral HPLC (CHIRALPAK IA) analysis. 为了提高反应的收率, 参考Hoveyda等[12]的反应条件, 我们将催化体系中也加入60倍量的甲醇, 随后考察四氢呋喃中的含水量对反应的影响.发现当四氢呋喃中的含水量是查尔酮的2倍量、联硼酸频哪醇酯也是2倍量时, 硼化反应的收率达到98%、对映选择性达到92% (表 2, Entry 4).增加水量(表 2, Entry 5)或减少水量(表 2, Entries 2, 6)均导致收率急剧降低.尤其令人惊讶的是, 无水条件下, 即使加入60倍量的甲醇, 反应也不能进行(表 2, Entry 7).我们认为水在该反应中可以起到两方面的作用:一是水可以促进酚羟基与联硼酸酯的酯交换反应, 生成活化的反应中间体; 二是水可以加速酚羟基硼酸酯的水解, 使催化剂再生, 完成催化反应循环.这个结果再次证明双功能[2.2]对环蕃基三氮唑卡宾可以通过酚氧基和卡宾的协同活化硼试剂作用而提高反应活性, 甲醇不是必需的, 反而水是不可或缺的.反应也可以在含水甲醇中顺利进行, 但收率和不对称选择性有所降低(表 2, Entry 8).

Entry H2O/equiv. Yieldd/% eee/% 1b 1 58 94 2 1 68 93 3b 2 48 93 4 2 98 92 5 3 45 93 6 0.5 40 92 7 0 Trace nd 8c 2 58 88 a Reaction conditions: (R, RP)-1 (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.20 mmol), 7a (0.1 mmol), and MeOH (6.0 mmol) at 25 ℃ for 24 h. bB2(Pin)2 (0.11mmol). cWithout THF. d Isolated yield. eDetermined by chiral HPLC (CHIRALPAK IA) analysis. 虽然反应收率达到了要求, 但反应的不对称选择性仍不能令人满意.因此, 我们考察了碱对查尔酮不对称硼加成反应的影响.首先对比了DBU量对反应的影响, 发现增加碱量或减少碱量都降低了反应的收率, 尽管在增加碱量时反应的选择性有所增加(表 3, Entries 2~3).碱量的变化对反应收率的巨大影响是由碱在反应中的作用决定的.适量的碱既可以使三氮唑盐生成卡宾催化剂又可以使联硼酸酯部分水解生成活性中间体, 从而促进反应的进行.当碱的量较少时, 反应速度较慢; 而当碱的量过多时, 会造成联硼酸酯的过量水解, 也不利于反应的进行.随后, 我们对碱的种类对反应的影响也进行了研究.强碱性的叔丁醇钾使反应的收率和对映选择性均明显减少(表 3, Entry 4), 弱碱性的氟化钾虽然提高了对映选择性却降低了收率(表 3, Entry 5).表现最好的碱是碳酸铯, 反应的收率(99%)和ee值(96%)都有所提高.因此, 我们选择碳酸铯作为我们接下来催化反应研究用碱(表 3, Entry 6).

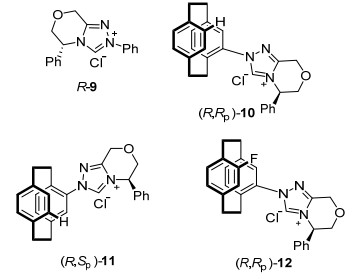
Entry Base Yieldb/% eec/% 1 30 mol% DBU 98 92 2 20 mol% DBU <20 nd 3 60 mol% DBU 37 95 4 30 mol% t-BuOK 76 89 5 30 mol% KF 82 94 6 30 mol% Cs2CO3 99 96 a Reaction conditions: (R, RP)-1 (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.20 mmol), 7a (0.1 mmol), and MeOH (6.0 mmol) at 25 ℃ for 24 h. b Isolated yield. c Determined by chiral HPLC (CHIRALPAK IA) analysis. 在确定了最优反应条件后, 我们又研究了不同手性三氮唑卡宾对查尔酮硼化反应的催化效果(图 2).由催化结果可以看出, [2.2]对环蕃取代基对催化剂的催化性质有明显影响, 无[2.2]对环蕃取代基的三氮唑卡宾前驱体R-9显示了最差的催化活性(表 4, Entry 3).中心手性和面手性相匹配的三氮唑卡宾前驱体(R, Rp)-1、(R, Rp)-10比不匹配的三氮唑卡宾前驱体(R, Sp)-2、(R, Sp)-11所催化的反应对映选择性更高(表 4, Entries 1, 2, 4, 5). [2.2]对环蕃骨架上的取代基对催化剂的催化性质有很大影响, 含有氟原子取代基的三氮唑卡宾前驱体(R, Rp)-12比[2.2]对环蕃骨架上无取代基的(R, Rp)-10表现出更好的催化活性(表 4, Entries 4, 6), 而含有酚羟基的双功能三氮唑卡宾前驱体展示了优异的催化效果(表 4, Entry 1).通过对三氮唑卡宾前驱体的对比实验, 我们发现所设计的新型双功能三氮唑卡宾前驱体(R, Rp)-1是最优催化剂, 因此被选用于下一步研究中.

Entry Precatalyst Yieldb/% eec/% 1 (R, Rp)-1 99 96 2 (R, Sp)-2 90 82 3 R-9 25 74 4 (R, Rp)-10 42 84 5 (R, Sp)-11 43 79 6 (R, Rp)-12 89 88 a Reaction conditions: chiral NHC precursors (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.20 mmol), 7a (0.1 mmol), and MeOH (6.0 mmol) at 25 ℃ for 24 h.b Isolated yield. cDetermined by chiral HPLC (CHIRALPAK IA) analysis. 在优化的反应条件下, 我们对最佳三氮唑卡宾前驱体(R, Rp)-1的底物适用性进行了研究.研究发现, 当查尔酮类化合物中双键上连有供电子取代基的苯环时, 不论取代基在苯环的什么位置都能够表现出很高的收率和对映选择性(表 5, Entries 2~5).然而, 当双键上连有吸电子取代基的苯环时, 硼化产物的对映选择性却剧烈降低(表 5, Entry 6).现有的催化体系也适用于双键上连有稠环芳基的底物(表 5, Entries 7~8), 但不同的取代位置, 硼化产物的对映选择性则表现出很大的不同, 1-萘基取代的反应物能给出较高的不对称选择性(表 5, Entry 7).芳杂环取代的底物很适合该催化体系, β-位噻吩取代的α, β-不饱和酮显示了非常好的收率和对映选择性(表 5, Entry 9).此外, 该催化体系还可以催化β-甲基取代的α, β-不饱和酮的不对称硼加成反应, 尽管产物的对映选择性不高(表 5, Entry 10).另一方面, 查尔酮类反应物可以拓展到羰基上连有不同电子效应取代基的苯环.含有供电子取代基的底物依然表现出很高的收率和对映选择性(表 5, Entries 11~12), 尤其是对位甲氧基取代的反应物展示了98%收率和97%对映选择性(表 5, Entry 11).但是, 当羰基上连有吸电子取代基的苯环时, 硼化产物的对映选择性有所降低(表 5, Entries 13~15).另外, 现有的催化体系也适用于烷基取代在羰基上的不饱和酮, 硼化产物的对映选择性能够达到90%, 收率高达98% (表 5, Entry 16).

Entry R1 R2 8 Yieldb/% eec, d/% 1 Ph Ph 8a 99 96 2 2-MeOC6H4 Ph 8b 98 90 3 3-MeOC6H4 Ph 8c 99 93 4 4-MeOC6H4 Ph 8d 95 95 5 4-MeC6H5 Ph 8e 80 91 6 3-ClC6H4 Ph 8f 80 67 7 1-Naphthyl Ph 8g 90 91 8 2-Naphthyl Ph 8h 92 79 9 2-Thienyl Ph 8i 99 95 10 Me Ph 8j 85 73 11 Ph 4-MeOC6H4 8k 98 97 12 Ph 4-MeC6H4 8l 96 94 13 Ph 4-FC6H4 8m 97 90 14 Ph 4-ClC6H4 8n 92 85 15 Ph 3-ClC6H4 8o 95 76 16 Ph t-Bu 8p 98 90 a Reaction conditions: (R, RP)-1 (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.20 mmol), 7a (0.1 mmol), and MeOH (6.0 mmol) at 25 ℃ for 24 h. bIsolated yield. cDetermined by chiral HPLC (CHIRALPAK IA) analysis. dAll products were characterized by 1H NMR and 13C NMR. 2 结论
我们依据文献报道的催化机理, 设计、合成了[2.2]对环蕃基双功能三氮唑卡宾前驱体(R, Rp)-1和(R, Sp)-2, 并成功地将其应用于非过渡金属催化的查尔酮衍生物的不对称硼加成反应中.研究发现, 中心手性和面手性相匹配的含酚羟基的[2.2]对环蕃基三氮唑卡宾在查尔酮衍生物的不对称硼化反应中显示了很好的催化效果, 符合我们设计催化剂结构时的设想.我们的催化体系最高能达到99%的收率、97%的对映选择性, 是迄今为止非过渡金属催化查尔酮衍生物的不对称硼加成反应最好的结果.同时, 我们的研究发现了水作为添加物在该不对称硼加成反应中发挥关键作用.
3 实验部分
3.1 仪器与试剂
商业购得的试剂除非特殊说明, 否则均未进一步纯化.柱色谱采用200~400目硅胶(烟台江友硅胶开发有限公司).洗脱剂采用乙酸乙酯和石油醚的混合溶剂.比旋光用WZZ-2旋光仪测定, 浓度单位是g/100 mL.熔点由XT5-100X熔点仪测定(温度计未校正).核磁共振氢谱和碳谱用Bruker公司的AVANCE-400型核磁共振仪(400 MHz/100 MHz)或AVANCE-300型核磁共振仪(300 MHz/75 MHz)测定, 化学位移以四甲基硅烷(Me4Si)为内标.
高分辨率质谱是由Agilent公司的6510 Q-Tof LC/MS型质谱仪测得.对映体过量值由高效液相色谱仪使用CHIRALPAK IA手性柱测得.
3.2 实验方法
3.2.1 Rp-4-(2-羟基苯基)-12-(N-甲酰基二苯酮腙基)[2.2]对环蕃[(Rp)-4]的合成
光学纯的Rp-4-溴-12-(N-甲酰基二苯酮腙基)[2.2]对环蕃[(Rp)-3][18](0.34 g, 0.66 mmol)、2-羟基苯硼酸(0.37 g, 2.64 mmol)、无水氟化钾(0.46 g, 7.92 mmol)、PdCl2(dppf) (27.03 mg, 0.033 mmol)、二氧六环(3.5 mL)和水(0.35 mL), 90 ℃反应.薄层色谱(TLC)跟踪进程, 当产物不再增加时, 停止反应, 柱层析, 回收(Rp)-3 0.15 g和得到(Rp)-4粗产物, 重结晶后得到产物(Rp)-4 0.17 g, 收率92%. m.p. 184~186 ℃; [α]D20-330.3 (c 0.2, CH2Cl2); 1H NMR (300 MHz, CDCl3) δ: 7.91~7.77 (m, 1H), 7.90~7.79 (m, 1H), 7.63~7.53 (m, 1H), 7.58 (t, J=7.4 Hz, 1H), 7.46 (t, J=7.5 Hz, 1H), 7.37 (d, J=11.6 Hz, 2H), 7.26 (s, 1H), 7.03~6.90 (m, 1H), 6.86~6.72 (m, 2H), 6.64 (d, J=7.8 Hz, 1H), 5.70 (t, J=7.3 Hz, 1H), 3.91~3.20 (m, 1H), 3.22~2.72 (m, 1H), 2.70~2.06 (m, 1H), 1.22~1.06 (m, 1H); 13C NMR (75 MHz, CDCl3) δ: 151.8, 135.9, 134.1, 131.6, 130.1, 128.4, 120.3, 114.8, 77.4, 77.0, 76.6, 35.4, 34.6, 34.1; HRMS (ESI) calcd for C36H31N2O2 (M+H)+: 523.2386, found 523.2386.
同样的方法得到光学纯的Sp-4-(2-羟基苯基)-12-(N-甲酰基二苯酮腙基)[2.2]环蕃[(Sp)-4][18] 0.17 g, 收率90%. m.p. 185~186 ℃; [α]D20+315 (c 0.2, CH2Cl2).
3.2.2 4-(2-羟基苯基)-12-(N-甲酰肼基)[2.2]对环蕃盐酸盐[(Rp)-5]的制备
向10 mL单口圆底烧瓶里加入0.20 g (Rp)-4 (0.38 mmol)、浓盐酸0.6 mL (6.00 mmol)和1.0 ml四氢呋喃, 然后将整个体系移入到25 ℃油浴里反应, TLC跟踪反应进程, 约3 h反应完全.旋转蒸出水和四氢呋喃, 直到无溶剂.残液中先加入2滴二氯甲烷, 然后加入5.0 mL无水乙醚超声震荡, 则有大量固体析出, 减压过滤, 得到灰黄色甲酰肼盐酸盐(Rp)-5 0.13 g, 产率为87%.由于产物不稳定, 不再进一步纯化, 直接用于下一步反应.
3.2.3 三氮唑盐(R, Rp)-1和(R, Sp)-2合成的一般步骤
在新制备的装有亚胺醚粗产品(0.23 g, 1.2 mmol)的反应管中, 加入无水甲醇(3.0 mL), 室温搅拌2 min, 氮气保护下加入光学纯的(Rp)-5 (0.39 g, 1.0 mmol), 50 ℃反应, TLC跟踪反应进程, 当反应体系不再发生变化时, 停止反应.蒸干甲醇, 加入原甲酸三乙酯(3.0 mL), 110 ℃关环反应, TLC跟踪反应进程, 产物不再增加时, 停止反应.柱层析提纯, 得到粗产品, 重结晶后得到白色的三氮唑盐(R, Rp)-1, 0.45 g, 收率83%. m.p. 294~295 ℃; [α]D20-330.3 (c 0.2, CH2Cl2); 1H NMR (300 MHz, CDCl3) δ: 9.13 (s, 1H), 7.50~7.48 (m, 2H), 7.39~7.37 (m, 2H), 7.10~7.09 (m, 1H), 7.07~7.05 (m, 1H), 6.98 (s, 1H), 6.88 (d, J=1.4 Hz, 1H), 6.86 (d, 1H), 6.80~6.78 (m, 1H), 6.77~6.75 (m, 2H), 6.70 (s, 1H), 6.55 (d, J=1.4 Hz, 1H), 6.52 (s, 1H), 5.40~5.35 (m, 2H), 4.82 (d, J=11.8 Hz, 2H), 4.45~4.32 (m, 2H), 3.71~3.58 (m, 2H), 3.53~3.39 (m, 2H), 3.37~3.26 (m, 2H), 3.06~2.90 (m, 2H); 13C NMR (75 MHz, CDCl3) δ: 153.2, 149.2, 143.0, 138.3, 136.7, 135.6, 135.2, 134.0, 133.7, 133.5, 132.0, 130.0, 129.6, 128.2, 127.5, 125.6, 119.6, 117.2, 68.9, 61.9, 58.2, 34.5, 33.9, 33.6, 33.3; HRMS (ESI) calcd for C33H30N3O2 (M-Cl)+: 500.2338, found 500.2296.
同样的方法制得三氮唑盐(R, Sp)-2 0.40 g, 收率75%. m.p. 293~295 ℃; [α]D20+320 (c 0.2, CH2Cl2); 1H NMR (300 MHz, CDCl3) δ: 11.16 (s, 1H), 7.84~7.76 (m, 1H), 7.78~7.74 (m, 1H), 7.49~7.41 (m, 2H), 7.32 (d, J=5.3 Hz, 2H), 7.20~7.16 (m, 1H), 7.10~7.05 (m, 2H), 6.94 (d, J=8.7 Hz, 1H), 6.81~6.73 (m, 2H), 6.73~6.66 (m, 1H), 6.47~6.40 (m, 2H), 6.07~6.04 (m, 1H), 5.41~5.36 (m, 1H), 5.33 (s, 1H), 5.10~5.04 (m, 1H), 5.04~4.98 (m, 1H), 4.51 (s, 1H), 3.35~3.20 (m, 2H), 3.13~2.96 (m, 2H), 2.88~2.77 (m, 2H), 2.74~2.62 (m, 2H); 13C NMR (75 MHz, CDCl3) δ: 143.0, 139.3, 138.3, 136.7, 135.6, 135.2, 134.0, 133.7, 133.5, 132.0, 130.0, 129.6, 128.8, 128.2, 127.5, 127.3, 125.6, 119.6, 117.2, 68.9, 61.9, 58.2, 34.5, 33.9, 33.6, 33.3; HRMS (ESI) calcd for C33H30N3O2 (M-Cl)+: 500.2338, found 500.2290.
3.2.4 卡宾催化的查尔酮衍生物不对称硼化反应的一般步骤
向带有合适磁子的小试管中加入查尔酮衍生物(0.1 mmol)、20.8 mg B2(pin)2(0.11 mmol)、5 mmol%三氮唑盐(0.005 mmol), 室温搅拌下加入240 uL(60倍量)无水甲醇, 200 μL四氢呋喃、3.6 μL水(0.2 mmol).室温搅拌5 min后加入碳酸铯9.78 mg (0.03mmol), 然后让反应体系在25 ℃油浴里反应24 h. TLC跟踪反应进程, 反应结束后, 快速柱层析获得产物8, 洗脱剂是V(石油醚):V(乙酸乙酯)=10:1.
(R)-1, 3-二苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8a)[16c]:无色透明油状物, 33.3 mg, 99%的收率, 96%的ee值; [α]D20-16.8 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为13.3 min (S, minor), tR为18.3 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 7.98~7.97 (m, 2H), 7.57~7.50 (m, 2H), 7.47~7.44 (m, 1H), 7.44~7.40 (m, 1H), 7.30 (s, 1H), 7.31~7.28 (m, 1H), 7.28 (s, 1H), 7.28~7.25 (m, 1H), 3.62~3.48 (m, 1H), 3.48~3.38 (m, 1H), 2.84~2.76 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 199.7, 141.9, 136.8, 132.9, 128.5, 128.5, 128.4, 128.0), 125.6, 83.4, 43.2, 29.7, 24.5.
(R)-3-(2-甲氧基苯基)-1-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8b)[16c]:无色透明油状物35.8 mg, 98%的收率, 90%的ee值; [α]D20-82.2 (c 0.10, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为15.5 min (S, minor), tR为16.3 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.00~7.93 (m, 2H), 7.57~7.50 (m, 2H), 7.47~7.40 (m, 2H), 7.30 (s, 1H), 7.28 (s, 1H), 7.28 (s, 1H), 7.28 (s, 1H), 7.26 (s, 1H), 3.62~3.48 (m, 3H), 3.47~3.43 (m, 1H), 3.48~3.38 (m, 1H), 2.84~2.76 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 157.1, 137.2, 132.6, 130.4, 128.3, 128.0, 126.8, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 25.0, 24.7, 24.6.
(R)-3-(3-甲氧基苯基)-1-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8c)[16c]:无色透明油状物36.2 mg, 99%的收率, 92%的ee值; [α]D20 -22.1 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min: tR为18.3 min (S, minor), tR为24.9 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.00~7.93 (m, 2H), 7.57~7.50 (m, 2H), 7.46 (s, 1H), 7.44 (s, 1H), 7.30 (s, 1H), 7.28 (s, 1H), 7.26 (s, 1H), 3.62~3.48 (m, 3H), 3.48~3.38 (m, 1H), 3.42~3.38 (m, 1H), 2.84~2.76 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 25.0, 24.7, 24.6.
(R)-3-(4-甲氧基苯基)-1-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8d)[16c]:无色透明油状物34.7 mg, 95%的收率, 91%的ee值; [α]D20 -22.3 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为20.3 min (S, minor), tR为27.9 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.00~7.94 (m, 2H), 7.57~7.50 (m, 2H), 7.46~7.45 (m, 1H), 7.43~7.41 (m, 1H), 7.30~7.29 (m, 1H), 7.29~7.28 (m, 1H), 7.27~7.25 (m, 1H), 3.62~3.48 (m, 3H), 3.48~3.38 (m, 1H), 3.42~3.38 (m, 1H), 2.84~2.76 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 25.0, 24.7, 24.6.
(R)-3-(4-甲基苯基)-1-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8e)[16c]:无色透明油状物28.3 mg, 80%的收率, 75%的ee值; [α]D20-12.3 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为13.9 min (S, minor), tR为18.0 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.00~7.94 (m, 2H), 7.57~7.50 (m, 2H), 7.47~7.40 (m, 2H), 7.31~7.29 (m, 1H), 7.29~7.25 (m, 2H), 3.53 (d, J=10.9 Hz, 1H), 3.48~3.38 (m, 1H), 3.40 (d, J=5.1 Hz, 1H), 2.84~2.76 (m, 3H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 25.0, 24.7, 24.6.
(R)-3-(3-氯代苯基)-1-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8f)[16c]:无色透明油状物29.6 mg, 80%的收率, 63%的ee值; [α]D20-50.2 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷)/V(异丙醇)=50:1, 流速为0.5 mL/min; tR为14.3 min (S, minor), tR为17.9 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.24~8.19 (m, 2H), 7.98~7.92 (m, 1H), 7.86~7.82 (m, 2H), 7.72~7.66 (m, 1H), 7.54~7.51 (m, 1H), 7.51~7.49 (m, 1H), 7.49~7.45 (m, 1H), 3.69 (d, J=6.3 Hz, 1H), 3.65~3.58 (m, 1H), 3.50 (d, 1H), 1.26~1.25 (m, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 24.8, 24.7, 24.6.
(R)-3-(萘-1-基)-1-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8g)[16c]:无色透明油状物34.7 mg, 90%的收率, 91%的ee值; [α]D20-95.6 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为15.4 min (S, minor), tR为16.5 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.25~8.22 (m, 1H), 8.21~8.19 (m, 1H), 7.9~7.95 (m, 2H), 7.95~7.93 (m, 1H), 7.86~7.82 (m, 1H), 7.81~7.79 (m, 1H), 7.72~7.66 (m, 1H), 7.50 (d, J=0.9 Hz, 1H), 7.49~7.45 (m, 1H), 7.45~7.41 (m, 1H), 7.42~7.38 (m, 1H), 3.71~3.67 (m, 1H), 3.65~3.58 (m, 1H), 3.52~3.48 (m, 1H), 1.26~1.24 (m, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 26.2, 24.7, 24.6.
(R)-3-(萘-2-基)-1-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8h):无色透明油状物35.5 mg, 92%的收率, 81%的ee值; [α]D20-85.7 (c 0.15, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为19.3 min (S, minor), tR为27.4 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.25~8.22 (m, 1H), 8.21~8.20 (m, 1H), 7.98~7.92 (m, 2H), 7.86~7.83 (m, 1H), 7.83~7.78 (m, 1H), 7.72~7.66 (m, 1H), 7.54~7.51 (m, 1H), 7.51~7.49 (m, 1H), 7.49~7.45 (m, 1H), 7.45~7.41 (m, 1H), 7.42~7.38 (m, 1H), 3.69 (d, J=6.3 Hz, 1H), 3.65~3.58 (m, 1H), 3.50 (d, 1H), 3.29~3.29 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83., 83.2, 55.0, 41.4, 25.0, 24.7, 24.6. HRMS (ESI) calcd for C25H28BO3(M+H)+: 387.2132, found 387.2126.
(R)-3-(噻吩-2-基)-1-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8i)[16d]:无色透明油状物34.2 mg, 99%的收率, 95%的ee值; [α]D20-30.7 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为14.4 min (S, minor), tR为18.0 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.24~8.19 (m, 2H), 7.98~7.92 (m, 1H), 7.86~7.82 (m, 2H), 7.72~7.66 (m, 1H), 7.52 (s, 1H), 7.45~7.41 (m, 2H), 3.71~3.67 (m, 1H), 3.65~3.58 (m, 1H), 3.52~3.48 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 1137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 24.9, 24.7, 24.6.
(R)-1-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丁烷-1-酮(8j)[16c]:无色透明油状物34.1 mg, 85%的收率, 73%的ee值; [α]D20-20.3 (c 0.15, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为9.9 min (S, minor), tR为11.8 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.24~8.19 (m, 2H), 7.98~7.92 (m, 2H), 7.72~7.66 (m, 1H), 3.70~3.69 (m, 1H), 3.64~3.62 (m, 1H), 3.52~3.48 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H), 1.10 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 24.8, 24.7, 24.6.
(R)-1-(4-甲氧基苯基)-3-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8k)[16c]:无色透明油状物35.8 mg, 98%的收率, 95%的ee值; [α]D20 -58.1 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为28.3 min (S, minor), tR为41.3 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.01~7.92 (m, 2H), 7.57~7.50 (m, 2H), 7.47~7.40 (m, 2H), 7.31~7.25 (m, 2H), 7.28~7.25 (m, 1H), 3.62~3.48 (m, 3H), 3.48~3.38 (m, 1H), 3.40 (d, J=5.1 Hz, 1H), 2.84~2.76 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 25.0, 24.7, 24.6.
(R)-3-苯基-1-(4-甲基苯基)-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8l)[16c]:无色透明油状物33.4 mg, 96%的收率, 94%的ee值; [α]D20-16 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为16.0min (S, minor), tR为26.6 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.00~7.92 (m, 2H), 7.57~7.50 (m, 2H), 7.47~7.40 (m, 2H), 7.31~7.25 (m, 1H), 7.29~7.24 (m, 2H), 3.62~3.48 (m, 1H), 3.48~3.38 (m, 1H), 3.42~3.38 (m, 1H), 2.84~2.76 (m, 3H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 25.0, 24.7, 24.6.
(R)-1-(4-氟代苯基)-3-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8m)[16c]:无色透明油状物34.3 mg, 97%的收率, 89%的ee值; [α]D20 -12.8 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为14.6 min (S, minor), tR为20.3 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.03~7.85 (m, 2H), 7.57~7.50 (m, 2H), 7.47~7.40 (m, 2H), 7.31~7.29 (m, 2H), 7.26 (s, 1H), 3.53 (d, J=10.9 Hz, 1H), 3.48~3.38 (m, 1H), 2.84~2.76 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 25.0, 24.7, 24.6.
(R)-1-(4-氯代苯基)-3-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8n):无色透明油状物34.1 mg, 92%的收率, 85%的ee值; [α]D20-75.7 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷)/V(异丙醇)=50:1, 流速为0.5 mL/min; tR为15.1 min (S, minor), tR为20.7 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.24~8.19 (m, 2H), 7.98~7.92 (m, 2H), 7.86~7.82 (m, 2H), 7.72~7.66 (m, 2H), 7.54~7.51 (m, 1H), 3.71~3.67 (m, 1H), 3.65~3.58 (m, 1H), 3.52~3.48 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 25.0, 24.7, 24.6. HRMS (ESI) calcd for C21H25BClO3(M+H)+: 371.1585, found 371.1587.
(R)-1-(3-氯代苯基)-3-苯基-3-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)丙烷-1-酮(8o):无色透明油状物35.2 mg, 95%的收率, 77%的ee值; [α]D20-80.3 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷)/V(异丙醇)=50:1, 流速为0.5 mL/min; tR为11.8 min (S, minor), tR为15.0 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.25~8.22 (m, 1H), 8.21~8.20 (m, 1H), 7.97~7.95 (m, 1H), 7.95~7.93 (m, 1H), 7.85~7.77 (m, 2H), 7.72~7.66 (m, 2H), 7.53~7.49 (m, 1H), 3.71~3.67 (m, 1H), 3.65~3.58 (m, 1H), 3.52~3.48 (m, 1H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 198.4, 141.6, 138.3, 134.8, 132.8, 129.8, 128.5, 128.3, 128.1, 126.1, 125.7, 83.5, 43.3, 24.5.HRMS (ESI) calcd for C21H25BClO3(M+H)+: 371.1585, found 371.1586.
(R)-4, 4-二甲基-1-苯基-1-(4, 4, 5, 5-四甲基-1, 3, 2-二氧硼杂环戊烷-2-基)戊烷-3-酮(8p)[16c]:无色透明油状物30.9 mg, 98%的收率, 90%的ee值; [α]D20-40 (c 0.20, CH2Cl2); ee值是由高效液相色谱仪测定: Chirapak IA柱, λ为254 nm, 流动相: V(正己烷):V(异丙醇)=50:1, 流速为0.5 mL/min; tR为9.2 min (S, minor), tR为10.0 min (R, major); 1H NMR (400 MHz, CDCl3) δ: 8.01~7.94 (m, 2H), 7.57~7.50 (m, 1H), 7.31~7.25 (m, 2H), 3.53 (d, J=10.9 Hz, 1H), 3.48~3.38 (m, 1H), 2.84~2.76 (m, 1H), 1.58 (s, 9H), 1.25 (s, 6H), 1.17 (s, 6H); 13C NMR (101 MHz, CDCl3) δ: 200.0, 157.1, 157.1, 137.2, 132.6, 130.9, 130.4, 128.3, 128.0, 126.8, 120.6, 110.1, 83.5, 83.2, 55.0, 41.4, 25.0, 24.7, 24.6.
辅助材料(Supporting Information) 化合物8a~8p、化合物(Rp)-4、(R, Rp)-1和(R, Sp)-2的核磁共振氢谱和碳谱, 化合物8a~8p的HPLC色谱图等.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Beletskaya, I.; Pelter, A. Tetrahedron 1997, 53, 4957.
(b) Laitar, D. S.; Tsui, E. Y.; Sadighi, J. P. J. Am. Chem. Soc. 2006, 128, 11036.
(c) Burks, H. E.; Morken, J. P. Chem. Commun. 2007, 130, 4717.
(d) Ishiyama, T.; Ishida, K.; Miyaura, N. Tetrahedron 2001, 57, 9813. -
[2]
(a) Scott, H. K.; Aggarwal, V. K. Chem.-Eur. J. 2011, 17, 13124.
(b) Xi, Y.; Hartwig, J. F. J. Am. Chem. Soc. 2016, 138, 6703. -
[3]
(a) Smith, S. M.; Thacker, N. C.; Takacs, J. M. J. Am. Chem. Soc. 2008, 130, 3734.
(b) Noh, D.; Chea, H.; Ju, J.; Yun, J. Angew. Chem., Int. Ed. 2009, 48, 6062.
(c) Burks, H. E.; Kliman, L. T.; Morken, J. P. J. Am. Chem. Soc. 2009, 131, 9134.
(d) Sasaki, Y.; Zhong, C.; Sawamura, M.; Ito, H. J. Am. Chem. Soc. 2010, 132, 1226.
(e) Lee, Y.; Jang, H.; Hoveyda, A. H. J. Am. Chem. Soc. 2009, 131, 18234.
(f) Park, J. K.; Lackey, H. H.; Ondrusek, B. A.; McQuade, D. T. J. Am. Chem. Soc. 2011, 133, 2410.
(g) Ibrahem, I.; Breistein, P.; Córdova, A. Angew. Chem., Int. Ed. 2011, 50, 12036.
(h) Sakae, R.; Hirano, K.; Satoh, T.; Miura, M. Angew. Chem., Int. Ed. 2015, 54, 613.
(i) Chen, I.; Yin, L.; Itano, W.; Kanai, M.; Shibasaki, M. J. Am. Chem. Soc. 2009, 131, 11664.
(j) Neeve, E. C.; Geier, S. J.; Mkhalid, I. A. I.; Westcott, S. A.; Marder, T. B. Chem. Rev. 2016, 116, 9091. -
[4]
(a) Kliman, L. T.; Mlynarski, S. N.; Morken, J. P. J. Am. Chem. Soc. 2009, 131, 13210.
(b) Pelz, N. F.; Woodward, A. R.; Burks, H. E.; Sieber, J. D.; Morken, J. P. J. Am. Chem. Soc. 2004, 126, 16328.
(c) For an overview, see:Takaya, J.; Iwasawa, N. ACS Catal. 2012, 2, 1993.
(d) Kliman, L. T.; Mlynarski, S. N.; Ferris, G. E.; Morken, J. P. Angew. Chem., Int. Ed. 2012, 51, 521. -
[5]
(a) Liu, P.; Fukui, Y.; Tian, P.; He, Z. T.; Wu, N. Y.; Lin, G. Q. J. Am. Chem. Soc. 2013, 135, 11700.
(b) He, Z. T.; Zhao, Y.; Tian, P.; Wang, C.; Dong, H.; Lin, G. Q. Org. Lett. 2014, 16, 1426.
(c) Jiang, L.; Cao, P.; Wang, M.; Chen, B.; Wang, B.; Liao, J. Angew. Chem., Int. Ed. 2016, 55, 13854.
(d) Lou, Y.; Cao, P.; Jia, T.; Zhang, Y.; Wang, M.; Liao, J. Angew. Chem., Int. Ed. 2015, 54, 12134.
(e) Park, J. K.; Lackey, H. H.; Rexford, M. D.; Kovnir, K.; Shatruk, M.; McQuade, D. T. Org. Lett. 2010, 12, 5008.
(f) Lee, J. C. H.; McDonald, R.; Hall, D. G. Nat. Chem. 2011, 3, 894.
(g) Kobayashi, S.; Xu, P.; Endo, T.; Ueno, M.; Kitanosono, T. Angew. Chem., Int. Ed. 2012, 51, 12763.
(h) Schiffner, J. A.; Müther, K.; Oestreich, M. Angew. Chem., Int. Ed. 2010, 49, 1194.
(i) Kubota, K.; Hayama, K.; Iwamoto, H.; Ito, H. Angew. Chem., Int. Ed. 2015, 54, 8809.
(j) Hornillos, V.; Vila, C.; Otten, E.; Feringa, B. L. Angew. Chem., Int. Ed. 2015, 54, 7867. -
[6]
For a review on Rh-catalyzed enantioselective hydroboration reactions, see:Carroll, A. M.; O'Sullivan, T. P.; Guiry, P. J. Adv. Synth. Catal. 2005, 347, 609.
-
[7]
Shiomi, T.; Adachi, T.; Toribatake, K.; Zhou, L.; Nishiyama, H. Chem. Commun. 2009, 5987.
-
[8]
(a) Schuster, C. H.; Li, B.; Morken, J. P. Angew. Chem. Int. Ed. 2011, 50, 7906.
(b) Burks, H. E.; Kliman, L. T.; Morken, J. P. J. Am. Chem. Soc. 2009, 131, 9134. -
[9]
(a) Mun, S. ; Lee, J. -E. ; Yun, J. Org. Lett. 2006, 8, 4887.
(b) Lee, J. -E. ; Kwon, J. ; Yun, J. Chem. Commun. 2008, 733.
(c) Cheng, Q. -Q. ; Xu, H. Z. ; Shou, F. ; Zhou, Q. L. Acta Chim. Sinica 2015, 73, 326(in Chinese).
(程清卿, 许唤朱, 守非, 周其林, 化学学报, 2015, 73, 326. )
(d) Lillo, V. ; Prieto, A. ; Bonet, A. ; Diaz-Requejo, M. M. ; Ramirez, J. ; Perez, P. J. ; Fernández, E. Organometallics 2009, 28, 659.
(e)Ding, W. ; Song, Q. L. Org. Chem. Front. 2016, 3, 14.
(f) Sim, H. -S. ; Feng, X. ; Yun, J. Chem. -Eur. J. 2009, 15, 1939.
(g) Liu, Q. ; Tian, B. ; Tian, P. ; Tong, X. F. ; Lin, G. Q. J. Org. Chem. 2015, 35, 1(in Chinese).
(刘强, 田兵, 田平, 童晓峰, 林国强, 有机化学, 2015, 35, 1. )
(h) Lee, J. -E. ; Yun, J. Angew. Chem., Int. Ed. 2008, 47, 145.
(i) Liu, X. -X. ; Zhang, W. B. J. Org. Chem. 2016, 36, 2249(in Chinese).
(刘媛媛, 张万斌, 有机化学, 2016, 36, 2249. ) -
[10]
Lillo, V.; Geier, M. J.; Westcott, S. A.; Fernández, E. Org. Biomol. Chem. 2009, 7, 4674. doi: 10.1039/b909341a
-
[11]
Radomkit, S.; Hoveyda, A. H. Angew. Chem., Int. Ed. 2014, 53, 3387. doi: 10.1002/anie.201309982
-
[12]
Wu, H.; Radomkit, S.; O'Brien, J. M.; Hoveyda, A. H. J. Am. Chem. Soc. 2012, 134, 8277. doi: 10.1021/ja302929d
-
[13]
Bonet, A.; Gulyás, H.; Fernández, E. Angew. Chem., Int. Ed. 2010, 49, 5130. doi: 10.1002/anie.v49:30
-
[14]
(a) Muchall, H. M. In Modern Cyclophane Chemistry, Eds.:Gleiter, R.; Hopf, H., Wiley-VCH, Verlag GmbH & Co. KGaA, 2004, 259.
(b) Aly, A. A.; Brown, A. B. Tetrahedron 2009, 65, 8055.
(c) Brown, C. J.; Farthing, A. C. Nature 1949, 164, 915. -
[15]
(a) Hou, X.; Wu, X.; Dai, L.; Cao, B.; Sun, J. Chem. Commun. 2000, 1195.
(b) Wu, X.; Hou, X.; Dai, L.; Tao, J.; Cao, B.; Sun, J. Tetrahedron:Asymmetry 2001, 12, 529.
(c) Wu, X.; Zhang, T.; Hou, X. Tetrahedron:Asymmetry 2004, 15, 2357.
(d) Jiang, B.; Zhao, X. Tetrahedron:Asymmetry 2004, 15, 1141.
(e) Jiang, B.; Lei, Y.; Zhao, X. J. Org. Chem. 2008, 73, 7833.
(f) Han, L.; Lei, Y.; Zhao, X.; Jiang, B. J. Org. Chem. 2015, 80, 3752.
(g) Pye, P. J.; Rossen, K.; Reamer, R. A.; Tsou, N. N.; Volante, R. P.; Reider, P. J. J. Am. Chem. Soc. 1997, 119, 6207.
(h) Hermanns, N.; Dahmen, S.; Bolm, C.; Bräse, S. Angew. Chem., Int. Ed. 2002, 41, 3692.
(i) Dahmen, S.; Bräse, S. J. Am. Chem. Soc. 2002, 124, 5940.
(j) Bräse, S.; Höfener, S. Angew. Chem., Int. Ed. 2005, 44, 7879.
(k) Fürstner, A.; Alcarazo, M.; Krause, H.; Lehmann, C. W. J. Am. Chem. Soc. 2007, 129, 12676.
(l) Ma, Y.; Song, C.; Ma, C.; Sun, Z.; Chai, Q.; Andrus, M. B. Angew. Chem., Int. Ed. 2003, 42, 5871.
(m) Rozenberg, V.; Sergeeva, E.; Hopf, H. In Modern Cyclophane Chemistry, Eds.:Gleiter, R.; Hopf, H.; Wily-VCH, Weinheim, Germany, 2004, p. 435. -
[16]
(a) Hong, B.; Ma, Y.; Zhao, L.; Duan, W.; He, F.; Song, C. Tetrahedron:Asymmetry 2011, 22, 1055.
(b) Zhao, L.; Ma, Y.; Duan, W.; He, F.; Chen, J.; Song, C. Org. Lett. 2012, 14, 5780.
(c) Niu, Z.; Chen, J.; Chen, Z.; Ma, M.; Song, C.; Ma, Y. J. Org. Chem. 2015, 80, 602.
(d) Wang, L.; Chen, Z.; Ma, M.; Duan, W.; Song, C.; Ma, Y. Org. Biomol. Chem. 2015, 13, 10691.
(e) Zhao, L.; Ma, Y.; Duan, W.; He, F.; Chen, J.; Song, C. J. Org. Chem. 2013, 78, 1677.
(f) Chen, J.; Duan, W.; Chen, Z.; Ma, M.; Song, C.; Ma, Y. RSC Adv. 2016, 6, 75144. -
[17]
Wu, H.; Garcia, J. M.; Haeffner, F.; Radomkit, S.; Zhugralin, A. R.; Hoveyda, A. H. J. Am. Chem. Soc. 2015, 137, 10585. doi: 10.1021/jacs.5b06745
-
[18]
Chen, Z.; Huo, Y.; An, P.; Wang, X.; Song, C.; Ma, Y. Org. Chem. Front. 2016, 3, 1725. doi: 10.1039/C6QO00386A
-
[19]
(a) Buckley, B. R.; Neary, S. P.; Neary, S. P. Tetrahedron:Asymmetry 2010, 21, 1959.
(b) Ma, Y.; Wei, S.; Wu, J.; Yang, Fei.; Liu, B.; Lan, J.; Yang, S.; You, J. Adv. Synth. Catal. 2008, 350, 2645.
-
[1]
-
表 1 水和四氢呋喃比例的筛选a
Table 1. Optimization of the ratio between water and tetrahydrofuran

Entry V(H2O):V(THF) Yieldc/% eed/% 1b 1:3 55 88 2 1:3 45 86 3 3:1 60 76 4 1:6 62 91 5b 1:6 50 94 6 1:20 67 86 7 1:50 Trace nd 8b 500:0 Trace nd aReaction conditions: (R, RP)-1 (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.11 mmol), and 11a (0.1 mmol) at 25 ℃ for 24 h. bB2(Pin)2 (0.20 mmol). c Isolated yield. dDetermined by chiral HPLC (CHIRALPAK IA) analysis. 表 2 B2(pin)2的用量和水的用量筛选a
Table 2. Optimization of the amounts of B2(pin)2 and water

Entry H2O/equiv. Yieldd/% eee/% 1b 1 58 94 2 1 68 93 3b 2 48 93 4 2 98 92 5 3 45 93 6 0.5 40 92 7 0 Trace nd 8c 2 58 88 a Reaction conditions: (R, RP)-1 (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.20 mmol), 7a (0.1 mmol), and MeOH (6.0 mmol) at 25 ℃ for 24 h. bB2(Pin)2 (0.11mmol). cWithout THF. d Isolated yield. eDetermined by chiral HPLC (CHIRALPAK IA) analysis. 表 3 碱效应的影响a
Table 3. Influence of bases

Entry Base Yieldb/% eec/% 1 30 mol% DBU 98 92 2 20 mol% DBU <20 nd 3 60 mol% DBU 37 95 4 30 mol% t-BuOK 76 89 5 30 mol% KF 82 94 6 30 mol% Cs2CO3 99 96 a Reaction conditions: (R, RP)-1 (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.20 mmol), 7a (0.1 mmol), and MeOH (6.0 mmol) at 25 ℃ for 24 h. b Isolated yield. c Determined by chiral HPLC (CHIRALPAK IA) analysis. 表 4 三氮唑卡宾前驱体的对比实验a
Table 4. Examination of different chiral NHC precursors

Entry Precatalyst Yieldb/% eec/% 1 (R, Rp)-1 99 96 2 (R, Sp)-2 90 82 3 R-9 25 74 4 (R, Rp)-10 42 84 5 (R, Sp)-11 43 79 6 (R, Rp)-12 89 88 a Reaction conditions: chiral NHC precursors (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.20 mmol), 7a (0.1 mmol), and MeOH (6.0 mmol) at 25 ℃ for 24 h.b Isolated yield. cDetermined by chiral HPLC (CHIRALPAK IA) analysis. 表 5 底物适应性的研究a
Table 5. Investigating the substrate scope of the reaction

Entry R1 R2 8 Yieldb/% eec, d/% 1 Ph Ph 8a 99 96 2 2-MeOC6H4 Ph 8b 98 90 3 3-MeOC6H4 Ph 8c 99 93 4 4-MeOC6H4 Ph 8d 95 95 5 4-MeC6H5 Ph 8e 80 91 6 3-ClC6H4 Ph 8f 80 67 7 1-Naphthyl Ph 8g 90 91 8 2-Naphthyl Ph 8h 92 79 9 2-Thienyl Ph 8i 99 95 10 Me Ph 8j 85 73 11 Ph 4-MeOC6H4 8k 98 97 12 Ph 4-MeC6H4 8l 96 94 13 Ph 4-FC6H4 8m 97 90 14 Ph 4-ClC6H4 8n 92 85 15 Ph 3-ClC6H4 8o 95 76 16 Ph t-Bu 8p 98 90 a Reaction conditions: (R, RP)-1 (5.0 mol%), DBU (30.0 mol%), B2(Pin)2 (0.20 mmol), 7a (0.1 mmol), and MeOH (6.0 mmol) at 25 ℃ for 24 h. bIsolated yield. cDetermined by chiral HPLC (CHIRALPAK IA) analysis. dAll products were characterized by 1H NMR and 13C NMR. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 10
- 文章访问数: 2746
- HTML全文浏览量: 304


 下载:
下载:



 下载:
下载:

