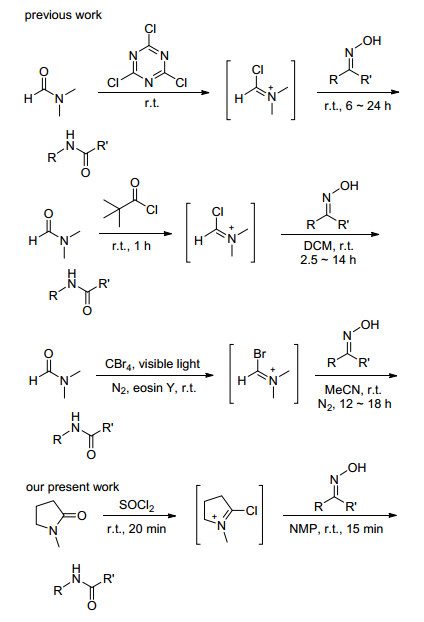
 图式 1
Vilsmeier试剂在Beckmann重排中的应用
Scheme1.
Application of Vilsmeier salts in Beckmann rearrangement
图式 1
Vilsmeier试剂在Beckmann重排中的应用
Scheme1.
Application of Vilsmeier salts in Beckmann rearrangement

Citation: Zhou Anxi, Zheng Dagui, Zhu Xianhong, Wang Meimei. SOCl2/N-Methyl Pyrrolidone-Mediated Beckmann Rearrangement of Ketoximes[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2905-2910. doi: 10.6023/cjoc201706020

SOCl2/N-甲基吡咯烷酮促进的酮肟Beckmann重排
-
关键词:
- Beckmann重排
- / Vilsmeier试剂
- / 酮肟
- / 酰胺
English
SOCl2/N-Methyl Pyrrolidone-Mediated Beckmann Rearrangement of Ketoximes
-
Key words:
- Beckmann rearrangement
- / vilsmeier reagent
- / ketoximes
- / amides
-
Beckmann重排反应自1886年被首次报道以来, 化学工作者们一直致力于其在酰胺或者内酰胺合成中的发展和应用[1].经典的Beckmann重排反应条件比较苛刻, 比如使用强酸作为反应促进剂且产生大量的副产物[2].为了使得反应更为经济高效和环境友好, 各种温和高效的有机促进方法已被报道, 比如三聚氰氯[3]、三苯基膦/碘[4]、双(2-氧代-3-噁唑烷基)次磷酰氯[5]、溴化二甲基溴化硫-氯化锌[6]、三聚膦腈[7]、正丙基膦酸酐[8]、对甲苯磺酰氯[9]、1, 2-二苯基-3-氯环丙烯正离子[10]、1, 2-二苯基-3, 3-二氯环丙烯[11]等.此外, 化学工作者们通过使用三聚氰氯、特戊酰氯和四溴化碳原位生成Vilsmeier试剂[12~14], 并将其应用于酮肟Beckmann重排反应合成酰胺或内酰胺(Scheme 1).然而, 以上反应在溶剂毒性、反应时长、化学试剂价格以及实验操作等方面都存在提升和改进的空间.
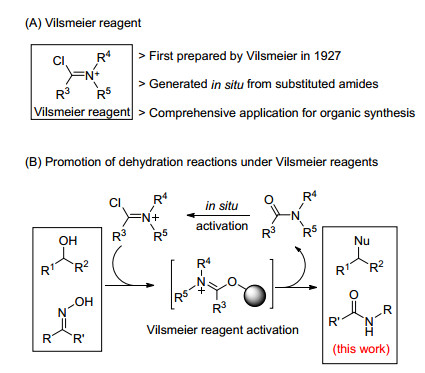
最近, 我们通过使用Vilsmeier试剂实现了醇的亲核取代反应, 成功合成得到氯代产物[15].该反应的特点在于可以应用于克级规模且反应过程中所生成的副产物N, N-二甲基乙酰胺(DMAc)和HCl易于除去.更为重要的是, 该反应中Vilsmeier试剂可以通过氯化试剂与取代酰胺试剂反应原位生成, 从而为有机合成设计提供了新方法和新思路.为了进一步拓展我们所发展的Vilsmeier试剂在Beckmann重排反应中的应用(Scheme 2).我们设计发展了SOCl2与N-甲基吡咯烷酮(NMP)原位生成Vilsmeier试剂促进的酮肟Beckmann重排反应, 成功合成得到内酰胺和酰胺及其衍生物.
1 结果与讨论
1.1 反应条件优化
在反应起始阶段, 我们选择使用苯乙酮肟(1a)作为模板反应底物.当使用之前工作中所用的DMAc和SOCl2反应原位生成对应的Vilsmeier试剂V2, 以此来促进苯乙酮肟的Beckmann重排反应; 室温条件下, 我们以52%的收率合成得到N-乙酰苯胺(2a)(表 1, Entry 1).为了进一步优化该反应, 我们尝试选择原位生成的其它Vilsmeier试剂来促进该反应的进行; 当使用N, N-二甲基甲酰胺(DMF)和NMP原位生成相应的Vilsmeier试剂V1[16]和V3作为反应促进剂, 分别以15%和94%的收率得到目标产物(表 1, Entries 2~3).由以上实验可知: NMP的效果最佳.基于以上事实, 我们随后考察了氯化试剂对该反应的影响; 当氯化亚砜被草酰氯替代时, 反应收率明显降低(表 1, Entry 4).接下来, 我们分别对反应氯化试剂用量、浓度、时间、温度和溶剂进行了实验(表 1, Entries 5~12;溶剂筛选见SI).实验结果表明反应的最佳条件是:室温条件下, SOCl2 (7.5 mmol, 0.55 mL)和NMP (20.0 mL)反应20 min, 而后加入苯乙酮肟(1a) (5 mmol)继续反应15 min, 最终以94%收率得到目标产物(表 1, Entry 3).

Entry [Cl] (mol%) Solvent (mL) Temp./℃ Time/min Yield/% 1 SOCl2 (150) DMAc (20) 25 15 52 2 SOCl2(150) DMF (20) 25 15 15 3 SOCl2 (150) NMP (20) 25 15 94 4 (COCl)2 (150) NMP (20) 25 15 35 5 SOCl2 (100) NMP (20) 25 15 66 6 SOCl2 (200) NMP (20) 25 15 94 7 SOCl2 (150) NMP (15) 25 15 84 8 SOCl2 (150) NMP (25) 25 15 83 9 SOCl2 (150) NMP (20) 25 25 94 10 SOCl2 (150) NMP (20) 25 5 53 11 SOCl2 (150) NMP (20) 0 15 76 12 SOCl2 (150) NMP (20) 50 15 94 aThe reaction was conducted with 1a (5.0 mmol) under an air atmosphere.
bIsolated yield after aqueous workup followed by column chromatography.1.2 反应底物筛选
基于以上结果, 我们在最佳条件下对反应底物适用范围进行了筛选, 如表 2所示.一系列取代苯乙酮肟在该反应条件下都可以顺利进行.实验结果表明:不论苯环上所连基团是吸电子基还是给电子基, 反应都能够顺利进行且以较好的产率得到目标产物; 尽管苯环上连有吸电子基时产率会相应地降低(表 2, Entry 1).除此之外, 苯乙丁酮肟(1g~1h)、萘乙酮肟(1i)、二苯甲酮肟(1j)、二噻吩甲酮肟(1k)、二苄甲酮肟(1l)、环十二酮肟(1m)以及环己酮肟(1n)等在该反应条件下也能顺利进行重排转化, 同样以较好的产率得到目标产物(表 2, Entries 2~8).值得注意的是:与已知的Vilsmeier试剂促进的方法相比, 该方法能够极大地缩短酰胺合成时间; 此外, 苯异丁酮肟作为反应底物且其顺反异构体比例为1.2:1 (E:Z)时, 以91%总收率得到N-苯基异丁酰胺(2g)和N-异丙基苯甲酰胺(2h) (1.2:1)两种化合物(表 2, Entry 2);也正如预测的那样, 该反应没有顺式迁移重排的现象发生.同时, 该实验结果表明:在该反应条件下, 酮肟没有发生异构化.有趣的是: 2-羟基酮肟(1o)在该反应条件下发生Beckmann重排串联环化反应, 以73%的收率得到2-甲基苯并噁唑(2o) (Eq. 1).
Entry Substrate Product Yield/% 1 

94
93
92
94
89
842 

91 3 

92 4 

96 5 

94 6 

92 7 

89 8 

88 aReaction conditions: 1 (5.0 mmol), SOCl2 (7.5 mmol) in NMP (20 mL) under an air atmosphere at room temperarure. bIsolated yield. 1.3 反应机理探讨
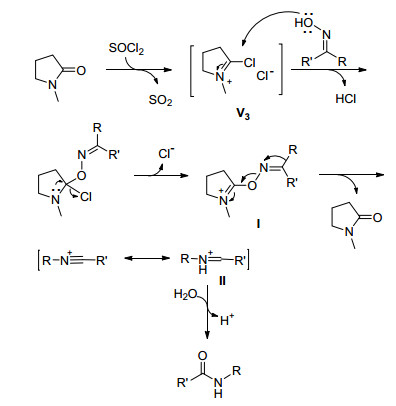
Deng等[17]对有机小分子促进Beckmann重排机理进行了研究, 通过实验和密度泛函(DFT)计算表明, 反应经自蔓延过程进行.为探究本实验反应机理, 我们进行了相关实验.首先, 若减少氯化亚砜的用量, 则产率相应降低; 此外, 在加水之前, 我们通过薄层色谱(TLC)跟踪反应发现没有目标产物生成; 该实验说明该反应不是通过自蔓延的过程进行.其次, 当我们尝试使用NMP与过量的氯化亚砜反应, 得到Vilsmeier试剂V3 (Scheme 3)且通过1H NMR, 13C NMR和高分辨质谱得以佐证[18].因此, 结合以上实验现象和数据, 推断该反应机理与之前Vilsmeier试剂及有关有机小分子促进Beckmann重排反应类似[12~14], 我们认为该反应机理正如Scheme 3所示.首先, 氯化亚砜与NMP原位生成Vilsmeier试剂V3, 然后酮肟与其反应得到活性中间体Ⅰ.接着, 该活性物质进一步发生重排得到中间体Ⅱ, 最后与水反应得到酰胺目标产物.
2 结论
总之, 我们发展了一种条件温和、经济高效地合成酰胺或内酰胺的方法.该方法通过SOCl2与NMP反应原位生成一种新的Vilsmeier试剂促进酮肟发生Beckmann重排反应来得以实现.与经典的Beckmann重排反应相比, 本法具有反应条件温和、反应时间短、产物产率高、后处理简单等特点; 而且与前人Vilsmeier试剂促进酮肟发生Beckmann重排反应相比, 本法具有反应时间短、原料廉价易得、反应体系简单以及反应副产物简单易除等特点.是由酮肟制备酰胺或者内酰胺的有效方法之一.此外, 该反应体系还可以促进2-羟基苯乙酮肟经Beckmann重排/串联环化反应成功合成了2-甲基苯并噁唑.
3 实验部分
3.1 仪器与试剂
X-6精密显微熔点测定仪(北京亚力恩机电技术研究院, 温度计未校正), Bruker Avance核磁共振波谱仪(德国Bruker公司), Bruker microTOF-Q Ⅱ高分辨质谱仪.
氯化亚砜和所用底物酮肟购自于阿拉丁试剂和阿法埃莎公司.石油醚(PE, 60~90 ℃)、乙酸乙酯(EA)、NMP为市售分析纯.普通柱层析硅胶(200~300目).
3.2 实验方法
取20 mL N-甲基吡咯烷酮(NMP)于50 mL圆底烧瓶中, 室温下加入氯化亚砜(7.5 mmol, 0.55 mL)并搅拌20 min.而后, 称取酮肟(5.0 mmol)加入该混合液中继续反应, TLC跟踪监测直至反应完全为止.待反应完全后, 加入水(10 mL)淬灭反应, 接着加饱和NaHCO3溶液(40 mL), 最后二氯甲烷萃取(50 mL×3);合并有机相用水(50 mL×3)和饱和食盐水洗涤, 然后经过干燥、浓缩以及柱层析得到目标产物(己内酰胺须经减压蒸馏分离纯化).
N-苯基乙酰胺(2a)[10, 11, 14]:白色固体, 0.636 g, 产率94%. m.p. 115~117 ℃ (Lit.[11] m.p. 114~115 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.85 (s, 1H), 7.50 (d, J=8.0 Hz, 2H), 7.29 (t, J=8.0 Hz, 2H), 7.09 (t, J=7.2 Hz, 1H), 2.15 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 168.7, 137.9, 128.9, 124.2, 120.0, 24.4. HRMS calcd for C8H10NO [M+H]+ 136.0757; found 136.0764.
N-对甲苯基乙酰胺(2b)[11, 14, 19]:白色固体, 0.694 g, 产率93%. m.p. 151~153 ℃ (Lit.[19] m.p. 149~151 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.79 (s, 1H), 7.37 (d, J=8.4 Hz, 2H), 7.08 (d, J=8.4 Hz, 2H), 2.29 (s, 3H), 2.12 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 168.6, 135.4, 133.8, 129.3, 120.1, 24.3, 20.8. HRMS calcd for C9H12NO[M+H]+ 150.0913; found 150.0909.
N-(4-甲氧基苯基)乙酰胺(2c)[10, 14]:白色固体, 0.760 g, 产率92%. m.p. 130~132 ℃ (Lit.[14] m.p. 129~131 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.39 (s, 1H), 7.29 (d, J=8.8 Hz, 2H), 6.70 (d, J=8.8 Hz, 2H), 3.65 (s, 3H), 1.99 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 168.6, 156.3, 131.0, 122.0, 114.0, 55.4, 24.1. HRMS calcd for C9H12NO2[M+H]+ 166.0863; found 166.0854.
N-(4-羟基苯基)乙酰胺(2d)[14]:白色固体, 0.710 g, 产率94%. m.p. 168~170 ℃ (Lit.[14] m.p. 167~168 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 9.67 (s, 1H), 9.17 (s, 1H), 7.36 (d, J=8.8 Hz, 2H), 6.71 (d, J=8.8 Hz, 2H), 2.00 (s, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 168.2, 153.7, 131.5, 121.5, 115.6, 24.2. HRMS calcd for C8H10NO2 [M+H]+ 152.0706; found 152.0709.
N-(4-溴苯基)乙酰胺(2e)[11, 14]:白色固体, 0.953 g, 产率89%. m.p. 167~169 ℃ (Lit.[14] m.p. 166~167 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 10.06 (s, 1H), 7.56 (d, J=8.8 Hz, 2H), 7.46 (d, J=8.8 Hz, 2H), 2.05 (s, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 168.9, 139.1, 131.9, 121.3, 114.9, 24.4. HRMS calcd for C8H9BrNO [M+H]+ 213.9862; found 213.9858.
N-(4-硝基苯基)乙酰胺(2f)[14, 20]:黄色固体, 0.757 g, 产率84%. m.p. 217~219 ℃ (Lit.[20] m.p. 215~216 ℃); 1H NMR (400 MHz, DMSO-d6) δ: 10.55 (s, 1H), 8.21 (d, J=9.2 Hz, 2H), 7.83 (d, J=9.2 Hz, 2H), 2.13 (s, 3H); 13C NMR (100 MHz, DMSO-d6) δ: 169.8, 145.9, 142.4, 125.4, 119.0, 24.7. HRMS calcd for C8H9N2O3[M+H]+ 181.0608; found 181.0604.
N-苯基异丁酰胺(2g)[21]:白色固体, 0.408 g, 产率50%. m.p. 109.0~111.0 ℃ (Lit.[21] m.p. 110~111 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.53 (d, J=8.0 Hz, 2H), 7.47 (s, 1H), 7.28 (t, J=7.2 Hz, 2H), 7.10 (t, J=7.2 Hz, 1H), 2.52 (hept, J=7.2 Hz, 1H), 1.24 (d, J=6.8 Hz, 6H); 13C NMR (100 MHz, CDCl3) δ: 175.4, 138.1, 128.9, 124.1, 119.8, 36.6, 19.6. HRMS calcd for C10H14NO[M+H]+ 164.1070; found 164.1067.
N-异丙基苯甲酰胺(2h)[22]:白色固体, 0.335 g, 产率41%. m.p. 100~102 ℃ (Lit.[22] m.p. 100~102 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.77~7.74 (m, 2H), 7.50~7.45 (m, 1H), 7.43~7.38 (m, 1H), 6.05 (s, 1H), 4.35~4.22 (m, 1H), 1.26 (d, J=6.8 Hz, 6H); 13C NMR (100 MHz, CDCl3) δ: 166.7, 134.9, 131.2, 128.4, 126.8, 41.8, 22.8. HRMS calcd for C10H14NO [M+H]+ 164.1070; found 164.1067.
N-萘-2-基乙酰胺(2i)[10, 14]:白色固体, 0.852 g, 产率92%. m.p. 130~131 ℃ (Lit.[14] m.p. 132~134 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.16 (d, J=1.2 Hz, 1H), 7.86 (s, 1H), 7.76~7.72 (m, 3H), 7.47~7.36 (m, 3H), 2.20 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 168.8, 135.4, 133.8, 130.6, 128.7, 127.6, 127.5, 126.4, 125.0, 119.9, 116.7, 24.6. HRMS calcd for C12H12NO[M+H]+ 186.0913; found 186.0910.
N-苯基苯甲酰胺(2j)[10, 14, 23]:白色固体, 0.947, 产率96%. m.p. 165~166 ℃ (Lit.[23] m.p. 165~166 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.94 (s, 1H), 7.87~7.84 (m, 2H), 7.64 (d, J=7.6 Hz, 2H), 7.56~7.51 (m, 1H), 7.48~7.44 (m, 2H), 7.38~7.25 (m, 2H), 7.15 (t, J=7.4 Hz, 1H); 13C NMR (100 MHz, CDCl3) δ: 165.8, 137.9, 135.0, 131.8, 129.1, 128.7, 127.0, 124.5, 120.2. HRMS calcd for C13H12NO[M+H]+ 198.0913; found 198.0916.
N-(噻吩-2-基)噻吩-2-甲酰胺(2k)[24]:白色固体, 0.983 g, 产率94%. m.p. 204~206 ℃ (Lit.[24] m.p. 205~206 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.81 (s, 1H), 7.70 (d, J=3.6 Hz, 1H), 7.55 (d, J=4.8 Hz, 1H), 7.12~7.09 (m, 1H), 6.89~6.85 (m, 1H), 6.82~6.79 (m, 1H); 13C NMR (100 MHz, CDCl3) δ: 158.6, 138.7, 137.4, 131.3, 129.0, 128.0, 124.1, 118.6, 112.8. HRMS calcd for C9H8NOS2 [M+H]+ 210.0042; found 210.0042.
N-苄基苯乙酰胺(2l)[10, 11, 14, 25]:白色固体, 1.036 g, 产率92%. m.p. 121.0~123 ℃ (Lit.[25] m.p. 121~123 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.35~7.21 (m, 8H), 7.16 (d, J=6.8 Hz, 2H), 5.92 (s, 1H), 4.38 (d, J=5.6 Hz, 2H), 3.59 (s, 2H); 13C NMR (100 MHz, CDCl3) δ: 166.7, 134.9, 137.4, 131.2, 128.4, 126.8, 41.8, 22.8. HRMS calcd for C15H16NO[M+H]+ 226.1226; found 226.1229.
环十二内酰胺(2m)[10, 11, 14]:白色固体, 0.878 g, 产率89%. m.p. 151~153 ℃ (Lit.[10] m.p. 149~153 ℃); 1H NMR (400 MHz, CDCl3) δ: 5.99 (s, 1H), 3.31~3.27 (m, 2H), 2.23~2.19 (m, 2H), 1.71~1.65 (m, 2H), 1.52~1.48 (m, 2H), 1.38~1.32 (m, 14H); 13C NMR (100 MHz, CDCl3) δ: 173.5, 39.0, 36.8, 28.2, 26.7, 26.3, 26.1, 25.6, 25.2, 24.9, 24.5, 23.8. HRMS calcd for C12H24NO [M+ H]+ 198.1852; found 198.1857.
己内酰胺(2n)[10, 11, 14]:白色固体, 0.498 g, 产率88 %. m.p. 69~71 ℃ (Lit.[10] m.p. 69~71 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.59 (s, 1H), 3.23~3.18 (m, 2H), 2.47~2.44 (m, 2H), 1.76~1.64 (m, 6H); 13C NMR (100 MHz, CDCl3) δ: 179.3, 42.3, 36.4, 30.3, 29.3, 22.9. HRMS calcd for C6H12NO[M+H]+ 114.0913; found 114.0906.
2-甲基苯并噁唑[26]:黄色油状液体, 产率73%. 1H NMR (400 MHz, CDCl3) δ: 7.67~7.63 (m, 1H), 7.48~7.45 (m, 1H), 7.30~7.27 (m, 2H), 2.63 (s, 3H); 13C NMR (100 MHz, CDCl3) δ: 163.7, 150.9, 141.3, 124.4, 124.0, 119.3, 110.1, 14.4. HRMS calcd for C8H8NO[M+H]+ 134.0600; found 134.0603.
辅助材料(Supporting Information) 化合物2a~2o的1H NMR和13C NMR谱图; 苯异丁酮肟的1H NMR和13C NMR谱图; NMP与SOCl2反应生成的Vilsmeier盐以及NMP的1H NMR和13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
For reviews, see: (a) Gawly, R. E. Org. React. 1988, 35, 1 and references therein.
(b) Smith, M. B.; March, J. In Advanced Organic Chemistry, 5th ed., John Wiley and Sons, New York, 2001, p. 1415 and references cited therein.
(c) Beckmann, E.; Ber. Dtsch. Chem. Ges. 1886, 19, 988.
(d) Blatt, A. H. Chem. Rev. 1933, 12, 215.
(e) Arisawa, M.; Yamaguchi, M. Org. Lett. 2001, 3, 311.
(f) Ramalingan, C.; Park, Y.-T. J. Org. Chem. 2007, 72, 4536.
(g) Li, J.; Cheng, C.; Zhang, X.; Li, Z.; Cai, F.; Xue, Y.; Liu, W. Chin. J. Chem. 2012, 30, 1687. -
[2]
For selected examples of catalytic Beckmann rearrangement, see:
(a) Narasaka, K.; Kusama, H.; Yamashita, Y.; Sato, H. Chem. Lett. 1993, 489.
(b) Ichihashi, H.; Kitamura, M. Catal. Today 2002, 73, 23.
(c) Yadav, J. S.; Reddy, B. V. S.; Madhavi, A. V.; Ganesh, Y. S. S. J. Chem. Res., Synop. 2002, 236.
(d) Srinvas, K. V. N. S.; Reddy, E. B.; Das, B. Synlett 2002, 625.
(e) Ikushima, Y.; Sato, O.; Sato, M.; Hatakeda, K.; Arai, M. Chem. Eng. Sci. 2003, 58, 935.
(f) Fernández, A. B.; Boronat, M.; Blasco, T.; Corna, A. Angew. Chem. Int. Ed. 2005, 44, 2370.
(g) Kopple, K. D.; Katz, J. J. J. Org. Chem. 1959, 24, 1975.
(h) Sato, H.; Yoshioka, H.; Izumi, Y. J. Mol. Catal. A: Chem. 1999, 149, 25. -
[3]
Xu, F.; Wang, N.-G.; Tian, Y.-P.; Chen, Y.-M.; Liu, W.-C. Synth. Commun. 2012, 42, 3532. doi: 10.1080/00397911.2011.585270
-
[4]
Furuya, Y.; Ishihara, K.; Yamamoto, H. J. Am. Chem. Soc. 2005, 127, 11240. doi: 10.1021/ja053441x
-
[5]
Zhu, M.; Cha, C.; Deng, W.-P.; Shi, X.-X. Tetrahedron Lett. 2006, 47, 4861. doi: 10.1016/j.tetlet.2006.05.029
-
[6]
Yadav, L. D. S.; Patel, R.; Srivastava, V. P. Synthesis 2010, 1771. doi: 10.1002/chin.201039059/full
-
[7]
(a) Hashimoto, M.; Obora, Y.; Sakaguchi, S.; Ishii, Y. J. Org. Chem. 2008, 73, 2894.
(b) Dong, J. D. Master's Thesis, East China University of Science and Technology, 2009, p. 21~31. -
[8]
Augustine, J. K.; Kumar, R.; Bombrun, A.; Mandal, A. B. Tetrahedron Lett. 2011, 52, 1074. doi: 10.1016/j.tetlet.2010.12.090
-
[9]
Pi, H.-J.; Dong, J.-D.; An, N.; Du, W.; Deng, W.-P. Tetrahedron 2009, 65, 7790. doi: 10.1016/j.tet.2009.07.036
-
[10]
Srivastava, V. P.; Patel, R.; Garima; Yadav, L. D. S. Chem. Commun. 2010, 46, 5808. doi: 10.1039/c0cc00815j
-
[11]
Vanos, C. M.; Lambert, T. H. Chem. Sci. 2010, 1, 705. doi: 10.1039/c0sc00421a
-
[12]
Luca, L. D.; Giacomelli, G.; Porcheddu, A. J. Org. Chem. 2002, 67, 6272. doi: 10.1021/jo025960d
-
[13]
Narahari, S. R.; Reguri, B. R.; Mukkanti, K. Tetrahedron Lett. 2011, 52, 4888. doi: 10.1016/j.tetlet.2011.07.045
-
[14]
Srivastava, V. P.; Yadav, A. K.; Yadav, L. D. S. Synlett 2014, 665. doi: 10.1002/chin.201436057/pdf
-
[15]
郑大贵, 周安西, 祝显虹, 郑洪富, 孙向前, 有机化学, 2016, 36, 137. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345239.shtmlZheng, D.; Zhou, A.; Zhu, X.; Zheng, H.; Sun, X. Chin. J. Org. Chem. 2016, 36, 137(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345239.shtml
-
[16]
Arrieta, A.; Aizpurua, J. M.; Palomo, C.; Tetrahedron Lett. 1983, 25, 3365. http://www.sciencedirect.com/science/article/pii/S0040403901813861
-
[17]
(a) An, N.; Tian, B.-X.; Pi, H.-J.; Eriksson, L. A.; Deng, W.-P. J. Org. Chem. 2013, 78, 4297.
(b) Tian, B.-X.; An, N.; Deng, W.-P.; Eriksson, L. A. J. Org. Chem. 2013, 78, 6782. -
[18]
Cantillo, D.; Gutmann, B.; Kappe, C. O. J. Am. Chem. Soc. 2011, 133, 4465. doi: 10.1021/ja109700b
-
[19]
Ramalingan, C.; Park, Y.-T. J. Org. Chem., 2007, 72, 4536. doi: 10.1021/jo070297k
-
[20]
Smith, Jr, W. T.; King, G. G. J. Org. Chem. 1959, 24, 976. doi: 10.1021/jo01089a023
-
[21]
Clayden, J.; Stimsonab, C. C.; Keenan, M. Chem. Commun. 2006, 1393. http://www.ncbi.nlm.nih.gov/pubmed/16550277
-
[22]
Murai, N.; Komatsu, M.; Yagii, T.; Nishihara, H.; Ohahiro, Y.; Agawa, T. J. Org. Chem. 1977, 42, 847. doi: 10.1021/jo00425a018
-
[23]
Comerford, J. W.; Clark, J. H.; Macquarie, D. J.; Breeden, S. W. Chem. Commun. 2009, 2562. http://www.ncbi.nlm.nih.gov/pubmed/19532890
-
[24]
Zhang, Z.; Yu Y.; Liebeskind, L. S. Org. Lett. 2008, 10, 3005. doi: 10.1021/ol8009682
-
[25]
Ignatenko, V. A.; Deligonul, N.; Viswanathan, R. Org. Lett. 2010, 12, 3594. doi: 10.1021/ol1012372
-
[26]
Saha, P.; Ramana, T.; Purkait, N.; Ali, M. A.; Paul, R.; Punniyamurthy, T. J. Org. Chem. 2009, 74, 8719. doi: 10.1021/jo901813g
-
[1]
-
表 1 反应条件优化a, b
Table 1. Optimization of the reaction conditions.a, b

Entry [Cl] (mol%) Solvent (mL) Temp./℃ Time/min Yield/% 1 SOCl2 (150) DMAc (20) 25 15 52 2 SOCl2(150) DMF (20) 25 15 15 3 SOCl2 (150) NMP (20) 25 15 94 4 (COCl)2 (150) NMP (20) 25 15 35 5 SOCl2 (100) NMP (20) 25 15 66 6 SOCl2 (200) NMP (20) 25 15 94 7 SOCl2 (150) NMP (15) 25 15 84 8 SOCl2 (150) NMP (25) 25 15 83 9 SOCl2 (150) NMP (20) 25 25 94 10 SOCl2 (150) NMP (20) 25 5 53 11 SOCl2 (150) NMP (20) 0 15 76 12 SOCl2 (150) NMP (20) 50 15 94 aThe reaction was conducted with 1a (5.0 mmol) under an air atmosphere.
bIsolated yield after aqueous workup followed by column chromatography.表 2 酮肟底物的适用范围a, b
Table 2. Scope of ketoximesa, b
Entry Substrate Product Yield/% 1 

94
93
92
94
89
842 

91 3 

92 4 

96 5 

94 6 

92 7 

89 8 

88 aReaction conditions: 1 (5.0 mmol), SOCl2 (7.5 mmol) in NMP (20 mL) under an air atmosphere at room temperarure. bIsolated yield. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 23
- 文章访问数: 5564
- HTML全文浏览量: 283


 下载:
下载:


 下载:
下载:

