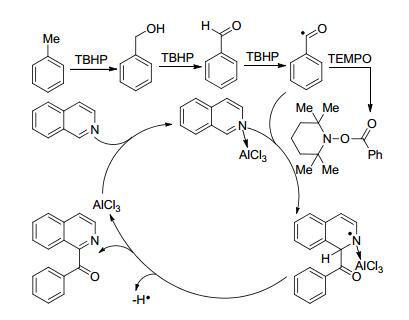
 图式 1
异喹啉衍生物的酰基化反应的可能机理
Scheme1.
Proposed mechanism for the acylation of isoquinolines
图式 1
异喹啉衍生物的酰基化反应的可能机理
Scheme1.
Proposed mechanism for the acylation of isoquinolines

Citation: Zhu Wenming, Ying Weiwei, Wei Wenting. Progress in Carbon-Oxygen Bonds Formation Using tert-Butyl Hydroperoxide[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2841-2849. doi: 10.6023/cjoc201706005

过氧化叔丁醇参与碳-氧键构建的研究进展
English
Progress in Carbon-Oxygen Bonds Formation Using tert-Butyl Hydroperoxide
-
Key words:
- tert-butyl hydroperoxide
- / carbon-oxygen bond
- / radical reaction
-
碳-氧键不仅广泛地存在于多种具有生物活性的分子中, 而且在一定程度上成为决定其生理活性的关键基团[1~6].因此, 采用便捷、高效的方法构建碳-氧键一直是有机合成中的关注焦点.经过多年的发展, 碳-氧键构建取得了较大的进展, 涌现了许多经典合成方法.传统构建碳-氧键的方法不仅需要过量的反应原料、相对苛刻的反应条件, 而且反应收率较低[7~10].近几十年来, 有机合成化学家们发展了乌尔曼等经典的偶联反应来构建碳-氧键.但是这些偶联反应需要使用强碱且金属催化剂在有机溶剂中的溶解性较差, 限制了其在有机合成中的进一步应用[11~14].近年来, 利用过渡金属催化的C—H键活化反应形成碳-氧键发展十分迅速, 但这些方法通常对反应底物的导向基有严格要求, 并且需要使用昂贵的金属催化剂和配体[15~18].因此, 急需发展出绿色可持续发展的构建碳-氧键的新方法.
过氧化叔丁醇参与的自由基反应具有原子经济性高、无需配体和额外氧化剂、有些甚至无需金属催化剂等优点, 因而近年来其已成为构建碳-氧键的一种重要策略.本文将从不同的反应底物类型出发, 对近年来过氧化叔丁醇参与碳-氧键构建的方法进行了综述.
1 与C(sp3)—H键反应
C(sp3)—H键是最稳定的化学键之一, 如何有效切断C(sp3)—H键进而构建碳-氧键一直是有机合成中具有挑战性的领域[19].通过过氧化叔丁醇等氧化剂氧化, 降低C(sp3)—H键的活化能从而实现氧化切断是有效途径之一. 2009年, Lee课题组[20]报道了过氧化叔丁醇氧化下由烷基芳烃合成芳香族羧酸的方法, 该反应通过微波照射, 无需添加额外有机溶剂及金属催化剂, 高效合成工业上具有重要应用价值的苯甲酸及邻苯二甲酸等化合物(Eq. 1).
2012年, Sun课题组[21]发展了钯催化下乙酰苯胺、甲苯和过氧化叔丁醇三组分的邻位酰化反应, 该方法通过甲苯衍生物与乙酰苯胺衍生物的氧化偶联反应实现.反应具有良好的底物普适性, 芳环上带有给电子或者吸电子基团的底物都可以顺利地发生反应.廉价和环境友好的过氧化叔丁醇被证明是该转化的有效氧化剂(Eq. 2).
2015年, Patel课题组[22]进一步实现了异喹啉衍生物的酰基化反应.该方法以AlCl3作为催化剂, 过氧化叔丁醇既是反应试剂又是氧化剂, 具有很高的原子经济性(Eq. 3).机理推测可能经过以下过程:首先, 在过氧化叔丁醇的氧化作用下甲苯产生酰基自由基.随后, 酰基自由基进攻异喹啉衍生物并经芳构化得到目标产物(Scheme 1).最近, Bhanage课题组[23]和Patel课题组[24]也分别实现了铜催化下2-苯基吡啶衍生物的酰氧基化反应.
2016年, Sun课题组[25]发展了苄氰衍生物与过氧化叔丁醇的氧化偶联反应, 该方法的特点在于:无需使用过渡金属催化剂, 在过氧化叔丁醇的氧化下只需要一步就能同时构建C—O键和C=O键, 这无疑具有实际应用价值(Eq. 4). 2017年, Niknam课题组[26]以Cu(OAc)2作为催化剂也实现了该类型的氧化偶联反应.
2017年, Xu课题组[27]报道了过氧化叔丁醇促进下苄基C(sp3)—H键的直接氧化反应合成芳基酮.该方法反应条件温和, 无需过渡金属参与, 操作便捷(Eq. 5).
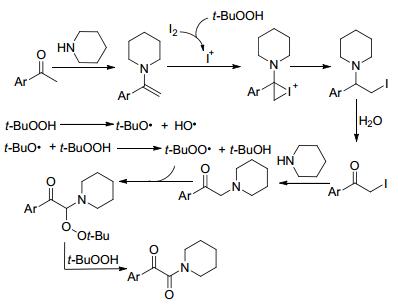
2012年, Wang课题组[28]报道了苯乙酮衍生物和胺的氧化偶联反应合成α-酮酰胺的新方法.该反应发展了过氧化叔丁醇/碘的经典体系, 无需添加任何金属催化剂和额外的有机溶剂, 并且在常温下就能实现氧化偶联反应(Eq. 6).可能经历的反应过程是先得到α-碘代芳酮, 其进一步与胺反应并经氧化反应得到目标产物(Scheme 2).随后, Wang课题组[29, 30]进一步报道了两种合成α-酮酰胺的有效方法. 2016年, Patel课题组[31]也报道了苯乙酮衍生物和烷基亚磷酰胺的氧化偶联反应.
2015年, Patel课题组[32]进一步利用过氧化叔丁醇/四正丁基碘化铵的体系实现了酯类化合物和苄胺衍生物的氧化偶联反应, 该反应底物适用范围广泛, 合成方法简单(Eq. 7). 2016年, Zhang课题组[33]在过氧化叔丁醇/四正丁基碘化铵体系下也实现了醛和烷基卤化物的氧化酯化反应.
随后, Patel课题组[34]实现了过氧化叔丁醇/四正丁基碘化铵体系下由烷基苯合成苄酯衍生物的新方法.该反应是自由基反应的机理, 反应条件温和且操作方便(Eq. 8).
2014年, Sun课题组[35]利用过氧化叔丁醇/四正丁基碘化铵体系发展了芳基乙烷衍生物和二烷基甲酰胺的氧化偶联反应.该方法不仅构建了C=O键, 而且构建了C—N键, 为α-酮酰胺类化合物的合成提供了一条便捷的途径(Eq. 9).
2014年, Han课题组[36]发展了芳香醛与环烷烃通过C—H氧化反应构建C—O键的方法.该方法通过过氧化叔丁醇产生环烷基自由基和酰基自由基, 以Cu(OAc)2作为催化剂, 顺利地实现C—H氧化反应, 并合成环烯酯类化合物(Eq. 10).
2014年, Cheng课题组[37]发展了苄醇衍生物和酮的氧化偶联反应.该反应中, 苄醇被氧化成醛进而产生酰基自由基, 控制实验表明, 该反应涉及自由基机理(Eq. 11).
2014年, Azizi课题组[38]报道了高价碘促进的甲基化合物的酰胺化反应.该体系能选择性地将甲基化合物氧化为酰胺, 反应过程中没有检测到羧酸的产生(Eq. 12). 2017年, Wang课题组[39]通过铜催化氧化也实现了该类型反应, 该方法无需额外的有机溶剂, 并且反应在50 ℃时就能顺利进行.
2 与烯烃C(sp2)—H键反应
烯基是有机化学中的重要官能团, 利用双键的高反应活性可以合成结构多样的有机化合物[40].另一方面, 烯基C(sp2)—H键键能较低, 容易引发其它反应, 反应选择性降低.因此, 如何高选择性地与烯烃反应并构建碳-氧键是此类反应的关键. 2010年, Jiang课题组[41]利用过氧化叔丁醇/碘的无金属体系实现了“一锅法”氧化/环化反应, 高效合成多取代噁唑衍生物.他们利用廉价易得的芳基烯烃和苄胺, 通过自由基环化反应, 高选择性地构建具有重要实用价值的多取代噁唑中间体(Eq. 13). 2016年, Khan课题组[42]在此基础上进一步发展了铜催化下分子内环化反应合成噁唑衍生物的方法.该反应在室温下就能进行.
2014年, Patel课题组[43]报道了钯催化下2-苯基吡啶衍生物的导向邻位酰基化反应.在过氧化叔丁醇的氧化作用下, 芳基烯烃经氧化断裂产生酰基自由基, 其在钯的催化下选择性进攻2-苯基吡啶衍生物的邻位.但是该方法需要使用5 equiv.的过氧化叔丁醇作为氧化剂, 并且反应温度较高(Eq. 14).
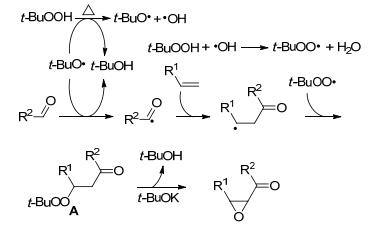
2015年, Li课题组[44]首次报道了无金属催化下烯烃、醛和过氧化叔丁醇三组分的氧化偶联反应, 一步实现了医药中间体2, 3-环氧酮衍生物的合成.其高效便捷的合成方法受到了有机合成工作者的广泛关注, 该方法反应条件简单并且底物适用范围广泛(Eq. 15).可能的反应过程如下:首先, 在过氧化叔丁醇的作用下醛产生酰基自由基.随后, 酰基自由基与烯烃加成得到烷基自由基中间体, 并进一步与过氧烷基自由基反应得到中间A.最后, 在叔丁醇钾的作用下发生环化反应得到目标产物(Scheme 3).早在2011年, Wan课题组[45]就报道了醛类化合物与过氧化叔丁醇的直接氧化偶联反应.
2014年, Li课题组[46]发展了烯烃与酰胺的氧化双官能团化反应.反应以过氧化叔丁醇作为氧化剂, 叔丁醇钾作为催化剂, 乙腈作为反应溶剂(Eq. 16).
2015年, Chen课题组[47]报道了钒催化下烯烃与醛的氧化偶联反应.与Li课题组不同的是, 该方法得到是β-羟基酮衍生物.值得指出的是, 实验表明VO(acac)2是唯一能选择性得到β-羟基酮衍生物的催化剂, 其它类似的催化剂Fe(acac)2、Fe(acac)3、Co(acac)2、Cu(acac)2、Rh(acac)2、Pd(acac)2都未能得到预期的目标产物(Eq. 17).
2015年, Wang课题组[48]进一步发展了烯烃与酮类化合物的氧化偶联反应, 通过对反应底物的设计高区域选择性地合成出具有应用价值的1, 4-二羰基化合物.该反应发展了铜-锰的共同催化体系, 以过氧化叔丁醇作为氧化剂.该方法涉及酮自由基对碳碳双键的自由基加成反应(Eq. 18).
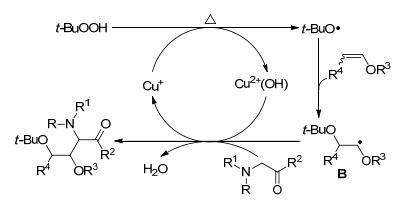
2015年, Li课题组[49]在研究中进一步发展了过氧化叔丁醇参与的烯醚化合物与α-胺基羰基化合物的双官能团化反应.他们从氧化自由基反应的理念出发, 实现了铜催化下烯醚的烷氧基化反应, 为合成氨基酸衍生物提供了一种简单快捷的新方法.通过控制实验检测到亚胺中间体的存在并通过亚胺的反应进一步明确了该反应的机理(Eq. 19).可能的反应机理如下:首先Cu+与过氧化叔丁醇反应得到烷基氧自由基. 随后, 烷基氧自由基与烯醚加成得到烷基自由基中间体B.最后, 烷基自由基中间体B作用于α-胺基羰基化合物并伴随着对Cu2+(OH)的氢原子攫取得到目标产物(Scheme 4).
2015年, Wan课题组[50]实现了温和条件下烯烃与重氮化合物的氧化偶联反应.该反应一步构建了C—O键和C—C键, 为γ-过氧酯衍生物的合成提供了一种简单的方法.值得指出的是, 通过优化反应体系可以进一步实现1, 4-二羰基化合物的选择性合成(Eq. 20).
2015年, Patel课题组[51]报道了烯烃、环烷烃及过氧化叔丁醇三组分间的氧化双官能团化反应.该反应具有明显的电子效应, 他们设计了强拉电子基团的烯烃来参与转化反应.有别于一般双官能团化反应的是该方法中自由基进攻的方向相反, 从而以较高的区域选择性得到三级过氧化酯衍生物(Eq. 21).
2016年, Xiang课题组[52]从简单易得的烯烃和碘代烷烃出发, 通过铜-银共催化的方法, 高选择性构建β-三氟甲基化/二氟甲基化的酮类化合物.他们通过实验证明了该反应为自由基反应, 但是催化体系中银催化剂的作用有待进一步研究(Eq. 22).随后, Wan课题组[53]实现了钴催化下烯烃、碘代烷烃及过氧化叔丁醇三组分的双官能团化反应.
2014年, Wan课题组[54]首次报道了醚类化合物的极性自由基交叉偶联反应, 该反应经历了自由基加成及重排的过程.在该方法中, 使用钴作为催化剂, 突破了之前相关反应只用铜作为催化剂的局限.但是反应中需要使用7 equiv.的过氧化叔丁醇作为自由基引发剂, 反应条件相对比较苛刻(Eq. 23).
2015年, Wan课题组[55]发展了钴催化下四组分串联反应合成β-酯-γ-胺基酮类化合物的新方法.该反应底物普适性好, 反应条件温和, 操作过程简单(Eq. 24).随后, Wan课题组[56]进一步探索发现铜催化剂也可以实现该类型转化.
2015年, Wan课题组[57]报道了自由基串联反应合成β-氟代烯胺的新方法.该方法不仅选择性切断了三个化学键, 而且高效构建了三个新的化学键(Eq. 25).随后, Wan课题组[58]进一步将该策略应用到β-氟代烯酮的合成当中.
3 与芳烃C(sp2)—H键反应
过氧化叔丁醇参与的通过芳烃来实现碳-氧键构建的报道不多. 2011年, Doyle课题组[59]报道了酚类化合物与过氧化叔丁醇的氧化自由基反应.该方法以Rh2(cap)4作为催化剂, 过氧化叔丁醇既作为氧化剂又作为反应底物, 具有较高的原子经济性(Eq. 26).
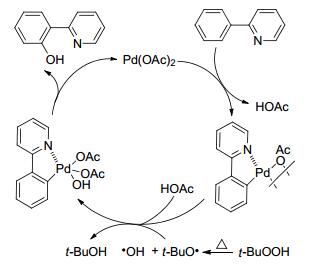
2015年, Sun课题组[60]报道了钯催化下2-芳基吡啶的羟基化反应.该方法以Pd(OAc)2作为催化剂, 1, 2-二氯乙烷(DCE)作为反应溶剂, 过氧化叔丁醇作为羟基源, 无需额外配体, 在吡啶的导向作用下高效构建C—O键(Eq. 27).他们提出了钯催化导向配位和羟基自由基相结合的反应机理(Scheme 5).
2016年, Fan课题组[61]在研究中发展了酚羟基导向的钯催化羟基化反应合成2, 2'-联苯酚类化合物的新方法.从同样的原料出发, 之前的相关报道都是合成二苯并呋喃, 但是该方法首次通过酚羟基的导向作用, 实现了芳烃C(sp2)—H键的羟基化反应(Eq. 28).
4 与杂环C(sp2)—H键反应
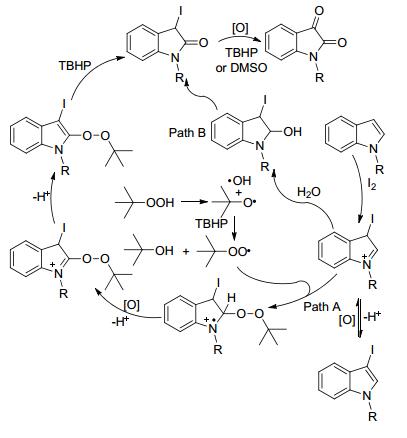
近年来, 杂环化合物参与的氧化反应取得了较大进展, 在天然产物、功能材料以及药物分子的合成中被普遍应用[62, 63]. 2014年, Wang课题组[64]报道了在过氧化叔丁醇/碘体系下由吲哚衍生物合成靛红衍生物的方法.该方法操作简单, 原料易得, 无需金属催化剂, 反应体系绿色(Eq. 29).控制实验表明, 3-碘吲哚为反应的中间体, 其在最优反应条件下以76%的收率得到相对应的产物靛红.自由基抑制剂的加入阻止了反应的进行, 表明该反应经历了自由基过程.基于以上控制实验, 他们提出了该反应的可能反应机理(Scheme 6).
2015年, Wang课题组[65]报道了2-芳基咪唑并吡啶衍生物在过氧化叔丁醇的作用下发生开环反应的方法.该方法经历了C—C键和C—N键的断裂, 从而选择性构建C=O键.该反应无需任何添加剂, 反应条件温和, 后处理简单.尽管作者提出了基于自由基过程的反应机理, 但是反应中C—C键和C—N键的断裂过程机理尚不清楚(Eq. 30).
2016年, Yang课题组[66]发展了一种无金属条件下异喹啉衍生物和甲苯衍生物氧化偶联的新方法.该反应以碘单质作为催化剂, 过氧化叔丁醇作为氧化剂, 通过一步反应构建C=O键和C—N键(Eq. 31).
随后, Li课题组[67]进一步报道了2-酰胺吲哚的氧化/螺环化反应.该反应具有原料廉价易得, 官能团容忍性良好, 反应条件温和的优点.反应中经历了吲哚-3-酮的活性中间体, 其进一步通过酰胺部分芳环上的环化反应得到目标产物(Eq. 32).
5 与C(sp)—H键反应
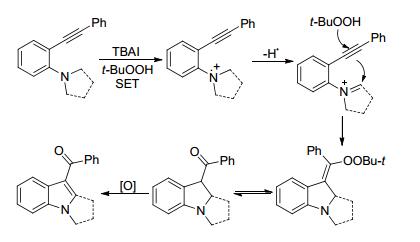
炔烃不仅廉价易得而且在自然界中广泛存在, 是有机合成中重要的中间体, 基于炔烃的官能团化反应受到越来越多的关注[68]. 2013年, Liang课题组[69]首次报道了钯-铜共催化下通过炔烃双官能团化反应合成3-酰基吲哚衍生物的方法.该方法反应条件简单并且应用范围广泛, 为复杂吲哚衍生物的合成提供了新思路(Eq. 33). 2014年, Patel课题组[70]进一步改善了该方法, 他们无需金属催化剂, 利用过氧化叔丁醇/四正丁基碘化铵体系实现了氧化串联反应.他们提出了涉及氮正离子过程的反应机理(Scheme 7).
随后, Patel课题组[71]进一步实现了2-芳基吡啶的邻位芳甲酰氧化反应.该方法以芳基端炔作为芳基羧酸化试剂, 过氧化叔丁醇作为氧化剂, Cu(OAc)2作为催化剂, 氯苯作为反应溶剂(Eq. 34).
2015年, Tang课题组[72]发展了炔酸类化合物与含磷化合物的氧化双官能团化反应.在硫酸铜的催化下, 一步反应构建C=O键和C—P键.该方法反应条件温和, 反应过程涉及磷自由基对炔烃的自由基加成反应(Eq. 35).
2017年, Zhao课题组[73]利用铜-金共催化体系实现了2-炔基芳胺的双分子串联反应.反应中过氧化叔丁醇既作为终端氧化剂又作为氧原子源.该方法经过分子内亲核加成反应、分子间环化反应和氧化偶联反应一步构建了四个新的化学键(Eq. 36).
6 结论与展望
综上所述, 过氧化叔丁醇参与碳-氧键构建在近几年中取得了一定的进展, 为合成结构多样性的含氧化合物提供了行之有效的策略.该类反应具有以下优点: (1)过氧化叔丁醇既作为氧化剂又作为氧原子来源, 无需额外氧化剂. (2)反应一般在中性条件下进行, 有助于实现对酸碱不稳定底物的选择性反应. (3)反应无需配体, 有些甚至无需金属催化剂, 拓宽了其在生物医药方面的应用范围.因此, 该类反应具有潜在的发展应用前景.但由于过氧化叔丁醇产生自由基后的高活性, 发展高化学选择性和高对映选择性的碳-氧键形成方法依然面临着挑战.同时, 探索更绿色的反应条件特别是实现室温下选择性氧化反应是亟待解决的难题.相信随着广大有机化学工作者的不断努力, 在温和反应条件下高选择性构建碳-氧键的方法一定能够实现.
-
-
[1]
Turner, N. J. Chem. Rev. 2011, 111, 4073. doi: 10.1021/cr200111v
-
[2]
Beccalli, E. M.; Broggini, G.; Martinelli, M.; Sottocornola, S. Chem. Rev. 2007, 107, 5318. doi: 10.1021/cr068006f
-
[3]
柳爱平, 王晓光, 欧晓明, 刘曙东, 莫洪波, 刘兴平, 王婷瑾, 何海军, 胡礼, 黄明智, 刘钊杰, 姚建仁, 有机化学, 2008, 28, 1772. http://sioc-journal.cn/Jwk_yjhx//CN/abstract/abstract338099.shtmlLiu, A.-S.; Wang, X.-G.; Ou, X.-M.; Liu, S.-D.; Mo, H.-B.; Liu, X.-P.; Wang, T.-J.; He, H.-J.; Hu, L.; Huang, M.-Z.; Liu, Z.-J.; Yao, J.-R. Chin. J. Org. Chem. 2008, 28, 1772 (in Chinese). http://sioc-journal.cn/Jwk_yjhx//CN/abstract/abstract338099.shtml
-
[4]
尚筱洁, 柳忠全, 化学学报, 2015, 73, 1275. http://d.wanfangdata.com.cn/Periodical/jsjxb201411015Shang, X.-J.; Liu, Z.-Q. Acta Chim. Sinica 2015, 73, 1275 (in Chinese). http://d.wanfangdata.com.cn/Periodical/jsjxb201411015
-
[5]
陆庆全, 易红, 雷爱文, 化学学报, 2015, 73, 1245. doi: 10.3969/j.issn.0253-2409.2015.10.013Lu, Q.-Q.; Yi, H.; Lei, A. W. Acta Chim. Sinica 2015, 73, 1245 (in Chinese). doi: 10.3969/j.issn.0253-2409.2015.10.013
-
[6]
Liu, Y.; Liu, Z.; Cui, Y. D. Chin. J. Chem. 2015, 33, 175. doi: 10.1002/cjoc.v33.2
-
[7]
Aranyos, A.; Old, D. W.; Kiyomori, A.; Wolfe, J. P.; Sadighi, J. P.; Buchwald, S. L. J. Am. Chem. Soc. 1999, 121, 4369. doi: 10.1021/ja990324r
-
[8]
Gowrisankar, S.; Sergeev, A. G.; Anbarasan, P.; Spannenberg, A.; Neumann, H.; Beller, M. J. Am. Chem. Soc. 2010, 132, 11592. doi: 10.1021/ja103248d
-
[9]
Palucki, M.; Wolfe, J. P.; Buchwald, S. L. J. Am. Chem. Soc. 1996, 118, 10333. doi: 10.1021/ja962408v
-
[10]
Hartwig, J. F. Angew. Chem., Int. Ed. 1998, 37, 2046. doi: 10.1002/(ISSN)1521-3773
-
[11]
Monnier, F.; Taillefer, M. Angew. Chem., Int. Ed. 2009, 48, 6954. doi: 10.1002/anie.v48:38
-
[12]
Torraca, K. E.; Huang, X.; Parrish, C. A.; Buchwald, S. L. J. Am. Chem. Soc. 2001, 123, 10770. doi: 10.1021/ja016863p
-
[13]
Fagan, P. J.; Hauptman, E.; Shapiro, R.; Casalnuovo, A. J. Am. Chem. Soc. 2000, 122, 5043. doi: 10.1021/ja000094c
-
[14]
Niu, J.; Guo, P.; Kang, J.; Li, Z.; Xu, J.; Hu, S. J. Org. Chem. 2009, 74, 5075. doi: 10.1021/jo900600m
-
[15]
Chen, X.; Hao, X.-S.; Goodhue, C. E.; Yu, J.-Q. J. Am. Chem. Soc. 2006, 128, 6790. doi: 10.1021/ja061715q
-
[16]
Jiang, T. S.; Wang, G. W. J. Org. Chem. 2012, 77, 9504. doi: 10.1021/jo301964m
-
[17]
Yin, Z.-W.; Jiang, X.-Q.; Sun, P.-P. J. Org. Chem. 2013, 78, 10002. doi: 10.1021/jo401623j
-
[18]
Shi, S.-P.; Kuang, C.-X. J. Org. Chem. 2014, 79, 6105. doi: 10.1021/jo5008306
-
[19]
谢叶香, 宋仁杰, 向建南, 李金恒, 有机化学, 2012, 32, 1555. http://sioc-journal.cn/Jwk_yjhx/CN/Y2012/V32/I09/1555Xie, Y.-X.; Song, R.-J.; Xiang, J.-N.; Li, J.-H. Chin. J. Org. Chem. 2012, 32, 1555 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/Y2012/V32/I09/1555
-
[20]
He, H.; Pei, B.-J.; Lee, A. W. M. Green Chem. 2009, 11, 1857. doi: 10.1039/b916265h
-
[21]
Yin, Z.-W.; Sun, P.-P. J. Org. Chem. 2012, 77, 11339. doi: 10.1021/jo302125h
-
[22]
Ali, W.; Behera, A.; Guin, S.; Patel, B. K. J. Org. Chem. 2015, 80, 5625. doi: 10.1021/acs.joc.5b00501
-
[23]
Khemnar, A. B.; Bhanage, B. M. Org. Biomol. Chem. 2015, 46, 9631. http://d.wanfangdata.com.cn/Periodical/jsjxb201411015
-
[24]
Khatun, N.; Banerjee, A.; Santra, S. K.; Ali, W.; Patel, B. K. RSC Adv. 2015, 5, 36461. doi: 10.1039/C5RA03462K
-
[25]
Chen, X.-L.; Li, Y.; Wu, M.-H.; Guo, H.-B.; Jiang, L.-Q.; Wang, J.; Sun, S.-F. RSC Adv. 2016, 6, 102023. doi: 10.1039/C6RA20966A
-
[26]
Hashemi, H.; Saberi, D.; Poorsadeghic, S.; Niknam, K. RSC Adv. 2017, 7, 7619. doi: 10.1039/C6RA27921J
-
[27]
Tan, J.-J.; Zheng, T.-Y.; Yu, Y.-Q.; Xu, K. RSC Adv. 2017, 7, 15176. doi: 10.1039/C7RA00352H
-
[28]
Zhang, X.-B.; Wang, L. Green Chem. 2012, 14, 2141. doi: 10.1039/c2gc35489f
-
[29]
Zhao, Q.; Miao, T.; Zhang, X. B.; Zhou, W.; Wang, L. Org. Biomol. Chem. 2013, 11, 1867. doi: 10.1039/c3ob27433k
-
[30]
Zhang, X. B.; Wang, M.; Zhang, Y. C.; Wang, L. RSC Adv. 2013, 3, 1311. doi: 10.1039/C2RA22116K
-
[31]
Behera, A.; Ali, W.; Tripathy, M.; Sahoo, D.; Patel, B. K. RSC Adv. 2016, 6, 91308. doi: 10.1039/C6RA16118A
-
[32]
Majji, G.; Rajamanickam, S.; Khatun, N.; Santra, S.-K.; Patel, B. K. J. Org. Chem. 2015, 80, 3440. doi: 10.1021/jo502903d
-
[33]
Wang, Q.-Q.; Wang, Z.-X.; Xu, Y.-S.; Zhang, X.-Y.; Fan, X.-S. Asian J. Org. Chem. 2016, 5, 1304. doi: 10.1002/ajoc.v5.11
-
[34]
Majji, G.; Guin, S.; Gogoi, A.; Rout, S. K.; Pate, B. K. Chem. Commun. 2013, 49, 3031. doi: 10.1039/c3cc40832a
-
[35]
Du, B.; Jina, B.; Sun, P.-P. Org. Biomol. Chem. 2014, 12, 4586. doi: 10.1039/C4OB00520A
-
[36]
Zhao, J.-C.; Fang, H.; Han, J.; Pan, Yi. Org. Lett. 2014, 16, 2530. doi: 10.1021/ol5009119
-
[37]
Guo, S.-J.; Yu, J.-T.; Dai, Q.; Yang, H.-T.; Cheng, J. Chem. Commun. 2014, 50, 6240. doi: 10.1039/c4cc01652a
-
[38]
Azizi, K.; Karim, M.; Heydari, A. RSC Adv. 2014, 4, 31817. doi: 10.1039/C4RA04215H
-
[39]
Liu, F.-Y.; Zhang, K.; Liu, Y.-F.; Chen, S.; Chen, Y.-P.; Zhang, D.-L.; Lin, C.-F.; Wang, B. RSC Adv. 2017, 7, 7158. doi: 10.1039/C6RA26679G
-
[40]
许健, 宋秋玲, 有机化学, 2016, 36, 1151. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201606001&dbname=CJFD&dbcode=CJFQXu, J.-N.; Song, Q.-L. Chin. J. Org. Chem. 2016, 36, 1151 (in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=yjhu201606001&dbname=CJFD&dbcode=CJFQ
-
[41]
Jiang, H.-F.; Huang, H.-W.; Cao, H.; Qi, C.-R. Org. Lett. 2010, 12, 5561. doi: 10.1021/ol1023085
-
[42]
Belala, M.; Khan, A. T. RSC Adv. 2016, 6, 18891. doi: 10.1039/C5RA27993C
-
[43]
Khatun, N.; Banerjee, A.; Santra, S. K.; Behera, A.; Patel, B. K. RSC Adv. 2014, 4, 54532. doi: 10.1039/C4RA11014E
-
[44]
Wei, W.-T.; Yang, X.-H.; Li, H.-B.; Li, J.-H. Adv. Synth. Catal. 2015, 357, 59. doi: 10.1002/adsc.v357.1
-
[45]
Wei, W.; Zhang, C.; Xu, Y.; Wan, X. B. Chem. Commun. 2011, 47, 10827. doi: 10.1039/c1cc14602e
-
[46]
Yang, X.-H.; Wei, W.-T.; Li, H.-B.; Song, R.-J.; Li, J.-H. Chem. Commun. 2014, 50, 12867. doi: 10.1039/C4CC05051G
-
[47]
Yang, W.-C.; Weng, S.-S.; Ramasamy, A.; Rajeshwaren, G.; Liao, Y.-Y.; Chen, C.-T. Org. Biomol. Chem. 2015, 13, 2385. doi: 10.1039/C4OB02621G
-
[48]
Lan, X.-W.; Wang, N.-X.; Zhang, W.; Wen, J.-L.; Bai, C.-B.; Xing, Y.-L.; Li, Y.-H. Org. Lett. 2015, 17, 4460. doi: 10.1021/acs.orglett.5b02116
-
[49]
Wei, W.-T.; Li, H.-B.; Song, R.-J.; Li, J.-H. Chem. Commun. 2015, 51, 11325. doi: 10.1039/C5CC03468J
-
[50]
Jiang, J.-W.; Liu, J.-J.; Yang, L.; Shao, Y.; Cheng, J.; Bao, X.-G.; Wan, X.-B. Chem. Commun. 2015, 51, 14728. doi: 10.1039/C5CC05183E
-
[51]
Banerjee, A.; Santra, S. K.; Khatun, N.; Ali, W.; Patel, B. K. Chem. Commun. 2015, 51, 15422. doi: 10.1039/C5CC06200D
-
[52]
Yi, N.-N.; Zhang, H.; Xu, C.-H.; Deng, W.; Wang, R.-J.; Peng, D.-M.; Zeng, Z.-B.; Xiang, J.-J. Org. Lett. 2016, 18, 1780. doi: 10.1021/acs.orglett.6b00498
-
[53]
Shi, E.; Liu, J. J.; Liu, C. M.; Shao, Y.; Wang, H. H.; Lv, Y. Z.; Ji, M. S.; Bao, X. G.; Wan, X. B. J. Org. Chem. 2016, 81, 5878. doi: 10.1021/acs.joc.6b00575
-
[54]
Du, P.; Li, H.-H.; Wang, Y.-X.; Cheng, J.; Wan, X.-B. Org. Lett. 2014, 16, 6350. doi: 10.1021/ol503128j
-
[55]
Zhang, J.; Jiang, J. W.; Xu, D. M.; Luo, Q.; Wang, H. X.; Chen, J. J.; Li, H. H.; Wang, Y. X.; Wan, X. B. Angew. Chem., Int. Ed. 2015, 54, 1231. doi: 10.1002/anie.201408874
-
[56]
Ling, J.-Y.; Zhang, J.; Zhao, Y.-W.; Xu, Y.-D.; Wang, H.-H.; Lv, Y.-Z.; Ji, M.-S.; Ma, L.; Maa, M.-H.; Wan, X.-B. Org. Biomol. Chem. 2016, 14, 5310. doi: 10.1039/C6OB00873A
-
[57]
Liu, C. M.; Shi, E.; Xu, F.; Luo, Q.; Wang, H. X.; Chen, J. J.; Wan, X. B. Chem. Commun. 2015, 51, 1214. doi: 10.1039/C4CC07833K
-
[58]
Luo, Q.; Liu, C. M.; Tong, J. J.; Shao, Y.; Shan, W. Y.; Wang, H. H.; Zheng, H.; Cheng, J.; Wan, X. B. J. Org. Chem. 2016, 81, 3103. doi: 10.1021/acs.joc.5b02664
-
[59]
Ratnikov, M. O.; Farkas, L. E.; McLaughlin, E. C.; Chiou, G.; Choi, H.; El-Khalafy, S. H.; Doyle, M. P. J. Org. Chem. 2011, 76, 2585. doi: 10.1021/jo1024865
-
[60]
Dong, J.-W.; Liu, P.; Sun, P.-P. J. Org. Chem. 2015, 80, 2925. doi: 10.1021/acs.joc.5b00167
-
[61]
Duan, S.-T.; Xu, Y.-S.; Zhang, X.-Y.; Fan, X.-S. Chem. Commun. 2016, 52, 10529. doi: 10.1039/C6CC04756D
-
[62]
Dang, P.; Zheng, Z.-L.; Liang, Y. J. Org. Chem. 2017, 82, 2263. doi: 10.1021/acs.joc.6b02943
-
[63]
Chen, X.; Tan, Z.; Gui, Q.-W.; Hu, L.; Liu, J.-D.; Wu, J.; Wang, G.-W. Chem. Eur. J. 2016, 22, 6218. doi: 10.1002/chem.v22.18
-
[64]
Zi, Y.; Cai, Z.-J.; Wang, S.-Y.; Ji, S.-J. Org. Lett. 2014, 16, 3094. doi: 10.1021/ol501203q
-
[65]
Yan, K.-L.; Yang, D.-S.; Wei, W.; Li, G.-Q.; Sun, M.-Y.; Zhang, Q.-Y.; Tian, L.-J.; Wang, H. RSC Adv. 2015, 5, 100102. doi: 10.1039/C5RA17740E
-
[66]
Luo, W.-K.; Shi, X.; Zhou, W.; Yang, L. Org. Lett. 2016, 18, 2036. doi: 10.1021/acs.orglett.6b00646
-
[67]
Kong, L.-K.; Wang, M.-D.; Zhang, F.-F.; Xu, M.-R.; Li, Y.-Z. Org. Lett. 2016, 18, 6124. doi: 10.1021/acs.orglett.6b03131
-
[68]
张剑, 陆庆全, 刘超, 雷爱文, 有机化学, 2015, 35, 743. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344810.shtmlZhang, J.; Lu, Q.-Q.; Liu, C.; Lei, A. Chin. J. Org. Chem. 2015, 35, 743 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344810.shtml
-
[69]
Xia, X.-F.; Zhang, L.-L.; Song, X.-R.; Niu, Y.-N.; Liu, X.-Y.; Liang, Y.-M. Chem. Commun. 2013, 49, 1410. doi: 10.1039/c2cc37805a
-
[70]
Gogoi, A.; Modi, A.; Guin, S.; Rout, S. K.; Das, D.; Patel, B. K. Chem. Commun. 2014, 50, 10445. doi: 10.1039/C4CC04407J
-
[71]
Rout, S. K.; Guin, S.; Gogoi, A.; Majji, G.; Patel, B. K. Org. Lett. 2014, 16, 1614. doi: 10.1021/ol500224e
-
[72]
Zhang, P.-B.; Zhang, L.-L.; Gao, Y.-Z.; Xu, J.; Fang, H.; Tang, G.; Zhao, Y.-F. Chem. Commun. 2015, 51, 7839. doi: 10.1039/C5CC01904D
-
[73]
Li, Y.-J.; Yan, N.; Liu, C.-H.; Yu, Y.; Zhao, Y.-L. Org. Lett. 2017, 19, 1160. doi: 10.1021/acs.orglett.7b00200
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 79
- 文章访问数: 11549
- HTML全文浏览量: 1543


 下载:
下载:






 下载:
下载:

