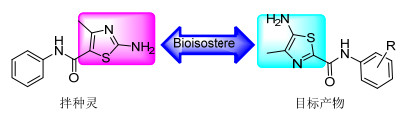
 图1
目标化合物的设计思想
Figure1.
Design method of the title compounds
图1
目标化合物的设计思想
Figure1.
Design method of the title compounds

Citation: Cao Lei, Sun Jingwei, Liu Qiang, Qian Cheng, Du Yanlin, Xu Wangjin, Chen Kaiyi, Liu Jianbing. Synthesis and Biological Activity of 5-Amino-4-methyl-N-phenylthiazole-2-carboxamide[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 3031-3036. doi: 10.6023/cjoc201705029

5-氨基-4-甲基噻唑-2-甲酰芳胺类化合物的合成及其生物活性
English
Synthesis and Biological Activity of 5-Amino-4-methyl-N-phenylthiazole-2-carboxamide
-
Key words:
- 5-aminothiazole
- / benzamide
- / synthesis
- / biological activity
-
噻唑类化合物具有广谱生物生理活性[1, 2], 其分支中2-氨基噻唑衍生物由于其合成方法简单[3, 5]、生物活性多样[6~11], 倍受农药和医药研发者的关注, 迄今为止, 已有许多商品化农药品种, 如内吸杀菌剂拌种灵是一种对人、畜低毒, 安全性高的内吸型杀菌剂, 能有效防治禾谷类作物黑穗病及其它作物炭疽病等, 具有极好的杀菌效果[12, 13].
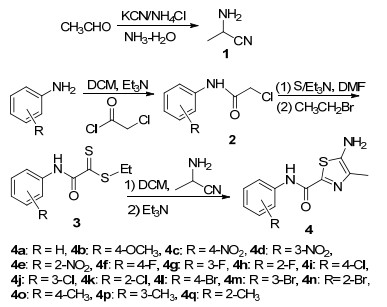
从结构上分析, 5-氨基噻唑与2-氨基噻唑互为同分异构体, 从生物电子等排的角度分析, 两者是一对经典的生物电子等排体, 两者在生物生理活性方面很可能存在相似性.但因5-氨基噻唑环核的构建方法较2-氨基噻唑复杂[14], 该类化合物的生物生理活性研究严重滞后于2-氨基噻唑衍生物.为了寻找高活性的5-氨基噻唑衍生物, 作者以拌种灵[15]结构(图 1)为先导, 利用生物电子等排理论, 以4-甲基-5-氨基噻唑片段替代拌种灵结构中4-甲基-2-氨基噻唑部分设计并合成了17个5-氨基-4-甲基噻唑-2-甲酰芳胺4(其合成路线如Scheme 1所示).所有化合物的结构均经1H NMR, 13C NMR, HRMS及IR确证.初步离体生物活性测试结果表明:许多该类化合物的杀菌活性高于阳性对照.
1 结果与讨论
1.1 目标化合物4-甲基-5-氨基噻唑-2-甲酰芳胺的合成
以三乙胺作催化剂、二氯甲烷作溶剂, 由2-氨基丙腈中间体1与中间体3反应合成目标化合物.研究发现, 用二氯甲烷作溶剂比文献报道[16]之乙醇更利于环合.该反应条件温和, 大多目标产物一经生成便从反应液中析出, 且纯度很高.若纯度不够, 可使其先与盐酸成盐, 再用碳酸钠游离即可纯化.
中间体3是合成目标化合物的关键中间体, 按文献[17]室温反应, 副产物较多, 特别是芳环上含强拉电子基硝基时.经探索温度及加料速度对该反应的影响, 发现控制温度0 ℃以下并缓慢滴加溴乙烷有利反应.
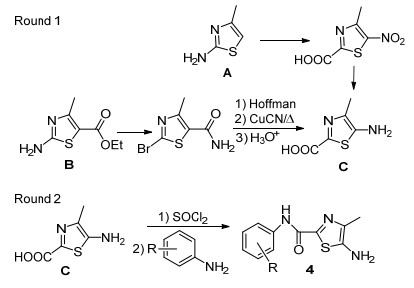
最初, 我们设计经由中间体4-甲基-5-氨基噻唑-2-甲酸C合成目标化合物(Scheme 2), 因关键中间体C的合成未见文献报道, 我们试图设计两条合成路线合成该化合物, 但未获成功.路线一采用2-氨基-4-甲基噻唑A为原料, 相继尝试了Fe-HOAc, Fe-NH4Cl, Zn-NH4Cl[18], 多硫化钠等方法[19]还原硝基噻唑, 但均未得到理想的效果:使用铁粉作还原剂时副产物多、产率低、后处理困难, 而改用锌粉, 反应效果并无改善; 采用多硫化钠还原时, 未见有反应.路线二采用易得中间体B为原料, 经氨解、Hoffman等反应步骤制备中间体C, 但氰基水解不完全, 酰胺为主要产物.我们尝试升温促进水解, 但脱羧产物随之生成.
1.2 目标化合物波谱数据分析
以目标化合物4a为例, 1H NMR谱图中, δ 8.8处为O=CNH的质子信号, 芳环上的质子信号在δ 7.7~7.1, δ 4.0处为NH2上的质子信号, CH3上的质子信号在δ 2.3; IR谱图中3299和3190 cm-1两个中强度的吸收峰为NH2的反对称和对称伸缩振动吸收, 2923和2853 cm-1为苯环上C-H伸缩振动吸收峰, 1599, 1522, 1497和1446 cm-1为苯环骨架振动吸收峰, 754和690 cm-1为苯环指纹区单取代C-H面外弯曲振动峰, 1231 cm-1为噻唑环氨基的C-N伸缩振动吸收峰, 1659和1645 cm-1为酰胺羰基伸缩振动吸收峰, 1316 cm-1为仲酰胺C-N伸缩振动和N-H弯曲振动的混合吸收峰, 1427和1384 cm-1为甲基的弯曲振动吸收峰.高分辨质谱图中, 所有化合物均出现[M+H]+分子离子峰.
1.3 化合物的杀菌活性
采用离体平皿法(Disc paper method), 浓度为50 μg/mL, 以拌种灵为阳性对照测定了目标化合物对黄瓜枯萎、西瓜炭疽等十四种菌种的杀菌活性(表 1).杀菌活性测试结果表明, 大多供试化合物对黄瓜枯萎、小麦纹枯、西瓜炭疽、水稻恶苗和番茄早疫的杀菌活性均高于对照物拌种灵:其中化合物4k对番茄早疫的杀菌活性是拌种灵的2.6倍; 化合物4b和4k对马铃薯晚疫的杀菌活性是拌种灵的2倍; 化合物4h、4k、4n、4p和4q对黄瓜枯萎的杀菌活性是拌种灵的2倍以上; 化合物4k对小麦纹枯的杀菌活性是拌种灵的2倍; 16个化合物对西瓜炭疽和水稻恶苗的杀菌活性均高于阳性对照, 其中有7个化合物对西瓜炭疽的杀菌活性高于阳性对照一倍以上.此外, 部分化合物对小麦赤霉、马铃薯晚疫、辣椒疫霉、黄瓜灰霉、花生褐斑、苹果轮纹和玉米小斑也显示出高于拌种灵的杀菌活性.
化合物 黄瓜枯萎 花生褐斑 苹果轮纹 小麦纹枯 玉米小斑 西瓜炭疽 水稻恶苗 番茄早疫 小麦赤霉 马铃薯晚疫 辣椒疫霉 油菜菌核 黄瓜灰霉 水稻纹枯 拌种灵 17.9 33.3 50.0 35.7 30.4 18.2 18.8 19.2 48.8 9.4 37.0 71.4 26.8 78.8 4a 21.4 23.8 67.9 33.9 21.7 40.9 25.0 30.8 36.6 12.5 65.2 8.9 8.9 53.0 4b 14.3 19.0 17.9 37.5 21.7 22.7 25.0 19.2 24.4 18.8 32.6 19.6 21.4 15.2 4c 21.4 19.0 42.9 37.5 13.0 18.2 25.0 15.4 12.2 3.1 10.9 42.9 8.9 7.6 4d 14.3 19.0 50.0 21.4 26.1 22.7 25.0 19.2 12.2 9.4 8.7 53.6 17.9 6.1 4e 17.9 19.0 35.7 42.9 13.0 13.6 25.0 15.4 7.3 9.4 10.9 57.1 26.8 7.6 4f 21.4 19.0 28.6 46.4 26.1 36.4 25.0 19.2 12.2 3.1 10.9 8.9 8.9 7.6 4g 14.3 23.8 32.1 21.4 13.0 22.7 18.8 15.4 7.3 3.1 21.7 8.9 7.1 6.1 4h 39.3 23.8 46.4 51.8 39.1 45.5 31.3 30.8 39.0 15.6 28.3 25.0 10.7 22.7 4i 28.6 19.0 53.6 37.5 21.7 27.3 12.5 26.9 17.1 3.1 21.7 35.7 7.1 7.6 4j 21.4 23.8 35.7 16.1 17.4 27.3 18.8 23.1 7.3 3.1 21.7 26.8 7.1 6.1 4k 42.9 33.3 42.9 71.4 43.5 45.5 31.3 50.0 48.8 25.0 47.8 35.7 17.9 45.5 4l 17.9 23.8 32.1 32.1 21.7 18.2 18.8 23.1 4.9 3.1 10.9 35.7 8.9 15.2 4m 21.4 19.0 25.0 19.6 13.0 22.7 18.8 23.1 12.2 9.4 17.4 8.9 8.9 22.7 4n 35.7 23.8 50.0 53.6 34.8 36.4 25.0 23.1 12.2 12.5 21.7 17.9 3.6 7.6 4o 10.7 19.0 21.4 28.6 21.7 27.3 25.0 30.8 29.3 3.1 17.4 8.9 26.8 6.1 4p 39.3 23.8 53.6 44.6 30.4 36.4 18.8 23.1 17.1 12.5 34.8 8.9 8.9 6.1 4q 42.9 33.3 50.0 55.4 43.5 36.4 25.0 30.8 46.3 12.5 10.9 26.8 12.5 15.2 构效关系研究表明:除一个化合物外, 其余所有化合物对拌种灵敏感菌株的活性均高于阳性对照, 其中R=2-F和R=2-Cl活性最高; 多数化合物, 苯环上取代基之活性邻位最高间位最低; 邻位取代基以含F和Cl两类取代基活性较好.后续结构优化将以此为参照, 相关研究结果将予以报道.
表观数据分析, 所有化合物的杀菌活性(包括对照物拌种灵)数值较低.考虑拌种灵是一种内吸型杀菌剂, 而我们在生物活性初筛时采用的是离体生物活性测试法, 故表中数据并未真实反应目标化合物的内吸杀菌活性, 而只反应了化合物与对照物拌种灵的相对离体杀菌活性.为此, 我们在后续生物活性研究中以拌种灵的杀菌谱(黑穗病菌和炭疽病菌)为主要研究对象, 重点测试目标化合物对两类病菌的内吸杀菌活性.
2 结论
以拌种灵结构为先导, 利用生物电子等排原理, 设计并合成了17个5-氨基-4-甲基噻唑-2-甲酰芳胺(4)拌种灵类似物, 所有化合物的结构均经1H NMR, 13C NMR, HRMS及IR确证.初步离体生物活性测试结果表明, 所有化合物均显示较好的杀菌活性.其中化合物4k对番茄早疫的杀菌活性是对照样拌种灵的2.6倍, 化合物4h、4k、4n、4p和4q对黄瓜枯萎的杀菌活性是拌种灵的2倍以上, 16个化合物对西瓜炭疽和水稻恶苗的杀菌活性均高于阳性对照, 其中7个化合物对西瓜炭疽的杀菌活性高于阳性对照一倍以上.
3 实验部分
3.1 仪器与试剂
1H NMR和13C NMR采用Bruker DPX-500型核磁共振仪测定, DMSO-d6为溶剂, TMS为内标; 高分辨质谱采用LCQ Advantage MAX mass spectrometer高分辨质谱仪测定; 红外光谱采用FT-IR红外光谱仪(KBr压片); 熔点采用X-4数字熔点仪测定, 温度计未经校正.目标化合物4a~4q的生物活性是由南开大学生测试中心按文献[20]方法测定.中间体1、2和3分别按文献[21]、[22]和[17]合成, 目标化合物4参考文献[16]合成, 其它药品均为市售分析纯试剂.
2.2 实验方法
2.2.1 中间体3的合成
于100 mL三口瓶中, 依次加入硫粉20 mmol (0.64 g)、三乙胺(3.00 g)、N, N-二甲基甲酰胺(DMF) (4 mL), 剧烈搅拌, 冰浴冷却下分批加10 mmol (1.70 g)中间体2, 0.5 h后撤出冰浴, 室温反应1.5 h.用冰浴冷却至0 ℃后滴加溴乙烷11 mmol (1.20 g), 室温反应1~2 h, 薄层色谱(TLC)监测反应至完成.向反应液倒入大量冰水, 析出红色固体, 抽滤, 水洗, 得中间体3[14].粗品不经提纯, 可直接用于下一步反应.
1-乙基-2-苯基-1.1-二硫代草酰胺(3a):产率72.1%. m.p. 61.2~63.2 ℃; 1H NMR (500 MHz, CDCl3) δ: 1.41 (d, J=7.5 Hz, 3H, CH3), 3.21~3.25 (m, 2H, CH2), 7.18 (t, J=7.4 Hz, 1H, PhH), 7.37 (t, J=7.9 Hz, 2H, PhH), 7.68 (d, J=8.1 Hz, 2H, PhH), 9.40 (s, 1H, NH); 13C NMR (125 MHz, CDCl3) δ: 11.35, 31.44, 119.84, 125.15, 129.12, 136.69, 155.99, 224.14.
2.2.2 目标化合物4的合成
于50 mL单口瓶中, 加入溶有5 mmol (1.13 g)中间体3的二氯甲烷混合液, 冰浴冷却至0 ℃后滴加5.5 mmol (0.39 g)中间体1.搅拌反应10 min后, 滴加数滴三乙胺并在此温度下继续反应20 min, 析出黄色固体(部分化合物需移至室温搅拌反应才能析出).将反应液于冰箱中静置冷却析晶, 抽滤, 用少许二氯甲烷洗涤固体, 得目标化合物4.
5-氨基-4-甲基噻唑-2-甲酰苯胺(4a):红棕色固体, 产率39.7%. m.p. 139.8~142.0 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.31 (s, 3H, CH3), 4.01 (s, 2H, NH2), 7.14 (t, J=6.7 Hz, 1H, PhH), 7.38 (t, J=7.2 Hz, 2H, PhH), 7.69 (d, J=7.5 Hz, 2H), 8.86 (s, 1H, PhH); 13C NMR (125 MHz, DMSO-d6) δ: 13.74, 120.49, 120.49, 123.77, 128.99, 128.99, 130.83, 139.16, 142.19, 151.31, 159.02; IR (KBr) v: 3299, 3190, 2923, 2853, 1659, 1645, 1599, 1522, 1497, 1446, 1427, 1384, 1231, 1316, 754, 690 cm-1; HRMS calcd for C11H12ON3S (M+H)+ 234.0696, found 234.0696.
5-氨基-4-甲基噻唑-2-甲酰-(4-甲氧基)苯胺(4b):黄色固体, 产率70.8%. m.p. 177.3~178.9 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.23 (s, 3H, CH3), 3.72 (s, 3H, OCH3), 6.14 (s, 2H, NH2), 6.87 (d, J=9.0 Hz, 2H, PhH), 7.70 (d, J=9.0 Hz, 2H, PhH), 9.95 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.73, 55.62, 114.16, 114.16, 122.04, 122.04, 130.72, 132.27, 142.64, 150.86, 155.80, 158.70; IR (KBr) v: 3318, 3169, 3002, 2960, 2836, 1633, 1601, 1525, 1437, 1390, 1243, 1032, 829 cm-1; HRMS calcd for C12H14O2N3S (M+H)+ 264.0801, found 264.0800.
5-氨基-4-甲基噻唑-2-甲酰-(4-硝基)苯胺(4c):黄色固体, 产率57.8%. m.p. 237.4~239.1 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.21 (s, 3H, CH3), 3.04 (s, 2H, NH2), 7.99 (d, J=9.0 Hz, 2H, PhH), 8.10 (d, J=9.0 Hz, 2H, PhH), 10.55 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.62, 120.02, 120.02, 125.13, 125.13, 131.68, 140.36, 142.63, 145.33, 152.69, 159.46; IR (KBr) v: 3356, 3317, 3216, 2916, 1665, 1633, 1589, 1543, 1518, 1422, 1385, 1304, 1230, 802, 692 cm-1; HRMS calcd for C11H11O3N4S (M+H)+ 279.0546, found 279.0545.
5-氨基-4-甲基噻唑-2-甲酰-(3-硝基)苯胺(4d):棕色固体, 产率45.8%. m.p. 189.4~191.6 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.25 (s, 3H, CH3), 6.37 (s, 2H, NH2), 7.58 (t, J=8.2 Hz, 1H, PhH), 7.88~7.90 (m, 1H, PhH), 8.19 (d, J=8.0 Hz, 1H, PhH), 8.87 (s, 1H, PhH), 10.64 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.73, 14.58, 118.12, 126.50, 130.31, 131.15, 140.54, 140.81, 148.37, 152.27, 159.57; IR (KBr) v: 3445, 3344, 2922, 1670, 1626, 1543, 1526, 1433, 1384, 1236, 799, 738 cm-1; HRMS calcd for C11H11O3N4S (M+H)+ 279.0546, found 279.0548.
5-氨基-4-甲基噻唑-2-甲酰-(2-硝基)苯胺(4e):红色固体, 产率34.4%. m.p. 235.8~237.3 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.24 (s, 3H, CH3), 6.53 (s, 2H, NH2), 7.29 (t, J=7.5 Hz, 1H, PhH), 7.71~7.77 (m, 1H, PhH), 8.15~8.17 (m, 1H, PhH), 8.51 (d, J=8.0 Hz, 1H, PhH), 11.34 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.83, 122.70, 123.98, 126.13, 131.37, 134.07, 135.90, 138.22, 139.52, 153.24, 158.85; IR (KBr) v: 3425, 3331, , 2922, 1665, 1633, 1579, 1506, 1385, 1337, 1258, 740 cm-1; HRMS calcd for C11H11O3N4S (M+H)+ 279.0546, found 279.0547.
5-氨基-4-甲基噻唑-2-甲酰-(4-氟)苯胺(4f):浅黄色固体, 产率53.8%. m.p. 171.4~173.5 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.23 (s, 3H, CH3), 6.22 (s, 2H, NH2), 7.13 (t, J=8.8 Hz, 2H, PhH), 7.79~7.82 (m, 2H, PhH), 10.17 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6); δ: 13.70, 115.46, 115.64, 122.30, 122.36, 130.90, 135.51, 141.96, 151.31, 157.63, 159.01; IR (KBr) v: 3344, 3177, 2921, 1649, 1523, 1507, 1431, 1388, 1311, 1211, 841 cm-1; HRMS calcd for C11H11ON3SF (M+H)+ 252.0601, found 252.0603.
5-氨基-4-甲基噻唑-2-甲酰-(3-氟)苯胺(4g):黄色固体, 产率45.9%. m.p. 213.2~214.6 ℃. 1H NMR (500 MHz, DMSO-d6) δ: 2.24 (s, 3H, CH3), 6.29 (s, 2H, NH2), 6.84~6.88 (m, 1H, PhH), 7.30~7.35 (m, 1H, PhH), 7.63~7.65 (m, 1H, PhH), 7.74~7.77 (m, 1H, PhH), 10.30 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.72, 107.15 (d, J=26.1 Hz), 110.13 (d, J=21.1 Hz), 116.26, 130.56 (d, J=9.4 Hz), 130.99, 141.07 (t, J=31.6 Hz), 151.82, 159.26, 161.54, 163.45; IR (KBr) v: 3301, 3197, 2917, 1662, 1611, 1557, 1524, 1488, 1384, 1298, 1234, 780, 678 cm-1; HRMS calcd for C11H11ON3SF (M+H)+252.0601, found 252.0601.
5-氨基-4-甲基噻唑-2-甲酰-(2-氟)苯胺(4h):棕色固体, 产率36.2%. m.p. 152.2~154.1 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.23 (s, 3H, CH3), 6.32 (s, 2H, NH2), 7.16~7.20 (m, 2H, PhH), 7.25~7.30 (m, 1H, PhH), 7.87~7.90 (m, 1H, PhH), 9.51 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.73, 115.92 (d, J=18.7 Hz), 124.48, 124.89 (d, J=5.0 Hz), 125.91 (d, J=7.5 Hz), 126.18 (d, J=11.2 Hz), 130.98, 140.59, 151.93, 153.56, 158.67; IR (KBr) v: 3311, 3187, 2913, 1657, 1618, 1595, 1521, 1455, 1425, 1386, 1318, 1250, 759 cm-1; HRMS calcd for C11H11ON3SF (M+H)+ 252.0601, found 252.0598.
5-氨基-4-甲基噻唑-2-甲酰-(4-氯)苯胺(4i):黄色固体, 产率55.1%. m.p. 199.8~201.5 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.29 (s, 3H, CH3), 3.94 (s, 2H, NH2), 7.31 (d, J=9.0 Hz, 2H, PhH), 7.63 (d, J=8.5 Hz, 2H, PhH), 8.82 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.72, 122.04, 122.04, 127.39, 128.86, 128.86, 130.94, 138.22, 141.71, 151.62, 159.13; IR (KBr) v: 3343, 3165, 1646, 1594, 1519, 1490, 1434, 1387, 1308, 1232, 817 cm-1; HRMS calcd for C11H11ON3SCl (M+H)+ 268.0306, found 268.0303.
5-氨基-4-甲基噻唑-2-甲酰-(3-氯)-苯胺(4j):黄色固体, 产率42.3%. m.p. 204.8~205.9 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.23 (s, 3H, CH3), 6.30 (s, 2H, NH2), 7.09 (d, J=7.0 Hz, 1H, PhH), 7.31 (t, J=7.7 Hz, 1H, PhH), 7.75 (d, J=7.5 Hz, 1H, PhH), 7.99 (s, 1H, PhH), 10.29 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.72, 118.89, 119.90, 123.38, 130.63, 131.00, 133.35, 140.76, 141.40, 151.87, 159.28; IR (KBr) v: 3445, 3305, 1664, 1620, 1596, 1519, 1435, 1385, 1296, 1240, 779, 680 cm-1; HRMS calcd for C11H11ON3SCl (M+H)+ 268.0306, found 268.0302.
5-氨基-4-甲基噻唑-2-甲酰-(2-氯)-苯胺(4k):棕色固体, 产率29.4%. m.p. 151.5~153.9 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.22 (s, 3H, CH3), 6.40 (s, 2H, NH2), 7.13~7.17 (m, 1H, PhH), 7.35 (t, J=7.5 Hz, 1H), 7.51~7.53 (m, 1H, PhH), 8.13~8.15 (m, 1H, PhH), 9.49 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.78, 122.87, 124.38, 125.70, 128.31, 129.82, 131.10, 134.88, 140.10, 152.44, 158.41; IR (KBr) v: 3398, 3319, 3217, 2918, 1665, 1633, 1594, 1544, 1519, 1424, 1393, 1307, 1231, 748 cm-1; HRMS calcd for C11H11ON3SCl (M+H)+ 268.0306, found 268.0302.
5-氨基-4-甲基噻唑-2-甲酰-(4-溴)苯胺(4l):黄色固体, 产率64.5%. m.p. 216.2~217.8 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.23 (s, 3H, CH3), 6.27 (s, 2H, NH2), 7.47 (d, J=8.0 Hz, 2H, PhH), 7.78 (d, J=7.5 Hz, 2H, PhH), 10.23 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.71, 115.49, 122.44, 122.62, 130.99, 131.79, 131.85, 138.58, 141.63, 151.65, 159.13; IR (KBr) v: 3331, 3209, 2913, 1669, 1644, 1621, 1592, 1518, 1423, 1388, 1309, 1233, 819, 795 cm-1; HRMS calcd for C11H11ON3SBr (M+H)+ 311.9801, found 311.9801.
5-氨基-4-甲基噻唑-2-甲酰-(3-溴)苯胺(4m):浅黄色固体, 产率53.3%. m.p. 180.4~182.0 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.23 (s, 3H, CH3), 6.30 (s, 2H, NH2), 7.21~7.27 (m, 2H, PhH), 7.77 (d, J=8.0 Hz, 1H, PhH), 8.12 (s, 1H, PhH), 10.27 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.71, 119.27, 121.85, 122.74, 126.34, 130.98, 131.06, 140.82, 141.33, 151.87, 159.26; IR (KBr) v: 3359, 3433, 3325, 2913, 1667, 1622, 1587, 1539, 1520, 1433, 1385, 1305, 1223, 778, 678 cm-1; HRMS calcd for C11H11ON3SBr (M+H)+ 311.9801, found 311.9799.
5-氨基-4-甲基噻唑-2-甲酰-(2-溴)-苯胺(4n):黄色固体, 产率36.2%. m.p. 187.9~189.3 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.22 (s, 3H, CH3), 6.40 (s, 2H, NH2), 7.08 (t, J=7.7 Hz, 1H, PhH), 7.39 (t, J=8.0 Hz, 1H, PhH), 7.67 (d, J=7.5 Hz, 1H, PhH), 8.15 (d, J=8.0 Hz, 1H, PhH), 9.48 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.83, 115.01, 122.89, 126.07, 128.88, 131.05, 133.02, 136.16, 140.11, 152.49, 158.39; IR (KBr) v: 339, 3317, 3216, 2916, 1665, 1633, 1589, 1543, 1518, 1422, 1385, 1304, 1230, 747 cm-1; HRMS calcd for C11H11ON3SBr (M+H)+ 311.9801, found 311.9798.
5-氨基-4-甲基噻唑-2-甲酰-(4-甲基)苯胺(4o):黄色固体, 产率64.5%. m.p. 206.3~208.1 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.22 (s, 3H, CH3), 2.24 (s, 3H, CH3), 6.18 (s, 2H, NH2), 7.10 (s, 2H, PhH), 7.65 (d, J=5.0 Hz, 2H, PhH), 9.95 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.71, 20.91, 120.48, 120.48, 129.43, 129.43, 130.81, 132.81, 136.54, 142.37, 151.09, 158.86; IR (KBr) v: 3356, 3179, 2916, 1648, 1618, 1595, 1555, 1521, 1431, 1393, 1317, 1233, 813 cm-1; HRMS calcd for C12H14ON3S (M+H)+ 248.0852, found 248.0849.
5-氨基-4-甲基噻唑-2-甲酰-(3-甲基)苯胺(4p):棕色固体, 产率52.5%. m.p. 149.3~151.3 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.19 (s, 3H, CH3), 2.21 (s, 3H, CH3), 6.14 (s, 2H, NH2), 6.08 (t, J=7.5 Hz, 1H, PhH), 7.16 (t, J=7.0 Hz, 1H, PhH), 7.21 (d, J=7.5 Hz, 1H, PhH), 7.52 (d, J=7.5 Hz, 1H, PhH), 9.42 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.65, 17.98, 124.67, 125.74, 126.64, 130.80, 131.14, 131.80, 136.15, 141.88, 151.06, 158.96; IR (KBr) v: 3375, 3321, 3218, 2918, 1662, 1591, 1548, 1522, 1456, 1425, 1389, 1311, 1245, 826, 751 cm-1; HRMS calcd for C12H14ON3S (M+H)+ 248.0852, found 248.0854.
5-氨基-4-甲基噻唑-2-甲酰-(2-甲基)-苯胺(4q):棕色固体, 产率35.8%. m.p. 147.1~149.2 ℃; 1H NMR (500 MHz, DMSO-d6) δ: 2.23 (s, 3H, CH3), 2.24 (s, 3H, CH3), 6.20 (s, 2H, NH2), 7.06~7.10 (m, 1H, PhH), 7.18 (t, J=7.5 Hz, 1H, PhH), 7.22 (d, J=7.5 Hz, 1H, PhH), 7.59 (d, J=7.5 Hz, 1H, PhH), 9.45 (s, 1H, NH); 13C NMR (125 MHz, DMSO-d6) δ: 13.79, 18.11, 124.59, 125.42, 126.54, 130.71, 130.74, 131.64, 136.50, 141.89, 151.15, 158.80; IR (KBr) v: 3376, 3321, 3218, 2918, 1662, 1591, 1548, 1521, 1456, 1425, 1389, 1311, 1245, 751 cm-1; HRMS calcd for C12H14ON3S (M+H)+ 248.0852, found 248.0851.
辅助材料(Supporting Information) 目标化合物4a~4q和中间体3a的核磁共振氢谱、核磁共振碳谱、高分辨质谱、红外光谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
麻利红, 闫晓静, 肖玉梅, 袁德凯, 张振华, 傅滨, 袁会珠, 有机化学, 2016, 36, 158. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345229.shtmlMa, L. H; Yan, X. J.; Xiao, Y. M.; Yuan, D. K.; Zhang, Z. H.; Fu, B.; Yuan, H., Z. Chin. J. Org. Chem. 2016, 36, 158(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345229.shtml
-
[2]
翁建全, 黄华, 谭成侠, 刘幸海, 储为盛, 陈杰, 有机化学, 2012, 32, 957. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340917.shtmlWeng, J. Q.; Huang, H.; Tan, C. X.; Liu, X. H.; Chu, W. S.; Chen, J. Chin. J. Org. Chem. 2012, 32, 957(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340917.shtml
-
[3]
王锋, 李稳宏, 李冬, 范峥, 李珍, 有机化学, 2012, 32, 601. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341128.shtmlWang, F.; Li, W. H.; Li, D.; Fan, Z.; Li, Z. Chin. J. Org. Chem. 2012, 32, 601(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341128.shtml
-
[4]
胡艾希, 贺丽敏, 夏林, 徐娟娟, 中国药物化学杂志, 2006, 16, 229. doi: 10.3969/j.issn.1005-0108.2006.04.009Hu, A. X.; He, L, M.; Xia, L.; Xu, J. J. Chin. J. Med. Chem. 2006, 16, 229(in Chinese). doi: 10.3969/j.issn.1005-0108.2006.04.009
-
[5]
王冬梅, 孙军勇, 商永嘉, 有机化学, 2011, 31, 1136. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340260.shtmlWang, D. M.; Sun, J. Y.; Shang, Y. J. Chin. J. Org. Chem. 2011, 31, 1136(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340260.shtml
-
[6]
Das, B.; Reddy V. S.; Ramu, R. J. Mol. Catal. A:Chem. 2006, 252, 235. doi: 10.1016/j.molcata.2006.02.065
-
[7]
Karade, H.; Sathe, M.; Kaushik, M. P. Catal. Commun. 2007, 8, 741. doi: 10.1016/j.catcom.2006.09.005
-
[8]
Potewar, T. M.; Ingale, S. A.; Srinivasan, K. V. Tetrahedron 2008, 64, 5019. doi: 10.1016/j.tet.2008.03.082
-
[9]
Arutyunyan, S.; Nefzi, A. J. Comb. Chem. 2010, 12, 315. doi: 10.1021/cc9001907
-
[10]
Beno, B. R.; Langley, D. R. J. Chem. Inf. Model. 2010, 50, 1159. doi: 10.1021/ci9004964
-
[11]
严曼, 石德清, 肖琳霞, 有机化学, 2008, 28, 1012. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract336785.shtmlYan, M.; Shi, D. Q.; Xiao, L. X. Chin. J. Org. Chem. 2008, 28, 1385(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract336785.shtml
-
[12]
胡奎, 李俊凯, 赵阳, 张旭, 杜铁钢, 方祖凯, 湖北农业科学, 2014, 53, 1061. doi: 10.3969/j.issn.0439-8114.2014.05.019Hu, K.; Li, J. K.; Zhao, Y.; Zhang, X.; Du, T. G.; Fang, Z. K. Chin. J. Hubei Agric. Sci. 2014, 53, 1061(in Chinese). doi: 10.3969/j.issn.0439-8114.2014.05.019
-
[13]
黄青春, 周明国, 叶钟音, 南京农业大学学报, 2001, 24, 31. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Hu, Q. Q.; Zhou, M. G.; Ye, Z. Y. J. Nanjing Agric. Univ. 2001, 24, 31(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[14]
钟世华, 杨柱, 范明亮, 张沐, 刘建兵, 有机化学, 2012, 32, 230. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340966.shtmlZhong, S. H.; Yang, Z.; Fang, M. L.; Zhang M.; Liu, J, B. Chin. J. Org. Chem. 2012, 32, 230(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract340966.shtml
-
[15]
Pitts, W. J. US 3725427, 1973[Chem. Abstr. 1973, 79, 42329.]
-
[16]
Thiel W. J. Prakt. Chem. 1990, 332, 845. doi: 10.1002/(ISSN)1521-3897
-
[17]
Thiel, W. Mayer, R. J. Prakt. Chem. 1989, 331, 243. doi: 10.1002/prac.19893310211
-
[18]
Yan, S.; Appleby, T.; Gunic, E.; Shim, J. H.; Tasu, T.; Kim, H.; Rong, F.; Chen, H.; Hamatake, R.; Wu, J. Z.; Yao, N. Bioorg. Med. Chem. Lett. 2007, 17, 28. doi: 10.1016/j.bmcl.2006.10.002
-
[19]
王红英, 杨雯, 周海波, 陶红玲, 安徽化工, 2014, 40, 24. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Wang, H. Y.; Yang, W.; Zhou, H. B.; Tao, H. L. Anhui Chem. Ind. 2014, 40, 24(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[20]
Fang, J. X.; Jin, Z.; Li, Z. M.; Liu, W. Appl. Org. Chem. 2003, 17, 145. doi: 10.1002/(ISSN)1099-0739
-
[21]
Ritson, D. J.; Sutherland, J. D. Angew. Chem. 2013, 52, 5845. doi: 10.1002/anie.201300321
-
[22]
赵华绒, 朱婷婷, 浙江大学学报, 2010, 37, 442. http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/Zhao, H. R.; Zhu, T. T. J. Zhejiang Univ. 2010, 37, 442(in Chinese). http://d.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ0231481181/
-
[1]
-
表 1 目标化合物的杀菌活性(抑制率/%)
Table 1. Fungicidal screening data (inhibitory ratio/%) of compounds
化合物 黄瓜枯萎 花生褐斑 苹果轮纹 小麦纹枯 玉米小斑 西瓜炭疽 水稻恶苗 番茄早疫 小麦赤霉 马铃薯晚疫 辣椒疫霉 油菜菌核 黄瓜灰霉 水稻纹枯 拌种灵 17.9 33.3 50.0 35.7 30.4 18.2 18.8 19.2 48.8 9.4 37.0 71.4 26.8 78.8 4a 21.4 23.8 67.9 33.9 21.7 40.9 25.0 30.8 36.6 12.5 65.2 8.9 8.9 53.0 4b 14.3 19.0 17.9 37.5 21.7 22.7 25.0 19.2 24.4 18.8 32.6 19.6 21.4 15.2 4c 21.4 19.0 42.9 37.5 13.0 18.2 25.0 15.4 12.2 3.1 10.9 42.9 8.9 7.6 4d 14.3 19.0 50.0 21.4 26.1 22.7 25.0 19.2 12.2 9.4 8.7 53.6 17.9 6.1 4e 17.9 19.0 35.7 42.9 13.0 13.6 25.0 15.4 7.3 9.4 10.9 57.1 26.8 7.6 4f 21.4 19.0 28.6 46.4 26.1 36.4 25.0 19.2 12.2 3.1 10.9 8.9 8.9 7.6 4g 14.3 23.8 32.1 21.4 13.0 22.7 18.8 15.4 7.3 3.1 21.7 8.9 7.1 6.1 4h 39.3 23.8 46.4 51.8 39.1 45.5 31.3 30.8 39.0 15.6 28.3 25.0 10.7 22.7 4i 28.6 19.0 53.6 37.5 21.7 27.3 12.5 26.9 17.1 3.1 21.7 35.7 7.1 7.6 4j 21.4 23.8 35.7 16.1 17.4 27.3 18.8 23.1 7.3 3.1 21.7 26.8 7.1 6.1 4k 42.9 33.3 42.9 71.4 43.5 45.5 31.3 50.0 48.8 25.0 47.8 35.7 17.9 45.5 4l 17.9 23.8 32.1 32.1 21.7 18.2 18.8 23.1 4.9 3.1 10.9 35.7 8.9 15.2 4m 21.4 19.0 25.0 19.6 13.0 22.7 18.8 23.1 12.2 9.4 17.4 8.9 8.9 22.7 4n 35.7 23.8 50.0 53.6 34.8 36.4 25.0 23.1 12.2 12.5 21.7 17.9 3.6 7.6 4o 10.7 19.0 21.4 28.6 21.7 27.3 25.0 30.8 29.3 3.1 17.4 8.9 26.8 6.1 4p 39.3 23.8 53.6 44.6 30.4 36.4 18.8 23.1 17.1 12.5 34.8 8.9 8.9 6.1 4q 42.9 33.3 50.0 55.4 43.5 36.4 25.0 30.8 46.3 12.5 10.9 26.8 12.5 15.2 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 8
- 文章访问数: 2481
- HTML全文浏览量: 113


 下载:
下载:


 下载:
下载:

