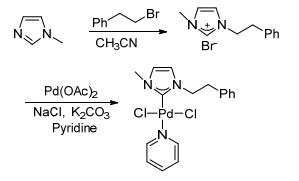
 图式 1
催化剂(NHC)PdCl2(Py)的合成路线
Scheme1.
Synthetic route to Pd-pyridine N-heterocyclic carbene complex
图式 1
催化剂(NHC)PdCl2(Py)的合成路线
Scheme1.
Synthetic route to Pd-pyridine N-heterocyclic carbene complex

Citation: Yuan Hang, Chen Huilian, Luo Zhibin, Gao Yuhua, Lu Hongfei. Synthesis of a Pd-Pyridine N-Heterocyclic Carbene Complex (NHC)-PdCl2(Py) and Its Efficient Application in Coupling Reaction[J]. Chinese Journal of Organic Chemistry, 2017, 37(11): 2948-2955. doi: 10.6023/cjoc201705027

一种含吡啶配体氮杂环卡宾钯络合物(NHC)PdCl2(Py)的合成及其高效催化偶联反应
-
关键词:
- 卡宾
- / Suzuki偶联反应
- / Heck偶联反应
- / Sonogashira偶联反应
English
Synthesis of a Pd-Pyridine N-Heterocyclic Carbene Complex (NHC)-PdCl2(Py) and Its Efficient Application in Coupling Reaction
-
Key words:
- carbene
- / suzuki coupling
- / Heck coupling
- / Sonogashira coupling
-
近几年来, N-杂环卡宾(NHC)作为一种配体已经成为过渡金属催化交叉偶联反应研究的热点[1].相比于传统的膦配体, NHC具有以下的一些优点:富电子、给电子能力强, 对金属的配位能力强, 合成出来的金属配合物具有较好的稳定性[2~4].同时NHC的结构也易于修饰[5].关于N-杂环卡宾金属配合物催化交叉偶联反应研究报道有很多[6~8].例如: Lin等报道了一系列N-杂环卡宾金属钯配合物催化Mizoroki-Heck反应.在相转移催化剂TBAB的共同作用下, 仅使用1 mol%催化量的催化剂就能取得最高大于99%的产率. Kuhn等报道了N-杂环卡宾金属钯配合物催化Suzuki-Miyaura反应.在常温下, 以水为溶剂, 使用1 mol%催化量的催化剂就能取得较好的收率. Navarro等使用(NHC)Pd和(NHC)Cu共同催化Sonogashira反应.使用0.01 mol% (NHC)Pd和1 mol% (NHC)Cu在二甲基亚砜(DMSO)作溶剂的条件下能取得较好的收率.我们课题组[9, 10]报道了简单的N-杂环卡宾钯配合物催化偶联反应.我们合成了一种简单的N-杂环卡宾钯配合物(NHC)PdCl2(Py) (Scheme 1), 并研究了其在Suzuki偶联反应、Heck偶联反应和Sonogashira偶联反应中的催化效果.
1 结果与讨论
1.1 Suzuki偶联反应
1.1.1 催化剂的筛选
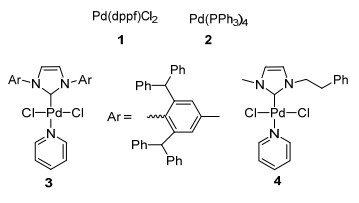
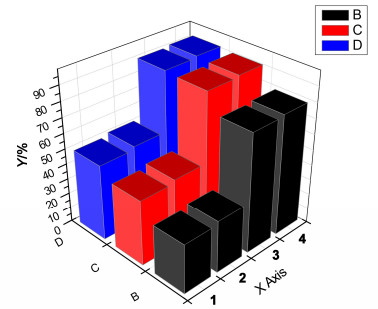
本实验以合成的(NHC)PdCl2(Py) (4), 传统的钯催化剂Pd(PPh3)4 (1)、Pd(dppf)Cl2 (2)和我们课题组已报道的催化剂3(图 1)[10]作为催化剂, 以苯硼酸(2a)和对甲氧基溴苯(B)、溴苯(C)、对氟溴苯(D)作为模板反应, 以碳酸钾为碱, 二氧六环作为溶剂于80 ℃下反应2 h考察了不同催化剂对于Suzuki偶联反应的影响.实验结果如图 2所示.
由图 2可以, 4和3的催化活性都要优于传统的催化剂2和1.当3的催化量是0.1 mol%, 使用0.1 mol%催化量4, 可以得到略高的收率.因此, 本实验采用4作为催化剂.
1.1.2 Suzuki偶联反应条件的优化
以苯硼酸和溴苯作为模板反应, (NHC)PdCl2(Py)为催化剂于80 ℃下反应2 h, 分别考察溶剂(四氢呋喃、二甲亚砜、甲苯、1, 4-二氧六环)和碱(醋酸钾、三水合磷酸钾、叔丁醇钾、碳酸钠)对于目标产物收率的影响.所有的筛选结果如表 1所示.
 表 1
Suzuki偶联反应反应条件的筛选a
Table 1.
Optimization of the reaction conditions in Suzuki-Miyaura coupling reaction
表 1
Suzuki偶联反应反应条件的筛选a
Table 1.
Optimization of the reaction conditions in Suzuki-Miyaura coupling reaction

Entry Solvent Base Yieldb/% 1 THF KOAc 23 2 DMSO KOAc 77 3 Toluene KOAc 37 4 1, 4-Dioxane KOAc 90 5 1, 4-Dioxane K3PO4·3H2O 25 6 1, 4-Dioxane NaOAc 53 7 1, 4-Dioxane Na2CO3 34 8 1, 4-Dioxane t-BuOK 21 aReaction conditions: bromobenzene (0.8 mmol), phenylboronic (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (0.1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. 由表 1可知, 不同种类的溶剂对于反应的影响很大.当使用二氧六环作为溶剂时, 产物的收率达到90%(表 1, Entry 4), 明显比四氢呋喃、二甲亚砜、甲苯(表 1, Entries 1~3)的收率要高.因此, 本实验选择二氧六环作为反应的溶剂.同时使用不同种类的碱, 对反应也有一定的影响.当使用三水合磷酸钾、醋酸钾、叔丁醇钾和碳酸钠(表 1, Entries 5~8)时, 得到了中等到良好的产率, 但是当使用醋酸钾时, 得到了最好的产率(表 1, Entry 4).因此, 本实验选择醋酸钾作为反应的碱.
1.1.3 Suzuki偶联反应底物的拓展
以芳基溴化物(0.8 mmol)和芳基硼酸(1 mmol)为原料, 醋酸钾(1.6 mmol)为碱, 二氧六环(2 mL)为溶剂, 0.1 mol% (NHC)PdCl2(Py)为催化剂于80 ℃下反应2 h, 得到一系列的目标产物.
由表 2可知, 无论芳基溴化物上的取代基是吸电子基团还是供电子基团, 反应都可以取得较好的结果.但是总的来说芳基溴化物上的取代基是吸电子基团的活性还是大于供电子基团.例如:含有硝基的芳基溴化物1b得到的产物3b的产率为93%(表 2, Entry 2), 而含有甲氧基的芳基溴化物1d得到的产物3d的产率为79%(表 2, Entry 4).同时取代基在芳基硼酸上对反应也是有影响的.例如:含有甲氧基的芳基硼酸2l到的产物3l产率为78%(表 2, Entry 12), 而苯硼酸2f得到的产物3f的产率为73%(表 2, Entry 6).

Entry Ar R1 3 Yieldb/% 1 C6H5 H 3a 91 2 p-O2NC6H4 H 3b 93 3 p-FC6H4 H 3c 92 4 p-CH3OC6H4 H 3d 79 5 m-CH3COC6H4 H 3e 86 6 o-HOC6H4 H 3f 73 7 o-F-p-CH3OC6H3 H 3g 81 8 C6H5 m-NO2 3h 80 9 p-FC6H4 m-NO2 3i 93 10 m-CH3COC6H4 m-NO2 3j 78 11 2-Thienyl m-NO2 3k 79 12 o-HOC6H4 p-OCH3 3l 79 aReaction conditions: aryl bormide (0.8 mmol), aryl boronic acid (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (0.1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. 1.2 Heck偶联反应
1.2.1 Heck偶联反应条件的优化
以苯乙烯和溴苯反应作为模板反应对Heck反应的反应条件进行了筛选.筛选的结果见表 3.

Entry Solvent Base Yieldb/% 1 THF TEA 24 2 DMSO TEA 61 3 Toluene TEA 55 4 DMF TEA 62 5 1, 4-Dioxane TEA 75 6 1, 4-Dioxane K3PO4·3H2O 45 7 1, 4-Dioxane K2CO3 48 8 1, 4-Dioxane Na2CO3 43 aReaction conditions: bormobenzene (0.8 mmol), styrene (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. 由表 3可知, 碱和溶剂对于Heck反应的影响较大.溶剂的影响表现得非常明显, 当使用四氢呋喃、二甲亚砜、甲苯和N, N-二甲基甲酰胺时, 可以取得一般到中等的产率(表 3, Entries 1~4).但是当使用二氧六环时, 产物的收率最高(表 3, Entry 5).因此, 本实验选择二氧六环作为反应的溶剂.同时, 研究了包括碳酸钾、碳酸钠、三水合磷酸钾(表 3, Entries 6~8)和三乙胺等不同种类的碱.当使用三乙胺作为碱时, 产物的收率最高可达75% (表 3, Entry 5).因此, 本实验选择三乙胺作为碱.
1.2.2 Heck偶联反应底物的拓展
以芳基溴化物(0.8 mmol)和苯乙烯衍生物(1 mmol)为原料, 三乙胺(1.6 mmol)为碱, 二氧六环(2 mL)为溶剂, 1 mol% (NHC)PdCl2(Py)为催化剂于80 ℃下反应2 h, 得到一系列的目标产物.
由表 4可知, 无论吸电子基团在芳基溴化物还是在苯乙烯衍生物上都能提高产物的收率.例如:含有吸电子基团氟在芳基溴化物上得到的产物4f(表 4, Entry 6)和含有吸电子基团氟在苯乙烯衍生物上得到的产物4i(表 4, Entry 9)都比不含吸电子基团的产物4a(表 4, Entry 1)的产率要高.当苯环上有供电子基团时(表 4, Entry 7), 产物的收率有所下降.

Entry R1 R2 4 Yieldb/% 1 H H 4a 75 2 H p-OH 4b 62 3 H p-OCH3 4c 60 4 H p-CH3 4d 67 5 H p-Cl 4e 79 6 H m-F 4f 77 7 p-F p-OCH3 4g 57 8 p-F p-CH3 4h 80 9 p-F H 4i 80 10 p-F m-F 4j 62 11 p-F p-Cl 4k 73 12 p-Cl p-OCH3 4l 78 13 p-Cl p-Cl 4m 81 14 p-Cl m-F 4n 85 aReaction conditions: aryl bormide (0.8 mmol), styrene derivatives (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (1 mol%), 2 h, 80 ℃, bIsolated yield by column chromatography. 1.3 Sonogashia偶联反应
1.3.1 Sonogashia偶联反应条件的优化
以苯乙炔和溴苯作为模板反应对Sonogashira反应的条件进行了筛选, 筛选的结果见表 5.
 表 5
Sonogashia偶联反应条件的筛选a
Table 5.
Optimization of the reaction conditions in Sonogashira coupling reaction
表 5
Sonogashia偶联反应条件的筛选a
Table 5.
Optimization of the reaction conditions in Sonogashira coupling reaction

Entry Solvent Base Yieldb/% 1 THF TEA 73 2 DMSO TEA 86 3 Toluene TEA 23 4 DMF TEA 72 5 1, 4-Dioxane TEA 75 6 DMSO K2CO3 41 7 DMSO Na2CO3 34 8 DMSO Pyridine 74 9 DMSO Piperidine 72 aReaction conditions: aryl bormide (0.8 mmol), phenylacetylene (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (0.1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. 由表可知, 溶剂对于反应的影响很大.当使用四氢呋喃、N, N-二甲基甲酰胺和二氧六环时, 反应可以取得中等的收率(表 5, Entries 1, 4, 5).使用甲苯作为溶剂时, 产物的收率很低(表 5, Entry 3).当使用二甲亚砜作为溶剂时, 产物的收率比其他的溶剂高很多(表 5, Entry 2).同时也研究了不同种类的碱对于反应的影响.当使用无机碱时, 例如:碳酸钠、碳酸钾(表 5, Entries 6, 7), 产物的收率很低.当使用吡啶和哌啶作为碱时(表 5, Entries 8, 9), 可以达到中等的产率.当使用三乙胺作为碱时, 得到了最高产率86%.因此, 本实验采用二甲亚砜作为溶剂和三乙胺作为碱.
1.3.2 Sonogashia偶联反应底物的拓展
以芳基溴化物或芳基磺酸酯(0.8 mmol)和苯乙炔衍生物(1 mmol)为原料, 三乙胺(1.6 mmol)为碱, 二甲亚砜(2 mL)为溶剂, 0.1 mol% (NHC)PdCl2(Py)为催化剂于80 ℃下反应2 h, 得到一系列的目标产物.
由表 6可知, 吸电子基团无论位于炔的苯环(表 6, Entry 13)或卤代化合物的苯环上(表 6, Entry 5)都可以提高产物的产率.给电子基团的存在将产率降低至72%(表 6, Entry 19).当使用萘环和杂环卤化物时, 产物的产率也将下降(表 6, Entries 6, 7).卤代烃的反应活性明显高于磺酸酯, 但从经济角度, 磺酸酯明显比卤代衍生物具有更好的应用价值.
 表 6
芳基卤化物和苯乙炔衍生物的Sonogashia偶联反应a
Table 6.
Sonogashira coupling reaction of aryl halide and aryl alkynes
表 6
芳基卤化物和苯乙炔衍生物的Sonogashia偶联反应a
Table 6.
Sonogashira coupling reaction of aryl halide and aryl alkynes

Entry R1 ArX 5 Yieldb/% 1 H PhBr 5a 86 2 H PhOTs 5a 81 3 H p-HOC6H4Br 5b 65 4 H o-CH3-m-CH3C6H3OTs 5c 75 5 H p-CNC6H4Br 5d 89 6 H 2-Bromothiophene 5e 85 7 H 1-Bromonaphthalene 5f 75 8 p-CH3 p-HOC6H4Br 5g 60 9 p-CH3 o-CH3-m-CH3C6H3Br 5h 63 10 p-CH3 p-CNC6H4Br 5i 83 11 p-CH3 2-Bromothiophene 5j 76 12 p-CH3 1-Bromonaphthalene 5k 65 13 p-F PhBr 5l 93 14 p-F PhOTs 5l 87 15 p-F p-CH3C6H4Br 5m 74 16 H p-ClC6H4OTs 5n 83 17 H p-O2NC6H4Br 5o 92 18 H p-O2NC6H4OTs 5o 86 19 p-CH3 C6H5Br 5p 72 20 p-CH3 p-CH3C6H4Br 5q 61 21 p-CH3 p-ClC6H4Br 5r 76 22 p-CH3 p-NO2C6H4Br 5s 77 aReaction conditions: aryl bormide (0.8 mmol), phenylethylene derivatives (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (0.1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. 2 结论
通过两步反应制备了一种NHC及其金属配合物, 并研究了该催化剂在Suzuki偶联、Heck偶联和Sonogashira偶联中的应用.该催化剂在Suzuki偶联、Heck偶联和Sonogashira偶联中显示了对溴苯底物和磺酸酯底物优异的活性.该催化剂具有制备简单、在空气中能稳定的存在等优点.在接下的研究中, 将对于催化剂的结构进行修饰, 并将研究其在芳基氯化物中的性能.
3 实验部分
3.1 仪器与试剂
Yansco显微熔点仪(天津市分析仪器厂, 型号RY-51), 温度计未校正; Bruker Avance Ⅱ (400 MHz)和Bruker DRX500 (500 MHz)型核磁共振仪.实验过程中所用的溶剂和试剂都是分析纯级的, 柱层析采用200~300目的柱层析硅胶.
3.2 催化剂的合成
3.2.1 N-杂环卡宾的合成
在氮气保护的条件下, 在50 mL的圆底烧瓶中加入N-甲基咪唑(200 mg, 2.436 mmol)和β-溴代苯乙烷(451 mg, 2.436 mmol), 加入20 mL乙腈作为溶剂, 搅拌过夜.反应结束后, 旋干多余的溶剂, 用少量的二氯甲烷溶解, 用乙醚洗涤, 减压蒸馏得到无色油状液体(355.7 mg, 产率78%). 1H NMR (400 MHz, CDCl3) δ: 9.94 (s, 1H), 7.45 (t, J=1.8 Hz, 1H), 7.32 (t, J=1.8 Hz, 1H), 7.23~7.15 (m, 5H), 4.57 (t, J=7.3 Hz, 2H), 3.96 (s, 3H), 3.19 (t, J=7.3 Hz, 2H).
3.2.2 N-杂环卡宾配合物(NHC)PdCl2(Py)的合成
向50 mL烧瓶中加入3-甲基-1-苯乙基咪唑溴化物(200 mg, 1.068 mmol), 醋酸钯(251.4 mg, 1.12 mmol), 氯化钠(1.248 g, 21.36 mmol), 碳酸钾(739.4 mg, 5.35 mmol)和15 mL吡啶.将上述溶液在100 ℃加热过夜, 反应结束后除去吡啶.残余物用乙醚洗涤数次以除去大部分吡啶, 最后溶于二氯甲烷中并过滤.纯化合物通过柱层析法获得(黄色固体, 275.5 mg, 产率58%). m.p. 206~208 ℃; 1H NMR (400 MHz, DMSO-d6) δ: 8.90 (d, J=5.6 Hz, 2H), 8.01 (s, 1H), 7.57 (d, J=7.7 Hz, 2H), 7.35 (ddd, J=10.3, 4.8, 2.5 Hz, 5H), 7.27 (t, J=4.9 Hz, 1H), 7.17 (t, J=1.9 Hz, 1H), 4.65 (s, 2H), 4.00 (d, J=8.6 Hz, 2H), 3.40 (s, 3H); 13C NMR (101 MHz, CDCl3) δ: 152.61, 152.01, 147.57, 138.05, 129.21, 128.66, 126.75, 124.58, 122.48, 52.69, 38.45, 36.45. Anal. calcd for C17H19Cl2N3-Pd: C 46.02, H 4.54, N 9.47; found C 46.12, H 4.56, N 9.49.
3.3 Suzuki偶联反应
以合成联苯(3a)为例.将溴苯(0.80 mmol, 126 mg), 苯硼酸(1.0 mmol, 122 mg), (NHC)PdCl2(Py) (0.1 mol%, 0.36 mg), 碳酸钾(1.6 mmol, 221 mg)和二氧六环(2 mL)加入10 mL反应试管中.将混合物在80 ℃下搅拌2 h.反应结束后冷却至室温, 反应用水淬灭, 对于含酚羟基的产物3f, 3l反应结束后先用稀盐酸酸化, 然后将混合物用乙酸乙酯萃取三次.合并有机相分用盐水洗涤两次, 然后将有机相用无水硫酸钠干燥, 并通过硅藻土过滤.将滤液蒸干, 粗产物通过柱层析纯化.
1, 1'-联苯(3a):白色固体0.111 g, 产率90%. m.p. 65~66 ℃(文献值[11] 67~69 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.65~7.58 (m, 4H), 7.46 (t, J=7.4 Hz, 4H), 7.36 (dd, J=10.8, 3.9 Hz, 2H).
4-硝基-1, 1'-联苯(3b):浅黄色固体0.148 g, 产率93%. m.p. 111~113 ℃(文献值[12] 112~113 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.37~8.29 (m, 2H), 7.81~7.72 (m, 2H), 7.69~7.61 (m, 2H), 7.57~7.43 (m, 3H).
4-氟-1-1'-联苯(3c):白色固体0.124 g, 产率90%. m.p. 72~73℃(文献值[13] 75~76 ℃); 1H NMR (500 MHz, CDCl3) δ: 7.55 (dd, J=8.0, 4.4 Hz, 4H), 7.44 (dd, J=10.2, 5.0 Hz, 2H), 7.35 (t, J=7.3 Hz, 1H), 7.13 (t, J=8.6 Hz, 2H).
4-甲氧基-1-1'-联苯(3d):白色固体0.115 g, 产率78%. m.p. 98~99℃(文献值[11] 96~98 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.59 (ddd, J=4.4, 3.8, 2.4 Hz, 4H), 7.44 (ddd, J=7.8, 4.3, 2.1 Hz, 4H), 7.35 (ddd, J=7.4, 3.9, 1.2 Hz, 1H), 4.75 (s, 2H), 1.78~1.55 (m, 1H).
3-乙酰基-1, 1'-联苯(3e)[11]:浅黄色油状物0.135 g, 产率86%. 1H NMR (400 MHz, CDCl3) δ: 8.18 (t, J=1.7 Hz, 1H), 7.93 (ddd, J=7.7, 1.6, 1.2 Hz, 1H), 7.78 (ddd, J=7.7, 1.8, 1.1 Hz, 1H), 7.61 (dq, J=2.6, 1.8 Hz, 2H), 7.56~7.34 (m, 4H), 2.65 (s, 3H).
1, 1'-联苯-2-酚(3f)[14]:黄色油状物0.099 g, 产率73%. 1H NMR (400 MHz, CDCl3) δ: 7.51~7.43 (m, 4H), 7.41~7.35 (m, 1H), 7.28~7.21 (m, 2H), 7.02~6.94 (m, 2H), 4.92 (s, 1H).
2-氟-4-甲氧基-1, 1'-联苯(3g):灰白色固体0.131 g, 产率81%; m.p. 90~91℃ (文献值[15] 88~89 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.53 (d, J=7.4 Hz, 2H), 7.42 (t, J=7.6 Hz, 2H), 7.36~7.28 (m, 3H), 7.02 (t, J=8.6 Hz, 1H), 3.93 (s, 3H).
3-硝基-1, 1'-联苯(3h):浅黄色固体0.124 g, 产率78%. m.p. 58~59℃ (文献值[12] 56~58 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.45 (t, J=2.0 Hz, 1H), 8.19 (ddd, J=8.2, 2.3, 1.0 Hz, 1H), 7.91 (ddd, J=7.7, 1.7, 1.1 Hz, 1H), 7.61 (ddd, J=12.8, 7.0, 4.7 Hz, 3H), 7.53~7.46 (m, 2H), 7.43 (ddd, J=7.3, 3.7, 1.3 Hz, 1H).
4'-氟-3-硝基-1, 1'-联苯(3i):浅黄色固体0.162 g, 产率93%. m.p. 82~83℃(文献值[12] 83~85 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.43 (t, J=2.0 Hz, 1H), 8.23 (ddd, J=8.2, 2.2, 0.9 Hz, 1H), 7.89 (ddd, J=7.8, 1.7, 1.1 Hz, 1H), 7.62 (ddd, J=8.7, 6.7, 5.0 Hz, 3H), 7.26~7.16 (m, 2H).
3-硝基-3'-乙酰基-1, 1'-联苯(3j):浅黄色固体0.150 g, 产率78%. m.p. 85~86 ℃(文献值[16] 84~86 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.47 (d, J=1.4 Hz, 1H), 8.29~8.17 (m, 2H), 8.01 (d, J=7.8 Hz, 1H), 7.95 (d, J=7.8 Hz, 1H), 7.83 (dd, J=7.7, 0.7 Hz, 1H), 7.63 (dt, J=15.8, 7.8 Hz, 2H), 2.68 (s, 3H).
2-(3-硝基苯基)噻吩(3k):黄色固体0.130 g, 产率79%. m.p. 71~72℃(文献值[17] 69~71 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.44 (s, 1H), 8.11 (d, J=8.2 Hz, 1H), 7.90 (d, J=7.8 Hz, 1H), 7.54 (t, J=8.0 Hz, 1H), 7.45~7.33 (m, 2H), 7.17~7.08 (m, 1H).
4'-甲氧基-(1, 1'-联苯)-2-酚(3l):白色固体0.127 g, 产率79%. m.p. 59~61 ℃(文献值[18] 60~62 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.43~7.36 (m, 2H), 7.26~7.19 (m, 2H), 7.04~6.94 (m, 4H), 5.27 (s, 1H), 3.89~3.81 (m, 3H).
3.4 Heck偶联反应
以合成反式-1, 2二苯乙烯(4a)为例.将溴苯(0.80 mmol, 126 mg)、苯乙烯(1.0 mmol, 104 mg)、(NHC)-PdCl2(Py) (1 mol%, 3.6 mg)、三乙胺(1.6 mmol, 162 mg)和二氧六环(2 mL)加入10 mL反应试管中.将混合物在80 ℃下搅拌2 h.反应结束后冷却至室温, 反应用水淬灭, 对于含酚羟基的产物4b反应结束后先用稀盐酸酸化, 然后将混合物用乙酸乙酯萃取三次.合并有机相分用盐水洗涤两次, 然后将有机相用无水硫酸钠干燥, 并通过硅藻土过滤.将滤液蒸干, 粗产物通过柱层析纯化.
反式-1, 2二苯乙烯(4a):白色固体0.11 g, 产率75%. m.p. 121~122℃(文献值[19] 122~124 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.52 (dd, J=5.1, 3.4 Hz, 4H), 7.39~7.32 (m, 4H), 7.29~7.22 (m, 2H), 7.11 (s, 2H).
反式-4-苯乙烯基苯酚(4b):白色固体0.097 g, 产率62%. m.p. 183~184℃(文献值[19] 180~182 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.48 (d, J=7.6 Hz, 2H), 7.41 (d, J=8.4 Hz, 2H), 7.34 (t, J=7.5 Hz, 2H), 7.25 (d, J=9.4 Hz, 2H), 7.05 (d, J=16.3 Hz, 1H), 6.96 (d, J=16.3 Hz, 1H), 6.83 (d, J=8.3 Hz, 2H).
反式-1-甲氧基-4-苯乙烯基苯(4c):白色固体0.10 g, 产率60%. m.p. 135~136℃(文献值[19] 134~135 ℃); 1H NMR (400 MHz, Chloroform-d) δ: 7.56~7.46 (m, 4H), 7.38 (t, J=7.7 Hz, 2H), 7.31~7.23 (m, 1H), 7.10 (d, J=16.3 Hz, 1H), 7.01 (d, J=16.3 Hz, 1H), 6.93 (d, J=8.8 Hz, 2H), 3.86 (s, 3H).
反式-1-甲基-4-苯乙烯基苯(4d):白色固体0.10 g, 产率67%. m.p. 119~120℃(文献值[19] 117~118 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.53~7.48 (m, 2H), 7.42 (d, J=8.1 Hz, 2H), 7.36 (dd, J=10.4, 4.8 Hz, 2H), 7.25 (dt, J=9.1, 4.1 Hz, 1H), 7.17 (d, J=7.9 Hz, 2H), 7.08 (d, J=2.5 Hz, 2H), 2.36 (s, 3H).
反式-1-氯-4-苯乙烯基苯(4e):白色固体0.14 g, 产率79%. m.p. 127~128℃(文献值[20] 127~129 ℃); 1H NMR (400 MHz, CDCl3-d) δ: 7.56~7.48 (m, 2H), 7.44 (d, J=8.5 Hz, 2H), 7.40~7.30 (m, 2H), 7.31~7.23 (m, 2H), 7.06 (d, J=16.3 Hz, 2H).
反式-1-氟-3-苯乙烯基苯(4f):白色固体0.12 g, 产率77%. m.p. 70~71℃(文献值[21] 75~76 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.51 (d, J=7.5 Hz, 2H), 7.37 (t, J=7.6 Hz, 2H), 7.31 (d, J=8.1 Hz, 2H), 7.26~7.19 (m, 2H), 7.08 (d, J=7.0 Hz, 2H), 6.95 (t, J=8.3 Hz, 1H).
反式-1-氟-4-(4-甲氧基苯乙烯基)苯(4g):白色固体0.11 g, 产率57%. m.p. 136~137 ℃(文献值[19] 134~135 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.45 (t, J=7.1 Hz, 4H), 7.03 (dd, J=15.8, 6.3 Hz, 2H), 6.95 (d, J=6.0 Hz, 2H), 6.90 (d, J=8.3 Hz, 2H), 3.83 (s, 3H).
反式-1-氟-4-(4-甲基苯乙烯基)苯(4h):白色固体0.12 g, 产率80%. m.p. 125~126 ℃(文献值[19] 123~124 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.45 (dd, J=8.8, 5.4 Hz, 2H), 7.39 (d, J=8.1 Hz, 2H), 7.16 (d, J=7.9 Hz, 2H), 7.08~6.94 (m, 4H), 2.36 (s, 3H).
反式-1-氟-4-苯乙烯基苯(4i):白色固体0.12 g, 产率80%. m.p. 123~124 ℃(文献值[19] 122~123 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.49 (t, J=9.4 Hz, 4H), 7.36 (t, J=7.6 Hz, 2H), 7.25 (d, J=5.0 Hz, 1H), 7.10~6.98 (m, 4H).
反式-1-氟-3-氟苯乙烯基苯(4j):白色固体0.14 g, 产率62%. m.p. 92~93 ℃(文献值[22] 91~92 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.47 (dd, J=8.1, 5.7 Hz, 2H), 7.35~7.29 (m, 1H), 7.25 (s, 1H), 7.24~7.17 (m, 1H), 7.10~7.02 (m, 3H), 6.96 (dd, J=16.1, 4.9 Hz, 2H).
反式-1-氟-4-(4-甲氧基苯乙烯基)苯(4k):白色固体0.16 g, 产率73%. m.p. 130~131 ℃(文献值[22] 128~129 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.49~7.39 (m, 4H), 7.32 (d, J=8.3 Hz, 2H), 7.04 (dd, J=15.5, 6.8 Hz, 3H), 6.95 (d, J=16.4 Hz, 1H).
反式-1-氯-4-(4-甲氧基苯乙烯基)苯(4l):白色固体0.11 g, 产率78%. m.p. 178~179 ℃(文献值[22] 176~178 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.43 (dd, J=12.9, 8.5 Hz, 4H), 7.30 (d, J=8.2 Hz, 2H), 7.03 (d, J=16.3 Hz, 1H), 6.95~6.87 (m, 3H), 3.83 (s, 3H).
反式-1, 2-二(4-氯苯基)乙烷(4m):白色固体0.16 g, 产率81%. m.p. 70~71 ℃(文献值[22] 68~70 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.46~7.40 (m, 4H), 7.33 (d, J=8.4 Hz, 4H), 7.02 (s, 2H).
反式-1-氯-4-(4-氟苯乙烯基)苯(4n):白色固体0.16 g, 产率85%. m.p. 130~131℃(文献值[22] 128~129 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.49~7.39 (m, 4H), 7.32 (d, J=8.3 Hz, 2H), 7.04 (dd, J=15.5, 6.8 Hz, 3H), 6.95 (d, J=16.4 Hz, 1H).
3.5 Sonogashira偶联反应
以合成二苯基乙炔(5a)为例.将溴苯(0.80 mmol, 126 mg), 苯乙炔(1.0 mmol, 102 mg), (NHC)PdCl2(Py) (0.1 mol%, 0.36 mg), 三乙胺1.6 mmol, 162 mg)和二甲基亚砜(2 mL)加入10 mL反应试管中.将混合物在80 ℃下搅拌2 h.反应结束后冷却至室温, 反应用水淬灭, 对于含酚羟基的产物5b, 5g反应结束后先用稀盐酸酸化, 然后将混合物用乙酸乙酯萃取三次.合并有机相分用盐水洗涤两次, 然后将有机相用无水硫酸钠干燥, 并通过硅藻土过滤.将滤液蒸干, 粗产物通过柱层析纯化.
1, 2-二苯基乙炔(5a):黄色固体0.12 g, 产率86%. m.p. 59~60℃(文献值[23] 60~61 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.53 (ddd, J=6.4, 4.0, 2.8 Hz, 4H), 7.39~7.30 (m, 6H).
4-(苯基乙炔基)苯酚(5b):白色固体0.10 g, 产率65%. m.p. 121~122℃(文献值[23] 122~123 ℃); 1H NMR (500 MHz, CDCl3) δ: 7.56~7.48 (m, 2H), 7.43 (d, J=8.6 Hz, 2H), 7.37~7.28 (m, 3H), 6.82 (d, J=8.6 Hz, 2H), 5.11 (s, 1H).
1, 2-二甲基-3-(苯基乙炔基)苯(5c)[24]:无色油状物0.12 g, 产率75%. 1H NMR (400 MHz, CDCl3) δ: 7.54 (dd, J=7.7, 1.7 Hz, 2H), 7.39~7.31 (m, 4H), 7.09 (dt, J=15.0, 7.4 Hz, 2H), 2.47 (s, 3H), 2.30 (s, 3H). Anal. calcd for C16H14: C 93.16, H 6.84; found C 93.40, H 6.60.
4-(苯基乙炔基)苄腈(5d):黄色固体0.14 g, 产率89%.m.p. 107~108℃(文献值[23] 108~110 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.69~7.61 (m, 4H), 7.60~7.54 (m, 2H), 7.44~7.38 (m, 3H).
2-(苯基乙炔基)噻吩(5e):浅黄色固体0.13 g, 产率85%. m.p. 48~49℃(文献值[24] 48~50 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.59~7.54 (m, 2H), 7.41~7.36 (m, 3H), 7.35~7.30 (m, 2H), 7.07~7.02 (m, 1H).
1-(苯基乙炔基)萘(5f)[24]:黄色粘稠油状物0.14 g, 产率75%. 1H NMR (400 MHz, CDCl3) δ: 8.50 (d, J=8.3 Hz, 1H), 7.90 (t, J=9.0 Hz, 2H), 7.81 (dd, J=7.1, 1.1 Hz, 1H), 7.74~7.68 (m, 2H), 7.65 (ddd, J=8.3, 6.9, 1.4 Hz, 1H), 7.58 (ddd, J=8.1, 6.9, 1.3 Hz, 1H), 7.50 (dd, J=8.2, 7.2 Hz, 1H), 7.47~7.39 (m, 3H).
4-(对甲基苯乙炔基)苯酚(5g):黄色固体0.10 g, 产率60%. m.p. 120~121℃(文献值[25] 124℃); 1H NMR (400 MHz, CDCl3) δ: 7.41 (dd, J=7.9, 6.3 Hz, 4H), 7.14 (d, J=7.9 Hz, 2H), 6.80 (d, J=8.5 Hz, 2H), 4.89 (s, 1H), 2.36 (s, 3H).
1, 2-二甲基-3-(对甲基苯乙炔基)苯(5h)[24]:无色油状物0.11 g, 产率63%. 1H NMR (400 MHz, CDCl3) δ: 7.43 (d, J=8.0 Hz, 2H), 7.36 (d, J=7.3 Hz, 1H), 7.15 (d, J=7.9 Hz, 2H), 7.08 (dt, J=14.9, 7.4 Hz, 2H), 2.46 (s, 3H), 2.37 (s, 3H), 2.29 (s, 3H).
4-(对甲基苯乙炔基)苄腈(5i):黄色固体0.14 g, 产率83%. m.p. 161~162 ℃(文献值[26] 162~163℃); 1H NMR (400 MHz, CDCl3) δ: 7.61 (q, J=8.3 Hz, 4H), 7.44 (d, J=7.9 Hz, 2H), 7.19 (d, J=7.8 Hz, 2H), 2.39 (s, 3H).
2-(对甲基苯乙炔基)噻吩(5j):浅黄色固体0.12 g, 产率76%. m.p. 64~65℃(文献值[25] 68~70℃); 1H NMR (400 MHz, CDCl3) δ: 7.49~7.40 (m, 2H), 7.30 (qd, J=3.4, 1.6 Hz, 2H), 7.19 (d, J=7.9 Hz, 2H), 7.03 (dd, J=5.1, 3.7 Hz, 1H), 2.40 (s, 3H). Anal. calcd for C13H10S: C 78.75, H 5.08, S 16.17; found C 78.58, H 4.93, S 16.49.
1-(对甲基苯乙炔基)萘(5k):浅黄色固体0.13 g, 产率65%. m.p. 54~55 ℃(文献值[26] 51~53℃); 1H NMR (400 MHz, CDCl3) δ: 8.48 (d, J=8.3 Hz, 1H), 7.88 (dd, J=12.8, 8.2 Hz, 2H), 7.79 (dd, J=7.2, 1.1 Hz, 1H), 7.66~7.55 (m, 4H), 7.49 (dd, J=8.2, 7.2 Hz, 1H), 7.24 (d, J=7.8 Hz, 2H), 2.43 (s, 3H).
1-氟-4-(苯基乙炔基)苯(5l):白色固体0.12 g, 产率79%. m.p. 108~109℃(文献值[23] 108~110℃); 1H NMR (400 MHz, CDCl3) δ: 7.59~7.51 (m, 4H), 7.42~7.34 (m, 3H), 7.08 (ddd, J=8.8, 5.9, 2.5 Hz, 2H).
1-氟-4-(对甲基苯乙炔基)苯(5m):白色固体0.12 g, 产率74%. m.p. 96~97 ℃(文献值[24]97~98℃); 1H NMR (400 MHz, CDCl3) δ: 7.58~7.50 (m, 2H), 7.48~7.41 (m, 2H), 7.19 (d, J=7.9 Hz, 2H), 7.11~7.03 (m, 2H), 2.40 (s, 3H).
1-氯-4-(苯乙炔基)苯(5n):白色固体0.14 g, 产率83%. m.p. 81~82 ℃(文献值[24] 82~84℃); 1H NMR (400 MHz, CDCl3) δ: 7.58~7.54 (m, 2H), 7.51~7.47 (m, 2H), 7.42~7.33 (m, 5H).
1-硝基-4-(苯乙炔基)苯(5o):黄色固体0.15 g, 产率86%. m.p. 121~122℃(文献值[23] 120~122℃); 1H NMR (400 MHz, CDCl3) δ: 8.28~8.20 (m, 2H), 7.73~7.65 (m, 2H), 7.58 (dt, J=5.5, 2.1 Hz, 2H), 7.47~7.37 (m, 3H).
1-甲基-4-(苯乙炔基)苯(5p):白色固体0.11 g, 产率72%. m.p. 67~68 ℃(文献值[23] 69~71℃); 1H NMR (400 MHz, CDCl3) δ: 7.60~7.53 (m, 2H), 7.51~7.44 (m, 2H), 7.41~7.32 (m, 3H), 7.19 (d, J=7.9 Hz, 2H), 2.40 (s, 3H).
1, 2-二甲基二苯基乙炔(5q):白色固体0.10 g, 产率61%. m.p. 138~139℃(文献值[24] 137~139℃); 1H NMR (400 MHz, CDCl3) δ: 7.41 (d, J=8.0 Hz, 4H), 7.15 (d, J=7.9 Hz, 4H), 2.36 (s, 6H).
1-氯-4-(对甲基苯乙炔基)苯(5r):白色固体0.14 g, 产率76%. m.p. 149~150 ℃(文献值[24] 148~150 ℃); 1H NMR (400 MHz, CDCl3) δ: 7.46 (ddd, J=10.8, 6.3, 2.0 Hz, 4H), 7.38~7.31 (m, 2H), 7.19 (d, J=7.9 Hz, 2H), 2.40 (s, 3H).
1-甲基-4-[(4-硝基苯基)乙炔基]苯(5s):黄色固体0.15 g, 产率77%. m.p. 155~156 ℃(文献值[24]155~157 ℃); 1H NMR (400 MHz, CDCl3) δ: 8.29~8.18 (m, 2H), 7.72~7.61 (m, 2H), 7.48 (d, J=8.1 Hz, 2H), 7.22 (d, J=7.9 Hz, 2H), 2.41 (s, 3H).
辅助材料(Supporting Information) 催化剂及所有产物的1H NMR、13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Schuster, O.; Yang, L. Y.; Raubenheimer, G. H.; Albrecht, M. Chem. Rev.2009, 109, 3445. doi: 10.1021/cr8005087
-
[2]
(a) Hahn, F. E.; Jahnke, M. C. Angew. Chem., Int. Ed. 2009, 47, 3122.
(b) Brien, C. J.; E. Kantchev, A. B.; Hadei, C. V.; Chass, G. A.; .Lough, A.; Hopkinson, A. C.; Organ, M, G. Chem. Eur. J. 2006, 12, 4743.
(c) Organ, M. G.; Avola, S.; Dubovyk, I.; Hadei, N.; Kantchev, A. B.; C. Brien, J.; Valente, V. Chem. Eur. J.2006, 12, 4749.
(d) Calimsiz, S.; Sayah, M.; Mallik, D.; Organ, M. G. Angew. Chem., Int. Ed. 2010, 49, 2014.
(e) Calimsiz, S.; Organ, M. G. Chem. Commun. 2011, 47, 5181.
(f) Hoi, K. W.; Froese, R. D.; Hopkinson, A. C.; Organ, M. G. Chem. Eur. J. 2012, 18, 145. -
[3]
(a) Herrmann, W. A. Angew. Chem., Int. Ed. 2002, 41, 1290.
(b) Chartoire, A; Frogneux, X.; Boreux, A.; Slawin, A. M. Z.; Nolan, S. P. Organometallics 2012, 31, 6947.
(c) Farmer, J. L.; Hunter, H. N.; Organ, M. G. J. Am. Chem. Soc. 2012, 134, 17470.
(d) Sase, S.; Jaric, M.; Metzger, A.; Malakhov, V.; Knochel, P. J. Org. Chem.2008, 73, 7380.
(e) Colombel, V.; Rombouts, F.; Oehlrich, D.; Molander, G. A. J. Org. Chem. 2012, 77, 2966. -
[4]
(a) Kaufhold, O.; Hahn, F. E. Angew. Chem., Int. Ed. 2008, 47, 4507.
(b) Han, Y.; Huynh, H. V.; Tan, G. K. Organometallics 2007, 26, 6447.
(c) Liao, C. Y.; Chan, K. T.; Zeng, J. Y.; Hu, C. H.; Tu, C. Y.; Lee, H. M. Organometallics 2007, 26, 1692.
(d) Zanardi, A.; Mata, J. A.; Peris, E. Organometallics 2009, 28, 4335. -
[5]
(a) Arduengo, A. J.; Harlow, R. L.; Kline, M. J. Am. Chem. Soc. 1991, 113, 361.
(b) Valente, C.; Ho, K. O.; Mallik, D.; Sayah, M.; Organ, M. G. Angew. Chem., Int. Ed. 2012, 51, 3314. -
[6]
(a) Lin, Y. C.; Hsueh, H. H.; Kanne, S.; Chang, L. K.; Liu, F. C.; Lee, G. H.; Peng, S. M. Organometallics 2013, 32, 3859.
(b) Tamami, B.; Farjadian, F.; Ghasemi, S.; Allahyari, H. New J. Chem. 2013, 37, 2011.
(c) Faraji, L.; Jadidi, K.; Notash, B. Tetrahedron Lett. 2014, 55, 346.
(d) Wilczewska, A. Z.; Misztalewsk, I. Organometallics 2014, 33, 5203.
(e) Taira, T.; Yanagimoto, T.; Sakai, K.; Sakai, H.; Endo, A.; Imura, T. Tetrahedron2016, 72, 4117. -
[7]
(a) Zhong, R.; Pö thig, A.; Feng, Y. K.; Riener, K.; Herrmann, W. A.; Kühn, F. E. Green Chem.2014, 16, 4955.
(b)Marion, N.; Nolan, S. P. Acc. Chem. Res. 2008, 41, 1440.
(c) Xu, S. J.; Song, K. P.; Li, T.; Tan, B. J. Mater. Chem. A 2015, 3, 1272.
(d) Xu, C.; Li, H. M.; Xiao, Z. Q.; Wang, Z. Q.; Tang, S. F.; Ji, B. M.; Hao, X. Q.; Song, M. P. Dalton Trans. 2014, 43, 10235.
(e) Rajabi, F.; Thiel, W. R. Adv. Synth. Catal. 2014, 356, 1873. -
[8]
(a) Gallop, C. W. D.; Chen, M. T.; Navarro, O. Org. Lett. 2014, 16, 3724.
(b) Boubakri, L.; Yasar, S.; Dorcet, V.; Roisnel, T.; Bruneau, C.; Hamdib, N.; Ozdemira, I. New J. Chem. 2017, 41, 5105.
(c) Bernhammer, J. C.; Chong, N. X.; Jothibasu, R.; Zhou, B. B; Huynh, H. V. Organometallics 2014, 33, 3607.
(d) John, A.; Modak, S.; Madasu, M.; Katari, M.; Ghosh, P. Polyhedron 2013, 64, 20. -
[9]
Lu, H. F.; Wang, L.; Yang, F. F.; Wu, R. Z.; Shen, W. RSC Adv. 2014, 4, 30447. doi: 10.1039/C4RA02480J
-
[10]
唐演, 杨飞飞, 聂士鹏, 王林, 罗治斌, 陆鸿飞, 有机化学, 2015, 35, 705. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344694.shtmlTang, Y.; Yang, F. F.; Nie, S. P.; Wang, L.; Luo, Z. B.; Lu, H. F. Chin. J. Org. Chem. 2015, 35, 705(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract344694.shtml
-
[11]
Rajabi, F.; Thiel, W. R. Adv. Synth. Catal. 2014, 356, 1873. doi: 10.1002/adsc.201300841
-
[12]
Zhou, W. J.; Wang, K. H.; Wang, J. X.; Huang, D. F. Eur. J. Org. Chem. 2010, 416. http://new.med.wanfangdata.com.cn/Paper/Detail?id=PeriodicalPaper_JJ0215629060
-
[13]
Liu, W.; Tian, F.; Wang, X. L.; Yu, H.; Bi, Y. L. Chem. Commun. 2013, 49, 2983. doi: 10.1039/c3cc40695d
-
[14]
Long, R. R.; Yan, X. F.; Wu, Z. Q.; Li, Z. K.; Xiang, H. F.; Zhou, X. G. Org. Biomol. Chem. 2015, 13, 3571. doi: 10.1039/C5OB00132C
-
[15]
Edsall, R. J.; Harris, H. A.; Manas, E. S.; Mewshaw, R. E. Bioorg. Med. Chem. 2003, 11, 3457. doi: 10.1016/S0968-0896(03)00303-1
-
[16]
So, C. M.; Chow, W. K.; Choy, P. Y.; Lau, C. P.; Kwong, F. Y. Chem. Eur. J. 2010, 16, 7996. doi: 10.1002/chem.201000723
-
[17]
Perretti, M. D.; Monzon, D. M.; Crisostomo, F. P.; Martn, V. S.; Carrillo, R. Chem. Commun. 2016, 52, 9036. doi: 10.1039/C5CC09911K
-
[18]
Duan, S. T.; Xu, Y. S.; Zhang, X. Y.; Fan, Y. S. Chem. Commun. 2016, 52, 10529. doi: 10.1039/C6CC04756D
-
[19]
Zhao, F.; Luo, J. Y.; Tan, Q.; Liao, Y. F.; Peng, S. M.; Deng, G. J. Adv. Synth. Catal. 2012, 354, 1914. doi: 10.1002/adsc.v354.10
-
[20]
Zhang, Y. G.; Liu, X. L.; He, Y. Z.; Li, X. M.; Kang, H. J.; Tian, S. K. Chem. Eur. J. 2014, 20, 2765. doi: 10.1002/chem.v20.10
-
[21]
Yu, L.; Huang, Y. P.; Wei, Z.; Ding, Y. H.; Su, C. L.; Xu, Q. J. Org. Chem. 2015, 80, 8677. doi: 10.1021/acs.joc.5b01358
-
[22]
Hong, F. J.; Low, Y. Y.; Chong, K. W.; Thomas, N. F.; Kam, T. S. J. Org. Chem. 2014, 79, 4528. doi: 10.1021/jo500559r
-
[23]
Sagadevan, A.; Hwanga, K. C. Adv. Synth. Catal. 2012, 354, 3421. doi: 10.1002/adsc.v354.18
-
[24]
Zhao, D. B.; Gao, C.; Su, X. Y.; He, Y. Q.; You, J. S.; Xue, Y. Chem. Commun. 2010, 46, 9049. doi: 10.1039/c0cc03772a
-
[25]
Kim, T.; Jeong, K. H.; Kim, Y.; Noh, T.; Choi, J.; Ham, J. Eur. J. Org. Chem. 2017, 2425.
-
[26]
Jadhav, S. N.; Kumbhar, A. S.; Mali, S. S.; Hong, C. K.; Salunkhe, R. S. New J. Chem. 2015, 39, 2333. doi: 10.1039/C4NJ02025A
-
[1]
-
表 1 Suzuki偶联反应反应条件的筛选a
Table 1. Optimization of the reaction conditions in Suzuki-Miyaura coupling reaction

Entry Solvent Base Yieldb/% 1 THF KOAc 23 2 DMSO KOAc 77 3 Toluene KOAc 37 4 1, 4-Dioxane KOAc 90 5 1, 4-Dioxane K3PO4·3H2O 25 6 1, 4-Dioxane NaOAc 53 7 1, 4-Dioxane Na2CO3 34 8 1, 4-Dioxane t-BuOK 21 aReaction conditions: bromobenzene (0.8 mmol), phenylboronic (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (0.1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. 表 2 芳基溴化物和芳基硼酸的Suzuki偶联反应a
Table 2. Suzuki coupling reaction of aryl bromide and aryl boronic acid

Entry Ar R1 3 Yieldb/% 1 C6H5 H 3a 91 2 p-O2NC6H4 H 3b 93 3 p-FC6H4 H 3c 92 4 p-CH3OC6H4 H 3d 79 5 m-CH3COC6H4 H 3e 86 6 o-HOC6H4 H 3f 73 7 o-F-p-CH3OC6H3 H 3g 81 8 C6H5 m-NO2 3h 80 9 p-FC6H4 m-NO2 3i 93 10 m-CH3COC6H4 m-NO2 3j 78 11 2-Thienyl m-NO2 3k 79 12 o-HOC6H4 p-OCH3 3l 79 aReaction conditions: aryl bormide (0.8 mmol), aryl boronic acid (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (0.1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. 表 3 Heck偶联反应条件的筛选a
Table 3. Optimization of the reaction conditions in Heck coupling reaction

Entry Solvent Base Yieldb/% 1 THF TEA 24 2 DMSO TEA 61 3 Toluene TEA 55 4 DMF TEA 62 5 1, 4-Dioxane TEA 75 6 1, 4-Dioxane K3PO4·3H2O 45 7 1, 4-Dioxane K2CO3 48 8 1, 4-Dioxane Na2CO3 43 aReaction conditions: bormobenzene (0.8 mmol), styrene (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. 表 4 芳基溴化物和苯乙烯衍生物的Heck偶联反应a
Table 4. Heck coupling reaction of aryl bromide and aryl alkene

Entry R1 R2 4 Yieldb/% 1 H H 4a 75 2 H p-OH 4b 62 3 H p-OCH3 4c 60 4 H p-CH3 4d 67 5 H p-Cl 4e 79 6 H m-F 4f 77 7 p-F p-OCH3 4g 57 8 p-F p-CH3 4h 80 9 p-F H 4i 80 10 p-F m-F 4j 62 11 p-F p-Cl 4k 73 12 p-Cl p-OCH3 4l 78 13 p-Cl p-Cl 4m 81 14 p-Cl m-F 4n 85 aReaction conditions: aryl bormide (0.8 mmol), styrene derivatives (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (1 mol%), 2 h, 80 ℃, bIsolated yield by column chromatography. 表 5 Sonogashia偶联反应条件的筛选a
Table 5. Optimization of the reaction conditions in Sonogashira coupling reaction

Entry Solvent Base Yieldb/% 1 THF TEA 73 2 DMSO TEA 86 3 Toluene TEA 23 4 DMF TEA 72 5 1, 4-Dioxane TEA 75 6 DMSO K2CO3 41 7 DMSO Na2CO3 34 8 DMSO Pyridine 74 9 DMSO Piperidine 72 aReaction conditions: aryl bormide (0.8 mmol), phenylacetylene (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (0.1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. 表 6 芳基卤化物和苯乙炔衍生物的Sonogashia偶联反应a
Table 6. Sonogashira coupling reaction of aryl halide and aryl alkynes

Entry R1 ArX 5 Yieldb/% 1 H PhBr 5a 86 2 H PhOTs 5a 81 3 H p-HOC6H4Br 5b 65 4 H o-CH3-m-CH3C6H3OTs 5c 75 5 H p-CNC6H4Br 5d 89 6 H 2-Bromothiophene 5e 85 7 H 1-Bromonaphthalene 5f 75 8 p-CH3 p-HOC6H4Br 5g 60 9 p-CH3 o-CH3-m-CH3C6H3Br 5h 63 10 p-CH3 p-CNC6H4Br 5i 83 11 p-CH3 2-Bromothiophene 5j 76 12 p-CH3 1-Bromonaphthalene 5k 65 13 p-F PhBr 5l 93 14 p-F PhOTs 5l 87 15 p-F p-CH3C6H4Br 5m 74 16 H p-ClC6H4OTs 5n 83 17 H p-O2NC6H4Br 5o 92 18 H p-O2NC6H4OTs 5o 86 19 p-CH3 C6H5Br 5p 72 20 p-CH3 p-CH3C6H4Br 5q 61 21 p-CH3 p-ClC6H4Br 5r 76 22 p-CH3 p-NO2C6H4Br 5s 77 aReaction conditions: aryl bormide (0.8 mmol), phenylethylene derivatives (1 mmol), base (1.6 mmol), solvent (2 mL), (NHC)PdCl2(Py) (0.1 mol%), 2 h, 80 ℃. bIsolated yield by column chromatography. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 3429
- HTML全文浏览量: 213


 下载:
下载:


 下载:
下载:

