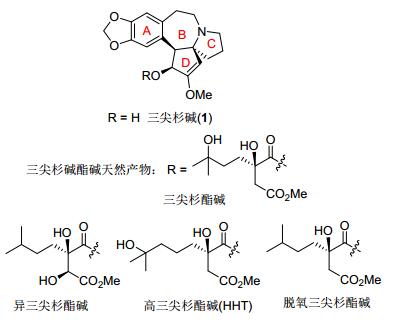
 图1
三尖杉碱及其酯碱类天然产物
Figure1.
(-)-Cephalotaxine and ester-type cephalotaxus alkaloids
图1
三尖杉碱及其酯碱类天然产物
Figure1.
(-)-Cephalotaxine and ester-type cephalotaxus alkaloids

Citation: Chen Yang, Li Wei-Dong Z. Asymmetric Total Synthesis of (-)-Cephalotaxine[J]. Chinese Journal of Organic Chemistry, 2017, 37(8): 1885-1902. doi: 10.6023/cjoc201705025

天然三尖杉碱((-)-Cephalotaxine)的不对称全合成研究
English
Asymmetric Total Synthesis of (-)-Cephalotaxine
-
Key words:
- natural products
- / total synthesis
- / (-)-cephalotaxine
- / asymmetric synthesis
- / racemization
-
1954年, Wall等[1]报道了三尖杉属植物(Cephalotaxus sp)含有生物碱化合物. 1963年, Paudler等[2]从三尖杉植物中分离得到结晶性生物碱并命名为三尖杉碱(Cephalotaxine, 1). 1969年, Abraham等[3]通过三尖杉碱碘甲烷季铵盐的X射线单晶衍射确定了其骨架结构, 但该结晶为外消旋体. 1974年, Powell等[4]通过三尖杉碱的对溴苯甲酸酯的X射线单晶衍射确定了其绝对立体化学(如图 1中1所示).三尖杉碱具有独特结构特征: (1) 异喹啉生物碱天然产物特有的包含苯并杂(benza-zepine)的[6-7-5-5]氮杂环系结构; (2) 多官能团取代及具有三个相邻手性中心的D-环单元; (3) 烯醚官能团.
三尖杉碱本身并不具有生物活性, 但它的很多酯碱衍生物(图 1)具有显著的抗肿瘤活性[5].自19世纪70年代以来, 我国就已将三尖杉酯碱用于癌症和急性粒细胞白血病等相关疾病的治疗中, 取得了显著效果, 并载入1990版中国药典[6]. 2012年, 美国食品药品监督管理局(FDA)批准高三尖杉酯碱(HHT)用于治疗慢性粒白血病(CML)适应症[7].目前, 该药物仍依赖人工半合成[8, 9]的方式获得.
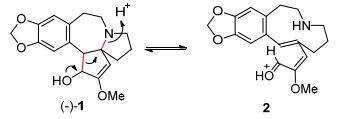
三尖杉碱易于消旋化. 1969年, Abraham等[3]发现天然三尖杉碱的碘甲烷盐在结晶过程中发生了外消旋化.此外, 1980年, 黄文魁、李裕林和潘鑫复先生等[10]发现从福建三尖杉中分离所得三尖杉碱有15%消旋化. 1980年, 我国著名化学家梁晓天先生[11]发现天然三尖杉碱的盐酸盐在水溶液中确实存在外消旋化现象, 并首次提出了三尖杉碱外消旋化机理假说, 认为三尖杉碱在发生消旋时, 首先氮原子被质子化, 再断裂C—N键和C—C键, 3个手性中心全部平面化, 生成共轭二烯醛中间体2, 再发生二级胺的串联跨环环化得到消旋三尖杉碱(Scheme 1).
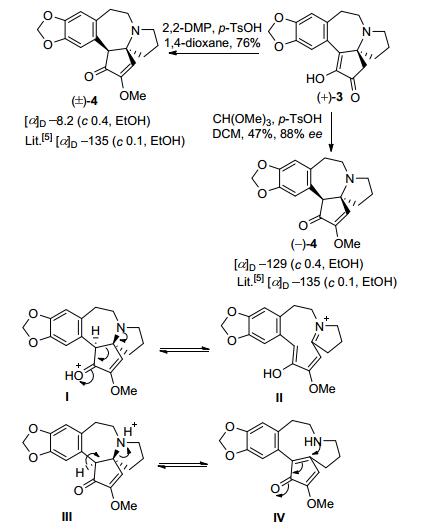
三尖杉碱家族其他化合物如三尖杉酮碱也存在消旋化现象. 1995年, Mori等[12]在首次不对称全合成天然三尖杉碱过程中, 发现(-)-三尖杉酮碱在对甲苯磺酸的1, 4-二氧六环溶液中发生了消旋化.推测三尖杉酮碱外消旋化机理如Scheme 2所示, 一种可能是羟基氧经质子化得到Ⅰ, 然后断裂C—C键生成Ⅱ, 再环合的消旋化历程; 另一种可能是三级胺氮原子质子化得到Ⅲ, 再断裂C—N键得到Ⅳ, 然后环合发生消旋化的历程(Scheme 2).
天然三尖杉碱的光学不稳定性导致其不对称全合成非常困难.直至1995年, 才有Mori等[12]完成了天然三尖杉碱的首次不对称全合成, 至今已有18个小组发展了23条合成策略. 2012年, Nay等[13]对三尖杉碱家族化合物的化学多样性及合成研究工作进行了系统综述, 但关于天然三尖杉碱不对称全合成研究工作的综述仅有O'Doherty等[14a]于2009年对Ishibashi小组[15]和Hayes小组[16]的工作进行了简要评述, 以及2016年曾步兵等[14b]在《药用天然产物全合成:合成路线精选》一书中总结了自1972年以来的26条三尖杉碱全合成策略, 包含了14条光学纯左旋三尖杉碱的全合成策略.
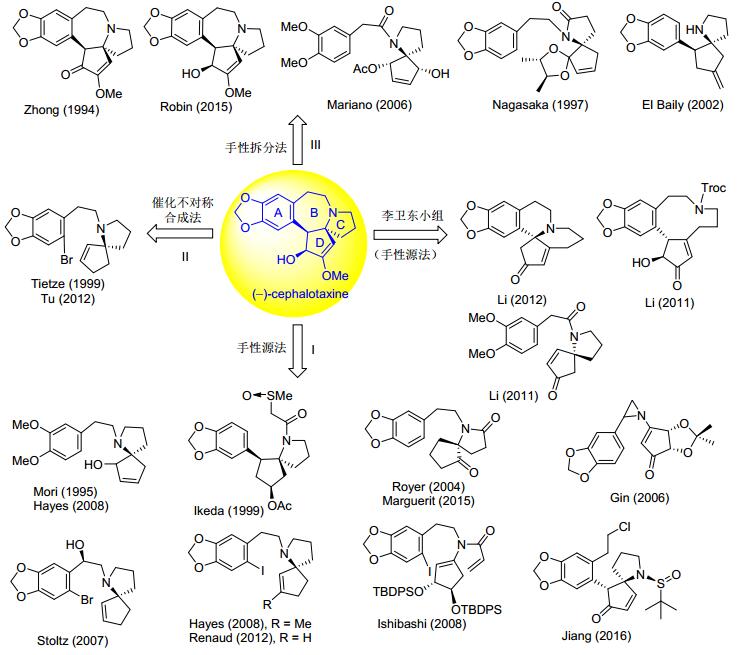
鉴于此, 本文综述了从1994年以来不对称全合成天然三尖杉碱的23条路线, 按照手性中间体和目标化合物的构建方式不同, 分为3种策略论述: (1) 手性源法, (2) 催化不对称合成法, (3) 手性拆分法.此外, 还总结了作者课题组在这方面的研究进展.下面, 将从这四个方面对天然三尖杉碱不对称全合成研究工作进行文献回顾(图 2).
1 手性源法
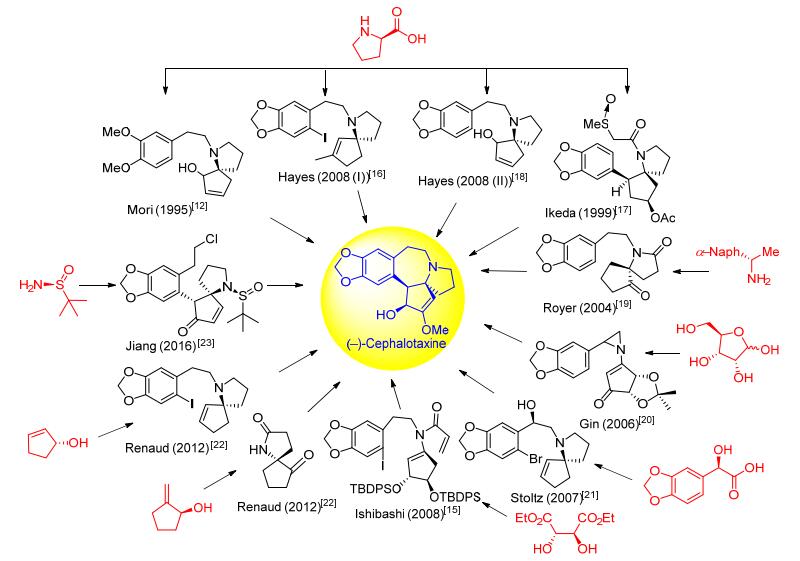
手性源法是广泛用于天然产物不对称合成的传统方法.如图 3所示, 应用手性源法, 从1995年至今, 有10个研究组基于8种不同的手性原料发展了11条策略, 实现天然三尖杉碱的不对称全合成. Mori[12]、Ikeda[17]和Hayes[16, 18]三个小组采用的D-(+)-脯氨酸、Royer小组[19]采用的手性α-萘乙胺26、Ishibashi小组[15]采用的D-(-)-酒石酸二乙酯, Gin小组[20]采用的D-核酸, Stoltz小组[21]采用的手性胡椒基羟基乙酸54, Renaud小组[22]采用的羟基环戊烯(S)-92和(-)-103, 姜标小组[23]采用的手性亚磺酰胺108.
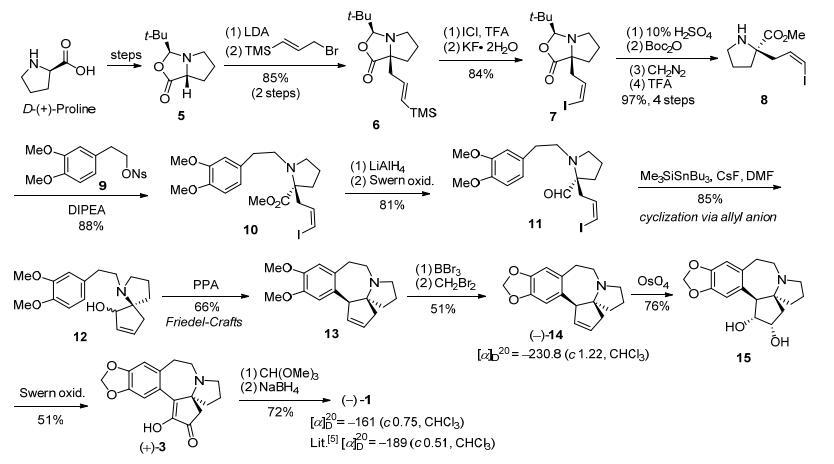
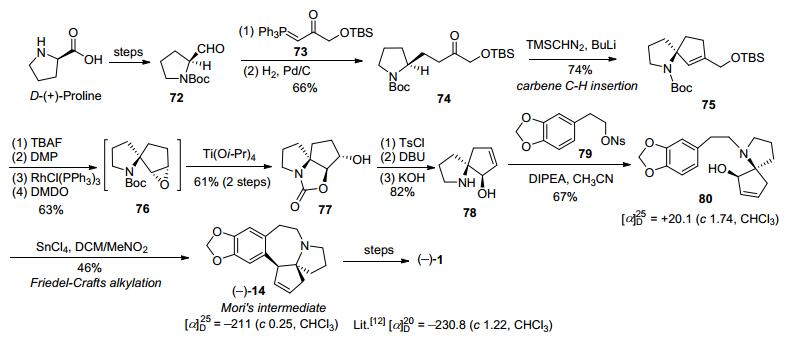
1995年, Mori等[12]以D-(+)-脯氨酸为手性起始原料, 采用Seebach[24]的方法经过几步转化得到化合物5, 该化合物在LDA (lithium diisopropylamide)作用下, 羰基α位烷基化得到烯丙基硅化合物6, 在ICl/TFA (trifluoroacetic acid)以及KF条件下, 化合物6可转化得到烯丙基碘代物7, 然后经10%硫酸水解、Boc2O保护、CH2N2甲基化、TFA脱Boc保护基等4步反应得胺中间体30.该化合物经两步官能团转化得到光学纯到化合物8.在DIPEA (N, N-Diisopropylethylamine)条件下吡咯烷化合物8与A环片段9经烷基化得到偶联化合物10.化合物10的酯基经氢化铝锂还原和Swern氧化得到烯丙基醛11.在Me3SiSnBu3/CsF/DMF (N, N-dimethyl-formamide)条件下11经烯丙基阴离子环化得到螺环骨架化合物12, 再在多聚磷酸作用下, 发生分子内Friedel-Crafts烷基化反应, 构建A/B/C/D环系三尖杉碱核心骨架化合物13, 在三溴化硼和二溴甲烷作用下二甲氧基转化为二氧亚甲基, 得到重要的光学纯三尖杉碱骨架化合物14, 然后经双键氧化、羟基氧化、烯醇甲醚化、羰基还原等4步简单转化, 制得光学纯左旋三尖杉碱.至此, 通过手性源法, 经19步反应以1.8%的总收率, 完成了天然三尖杉碱的首次不对称全合成(Scheme 3).
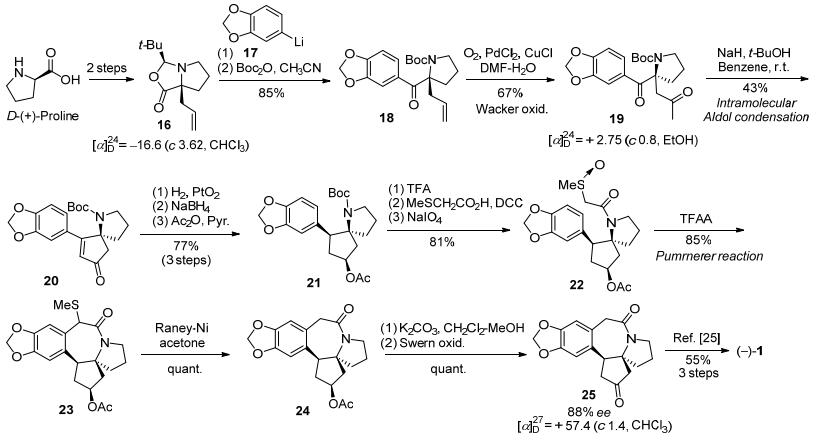
1999年, Ikeda等[17]同样以D-(+)-脯氨酸作为手性起始原料, 采用Seebach[24]的方法经两步转化得到氮杂烯丙基内酯化合物16, 再与胡椒基锂17反应及Boc保护得到化合物18, 经Wacker氧化及分子内Aldol缩合得到氮杂螺环戊烯酮20.之后按照他们小组1993年发展的消旋三尖杉碱合成路线[25], 经还原、酰化、N-保护基转换以及甲硫醚氧化等6步反应得到亚砜化合物22.在三氟醋酸作用下, 22经过Pummerer反应环化得到[7-5-5]环系骨架化合物23, 然后经Raney-Ni脱甲硫醚、K2CO3/DCM-MeOH条件脱乙酰基后经Swern氧化得到与消旋路线一致的三尖杉碱骨架环戊酮25 (88% ee).这样, 采用手性源法, 以19步反应及7%的总收率完成了天然三尖杉碱的形式不对称全合成(Scheme 4所示).
2004年, Royer等[19]利用他们小组早期发展的手性辅基诱导的非对映选择性semi-pinacol重排策略, 以(R)-(+)-1-(1-萘基)乙胺(26)作为起始原料, 经三步转化制得semi-pinacol重排前体29, 再在盐酸的作用下发生异构化/非对映选择性semi-pinacol重排得到关键的螺酰螺环化合物31, 然后与A环片段32发生N-烷基化得到偶联产物33.缩酮33在醋酸条件下水解得到Kuenhe[26]路线的类似中间体34.后续反应参考Kuenhe的路线, 经几步转化得到光学纯左旋三尖杉碱.这样, 采用手性源法, 经16步反应以9%的总收率实现了天然三尖杉碱的不对称形式全合成(Scheme 5).
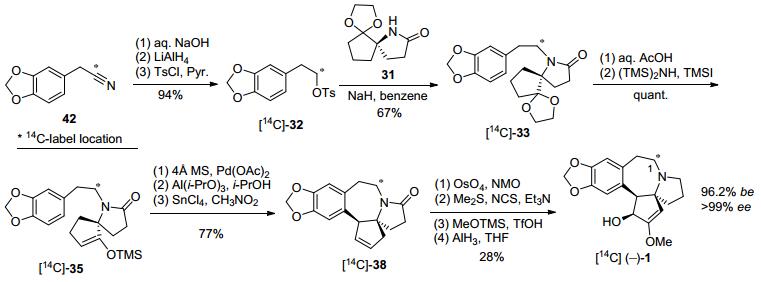
2015年, Marguerit等[27]利用K14CN作为同位素源对氮杂七元环C(1) 进行标记, 参考2004年Royer等[19]的光学纯三尖杉碱不对称全合成策略, 合成[14C]同位素标记的三尖杉碱, 再与侧链酯化, 以17步完成[14C]同位素标记的高三尖杉酯碱全合成, 为生物医药应用提供可参考的同位素标记方法(Scheme 6).
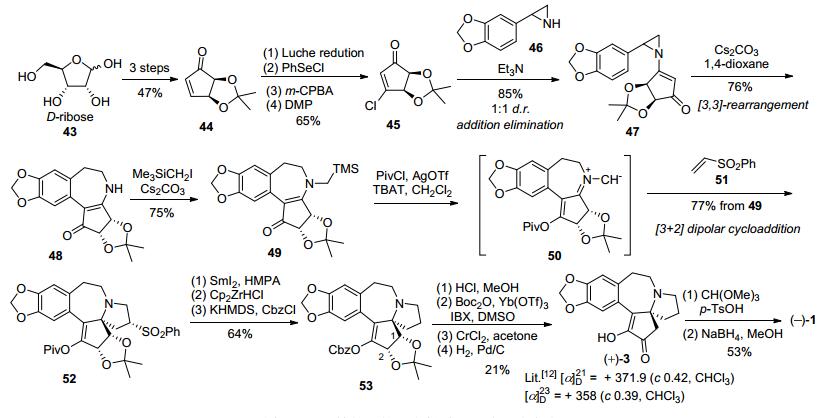
2006年, Gin等[20]以D-核酸作为手性源, 经过3步环化制得光学纯环戊烯酮44, 经Luche还原、PhSeCl氯代、m-CPBA氧化消除以及烯丙醇的Dess-Martin氧化4步转化制得β-氯代环戊烯酮45.在三乙胺作用下, 化合物45与简单易得的消旋吖啶化合物46经过加成消除反应, 以85%的收率和1:1的dr值得到非对映异构体混合的N-烯酮-2-芳基吖啶47, 柱层析分离纯化得到光学纯化合物.化合物47在碳酸铯碱性条件下经[3, 3]-重排环合得到苯并氮杂七元环二级胺48, 然后在Me3SiCH2I作用下经N-烷基化得到三级胺49.化合物49在特戊酰氯和三氟甲磺酸银作用下首先发生羰基氧的选择性烷基化, 然后在TBAT作用下脱去TMS得到亚甲胺叶立德50, 再与苯基乙烯基砜51发生[3+2]偶极环加成反应得到化合物52.在SmI2作用下, 52脱去苯磺酰基, 再经两步转化, 烯醇Piv酯转化为烯醇Cbz酯53.化合物53经过盐酸条件脱去缩酮保护基得到邻二醇, 再经Boc2O/Yb(OTf)·xH2O选择性保护C(1) 羟基后IBX/DMSO氧化C(2) 羟基的α-酰氧基酮, 然后在CrCl2作用下选择性脱去C(1) 位的OBoc得Cbz酯, 再经Pd-C/H2催化氢化得到光学纯去甲基三尖杉酮碱3, 最后通过烯醇甲醚化和硼氢化还原酮羰基得到天然三尖杉碱, 共19步总收率为1% (Scheme 7).
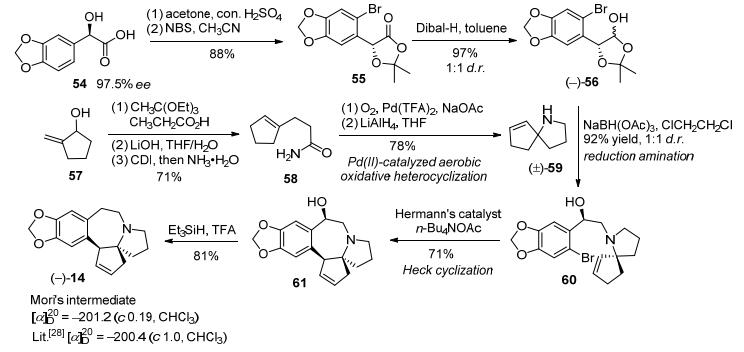
2007年, Stoltz等[21]采用汇聚式策略, 分别通过钯催化氧化氮杂环化和分子内Heck反应策略构筑氮杂螺环和七元环, 完成了三尖杉碱的不对称形式全合成.以化合物54作为手性起始原料, 邻二醇羟基缩酮保护和NBS溴代得到溴代缩酮酯55, 再在Dibal-H作用下还原得到手性缩酮56, 在低活性还原剂NaBH(OAc)3作用下, 与消旋的氮杂螺环59经还原胺化得到偶联化合物60.化合物60在Herrmann-Beller催化剂作用下经过分子内Heck环化反应构筑B环得到三尖杉碱骨架61, 然后在三乙基硅烷与三氟醋酸作用下脱除苄位羟基得到Mori路线中间体14[12], 共11步反应总收率为6% (Scheme 8).
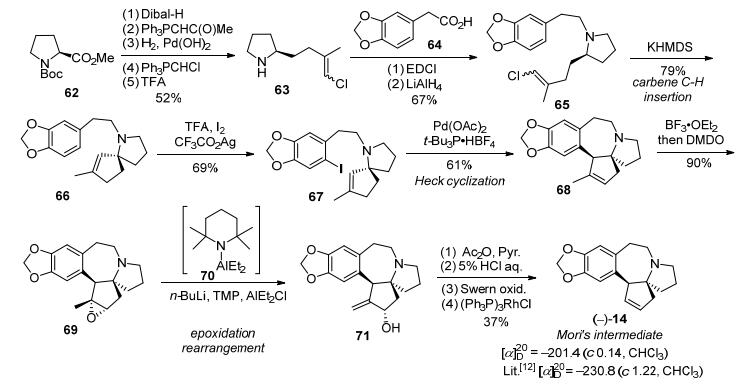
2008年, Hayes等[16]报道了天然三尖杉碱的形式全合成路线.以N-Boc保护的D-(+)-脯氨酸甲酯(62)作为起始原料, 经还原、烯烃化等反应得到手性氯乙烯吡咯烷63, 与3, 4-二氧亚甲基苯乙酸(64)经过氮烷基化得到化合物65.化合物65在KHMDS作用下通过不对称卡宾插入反应构建氮杂五元螺环化合物66.之后利用Heck反应构建B环得到三尖杉碱骨架中间体68, 化合物68在DMDO/BF3·OEt2作用下得到环氧化物69, 然后在原位生成DATMP (Diethylaluminum 2, 2, 6, 6-tetra-methylpiperidine)作用下经环氧重排得到烯丙醇71, 在醋酸酐作用下乙酰化二级醇, 在5% HCl作用下双键转化伯醇, 然后经Swern氧化为醛以及Wilkinson催化剂(Ph3P)3RhCl作用下脱羰基, 得到光学纯的Mori[12]路线中间体14, 共16步反应总收率为1.3% (Scheme 9).
为了缩短合成步骤, Hayes等[18]发展了第二条合成路线.以D-(+)-脯氨酸为手性起始原料, 先利用卡宾插入反应形成氮杂五元螺环化合物75, 经几步转化得到二级醇78.在DIPEA作用下, 化合物78与3, 4-二氧亚甲基苯乙醇磺酸酯(79)偶联得到化合物80.化合物80在SnCl2作用下经过Friedel-Crafts反应环化构建三尖杉碱骨架中B环, 得到Mori[12]路线中间体14, 共13步反应总收率为4.7% (Scheme 10).
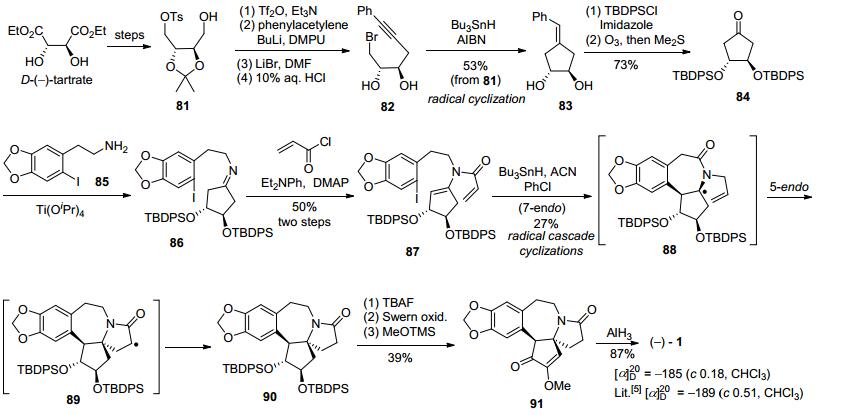
2008年, Ishibashi等[15]利用该课题组早期发展的自由基串联环化反应策略完成了天然三尖杉碱形式全合成.以D-(-)-酒石酸二乙酯作为手性源, 经几步转化得缩酮81, 经过七步转化得到手性环戊酮衍生物84, 与2-碘代胡椒乙胺85生成亚胺86, 和丙烯酰氯经酰胺化得到烯酰胺环化前体87.该前体在CAN (1, 1'-azobiscyclo-hexanecarbonitrile)和三丁基锡化氢的氯苯溶液中经过自由基串联环化得到三尖杉碱骨架化合物90, 再经脱去硅保护基、羟基氧化和烯醇甲醚化得到91, 最后在AlH3条件下还原得到天然三尖杉碱, 共14步反应总收率为1.8% (Scheme 11).
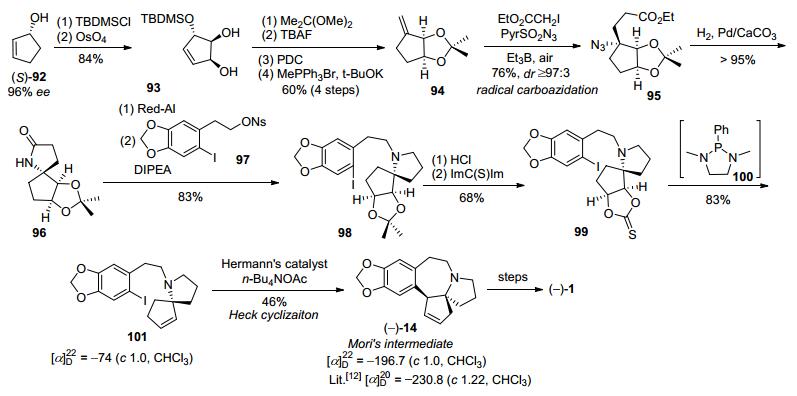
2012年, Renaud等[22]以烯烃的立体选择性叠氮化反应作为关键反应, 通过两条路线完成天然三尖杉碱不对称形式全合成.第一条路线是以(S)-2-羟基环戊烯(92)作为起始原料, 经过几步转化得到的氮杂螺环96, 再与碘代胡椒乙醇磺酸酯(97)经烷基化得到98, 然后通过官能团转化得到硫缩酮99, 再在特殊膦催化剂100作用下脱硫缩酮得到螺酰胺101, 最后通过分子内Heck环化得到了Mori路线[12]的中间体14, 共18步反应总收率为2.2% (Scheme 12).
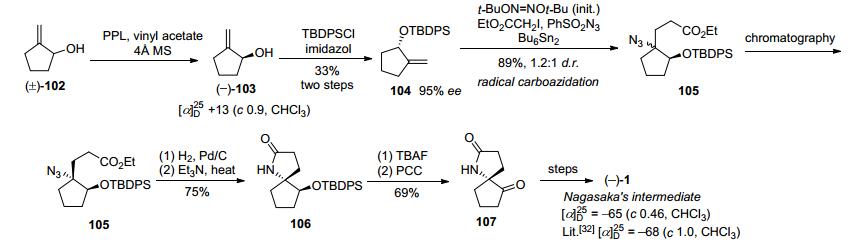
Renaud小组[22]第二条路线, 以(1S)-2-亚甲基环戊烯醇[(-)-103]作为手性起始原料, 经自由基次甲基叠氮反应等几步转化得到叠氮甲酸乙酯化合物105, 再通过手性底物控制的内酰胺化得到螺酰胺106, 最后TBAF脱硅再氧化得到光学纯的Nagasaka路线[32]中间体107, 共7步反应总收率为8.3% (Scheme 13).
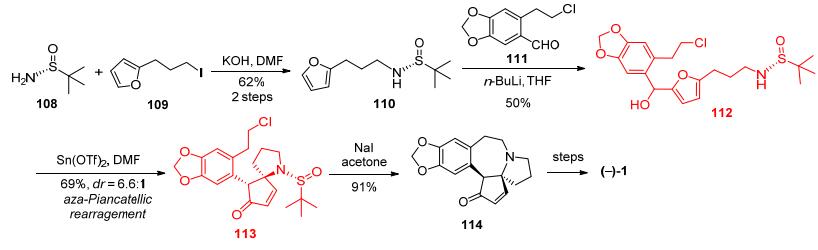
2016年, 姜标等[23]以手性亚磺酰胺108为手性源, 与简单易得的2-(3-碘代丙基)呋喃(109), 经过氮烷基化得到手性化合物110, 然后与2-(2-氯乙基)胡椒醛111反应得到手性二级醇化合物112, 再在Sn(OTf)2作用下经aza-Piancatellic重排得到手性氮杂螺环化合物113, 然后在碘化钠作用下脱亚磺酰基环合形成三尖杉碱核心骨架114, 共6步反应总收率为11.7%, 后续经过几步简单转化即可得到天然三尖杉碱(Scheme 14).
2 催化不对称合成法
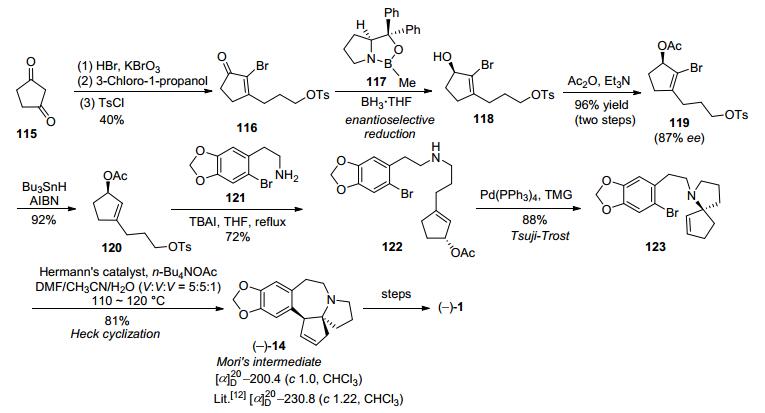
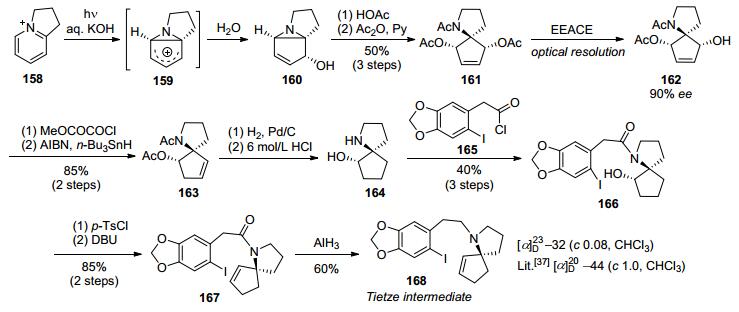
1999年, Tietze等[28]以1, 3-环戊二酮115作为起始原料, 经过溴代、烷基化、格氏反应、羟基保护等反应制得α-溴代环戊烯酮衍生物116.化合物116在CBS还原剂117作用下经不对称还原得到光学纯环戊醇衍生物118.化合物118经乙酰基保护后再在锡试剂作用下脱除溴得到化合物120.化合物120与2-溴代胡椒基乙胺(121)经偶联得到二级胺122, 然后在Pd(PPh3)4催化剂作用下经过Tsuji-Trost反应得到光学纯氮杂螺环化合物123, 最后在Herrmann-Beller催化剂作用下发生分子内Heck环化反应得到光学纯Mori路线[12]中间体14, 完成了天然三尖杉碱的形式合成, 共13步反应总收率为5% (Scheme 15).
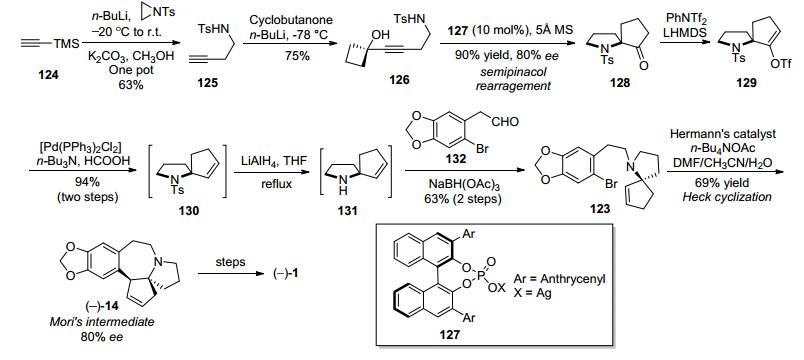
2012年, 涂永强等[29]以串联的分子内氢胺化/semi-pinacol重排构建氮杂五元螺环作为关键反应, 实现了天然三尖杉碱不对称形式全合成.以TMS乙炔124作为起始原料, 经两步转化得到炔基环丁醇126, 然后在手性磷酸盐催化剂127作用下, 经过立体选择性的串联分子内氢胺化/semi-pinacol重排反应构建氮杂五元螺环, 得到氮杂螺环化合物128.再经羰基烯醇活化并与2-溴代胡椒基乙醛132发生还原胺化, 得到化合物123.化合物123在Herrmann-Beller催化剂作用下经分子内Heck环化反应得到光学纯Mori路线[12]中间体14, 但ee值只有80%, 通过普通硅胶柱层析分离所得14的ee值达到99%, 作者认为是发生了手性富集, 使光学纯度大幅度提高.共12步反应总收率4.9% (Scheme 16).
3 手性拆分法
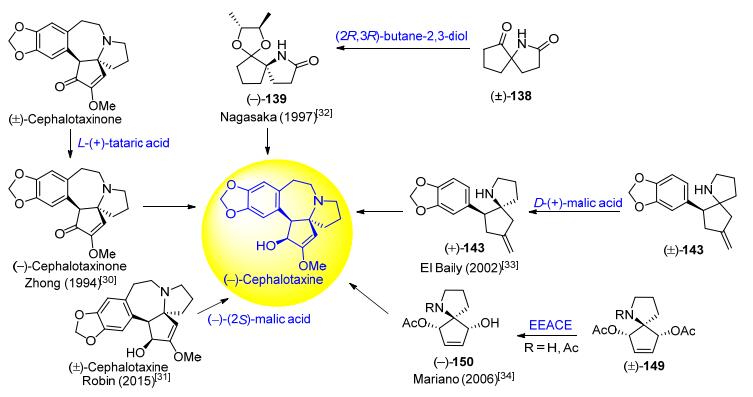
采用化学拆分试剂或生物酶对消旋的目标产物进行直接拆分, 或对消旋的关键中间体进行拆分后通过化学转化得到光学纯目标产物的手性拆分法, 是制备光学纯天然产物的传统方法.在合成天然三尖杉碱的策略中, 有5位化学家采用了手性拆分法.钟三保[30]和Robin等[31]分别采用化学拆分法对目标天然产物前体及目标天然产物进行拆分得到光学纯左旋三尖杉碱. Nagasaka[32]和El Baily等[33]采用光学纯化学拆分试剂对关键螺环中间体进行手性拆分得到光学纯中间体, 然后通过文献方法合成到光学纯左旋三尖杉碱. Mariano等[34]采用生物酶法对螺环中间体进行了手性拆分得到光学纯中间体(图 4).
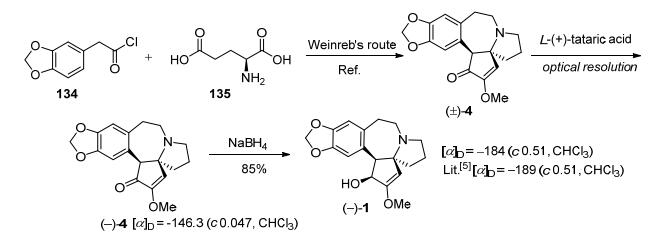
1994年, 钟三保等[30]采用Weinreb的策略[35], 以胡椒乙酰氯(134)和L-谷氨酸(135)为起始原料, 经14步反应, 以9%的总收率得到消旋三尖杉酮碱[(±)-4].再用L-(+)酒石酸将外消旋三尖杉酮碱[(±)-4]拆分为(+)-三尖杉酮碱[(+)-4]和(-)-三尖杉酮碱[(-)-4].最后, (-)-三尖杉酮碱[(-)-4]经过NaBH4还原得到光学纯左旋三尖杉碱(Scheme 17).
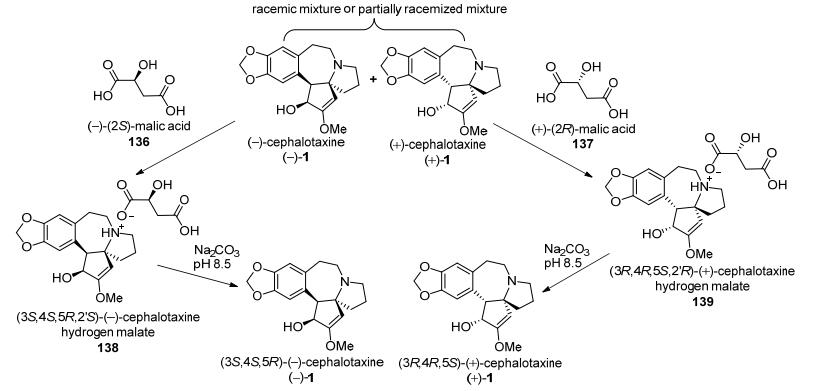
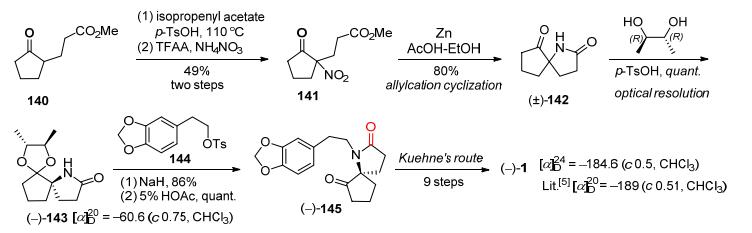
2015年, Robin等[31]报道了采用手性酸拆分消旋或部分消化的三尖杉碱制得光学纯三尖杉碱的专利.以苹果酸(Malic acid)为手性拆分试剂, 消旋或部分消旋化的三尖杉碱分别与(−)-(2S)-苹果酸(136)和(+)-(2R)-苹果酸(137)成盐, 通过结晶的方法分别得到(3S, 4S, 5R, 2S')-(-)-三尖杉碱苹果酸盐(138)和(3R, 4R, 5S, 2'R)-(+)-三尖杉碱苹果酸盐(139), 再分别用碳酸氢钠溶液调节pH值为8.5, 得到(-)-三尖杉碱和(+)-三尖杉碱(Scheme 18). 1997年, Nagasaka等[32]用锌粉/醋酸体系还原硝基生成γ-内酰胺作为关键反应, 合成到消旋氮杂螺环中间体(±)-142, 其结构中的羰基与光学纯(R, R)-(-)-2, 3-丁二醇进行缩酮化得到一对非对映异构体143, 通过常规分离得到非对映异构体(-)-143, 再与胡椒乙醇对甲苯磺酸酯(144)发生烷基化后在酸性条件水解制得光学纯的Kuehne路线[26]关键中间体(-)-145, 共6步反应总收率为17% (Scheme 19).
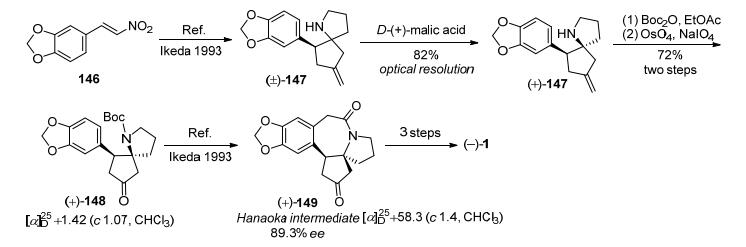
2002年, El Baily等[33]以3, 4-亚甲二氧-β-硝基苯乙烯(146)为起始原料, 通过Ikeda路线[25]方法制得消旋的氮杂螺环化合物(±)-147, 再用D-(+)-马来酸进行手性拆分, 得到光学纯的(+)-147, 该化合物经Boc2O保护再经OsO4/NaIO4条件下氧化断裂C=C键, 得到Ikeda路线[25]中间体氮杂螺环化合物(+)-148 (89.3% ee), 再用Ikeda的方法得到了Hanaoka路线[36]中间体(+)-149, 共14步反应总收率为11%, 后续经过几步转化得到天然三尖杉碱(Scheme 20).
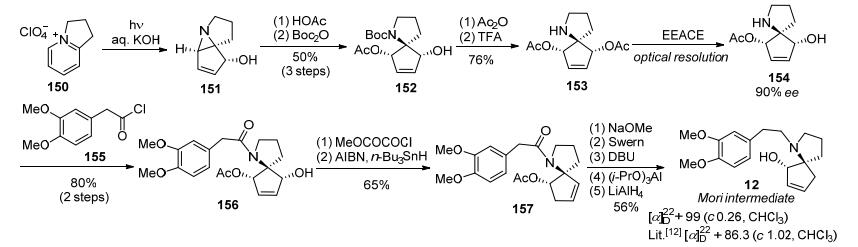
2006年, Mariano等[34]通过对两种不同的螺环中间体酶拆分实现了(-)-三尖杉碱不对称形式全合成.一是对消旋的双乙酰化螺吡咯烷(±)-153采用脂肪酶EEACE (electric eel acetyl cholinesterase)进行动力学拆分, 得到光学纯的单乙酰化螺吡咯烷154 (90% ee).手性氮杂螺环化合物154与A环系片段155进行N-烷基化构建含有A-B/C螺环化合物156, 再经锡试剂脱羟基及后续5步转化得到Mori路线[12]光学纯中间体12, 共14步反应总收率为11%的总收率(Scheme 21).
第二种是消旋的三乙酰化螺环吡咯烷161经EEACE酶动力学拆分, 得到光学纯双乙酰化螺吡咯烷162 (90% ee).光学纯螺吡咯烷162先在AIBN/ n-Bu3SnH作用下脱羟基和还原水解后得到羟基螺吡咯烷164, 再进一步与A环片段165发生N-烷基化得到A-B/C螺环的化合物166, 最后用AlH3还原羰基得到光学纯的Tietze路线[28]中间体168, 光学纯度与文献值一致[37], 共12步反应总收率为9% (Scheme 22).
4 李卫东小组的不对称合成研究工作
2003年, 李卫东小组的王永强等[38]运用还原重排的仿生合成策略在国内首次实现了外消旋三尖杉碱的全合成, 之后, 他们小组一直致力于三尖杉碱全合成的新策略、新方法及不对称合成方法的研究[39].国内其他小组也相继开展了三尖杉碱的全合成研究, 包括涂永强[40]、姜标[41]、黄培强[42]、洪然[43]、张志伟[44]、杨华[45]及樊春安[46]小组.
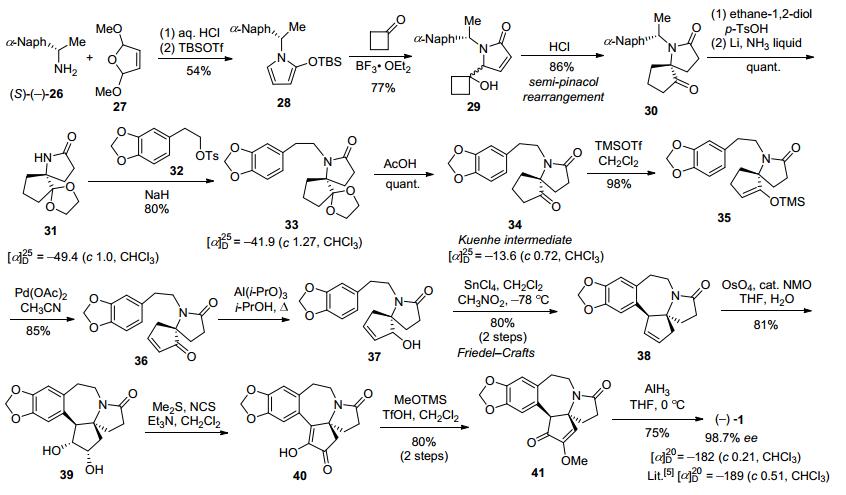
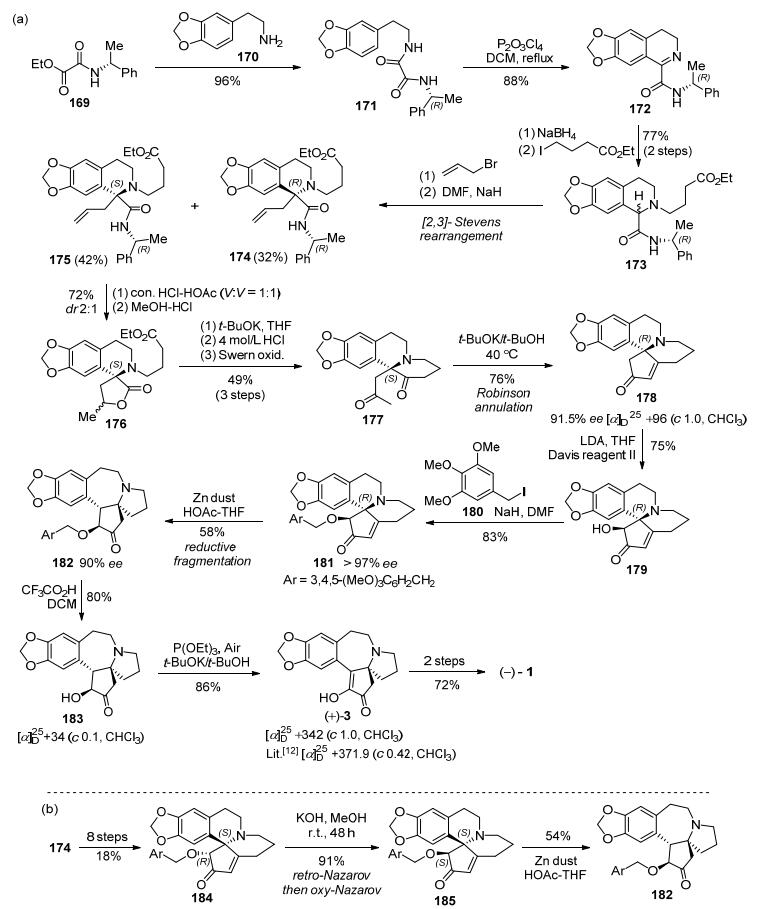
2012年, 李卫东小组的李盛华等[47]以手性α-苯乙胺衍生物169作为起始原料, 经氮酰胺化、Bischler-Napieralski环化得到二氢异喹啉衍生物172, 再在硼氢化钠条件条件下还原亚胺后发生N原子烷基化得到四氢异喹啉衍生物173.化合物173经[2, 3]-Stevens重排得到(R, R)构型的酰胺酯174和(R, S)构型的酰胺酯175.将酰胺酯175在V(HOAc):V(conc. HCl)=1:1体系中回流过夜, 用MeOH-HCl处理后以72%的收率得到dr值为1:2的非对映异构体混合物176.内酯176在叔丁醇钾作用下发生Deckmann缩合、4 mol/L盐酸溶液下加热脱羧、Swern氧化即可得到二酮177, 经过Robinson环化即可得到光学活性的重排前体苯并喹嗪178.在Davis Reagent Ⅱ作用下, 苯并喹嗪178结构中环戊烯酮经过Davis氧化引入羟基, 经富电子的3, 4, 5-三甲氧基苄基保护后所得的181在锌粉/醋酸条件下发生Clemmensen-Clemo-Prelog-Leonard还原重排得到光学纯的三尖杉碱骨架182, 但光学纯度有所下降, 发生了部分消旋化.将得到的182在三氟乙酸下水解除去三甲氧基苯基得到羟基酮183, 然后通过空气氧化得到光学纯的去甲基三尖杉酮碱3.参照Mori的方法通过烯醇甲醚化、硼氢化还原即可得到天然三尖杉碱, 共19步反应总收率为1.8% (Scheme 23a).
另外, 如Scheme 23b所示, (R, R)构型的174通过相同的转化得到(S, R)-构型烯酮184, 在KOH强碱条件下得到(S, S)-烯酮185, 推测其经历了retro-Nazarov异构化机理.
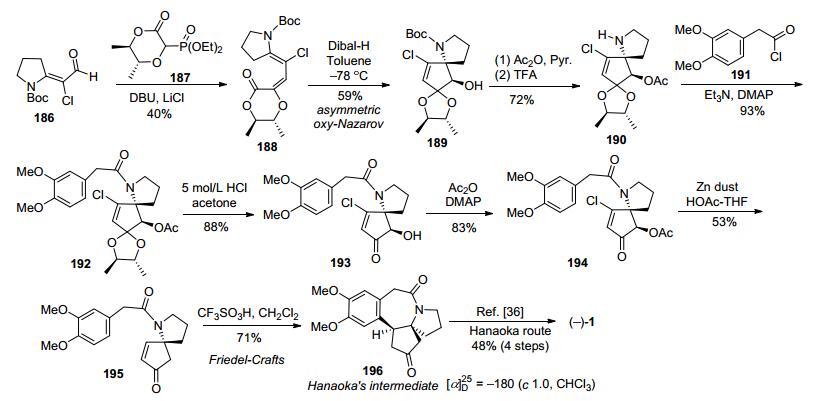
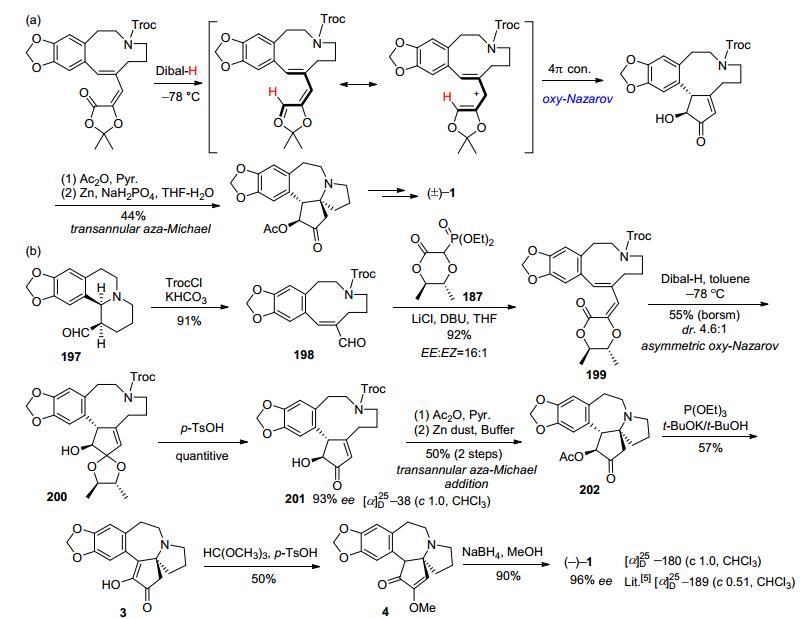
2011年, 李卫东小组的雍胜利[48]以吡咯烷酮衍生物186作为起始原料, 与光学纯的dixoanone磷酸酯187经过立体选择性Horner-Wadsworth-Emmons (HWE)反应制得光学纯(E, E)-构型dioxanone双烯酯188, 再在DIBAL-H作用下, 发生不对称还原oxy-Nazarov电环化反应, 得到光学纯羟基环戊缩酮189.然后先保护羟基再脱除N-Boc得到螺吡咯烷190, 与3, 4-二甲氧基苯乙酰氯(191)发生N-酰基化得到酰胺192.螺环酰胺192经去保护和再次乙酰化保护羟基得到氯代乙酰氧基环戊烯酮194, 在锌粉/醋酸条件下脱氯和乙酰氧基得到环戊烯酮195, 最后在三氟甲磺酸作用下经Friedel-Crafts环化得到Hanaoka路线[36]光学纯中间体196.这样, 通过手性辅基诱导的不对称合成法, 经8步反应以4.3%的总收率, 合成到Hanaoka路线关键中间体196, 实现了天然三尖杉碱的不对称形式全合成(Scheme 24).
2011年, 李卫东小组庄程翰等[49]采用该小组[50]发展的消旋三尖杉碱的跨环串联环化全合成新策略(Scheme 25a), 通过手性辅基诱导的不对称oxy-Nazarov反应作为关键步骤, 实现了天然三尖杉碱的不对称全合成.以简单易得的cis环化醛197作为起始原料, 在TrocCl作用下经过Hofmann降解开环得到E-式烯醛198, 再与六元环系dioxanone手性磷酸酯187经HWE反应, 引入dioxanone手性辅基得到光学纯的(E, E)-构型双烯酯199, 再在DIBAL-H还原作用下经不对称oxy-Nazarov电环化反应, 以4.6:1的dr值得到环化缩酮200, 然后在甲苯磺酸条件下水解, 定量地得到光学纯的trans-羟基环戊烯酮201, 同时定量地回收得到光学纯的2, 3-丁二醇, 可以循环用于制备手性磷酸酯187的制备.化合物201再经过羟基乙酰化保护、跨环环化反应、空气氧化脱氢脱乙酰基以及原甲酸三甲酯烯醇甲醚化和硼氢化还原等5步转化得到天然三尖杉碱, ee值为96%, 共9步反应总收率为4.6% (Scheme 25).
5 总结与展望
迄今为止, 已经有很多种方法和策略应用于制备天然三尖杉碱(如表 1所示), 总共有18个小组发展了23种方法.其中以手性源法占主流, 有10个小组发展了11条策略以光学纯脯氨酸等作为起始原料, 经过多种方法构建三尖杉碱骨架, 实现天然三尖杉碱或关键中间体的合成, 每一条路线都有其科学价值, 但是由于路线冗长以及采用贵金属试剂, 导致很难实现高效简洁合成.然而, 只有两个小组采用催化不对称合成法实现天然三尖杉碱的形式合成, 仅制备得到Mori路线关键中间体, 就需要12或13步, 总收率仅有约5%, 很难放大量合成、路线长、对映立体选择性仅有87%和80%, 需要进一步优化合成路线.此外, 还有5个小组通过手性拆分法制备得到天然三尖杉碱, 其中钟三保及Robin对消旋的三尖杉酮碱和三尖杉碱进行手性拆分, 其余三个小组对关键的螺环中间体进行化学拆分或酶拆分, 制得光学纯关键中间体, 实现天然三尖杉碱的形式合成, 但该方法拆分效率最高仅有50%, 导致原料制备困难且大量浪费, 同时昂贵拆分试剂的使用都使得合成过程并不经济.李卫东小组发展了手性诱导的不对称合成法以及手性源法合成了天然三尖杉碱, 显著提高了合成的效率.
研究组 年份 手性源/手性拆分试剂/手性催化剂 步骤数 总收率/% 参考文献 分类 Mori小组 1995 D-(+)-proline 19 1.8 [12] 手性源法 Ikeda小组 1999 D-(+)-proline 19 7.0 [17] Royer小组 2004 (S)-1-(1-naphthyl)ethylamine 16 9.0 [19] Marguerit小组 2015 (S)-1-(1-naphthyl)ethylamine 16 10.0 [27] Gin小组 2006 (S, S)-4, 5-dihydroxycyclopent-2-enone
isopropylidene acetal19 1.0 [20] Stoltz小组 2007 (R)-3, 4-(methylenedioxy)mandelic acid 11 6.0 [21] Hayes小组 2008 D-(+)-proline 16 1.3 [16] 2008 D-(+)-proline 13 4.7 [18] Ishibashi小组 2008 Diethyl D-(-)-tartrate 14 1.8 [15] Renaud小组 2012 (1S)-2-methylenecyclopentanol derivative 18 2.2 [22] (S)-2-methylenecyclopentan-1-ol 7 8.3 Jiang小组 2016 (S)-(-)-t-butylsulfinamide 6 11.7 [23] Tietze小组 1999 CBS-catalyst 13 5.0 [28] 催化不对称合成法 Tu小组 2012 chiral phosphoric acid 12 4.9 [29] Zhong小组 1994 L-(+)-tartaric acid — — [30] 手性拆分法 Robin小组 2016 chiral organic acid — — [31] Nagasaka小组 1997 (2R, 3R)-(−)-butanediol 15 4 [32] El Bialy小组 2002 L-(+)-malic acid 17 5 [33] Mariano小组 2006 EEACE 14 3.5 [34] EEACE 12 3.8 Li小组 2012 α-phenylethan-2-amine 19 1.8 [47] 李卫东小组研究工作 2011 (2R, 3R)-(-)-butanediol 9 4.3 [48] 2010 (2R, 3R)-(-)-butanediol 9 4.6 [49] 自从1963年三尖杉碱被发现以来, 因其独特的环系结构及其酯碱衍生物显著的抗癌活性, 五十多年来一直吸引着化学家探索其新合成策略. 2012年, 在高三尖杉酯碱被FDA批准上市用于治疗慢性粒白血病药物以来, 作为该药物母核的三尖杉碱的合成研究, 出现了很多新策略.然而, 由于三尖杉碱结构母核容易消旋化, 导致天然三尖杉碱不对称全合成发展缓慢, 且缺乏高效简洁策略.同时, 医药的快速发展增大了对光学纯左旋三尖杉碱的需求, 亟待开发新合成策略及高效高选择性的合成方法, 以解决天然三尖杉碱来源问题.
-
-
[1]
Wall, M. E.; Eddy, C. R.; Willaman, J. J.; Correll, D. S.; Schubert, B. G.; Gentry, H. S. J. Am. Pharm. Assoc., Sci. Ed. 1954, 43, 503. doi: 10.1002/jps.3030430819
-
[2]
Paudler, W. W.; Kerley, G. I.; McKay, J. J. Org. Chem. 1963, 28, 2194. doi: 10.1021/jo01044a010
-
[3]
Abraham, D. J.; Rosenstein, R. D.; McGandy, E. L. Tetrahedron Lett. 1969, 10, 4085. doi: 10.1016/S0040-4039(01)88621-4
-
[4]
Arora, S. K.; Bates, R. B.; Grady, R. A.; Powell, R. G. J. Org. Chem. 1974, 39, 1269. doi: 10.1021/jo00923a024
-
[5]
Powell, R. G.; Weisleder, D.; Smith, C. R. Jr. J. Pharm. Sci. 1972, 61, 1227. doi: 10.1002/jps.2600610812
-
[6]
For cephalotaxus esters as anticancer and antileukemic agents from the 1970s in China, see: (a) Cephalotaxus Research Coordinating Group Chin. Med. J. (Engl. ) 1976, 2, 263-272.
(b) Leukemia Research Group of the Chinese Liberation Army 187th Hospital Chin. Med. J. 1978, 58, 163(in Chinese).
(中国人民解放军第一八七医院白血病研究小组, 中华医学杂志, 1978, 58, 163. )
(c) Pharmacopoeia Committee of Ministry of Health Chinese Pharmacopoeia, 1990 Edition Ⅱ, People's Health Pub House, Beijing, 1990, pp. 588~590(in Chinese).
(中华人民共和国卫生部药典委员会, 中华人民共和国药典1990年版二部, 人民卫生出版社, 北京, 1990, pp. 588~590. ) -
[7]
For Homoharringtonine/Omacetaxine Mepesuccinate (FDA), see:(a) Kantarjian, H. M.; O'Brien, S.; Cortes, J. Clin. Lymphoma Myeloma Leuk. 2013, 13, 530.
(b) Heiblig, M.; Sobh, M.; Nicolini, F. E. Leuk Res. 2014, 38, 1145. -
[8]
For diastereoselective synthesis of cephalotaxus esters via asymmetric Mukaiyama Aldol reaction, see:Ma, G. -Z.; Li, P. -F.; Liu, L.; Li, W. -D. Z.; Chen, L. Org. Lett. 2017, 19, 2250.
-
[9]
For semisynthesis of homoharringtonine from cephalotaxine, see:(a) Wang, Y.-K.; Li, Y.-L.; Pan, S.-F.; Li S.-B.; Huang, W.-K. Sci. Bull. 1980, 25, 576(in Chinese).
(王永铿, 李裕林, 潘鑫复, 李绍白, 黄文魁, 科学通报, 1980, 25, 576.)
(b) Wang, Y.-K.; Li, Y.-L.; Pan, S.-F.; Li S.-B.; Huang, W.-K. J. Lanzhou Univ., Nat. Sci. 1980, 71(in Chinese).
(王永铿, 李裕林, 潘鑫复, 李绍白, 黄文魁, 兰州大学学报(自然科学版), 1980, 71.)
(c) Zhao, Z.-Z.; Xi, Y.-G.; Zhao, H.-F.; Hou, J.-Y.; Zhang J.-Y.; Wang, Z.-H. Acta Pharm. Sin. 1980, 15, 46(in Chinese).
(赵知中, 席与珪, 赵翰飞, 侯建英, 张建友, 王子厚, 药学学报, 1980, 15, 46.)
(d) Hiranuma, S.; Hudlicky, T. Tetrahedron Lett. 1982, 23, 3431.
(e) Hiranuma, S.; Shibata, M.; Hudlicky, T. J. Org. Chem. 1983, 48, 5321.
(f) Cheng, J. -C.; Zhang, J. -H.; Zhang, Q. -B.; Yang J.; Huang, L. Acta Pharm. Sin. 1984, 19, 178(in Chinese).
(程家宠, 张建华, 张千兵, 杨晶, 黄量, 药学学报, 1984, 19, 178.)
(g) Wang, Y.-K.; Li, Y.-L.; Pan, S.-F.; Li S.-B.; Huang, W.-K. Acta Chim. Sinica 1985, 43, 161(in Chinese).
(王永铿, 李裕林, 潘鑫复, 李绍白, 黄文魁, 化学学报, 1985, 43, 161.)
(h) Robin, J. P.; Dhal, R.; Dujardin, G.; Girodier, L.; Mevellec, L.; Poutot, S. Tetrahedron Lett. 1999, 40, 2931. -
[10]
黄文魁, 李裕林, 潘鑫复, 中国科学, 1979, 12, 1171.For the optical instability of cephalotaxine, see:Huang, W.-K.; Li, Y.-L.; Pan, S.-F. Sci. China, Ser. A 1979, 12, 1171(in Chinese).
-
[11]
For Liang's racemization mechanism hypothesis of cephalotaxine, see:(a) Liang, X.-T. In Chemistry of Natural Products-The Proceedings of Sino-American Symposium on Chemistry of Natural Products, Ed.:Wang, Y., Science Press, Beijing, 1982, pp. 19~28.
(b) Liang, X.-T. Chin. J. Org. Chem. 1981, 1, 243(in Chinese).
(梁晓天, 有机化学, 1981, 1, 243.) -
[12]
Isono, N.; Mori, M. J. Org. Chem. 1995, 60, 115. doi: 10.1021/jo00106a023
-
[13]
Abdelkafi, H.; Nay, B. Nat. Prod. Rep. 2012, 29, 845. doi: 10.1039/c2np20037f
-
[14]
For reviews of (-)-cephalotaxine, see:(a) Niu, D.; Yan, W.; Sharif, E.; Rajaratnam, M.; O'Doherty, G. A. Chemtracts:Org. Chem. 2009, 22, 89.
(b) Zeng, B.-B.; Ren, J.-Y. Medicinal Natural Products-Total Synthetic Approaches, East China University of Science and Technology Press, Shanghai, 2016, pp. 88~118(in Chinese).
(曾步兵, 任江萌, 药用天然产物全合成:合成路线精选, 华东理工大学出版社, 上海, 2016, pp. 88~118.) -
[15]
Taniguchi, T.; Ishibashi, H. Org. Lett. 2008, 10, 4129. doi: 10.1021/ol801747m
-
[16]
Esmieu, W. R.; Worden, S. M.; Catterick, D.; Wilson, C.; Hayes, C. J. Org. Lett. 2008, 10, 3045. doi: 10.1021/ol8010166
-
[17]
Ikeda, M.; El Bialy, S. A. A.; Hirose, K.; Kotake, M.; Sato, T.; Bayomi, S. M. M.; Shehata, I. A.; Abdelal, A. M.; Gad, L. M.; Yakura, T. Chem. Pharm. Bull. 1999, 47, 983. doi: 10.1248/cpb.47.983
-
[18]
Hameed, A.; Blake, A. J.; Hayes, C. J. J. Org. Chem. 2008, 73, 8045. doi: 10.1021/jo801540q
-
[19]
(a) Planas, L.; Perard-Viret, J.; Royer, J. J. Org. Chem. 2004, 69, 3087.
(b) Baussanne, I.; Dudot, B.; Pérard-Viret, J.; Planas, L.; Royer, J. Arkivoc 2006, 7, 57.
(c) Berhal, F.; Perard-Viret, J.; Royer, J. Tetrahedron:Asymmetry 2010, 21, 325. -
[20]
Eckelbarger, J. D.; Wilmot, J. T.; Gin, D. Y. J. Am. Chem. Soc. 2006, 128, 10370. doi: 10.1021/ja063304f
-
[21]
Liu, Q.; Ferreira, E. M.; Stoltz, B. M. J. Org. Chem. 2007, 72, 7352. doi: 10.1021/jo0710883
-
[22]
Gonçalves-Martin, M. G.; Zigmantas, S.; Renaud, P. Helv. Chim. Acta 2012, 95, 2502. doi: 10.1002/hlca.201200486
-
[23]
姜标, 第六届岭南有机化学论坛, 深圳, 2016, p. 10.Jiang, B. In The 6th Lingnan Organic Chemistry Forum, Shenzhen, 2016, p. 10(in Chinese).
-
[24]
Seebach, D.; Boes, M.; Naef, R.; Schweizer, W. B. J. Am. Chem. Soc. 1983, 105, 5390. doi: 10.1021/ja00354a034
-
[25]
Ikeda, M.; Okano, M.; Kosaka, K.; Kido, M.; Ishibashi, H. Chem. Pharm. Bull. 1993, 41, 276. doi: 10.1248/cpb.41.276
-
[26]
Kuehne, M. E.; Bornmann, W. G.; Parsons, W. H.; Spitzer, T. D.; Blount, J. F.; Zubieta, J. J. Org. Chem. 1988, 53, 3439. doi: 10.1021/jo00250a008
-
[27]
Marguerit, M.; Little, G.; Wang, Y.; He, L.; Allwein, S.; Reif, J.; Rossi, J.; Roemmele, R.; Bakale, R. Eur. J. Org. Chem. 2015, 2015, 8003. doi: 10.1002/ejoc.v2015.36
-
[28]
Tietze, L. F.; Schirok, H. J. Am. Chem. Soc. 1999, 121, 10264. doi: 10.1021/ja991650+
-
[29]
Zhang, Q.-W.; Xiang, K.; Tu, Y.-Q.; Zhang, S.-Y.; Zhang, X.-M.; Zhao, Y.-M.; Zhang, T.-C.; Chem. Asian J. 2012, 7, 894. doi: 10.1002/asia.v7.5
-
[30]
钟三保, 刘维勤, 凌仰之, 李仁利, 涂光忠, 马立斌, 冯少良, 中国药物化学杂志, 1994, 4, 84.Zhong, S.-B.; Liu, W.-Q.; Ling, Y.-Z.; Li, R.-L.; Tu, G.-Z.; Ma, L.-B.; Feng, S.-L. Chin. J. Med. Chem. 1994, 4, 84(in Chinese).
-
[31]
Robin, J.-P.; Blanchard, J.; Radosevic, N.; Roisnel, T.; Bataille, T. WO 2015162217, 2015[Chem. Abstr. 2015, 163, 656468].
-
[32]
Nagasaka, T.; Sato, H.; Saeki, S. Tetrahedron:Asymmetry 1997, 8, 191. doi: 10.1016/S0957-4166(96)00509-5
-
[33]
El Bialy, S. A. A.; Ismail, M. A.; Gad, L. M.; Abdelal, A. M. M. Med. Chem. Res. 2002, 11, 293. http://cat.inist.fr/?aModele=afficheN&cpsidt=14524047
-
[34]
Zhao, Z.; Mariano, P. S. Tetrahedron 2006, 62, 7266. doi: 10.1016/j.tet.2006.05.045
-
[35]
Auerbach, J.; Weinreb, S. M. J. Am. Chem. Soc. 1972, 94, 7172. doi: 10.1021/ja00775a062
-
[36]
Yasuda, S.; Yamada, T.; Hanaoka, M. Tetrahedron Lett. 1986, 27, 2023. doi: 10.1016/S0040-4039(00)84438-X
-
[37]
Suga, S.; Watanabe, M.; Yoshida, J.-I. J. Am. Chem. Soc. 2002, 124, 14824. doi: 10.1021/ja028663z
-
[38]
Li, W.-D. Z.; Wang, Y.-Q. Org. Lett. 2003, 5, 2931. doi: 10.1021/ol035098b
-
[39]
(a) Li, W.-D. Z.; Ma, B.-C. J. Org. Chem. 2005, 70, 3277.
(b) Ma, B.-C.; Wang, Y.-Q.; Li, W.-D. Z. J. Org. Chem. 2005, 70, 4528.
(c) Li, W.-D. Z.; Yang, H. Tetrahedron 2005, 61, 5037.
(d) Yang, H.; Wang, Y-Q; Li, W.-D. Z. Chin. Chem. Lett. 2005, 16.
(e) Li, W.-D. Z.; Wang, X.-W. Org. Lett. 2007, 9, 1211. -
[40]
Zhao, Y.-M.; Gu, P.; Zhang, H.-J.; Zhang, Q.-W.; Fan, C.-A.; Tu, Y.-Q.; Zhang, F.-M. J. Org. Chem. 2009, 74, 3211. doi: 10.1021/jo900113s
-
[41]
(a) Xing, P.; Huang, Z.-G.; Jin, Y.; Jiang, B. Synthesis 2013, 45, 596.
(b) Xu, Z.-L.; Xing, P.; Jiang, B. Org. Lett. 2017, 19, 1028. -
[42]
Xiao, K.-J.; Luo, J.-M.; Xia, X.-E.; Wang, Y.; Huang, P.-Q. Chem. Eur. J. 2013, 19, 13075. doi: 10.1002/chem.v19.39
-
[43]
(a) Huang, S.-H.; Tian, X.; Mi, X.; Wang, Y.; Hong, R. Tetrahedron Lett. 2015, 56, 6656.
(b) Liu, H.; Yu, J.; Li, X.; Yan, R.; Xiao, J.-C.; Hong, R. Org. Lett. 2015, 17, 4444.
(c) Hong, R.; Wang, Y.; Ouyang, J.; Mi, X. Synlett 2017, 762. -
[44]
Zhang, Z.-W.; Zhang, X.-F.; Feng, J.; Yang, Y.-H.; Wang, C.-C.; Feng, J.-C.; Liu, S. J. Org. Chem. 2013, 78, 786. doi: 10.1021/jo302608a
-
[45]
Sun, M.-R.; Lu, H.-T.; Wang, Y.-Z.; Yang, H.; Liu, H.-M. J. Org. Chem. 2009, 74, 2213. doi: 10.1021/jo8025252
-
[46]
Ma, X.-Y.; An, X.-T.; Zhao, X.-H.; Du, J.-Y.; Deng, Y.-H.; Zhang, X.-Z.; Fan, C.-A. Org. Lett. 2017, 19, 2965. doi: 10.1021/acs.orglett.7b01202
-
[47]
李盛华, 博士论文, 南开大学, 天津, 2012.Li, S.-H. Ph.D. Dissertation, Naikai University, Tianjin, 2012(in Chinese).
-
[48]
雍胜利, 博士论文, 南开大学, 天津, 2011.Yong, S.-L. Ph.D. Dissertation, Naikai University, Tianjin, 2011(in Chinese).
-
[49]
庄程翰, 博士论文, 南开大学, 天津, 2010.Zhuang, C.-H. Ph.D. Dissertation, Naikai University, Tianjin, 2010(in Chinese).
-
[50]
Li, W.-D. Z.; Duo, W.-G.; Zhuang, C.-H. Org. Lett. 2011, 13, 3538. doi: 10.1021/ol201390r
-
[1]
-
表 1 (-)-三尖杉碱不对称全合成研究工作总结
Table 1. Summary of asymmetric total synthesis of (-)-cephalotaxine
研究组 年份 手性源/手性拆分试剂/手性催化剂 步骤数 总收率/% 参考文献 分类 Mori小组 1995 D-(+)-proline 19 1.8 [12] 手性源法 Ikeda小组 1999 D-(+)-proline 19 7.0 [17] Royer小组 2004 (S)-1-(1-naphthyl)ethylamine 16 9.0 [19] Marguerit小组 2015 (S)-1-(1-naphthyl)ethylamine 16 10.0 [27] Gin小组 2006 (S, S)-4, 5-dihydroxycyclopent-2-enone
isopropylidene acetal19 1.0 [20] Stoltz小组 2007 (R)-3, 4-(methylenedioxy)mandelic acid 11 6.0 [21] Hayes小组 2008 D-(+)-proline 16 1.3 [16] 2008 D-(+)-proline 13 4.7 [18] Ishibashi小组 2008 Diethyl D-(-)-tartrate 14 1.8 [15] Renaud小组 2012 (1S)-2-methylenecyclopentanol derivative 18 2.2 [22] (S)-2-methylenecyclopentan-1-ol 7 8.3 Jiang小组 2016 (S)-(-)-t-butylsulfinamide 6 11.7 [23] Tietze小组 1999 CBS-catalyst 13 5.0 [28] 催化不对称合成法 Tu小组 2012 chiral phosphoric acid 12 4.9 [29] Zhong小组 1994 L-(+)-tartaric acid — — [30] 手性拆分法 Robin小组 2016 chiral organic acid — — [31] Nagasaka小组 1997 (2R, 3R)-(−)-butanediol 15 4 [32] El Bialy小组 2002 L-(+)-malic acid 17 5 [33] Mariano小组 2006 EEACE 14 3.5 [34] EEACE 12 3.8 Li小组 2012 α-phenylethan-2-amine 19 1.8 [47] 李卫东小组研究工作 2011 (2R, 3R)-(-)-butanediol 9 4.3 [48] 2010 (2R, 3R)-(-)-butanediol 9 4.6 [49] -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 49
- 文章访问数: 2959
- HTML全文浏览量: 655


 下载:
下载:




























 下载:
下载:

