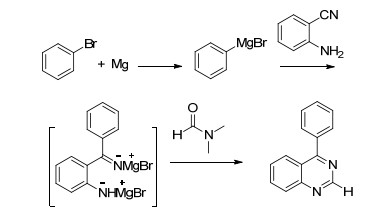
 图式1
4-苯基喹唑啉的合成
Scheme1.
Synthesis of 4-phenylquinazoline
图式1
4-苯基喹唑啉的合成
Scheme1.
Synthesis of 4-phenylquinazoline

Citation: Li Lingjie, Zhang Jing, Tang Yu, Xu Kaitian, Zhang Yuanming. Catalyst-Free One-Pot Synthesis of 4-Substituted Quinazolines[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2711-2716. doi: 10.6023/cjoc201705021

无催化剂一锅法合成4-取代喹唑啉
English
Catalyst-Free One-Pot Synthesis of 4-Substituted Quinazolines
-
Key words:
- quinazoline
- / one-pot
- / catalyst-free
- / Grignard reagent
- / synthesis
-
喹唑啉(Quinazolines)结构存在于众多的N-稠杂环天然产物和人工合成的药物中[1], 该类化合物有良好的抗肿瘤[1c, 2]、抗病毒[3]、抗炎[4]、抗氧化[4b]以及其他生物活性[5].因此, 喹唑啉的合成引起了广泛关注, 早期的制备方法相对繁琐, 其综述可见文献[6].近来, 有文献报道用2-氨基芳醛或酮、醛、乙酸铵三组分反应[7]制备喹唑啉, 在I2催化下可以获得较高的收率[6a], 没有催化剂时获得50%~77%的收率[6b].还有文献报道用2-氨基二苯甲酮与苄胺, 通过形成亚胺中间体, 在催化剂和氧化剂存在下合成喹唑啉[8].有报道指出在碱Cs2CO3存在下, CuI可以催化2-溴芳醛、酮或甲酸酯与脒反应得到喹唑啉[9], Beifuss课题组[10]的类似工作则是在Cs2CO3存在用Cu2O催化2-溴苄溴与脒反应下制备喹唑啉.
通过α-氨基酸与2-氨基芳酮反应生成2-氨基芳亚胺, 然后在I2/氧化剂辅助下, 氨基酸脱羧后与2位氨基偶联得到了4-取代喹唑啉[11].同样在I2/氧化剂辅助下, 2-氨基芳醛或酮与氯化铵、醋酸铵等生成芳亚胺后, 以甲基叔胺[11]或N, N-二甲基甲酰胺(DMF)、醇或醚[11]为碳源, 进行C(sp3)—H键氨基化也得到了4-取代喹唑啉. 2016年, Ma课题组[12]也报道了类似方法, 用氯化亚铜/ O2、2-氨基芳酮和醋酸铵体系, 二甲基亚砜(DMSO)作为碳源制备了4-取代喹唑啉.在这些结果中, 催化剂、氧化剂或碱是获取较好反应结果的重要条件.本文将报道了溴苯与镁通过生成格氏试剂, 然后与邻氨基苯甲腈反应形成亚胺镁盐, 再加入DMF在四氢呋喃和甲苯中, 无需催化剂一锅法合成4-苯基喹唑啉的新方法(Scheme 1).和文献[11]用DMF中的甲基作碳源不同, 此处的碳源是DMF的甲酰基, 用该方法可以高效地制备4-苯基喹唑啉并扩展用于制备带不同取代基的4-取代喹唑啉.在实验结果的基础上, 我们提出了涉及重复亲核加成、消除生成喹唑啉的新机理, 并因此扩展到可用酸酐代替DMF的反应, 而不能进行消除的醛酮则不能反应.共合成了15个化合物, 其中3个为新化合物, 收率37%~95%.
1 结果与讨论
在四氢呋喃(THF)和甲苯溶剂中, 一定温度下, 金属镁与溴苯(2a)先形成格氏试剂, 然后加入邻氨基苯甲腈(1a)反应生成了2-氨基二苯甲酮亚胺(3a), 我们考察溴苯、镁的用量、反应温度及时间对生成3a的影响(表 1).
 表 1
溴苯及镁用量、反应温度和时间对反应影响
Table 1.
Effects of PhBr and Mg amount, reacting temperature and time on the reaction
表 1
溴苯及镁用量、反应温度和时间对反应影响
Table 1.
Effects of PhBr and Mg amount, reacting temperature and time on the reaction

Entry Amount of PhBr and Mga/equiv. Temperatureb/℃ Time/min Yieldc/% 1 2.0 103d 10 36 2 3.0 103d 10 95 3 4.0 103d 5 82 4 4.0 103d 30 99 5 3.0 84e 10 77 6 3.0 78f 10 61 a Amount of PhMgBr based on 2-aminobenzonitrile. bReflux temperatures. cIsolated yields based on 2-aminobenzonitrile. d20 mL toluene+5 mL THF, e10 mL THF+15 mL toluene. f15 mL THF+10 mL toluene. 从表 1可以看出, 5 mmol邻氨基苯甲腈与2.0倍量的溴苯、镁在103 ℃反应10 min时, 得到亚胺的收率为36%(表 1, Entry 1).当溴苯、镁的用量增加到3.0倍量时, 在相同条件下, 亚胺的收率能达到95%(表 1, Entry 2).继续增加溴苯与镁的用量, 缩短其反应时间到5 min, 发现收率下降到82%(表 1, Entry 3), 将其时间延长到30 min, 亚胺的收率为99%(表 1, Entry 4).反应温度是影响反应的一个重要因素, 反应温度可以通过调节混合溶剂中THF与甲苯的体积比来控制.在3.0倍量溴苯、镁的用量下, 降低反应温度, 得到亚胺的收率也显著降低(表 1, Entries 2, 5, 6).因此, 最后确定反应温度为103 ℃, 溴苯、镁用量为3.0倍量, 反应时间为10 min为较优条件.
制备亚胺的反应结束后, 在103 ℃的条件下, 碳源DMF的用量在2.0倍量时, 反应6 h后亚胺已消失, 喹唑啉的收率能够高达95%(表 2, Entry 1), 同样条件下, 减少DMF到1.5或1.0倍量时, 喹唑啉的收率则明显下降(表 2, Entries 2, 3).

Entry DMF/equiv. Yielda/% 1 2.0 95 2 1.5 77 3 1.0 64 a Isolated yield based on 2-aminobenzonitrile. 通过对溴苯及镁用量、生成亚胺的反应温度和DMF用量的考察, 最终确定了合成4-苯基喹唑啉的较优化条件为: 15 mmol溴苯和镁在混合溶剂5 mL四氢呋喃和20 mL甲苯中, 103 ℃条件下反应到镁消失后, 加入5 mmol邻氨基苯甲腈反应10 min, 再加入10 mmol DMF继续在103 ℃条件下反应6 h.在此较优的条件下, 用不同的溴代烃探究该方法的普适性, 其结果如表 3所示, 用此方法共以中等到优的收率合成了13个4-取代喹唑啉化合物, 其中3个是新化合物.在用邻氨基苯甲腈、DMF进行的反应中, 除4-甲基溴苯只能以70%的收率获得目标产物外(表 3, Entry 2), 带给电子的甲基、甲氧基的溴苯以及没有取代基的溴苯, 都能够以高于80%的收率得到相应的4-取代喹唑啉产物(表 3, Entries 1, 3~5), 2-甲基、2-甲氧基溴苯(表 3, Entries 4, 5) 则表现出一定的位阻效应, 它们生成产物的收率比用4-甲氧基溴苯(表 3, Entry 3) 时略低.我们在4-甲基溴苯的反应产物中用气相色谱-质谱联用仪检测到了2-(4-甲基苯基)-4-(4-甲基苯基)喹唑啉, 分离收率为25%, 即在4-(4-甲基苯基)喹唑啉生成后, 其又与反应混合物中的4-甲基苯基溴化镁在2位发生了反应, 因此降低了目标产物的收率, 进一步的原因则需要我们进行系列的深入研究, 也有可能由此找到在喹唑啉2位取代不同基团的新方法, 从而可以不使用价格较高的2-氨基芳醛、酮为原料合成2, 4位取代基不同的不对称喹唑啉.一些带弱吸电子基的溴苯如对氯、间氟溴苯参与反应时, 生成产物的收率稍下降, 分别为75%和80%(表 3, Entries 6, 7).虽然以对二溴苯为原料制备的喹唑啉收率只有37%(表 3, Entry 8), 但是该产物4位的苯基上保留了一个溴, 这有利于其进一步反应生成结构更复杂的分子.间甲氧基溴苯得到中等收率(56%)的喹唑啉产物(表 3, Entry 9), 没有如对和邻甲氧基溴苯一样体现出甲氧基的给电子效应, 反而表现出吸电子基的影响.众所周知, 1-溴代萘的反应活性低于溴苯, 在我们前面所做的研究中也体现出这一规律[13], 因此稠环的1-溴代萘获得较好收率的喹唑啉产物也属正常(表 3, Entry 10, 62%).同样由于反应活性低的原因, 溴代烷烃如正溴丁烷、溴代环己烷反应得到的喹唑啉产物的收率在50%左右(表 3, Entries 11, 12).用4-氯-2-氨基苯甲腈、对溴苯甲醚、镁、DMF进行反应时, 得到相应喹唑啉产物的收率为60%(表 3, Entry 13), 而用5-硝基-2-氨基苯甲腈、溴苯、镁、DMF反应, 生成的主要产物为苯并吡唑(吲唑), 收率也只有20%左右, 而溴苯、镁生成苯基溴化镁后, 加入3-氨基-4-氰基吡唑, 反应不发生.
 表 3
不同溴代物合成4-取代喹唑啉衍生物
Table 3.
Synthesis of 4-substituted quinazoline derivatives using hydrocarbon bromides
表 3
不同溴代物合成4-取代喹唑啉衍生物
Table 3.
Synthesis of 4-substituted quinazoline derivatives using hydrocarbon bromides

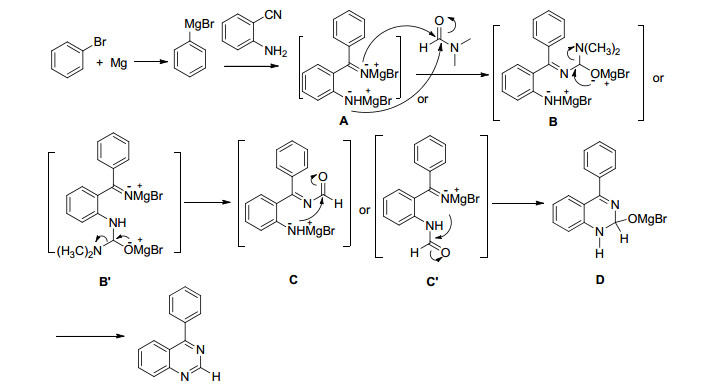
Entry R1 R2 Product Yielda/% 1 H Ph 4a 95 2 H 4-MeC6H4 4b 70 3 H 4-MeOC6H4 4c 90 4b H 2-MeC6H4 4d 81 5 H 2-MeOC6H4 4e 85 6b H 4-ClC6H4 4f 75 7b H 3-FC6H4 4g 80 8 H 4-BrC6H4 4h 37 9 H 3-MeOC6H4 4i 56 10 H Naphthyl 4j 62 11 H Butyl 4k 55 12 Hb Cyclohexyl 4l 45 13 4-Cl 4-MeOC6H4 4m 60 aIsolated yield based on 2-aminobenzonitrile. b Reaction time after adding DMF is 12 h. 然后我们考虑寻找DMF以外的原料进行反应, 希望制备结构不同的喹唑啉.由于DMF的甲酰基也是醛基, 苯甲醛首先被用来代替DMF参与反应, 却发现其不能与生成的亚胺镁盐反应, 环己酮也是如此, 用N, N'-二乙基甲酰胺代替DMF也不能反应.有文献[5b]报道邻氨基苯甲腈与DMF的缩醛反应才能得到碳氮双键结构[N=CN(CH3)2], 于是我们认为在反应中, DMF中的甲酰基不是起醛基与氨基亲核加成后脱水生成碳氮双键然后再与亚氨基发生亲核加成成环的作用, 而应该是在甲酰基亲核加成后消除二甲氨基生成酰(亚)胺, 然后再成环.由于醛酮不能进行消除, 因此不反应, 而N, N'-二乙基甲酰胺则由于二乙胺基不能被消除而不反应.在此基础上, 我们提出了可能的反应机理, 首先, 溴苯和镁反应生成格氏试剂, 其与邻氨基苯甲腈反应得到邻氨基二苯甲酮亚胺的镁盐A[14], 镁盐A中的亚氨基或氨基负离子都有可能与DMF中的甲酰基反应, 虽然它们的碱性和亲核性不同, 但由于都含有氮原子, 这种差异不足以大到使一种氨基反应, 而另一种氨基不反应.众所周知胺的亲核性大于亚胺, 因此氨基负离子有可能会先反应.为了探讨哪一种氨基负离子更易反应, 我们尝试用3倍量溴苯与镁反应生成苯基溴化镁后, 加入苯甲腈先生成亚胺镁盐, 反应10 min, 待苯甲腈消失后再加入1倍量的苯胺, 反应5 min后, 苯胺也检测不到了, 最后加入DMF, 却发现DMF不能反应, 这说明关环生成芳香的喹唑啉对于反应更重要.
我们认为镁盐A中的亚氨基或氨基负离子进攻DMF中的甲酰基发生亲核加成有可能在反应中并存, 形成中间体B或B', 中间体B或B'发生消除反应消去二甲氨基, 其氧负离子与所联碳原子重新形成羰基得到中间体酰亚胺C或酰胺C', 然后氨基或亚氨基负离子再进攻中间体C或C'中的甲酰基, 发生亲核加成得到中间体D, 中间体D发生消除反应生成4-苯基喹唑啉.值得一提的是, 当把苯基溴化镁与邻氨基苯甲腈生成的亚胺镁盐加水处理分离出亚胺后, 再用其与DMF在相同条件下反应, 却发现反应不能发生, 表现出了一锅反应的特殊性, 也说明生成喹唑啉需用亲核性更强的氮负离子与DMF反应.
按此机理, 应该可以用酸酐进行反应, 事实上用脂肪的乙酸酐和芳香的苯甲酸酐代替DMF, 分别以77%和85%的收率得到了相应的喹唑啉产物(表 4, Enrties 1, 2).虽然文献[15]也报道了用乙酸酐和三氟乙酸酐与类似邻氨基二苯甲酮亚胺的镁盐A反应生成喹唑啉, 但其收率最高为56%, 且没有提及反应机理, 也没有用芳香酸酐.

Entry Acid anhydride Product Yielda/% 1 Acetic anhydride 4n 77 2 Benzoic anhydride 4o 85 aIsolated yield based on 2-aminobenzonitrile. 2 结论
成功地找到一种合成喹唑啉的新方法, 用溴苯与镁通过生成格氏试剂, 然后与邻氨基苯甲腈反应形成亚胺镁盐, 再加入DMF反应, 一锅法合成4-苯基喹唑啉.该方法简单, 无需催化剂, 能有效地合成喹唑啉类化合物.通过对底物适应性的探究, 发现含有甲基、甲氧基等供电子基团有利于反应, 弱吸电子基如氯、氟等稍不利于反应, 苯基邻位的空间效应会略降低反应收率.在实验结果的基础上, 提出了涉及重复亲核加成和消除反应的可能机理, 并因此扩展到可用酸酐代替DMF反应.共合成了15个化合物, 其中3个新化合物, 收率37%~95%.
3 实验部分
3.1 仪器与试剂
核磁共振用Bruker 300核磁共振仪测定, 质谱用Finnigan Trace GC/MS仪测定, 高分辨质谱由Agilent 6210 LC/MSD TOF mass spectrometer (Agilent Technologies, CA, USA)测定, 熔点用SGW-X4显微熔点仪测定.实验所用试剂均为市售化学纯或分析纯试剂, 用前无需进行处理.
3.2 化合物4的合成
在一个典型的实验中, 先用15 mmol溴苯和15 mmol镁在5 mL THF和20 mL甲苯的混合溶剂中103 ℃条件下反应40 min, 待镁消失后, 加入5 mmol邻氨基苯甲腈, 用薄层层析法(TLC)监测反应, 反应10 min后, 加入10 mmol DMF继续进行下一步反应.反应6 h后, 结束并冷却反应到室温.将5 mL水和10 mL乙酸乙酯加入到反应液中, 搅拌几分钟, 抽滤得到滤液, 滤渣用少量乙酸乙酯洗涤后合并到滤液中, 然后用乙酸乙酯萃取(10 mL×3) 滤液.将有机相合并, 用无水硫酸镁干燥、过滤, 滤液旋转蒸发得到粗产物.称取0.1 g左右的粗产物溶于0.5 mL乙酸乙酯中, 以石油醚/乙酸乙酯(V:V=4:1) 为展开剂体系, 用TLC对粗产物进行分离提纯得到4-苯基喹唑啉产物, 计算其分离收率.
4-苯基喹唑啉(4a):白色固体, 95%. m.p. 99~101 ℃ (lit.[15] 95~97 ℃); 1H NMR (300 MHz, CDCl3) δ: 9.40 (s, 1H), 8.15 (ddd, J=8.1, 4.6, 1.3 Hz, 2H), 7.94 (ddd, J=8.5, 6.9, 1.4 Hz, 1H), 7.85~7.75 (m, 2H), 7.68~7.56 (m, 4H); MS (EI) m/z: 206 (M+), 151, 102, 76.
4-(4-甲基苯基)-喹唑啉(4b)[16]:黄色固体, 70%. m.p. 140~142 ℃; 1H NMR (300 MHz, CDCl3) δ: 9.39 (s, 1H), 8.16 (ddd, J=16.4, 8.2, 1.1 Hz, 2H), 7.94 (ddd, J=8.4, 6.9, 1.4 Hz, 1H), 7.76~7.69 (m, 2H), 7.63 (ddd, J=8.3, 6.9, 1.3 Hz, 1H), 7.41 (d, J=7.8 Hz, 2H), 2.51 (s, 3H); MS (EI) m/z: 220 (M+), 204, 151, 102, 76.
4-(4-甲氧基苯基)-喹唑啉(4c):白色固体, 90%. m.p. 81~83 ℃ (lit.[16] 82 ℃); 1H NMR (300 MHz, CDCl3) δ: 9.36 (s, 1H), 8.21 (ddd, J=8.4, 1.4, 0.7 Hz, 1H), 8.12 (dt, J=8.5, 0.9 Hz, 1H), 7.93 (ddd, J=8.4, 6.9, 1.4 Hz, 1H), 7.85~7.77 (m, 2H), 7.64 (ddd, J=8.3, 6.9, 1.3 Hz, 1H), 7.15~7.09 (m, 2H), 3.94 (s, 3H); MS (EI) m/z: 236 (M+), 220, 205, 192, 140, 102, 76.
4-(2-甲基苯基)-喹唑啉(4d)[17]:白色固体, 81%. m.p. 128~129 ℃; 1H NMR (300 MHz, CDCl3) δ: 9.42 (s, 1H), 8.15 (dd, J=8.6, 1.1 Hz, 1H), 7.94 (ddd, J=8.4, 6.8, 1.5 Hz, 1H), 7.71 (dd, J=8.4, 1.5 Hz, 1H), 7.58 (ddd, J=8.2, 6.8, 1.2 Hz, 1H), 7.46 (ddd, J=8.0, 6.0, 2.4 Hz, 1H), 7.42~7.32 (m, 3H), 2.16 (s, 3H); GC-MS m/z: 220.
4-(2-甲氧基苯基)-喹唑啉(4e)[16]:黄色固体, 85%. m.p. 136~137 ℃; 1H NMR (300 MHz, CDCl3) δ: 9.40 (s, 1H), 8.18~8.15 (m, 1H), 8.12 (d, J=8.0 Hz, 1H), 7.99~7.93 (m, 1H), 7.64 (ddd, J=8.3, 6.9, 1.2 Hz, 1H), 7.52~7.47 (m, 1H), 7.39~7.31 (m, 1H), 7.18~7.11 (m, 2H), 3.92 (s, 3H); MS (EI) m/z: 236 (M+), 219, 205, 151, 102, 76.
4-(4-氯苯基)-喹唑啉(4f):黄色固体, 75%. m.p. 122~123 ℃ (lit.[16] 122 ℃); 1H NMR (300 MHz, CDCl3) δ: 9.40 (s, 1H), 8.21~8.07 (m, 2H), 7.96 (ddd, J=8.4, 6.9, 1.4 Hz, 1H), 7.82~7.72 (m, 2H), 7.66 (ddd, J=8.3, 6.9, 1.2 Hz, 1H), 7.62~7.53 (m, 2H); MS (EI) m/z: 240 (M+), 204, 177, 151, 102, 76.
4-(3-氟苯基)-喹唑啉(4g)[18]:黄色固体, 80%. m.p. 147~149 ℃; 1H NMR (300 MHz, CDCl3) δ: 9.41 (s, 1H), 8.16 (td, J=8.2, 1.1 Hz, 2H), 7.98 (ddd, J=8.5, 6.9, 1.5 Hz, 1H), 7.68 (ddd, J=8.2, 6.9, 1.3 Hz, 1H), 7.63 – 7.53 (m, 3H), 7.54~7.48 (m, 1H); MS (EI) m/z: 224 (M+), 205, 176, 102, 76.
4-(4-溴苯基)-喹唑啉(4h):黄色固体, 37%. m.p. 177~178 ℃ (lit.[19] 152~154 ℃); 1H NMR (300 MHz, CDCl3) δ: 9.40 (s, 1H), 8.24~8.08 (m, 2H), 7.97 (ddd, J=8.4, 6.9, 1.4 Hz, 1H), 7.79~7.58 (m, 5H); MS (EI) m/z: 284 (M+), 282, 205, 178, 151, 102, 76.
4-(3-甲氧基苯基)-喹唑啉(4i):黄色油状液体, 56%. 1H NMR (300 MHz, CDCl3) δ: 9.39 (s, 1H), 8.16~8.12 (m, 2H), 7.93 (ddd, J=8.5, 6.8, 1.4 Hz, 1H), 7.62 (ddd, J=8.3, 6.9, 1.2 Hz, 1H), 7.49 (t, J=7.8 Hz, 1H), 7.3 (dd, J=7.7, 1.5 Hz, 2H), 7.16~7.09 (m, 1H), 3.90 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 168.3, 159.8, 154.6, 151.0, 138.3, 133.8, 129.7, 128.8, 127.8, 127.2, 123.2, 122.4, 116.0, 115.1, 55.5; TOF-HRMS calcd for C15H13N2O [M+H]+ 237.1022, found 237.1023.
4-(1-萘基)-喹唑啉(4j):黄色油状液体, 62%. 1H NMR (300 MHz, CDCl3) δ: 9.52 (s, 1H), 8.20 (d, J=8.6 Hz, 1H), 8.07 (dd, J=7.6, 1.9 Hz, 1H), 8.03~7.88 (m, 2H), 7.76~7.65 (m, 2H), 7.62 (dd, J=7.2, 2.0 Hz, 1H), 7.58~7.48 (m, 3H), 7.41 (ddd, J=8.4, 6.5, 1.4 Hz, 1H); 13C NMR (75 MHz, CDCl3) δ: 169.1, 154.7, 150.7, 134.3, 134.2, 133.7, 131.5, 130.0, 128.8, 128.5, 127.9, 127.9, 127.4, 126.9, 126.4, 125.4, 125.1, 124.9; TOF-HRMS calcd for C18H12N2Na [M+Na]+ 279.0893, found 279.0921.
4-正丁基喹唑啉(4k)[16]:白色固体, 55%. m.p. 107~108 ℃; 1H NMR (300 MHz, CDCl3) δ: 9.24 (s, 1H), 8.17 (dt, J=8.3, 1.1 Hz, 1H), 8.07 (dd, J=8.6, 1.2 Hz, 1H), 7.91 (ddd, J=8.4, 6.9, 1.4 Hz, 1H), 7.67 (ddd, J=8.2, 6.8, 1.2 Hz, 1H), 3.44~3.18 (m, 2H), 1.89 (tdd, J=12.8, 9.1, 5.4 Hz, 2H), 1.56~1.48 (m, 2H), 1.01 (t, J=7.3 Hz, 3H); MS (EI) m/z: 186 (M+), 171, 157, 144, 129, 102, 76.
4-环己基喹唑啉(4l)[20]:黄色固体, 45%. m.p. 124~127 ℃; 1H NMR (300 MHz, CDCl3) δ: 9.28 (s, 1H), 8.22 (dd, J=8.5, 1.3 Hz, 1H), 8.08 (d, J=8.6 Hz, 1H), 7.90 (ddd, J=8.4, 6.8, 1.4 Hz, 1H), 7.67 (ddd, J=8.3, 6.8, 1.3 Hz, 1H), 3.59 (tt, J=11.6, 3.3 Hz, 1H), 2.01~1.95 (m, 5H), 1.92~1.70 (m, 2H), 1.69~1.21 (m, 3H); MS (EI) m/z: 212 (M+), 183, 169, 157, 143, 129, 102, 76.
7-氯-4-(4-甲氧基苯基)-喹唑啉(4m):黄色固体, 60%. m.p. 170~171 ℃; 1H NMR (300 MHz, CDCl3) δ: 9.34 (s, 1H), 8.24~8.00 (m, 2H), 7.79 (d, J=8.6 Hz, 2H), 7.58 (dd, J=9.0, 2.1 Hz, 1H), 7.12 (d, J=8.6 Hz, 2H), 3.94 (s, 3H); 13C NMR (75 MHz, CDCl3) δ: 167.9, 161.6, 155.4, 151.7, 140.0, 131.7, 129.0, 128.8, 127.8, 121.5, 114.3, 55.5; TOF-HRMS calcd for C15H12ClN2O [M+H]+ 271.0633, found 271.0638.
2-甲基-4-苯基喹唑啉(4n):白色固体, 77%. m.p. 48~49 ℃ (lit.[21] 48~49 ℃); 1H NMR (300 MHz, CDCl3) δ: 8.12~8.00 (m, 2H), 7.90 (ddd, J=8.4, 6.8, 1.5 Hz, 1H), 7.80~7.74 (m, 2H), 7.62~7.50 (m, 4H), 2.98 (s, 3H); MS (EI) m/z: 220 (M+), 179, 151, 102, 76
2, 4-二苯基喹唑啉(4o):黄色固体, 85%. m.p. 120~122 ℃ (lit.[8c] 117~119 ℃); 1H NMR (300 MHz, CDCl3) δ: 8.80~8.69 (m, 2H), 8.23~8.12 (m, 2H), 8.0~7.98~7.87 (m, 3H), 7.60~7.53 (m, 7H); MS (EI) m/z: 282 (M+), 205, 178, 151, 102, 76.
辅助材料(Supporting Information) 新化合物的1H NMR, 13C NMR以及高分辨质谱(HRMS)谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Wattanapiromsakul, C.; Forster, P. I.; Waterman, P. G. Phytochemistry 2003, 64, 609.
(b) Foster, B. A.; Coffey, H. A.; Morin, M. J.; Rastinejad, F. Science 1999, 286, 2507.
(c) Doyle, L. A.; Ross, D. D. Oncogene 2003, 22, 7340.
(d) Deng, Y.; Xu, R.; Ye, Y. Pharm. Sci. 2000, 9, 116. -
[2]
(a) El-Azab, A. S.; Al-Omar, M. A.; Alaa, A.-M.; Abdel-Aziz, N. I.; Magda, A.-A.; Aleisa, A. M.; Sayed-Ahmed, M. M.; Abdel-Hamide, S. G. Eur. J. Med. Chem. 2010, 45, 4188.
(b) Henderson, E. A.; Bavetsias, V.; Theti, D. S.; Wilson, S. C.; Clauss, R.; Jackman, A. L. Bioorg. Med. Chem. 2006, 14, 5020.
(c) Noolvi, M. N.; Patel, H. M.; Bhardwaj, V.; Chauhan, A. Eur. J. Med. Chem. 2011, 46, 2327.
(d) Hou, X.; Zhang, J.; Zhao, X.; Chang, L.; Hu, P.; Liu. H. Chin. J. Chem. 2014, 32, 538. -
[3]
(a) Chien, T. C.; Chen, C. S.; Yu, F. H.; Chern, J. W. Chem. Pharm. Bull. 2004, 52, 1422.
(b) Waisser, K.; Gregor, J.; Dostál, H.; Kuneš, J.; Kubicová, L.; Klimešová, V.; Kaustová, J. Farmaco 2001, 56, 803.
(c) Herget, T.; Freitag, M.; Morbitzer, M.; Kupfer, R.; Stamminger, T.; Marschall, M. Antimicrob. Agents Ch emother. 2004, 48, 4154. -
[4]
(a) Kuneš, J.; Bažant, J.; Pour, M.; Waisser, K.; Šlosárek, M.; Janota, J. Farmaco 2000, 55, 725.
(b) Kumar, A.; Sharma, P.; Kumari, P.; Kalal, B. L. Bioorg. Med. Chem. Lett. 2011, 21, 4353.
(c) Balakumar, C.; Lamba, P.; Kishore, D. P.; Narayana, B. L.; Rao, K. V.; Rajwinder, K.; Rao, A. R.; Shireesha, B.; Narsaiah, B. Eur. J. Med. Chem. 2010, 45, 4904.
(d) Alafeefy, A. M.; Kadi, A. A.; Al-Deeb, O. A.; El-Tahir, K. E.; Al-jaber, N. A. Eur. J. Med. Chem. 2010, 45, 4947. -
[5]
(a) Gao, Y. -L. ; Xiong, Q. -Z. ; An, R. ; Bao, X. -P. Chin. J. Org. Chem. 2011, 31, 1529 (in Chinese).
(高元磊, 熊启中, 安锐, 鲍小平, 有机化学, 2011, 31, 1529. )
(b) Zhang, Y. ; Wang, P. -Y. ; Hu, D. -Y. ; Jin, L. -H. ; Yang, S. Chin. J. Org. Chem. 2012, 32, 444 (in Chinese).
(张英, 王培义, 胡德禹, 金林红, 杨松, 有机化学, 2012, 32, 444. ) -
[6]
(a) Gilchrist, T. L. J. Chem. Soc., Perkin Trans. 1 1998, 3, 615.
(b) Connolly, D. J.; Cusack, D.; O'Sullivan, T. P.; Guiry, P. J. Tetrahedron 2005, 61, 10153. -
[7]
(a) Panja, S. K.; Dwivedi, N.; Saha, S. Tetrahedron Lett. 2012, 53, 6167.
(b) Yan, Y.; Xu, Y.; Niu, B.; Xie, H.; Liu, Y. J. Org. Chem. 2015, 80, 5581.
(c) Bandaru, M.; Sabbavarapu, N. M.; Pavan, A. K.; Akula, A. K.; Durga, N. Y. V. Eur. J. Chem. 2012, 3, 252. -
[8]
(a) Han, B.; Wang, C.; Han, R.-F.; Yu, W.; Duan, X.-Y.; Fang, R.; Yang, X.-L. Chem. Commun. 2011, 47, 7818.
(b) Zhang, J.; Yu, C.; Wang, S.; Wan, C.; Wang, Z. Chem. Commun. 2010, 46, 5244.
(c) Zhang, J.; Zhu, D.; Yu, C.; Wan, C.; Wang, Z. Org. Lett. 2010, 12, 2841. -
[9]
Huang, C.; Fu, Y.; Fu, H.; Jiang, Y.; Zhao, Y. Chem. Commun. 2008, 44, 6333. doi: 10.1002/chin.200917162/full
-
[10]
Malakar, C. C.; Baskakova, A.; Conrad, J.; Beifuss, U. Chem.-Eur. J. 2012, 18, 8882. doi: 10.1002/chem.v18.29
-
[11]
Yan, Y.; Wang, Z. Chem. Commun. 2011, 47, 9513. doi: 10.1039/c1cc12885j
-
[12]
Duan, T.; Zhai, T.; Liu, H.; Yan, Z.; Zhao, Y.; Feng, L.; Ma, C. Org. Biomol. Chem. 2016, 14, 6561. doi: 10.1039/C6OB00625F
-
[13]
温运明, 陈桂芳, 唐渝, 陈静, 杨骏, 张渊明, 有机化学, 2015, 35, 2545. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345199.shtmlWen, Y.-M.; Chen, G.-F.; Tang, Y.; Chen. J.; Yang J.; Zhang, Y.-M. Chin. J. Org. Chem. 2015, 35, 2545. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345199.shtml
-
[14]
Maitraie, D.; Yakaiah, T.; Srinivas, K.; Reddy, G. V.; Ravikanth, S.; Narsaiah, B.; Rao, P. S.; Ravikumar, K.; Sridhar, B. J. Fluorine Chem. 2006, 127, 351. doi: 10.1016/j.jfluchem.2006.01.003
-
[15]
Yang, C.-H.; Fang, K.-H.; Su, W.-L.; Wang, S.-P.; Su, S.-K.; Sun, I.-W. J. Organomet. Chem. 2006, 691, 2767. doi: 10.1016/j.jorganchem.2006.02.034
-
[16]
Higashino, T.; Takemoto, M.; Hayashi, E. Chem. Pharm. Bull. 1985, 33, 1351. doi: 10.1248/cpb.33.1351
-
[17]
Kita, Y.; Higashida, K.; Yamaji, K.; Iimuro, A.; Mashima, K. Chem. Commun. 2015, 51, 4380. doi: 10.1039/C5CC00258C
-
[18]
Yang, Y. Synthesis 2016, 48, 2255. doi: 10.1055/s-00000084
-
[19]
Yan, Y.; Zhang, Y.; Feng, C.; Zha, Z.; Wang, Z. Angew. Chem., Int. Ed. 2012, 51, 8077. doi: 10.1002/anie.v51.32
-
[20]
Quattrini, M. C.; Fujii, S.; Yamada, K.; Fukuyama, T.; Ravelli, D.; Fagnoni, M.; Ryu, I. Chem. Commun. 2017, 53, 23358. http://europepmc.org/abstract/MED/28164184
-
[21]
Bergman, J.; Brynolf, A.; Elman, B.; Vuorinen, E. Tetrahedron 1986, 42, 3697. doi: 10.1016/S0040-4020(01)87338-5
-
[1]
-
表 1 溴苯及镁用量、反应温度和时间对反应影响
Table 1. Effects of PhBr and Mg amount, reacting temperature and time on the reaction

Entry Amount of PhBr and Mga/equiv. Temperatureb/℃ Time/min Yieldc/% 1 2.0 103d 10 36 2 3.0 103d 10 95 3 4.0 103d 5 82 4 4.0 103d 30 99 5 3.0 84e 10 77 6 3.0 78f 10 61 a Amount of PhMgBr based on 2-aminobenzonitrile. bReflux temperatures. cIsolated yields based on 2-aminobenzonitrile. d20 mL toluene+5 mL THF, e10 mL THF+15 mL toluene. f15 mL THF+10 mL toluene. 表 2 DMF用量对反应的影响
Table 2. Effects of amount of DMF on the reaction

Entry DMF/equiv. Yielda/% 1 2.0 95 2 1.5 77 3 1.0 64 a Isolated yield based on 2-aminobenzonitrile. 表 3 不同溴代物合成4-取代喹唑啉衍生物
Table 3. Synthesis of 4-substituted quinazoline derivatives using hydrocarbon bromides

Entry R1 R2 Product Yielda/% 1 H Ph 4a 95 2 H 4-MeC6H4 4b 70 3 H 4-MeOC6H4 4c 90 4b H 2-MeC6H4 4d 81 5 H 2-MeOC6H4 4e 85 6b H 4-ClC6H4 4f 75 7b H 3-FC6H4 4g 80 8 H 4-BrC6H4 4h 37 9 H 3-MeOC6H4 4i 56 10 H Naphthyl 4j 62 11 H Butyl 4k 55 12 Hb Cyclohexyl 4l 45 13 4-Cl 4-MeOC6H4 4m 60 aIsolated yield based on 2-aminobenzonitrile. b Reaction time after adding DMF is 12 h. 表 4 与酸酐反应合成喹唑啉
Table 4. Synthesis quinazolines with different anhydrides

Entry Acid anhydride Product Yielda/% 1 Acetic anhydride 4n 77 2 Benzoic anhydride 4o 85 aIsolated yield based on 2-aminobenzonitrile. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 12
- 文章访问数: 1962
- HTML全文浏览量: 445


 下载:
下载:

 下载:
下载:

