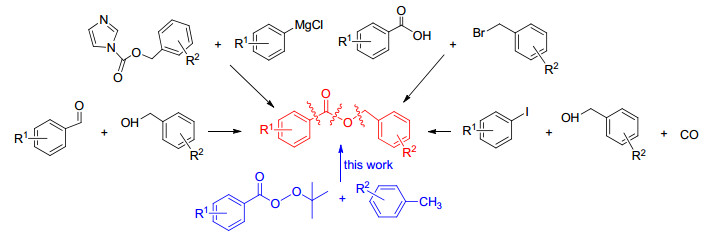
 图式1
芳基甲酸苄酯的合成方法
Scheme1.
Syntheses of benzyl benzoates
图式1
芳基甲酸苄酯的合成方法
Scheme1.
Syntheses of benzyl benzoates

Citation: Duanmu Dandan, Leong Pak-kin, Jiang Qibai, Yan Hong. Pd(Ⅱ)-Catalyzed Synthesis of Benzyl Benzoates via Benzyl C(sp3)-H Activation[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2669-2677. doi: 10.6023/cjoc201704040

钯催化苄基的C(sp3)—H键活化合成芳酸苄酯
English
Pd(Ⅱ)-Catalyzed Synthesis of Benzyl Benzoates via Benzyl C(sp3)-H Activation
-
Key words:
- Pd(Ⅱ)-catalysis
- / C—H activation
- / benzyl benzoates
- / perester
-
C—H键活化作为有机合成中重要的一个分支, 广泛应用于药物、天然产物、农药、聚合物和原料等化合物的合成[1].在过去的20年间, C—H键活化及官能团化取得了显著的发展[2].在各种类型的C—H键中, 惰性的C(sp3)—H键直接活化构建C—X (X=C, N, O)[3~5]的反应是一项极具挑战性的工作, 因为惰性的C(sp3)—H键具有更高的键解离能, 缺乏π键的共轭参与, 缺乏与过渡金属催化中心相互作用的活性HOMO或LUMO轨道[6].近年来, 相对活泼的烯丙基[7~9]和苄基[10~12]这两种特殊的C(sp3)—H键的研究逐渐增多, 促进了C—H键活化及功能化的发展.
芳基甲酸苄基酯其结构类似于烯丙基酯, 常用于合成芳基衍生物及作为C—O键化合物的前驱体[13].芳基甲酸苄基酯作为一类重要的化学合成子, 已经发展了多种合成方法, 包括酸或芳香醛与苄基醇的酯化反应、取代反应和卤代芳烃的羰基化反应[14~17].在此基础上, 我们发展了一种新的Pd催化、苄基C(sp3)—H键直接活化的氧化偶联合成方式(Scheme 1), 该反应具有很好的区域选择性和较高的反应产率.通过控制实验, 提出了一种氧化偶联反应机理.
1 结果与讨论
我们以4-氯过氧苯甲酸叔丁酯(1a)和甲苯(2a)作为模板反应底物, 对反应条件进行筛选和优化, 包括筛选催化剂、配体、反应温度和反应时间, 所有反应均在氩气保护下进行, 结果如表 1所示.在条件筛选中, 我们发现使用Pd(OAc)2 (5 mol%)作催化剂时能得到产率70%的苯甲酸苄酯(表 1, Entry 1).当使用其他催化剂如CuBr, Pd(bpy)2Cl2和Pd(PPh3)4时只能生成少量产物, 甚至没有产物生成(表 1, Entries 2~4).随后, 我们考察配体对反应的影响.当使用Pd(OAc)2 (5 mol%), 1, 3-(2, 6-双异丙基苯基)氯化咪唑鎓盐(i-Pr•HCl, 5 mol%)时能够得到92%的产物(表 1, Entry 5).当使用其他配体时产率没有增加甚至没有产物生成(表 1, Entries 6~8).另一方面, 更改其他溶剂或增加催化用量时, 对产率没有明显的改善.当反应温度提高到130 ℃时反应的产率反而减少至40%(表 1, Entry 9), 这可能是因为在高温下1a会分解导致的.最后, 在没有催化剂的情况下, 没有检测到产物(表 1, Entries 10~11).通过以上反应条件的优化, 我们确定了最佳反应条件为: Pd(OAc)2 (5 mol%), i-Pr•HCl (5 mol%), t-BuOK (5 mol%), 110 ℃反应12 h, 在氩气保护下进行反应(表 1, Entry 5).

Entry Catalyst Ligand Temp./℃ Time/h Yieldb/% 1 Pd(OAc)2 — 110 12 70 2 CuBr — 110 12 20 3 Pd(bpy)2Cl2 — 110 12 0 4 Pd(PPh3)4 — 110 12 0 5 Pd(OAc)2 i-Pr"HCl/t-BuOK 110 12 92 6 Pd(OAc)2 Tp*K/t-BuOK 110 12 84 7 Pd(OAc)2 Py/t-BuOK 110 12 0 8 Pd(OAc)2 PPh3/t-BuOK 110 12 0 9 Pd(OAc)2 i-Pr"HCl/t-BuOK 130 12 40 10 — i-Pr"HCl/t-BuOK 110 24 0 11 — — 110 24 0 aReaction conditions: 1a(1.0 mmol), 2a (1.5 mmol), catalyst (0.05 mmol), ligand (0.05 mmol) reacting in 3 mL of PhCF3. bYield detected by 1H NMR. 在最优化条件下, 我们首先固定甲苯为苄基底物, 考察该反应中芳基过氧叔丁酯的普适性, 结果如表 2所示.实验表明, 将1a换成其他的芳基过氧酯都能够得到相应的产物.过氧酯上取代基的电子效应对反应的结果并没有明显的影响; 无论是给电子基还是吸电子基的芳基过氧酯底物, 都能得到较好产率的产物.不同取代基包括卤素(3a和3f~3h)、醚类(3i~3k)、三氟甲基(3l和3m)以及硝基(3n和3o)的底物也能以较好收率的得到相应的产物.另一方面, 芳基过氧酯的位阻效应对反应性也没有显着的影响, 如邻位连有基团的过氧酯也均高产率地生成了相应地芳酸苄基酯(3h, 3i和3n).值得一提的是, 有机杂环类过氧酯也适用于本实验的最优化条件, 均能得到比较好的产率(3p和3q).
为了进一步地探究反应性, 我们其后固定4-氯过氧苯甲酸叔丁酯(1a)为底物, 考察了含有苄基C(sp3)—H键的底物的普适性, 结果如表 3所示.该反应体系对不同取代基的苄基类底物显示出良好至优秀的兼容性.值得注意的是, 对于含有多个C(sp3)—H键位点的底物, 在该催化条件下只选择性地得到苄基位活化的产物, 而没有任何其他的副产物生成(4a~4c).另一方面, 当使用乙基苯和异丙基苯时, 因位阻效应使相应的产率降低至78%和70% (4d和4e).同时, 当有强吸电子的基团时会降低产率(4g).此外, 杂环类底物, 如2-甲基吡啶、8-甲基喹啉、2-噻吩, 甚至是2, 5-二甲基呋喃也都能够在该反应条件下经历C—H键氧化而生成相应的产物(4h~4k).
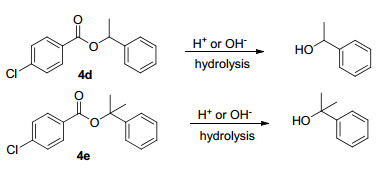
苄醇类物质被广泛用于合成治疗肿瘤的药物, 应用于制备光敏材料、醇氧化酶和标记蛋白质与DNA的探针, 同时也是重要的有机试剂和医药中间体.利用该反应体系制得的芳酸苄基酯类物质可以经过进一步地水解作用得到苄醇类物质.如苄酯4d和4e可以通过水解得到稳定的苄醇[18], 成功避免了使用其他氧化方法时过度氧化的问题(Scheme 2).
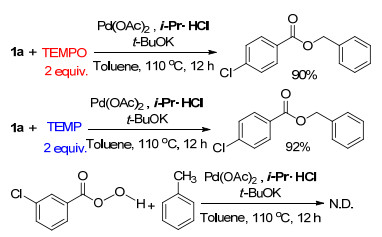
为了了解苄基C(sp3)—H键活化的反应机理, 我们以一系列控制实验进行了更进一步的研究.当我们将2, 2, 6, 6-四甲基哌啶氧化物(TEMPO)或者2, 2, 6, 6-四甲基哌啶(TEMP)加入到该反应体系中, 仍然能够得到产物, 而没有检测到任何与自由基捕获剂TEMPO或TEMP加和的产物.同时, 将3-氯过氧苯甲酸(一种很好的自由基的给体)代替4-氯过氧苯甲酸叔丁酯加入到反应体系中, 同样没有检测到类似的产物(Scheme 3).这些结果表明:该反应可能并不属于自由基机理.
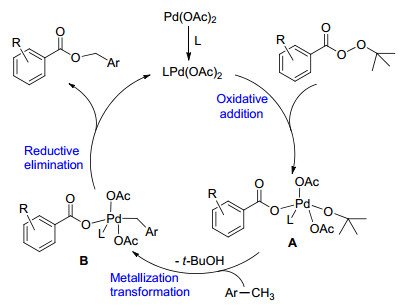
结合文献[19], 我们提出了一种可能的Pd(II)/ Pd(IV)催化循环机理, 如Scheme 4所示.反应初期, 由过氧酯对LPdII(OAc)2氧化加成, 生成中间体A (PdIV), 接着发生转金属化作用实现苄基C(sp3)—H键活化, 生成中间体B (PdIV), 随后中间体B发生还原消除得到预期产物, 并释放出PdII催化剂, 完成催化循环.
2 结论
报道了在钯(II)催化下, 通过苄基的C(sp3)—H键直接功能化合成芳酸苄酯的反应, 反应具有很宽的底物适用范围以及温和的反应条件.通过机理研究提出了一个可能的氧化偶联机理.该方法为相关的芳基衍生物和苄醇衍生物的合成提供了新的思路.
3 实验部分
3.1 仪器与试剂
柱层析使用青海海洋化工厂分厂200~300目硅胶.使用Bruker autoflex TOF/TOF质谱仪测量质谱MicromassI GC-TOF (70 eV).高分辨质谱(ESI)是通过maXis Impact+1290 Infinity质谱仪测定.使用Bruker AM-500型核磁共振仪(500 MHz)测定核磁共振谱, 以氘代氯仿(CDCl3)为溶剂, 1H NMR: 25 ℃, TMS作为内标(CHCl3, δ 7.27); 13C NMR: 25 ℃, CDCl3作为内标(δ 77.0).所有试剂均购于试剂公司, 未经进一步纯化.
3.2 实验方法
3.2.1 过氧芳甲酸叔丁酯1a~1q的制备
以相应的芳醛与过氧化叔丁醇为原料合成, 制备方法与鉴定数据参见文献[20], 具体步骤如下:在25 mL干净的反应管中依次加入Bu4NI (73.6 mg, 0.1 mmol)、2.0 mL H2O、芳醛(0.5 mmol)和TBHP (3.0 equiv., 70%水溶液), 加热至40 ℃反应24 h, 薄层色谱(TLC)监测反应至反应结束, 冷至室温, 反应物用乙酸乙酯萃取三次, 合并有机相, 有机相用无水硫酸钠干燥, 抽滤, 浓缩, 得浅黄色油状物, 硅胶柱分离得所需的过氧酯.
3.2.2 芳酸苄酯3a~3q和4a~4k的合成
在25 mL干燥的Schlenk瓶中依次加入芳基过氧酯1a~1q (1.0 mmol), Pd(OAc)2 (2.8 mg, 0.05 mmol)、i-Pr•HCl (4.9mg, 0.05 mmol), t-BuOK (2.8 mg, 0.05 mol), 含苄基底物2a~2k (1.5 mmol, 3 equiv.)和溶剂PhCF3 (3 mL), 110 ℃回流12 h, TLC跟踪反应至完全, 冷至室温, 除去溶剂得粗产品, 再经柱层析分离[洗脱剂为V(二氯甲烷):V(石油醚)=1:2]得产物, 产率为67%~93%.
4-氯苯甲酸苄酯(3a)[21]:浅黄色油状物, 产率92%. 1H NMR (500 MHz, CDCl3) δ: 8.03 (d, J=8.5 Hz, 2H), 7.46 (d, J=7.2 Hz, 2H), 7.43~7.40 (m, 4H), 7.38~7.35 (m, 1H), 5.38 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.55, 139.48, 135.77, 131.07, 128.71, 128.62, 128.56, 128.35, 128.22, 66.92; MS (70 eV) m/z (%): 246 (100.0, M+), 248 (32), 247 (15), 249.05 (4), 248 (1).
苯甲酸苄酯(3b)[21]:浅黄色油状物, 产率84%. 1H NMR (500 MHz, CDCl3) δ: 8.11 (d, J=7.5 Hz, 2H), 7.57 (t, J=7.5 Hz, 1H), 7.48~7.44 (m, 4H), 7.42~7.40 (m, 2H), 7.37~7.35 (m, 1H), 5.39 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 166.44, 136.06, 133.02, 130.14, 129.70, 128.59, 128.36, 128.23, 128.15, 66.68; MS (70 eV) m/z (%): 212 (100, M+), 213 (15), 214 (1).
4-甲基苯甲酸苄酯(3c)[22]:浅黄色油状物, 产率76%. 1H NMR (500 MHz, CDCl3) δ: 7.97 (d, J=6.6 Hz, 2H), 7.45 (d, J=7.3 Hz, 2H), 7.39 (t, J=7.3 Hz, 2H), 7.35 (m, 1H), 7.24 (d, J=7.3 Hz, 2H), 5.36 (s, 2H), 2.41 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 166.51, 143.70, 136.20, 129.73, 129.08, 128.56, 128.16, 128.10, 127.39, 66.49, 21.65; MS (70 eV) m/z (%): 226 (100, M+), 227 (16), 228 (1).
4-异丙基苯甲酸苄酯(3d):浅黄色油状物, 产率78%. 1H NMR (500 MHz, CDCl3) δ: 8.01 (d, J=8.0 Hz, 2H), 7.44 (d, J=7.0 Hz, 2H), 7.38 (t, J=8.0 Hz, 2H), 7.34 (t, J=7.0 Hz, 1H), 7.29 (d, J=8.0 Hz, 2H), 5.36 (s, 2H), 2.96 (dt, J=13.7, 6.9 Hz, 1H), 1.14~1.40 (m, 6H); 13C NMR (125 MHz, CDCl3) δ: 166.48, 154.48, 136.25, 129.87, 128.55, 128.13, 128.07, 127.74, 126.48, 66.45, 34.25, 23.68; MS (70 eV) m/z (%): 254 (100, M+), 255 (18), 256 (1); HRMS (ESI) calcd for C17H18NaO2 (M+ Na)+ 277.1199, found 277.1197.
2-萘甲酸苄酯(3e)[23]:浅黄色油状物, 产率79%. 1H NMR (500 MHz, CDCl3) δ: 8.97 (d, J=8.5 Hz, 1H), 8.25 (d, J=8.5 Hz, 1H), 8.04 (d, J=8.0 Hz, 1H), 7.90 (d, J=8.0 Hz, 1H), 7.63 (t, J=7.5 Hz, 1H), 7.56~7.49 (m, 4H), 7.43 (t, J=7.5 Hz, 2H), 7.39~7.36 (m, 1H), 5.48 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 167.27, 136.10, 133.84, 133.49, 131.43, 130.37, 128.63, 128.53, 128.25, 127.97, 127.80, 126.21, 125.79, 124.47, 66.78; MS (70 eV) m/z (%): 262 (100, M+), 263 (19), 264 (1).
4-氟苯甲酸苄酯(3f)[21]:浅黄色油状物, 产率82%. 1H NMR (500 MHz, CDCl3) δ: 8.08 (d, J=8.0 Hz, 2H), 7.56 (t, J=7.5 Hz, 1H), 7.45~7.42 (m, 3H), 7.39 (t, J=7.5 Hz, 2H), 7.36~7.33 (m, 1H), 5.37 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 166.07 (d, JC-F=173.8 Hz), 164.75, 135.85, 132.19 (d, JC-F=9.3 Hz), 128.56, 128.26, 128.15, 126.33 (d, JC-F=2.0 Hz), 115.45 (d, JC-F=22.0 Hz), 66.76; MS (70 eV) m/z (%): 230 (100, M+), 231 (15), 232 (1).
4-溴苯甲酸苄酯(3g)[23]:浅黄色油状物, 产率90%. 1H NMR (500 MHz, CDCl3) δ: 7.95 (d, J=8.5 Hz, 2H), 7.59 (d, J=8.0 Hz, 2H), 7.46~7.45 (m, 2H), 7.43~7.40 (m, 2H), 7.38~7.35 (m, 1H), 5.37 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.69, 135.76, 131.72, 131.22, 131.11, 129.03, 128.64, 128.38, 128.24, 128.17, 66.96; MS (70 eV) m/z (%): 290 (100, M+), 291 (97), 291 (15), 293 (14), 292 (1), 294 (1).
2-溴苯甲酸苄酯(3h)[24]:浅黄色油状物, 产率88%. 1H NMR (500 MHz, CDCl3) δ: 7.82 (d, J=7.5 Hz, 1H), 7.66 (d, J=7.5 Hz, 1H), 7.47~7.48 (m, 2H), 7.36 (m, 5H), 5.39 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.87, 135.45, 134.31, 132.56, 132.00, 131.36, 128.55, 128.38, 128.33, 127.09, 121.74, 67.30; MS (70 eV) m/z (%): 290 (100, M+), 291 (97), 291 (15), 293 (14), 292 (1), 294 (1).
2-甲氧基苯甲酸苄酯(3i)[21]:浅黄色油状物, 产率87%. 1H NMR (500 MHz, CDCl3) δ: 7.86 (d, J=7.8 Hz, 1H), 7.50~7.46 (m, 3H), 7.40 (t, J=7.1 Hz, 2H), 7.34 (t, J=7.1 Hz, 1H), 6.99 (d, J=8.2 Hz, 2H), 5.37 (s, 2H), 3.92 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 165.81, 159.29, 136.19, 133.55, 131.66, 128.42, 127.97, 120.03, 111.99, 66.38, 55.87; MS (70 eV) m/z (%): 242 (100, M+), 243 (16), 244 (1).
3-甲氧基苯甲酸苄酯(3j)[21]:浅黄色油状物, 产率90%. 1H NMR (500 MHz, CDCl3) δ: 7.66 (d, J=7.5 Hz, 1H), 7.58 (s, 1H), 7.43 (d, J=7.5 Hz, 2H), 7.34 (t, J=7.5 Hz, 2H), 7.31 (t, J=7.5 Hz, 2H), 7.09~7.07 (m, 1H), 5.34 (s, 2H), 3.80 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 166.23, 159.51, 135.98, 131.38, 129.34, 128.53, 128.17, 128.08, 122.03, 119.41, 114.16, 66.68, 55.35; MS (70 eV) m/z (%): 242 (100, M+), 243 (16), 244 (1).
4-甲氧基苯甲酸苄酯(3k)[21]:浅黄色油状物, 产率93%. 1H NMR (500 MHz, CDCl3) δ: 8.08 (d, J=8.7 Hz, 2H), 7.48 (d, J=7.4 Hz, 2H), 7.41 (t, J=7.4 Hz, 2H), 7.36 (t, J=7.4 Hz, 1H), 6.94 (d, J=8.7 Hz, 2H), 5.37 (s, 2H), 3.86 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 166.05, 163.35, 136.23, 131.63, 128.46, 128.03, 127.99, 122.44, 113.53, 66.26, 55.27; MS (70 eV) m/z (%): 242 (100, M+), 243 (16), 244 (1).
3-三氟甲基苯甲酸苄酯(3l)[21]:浅黄色油状物, 产率87%. 1H NMR (500 MHz, CDCl3) δ: 8.37 (s, 1H), 8.28 (d, J=8.0 Hz, 1H), 7.82 (d, J=8.0 Hz, 1H), 7.58 (t, J=7.5 Hz, 1H), 7.49 (d, J=8.0 Hz, 2H), 7.26~7.56 (m, 3H), 5.43 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.04, 135.54, 132.85, 131.04 (q, JC-F=33.1 Hz), 130.98, 129.46 (d, JC-F=3.6 Hz), 129.01, 128.63, 128.44, 128.31, 128.13, 126.53 (d, JC-F=3.6 Hz), 123.62 (q, JC-F=272.5 Hz), 67.19; MS (70 eV) m/z (%): 280 (100, M+), 281 (16), 282 (1).
4-三氟甲基苯甲酸苄酯(3m)[21]:浅黄色油状物, 产率89%. 1H NMR (500 MHz, CDCl3) δ: 8.21 (d, J=8.0 Hz, 2H), 7.71 (d, J=8.0 Hz, 2H), 7.48 (d, J=7.5 Hz, 2H), 7.43 (t, J=7.5 Hz, 2H), 7.38~7.40 (m, 1H), 5.42 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.10, 135.55, 134.42(q, JC-F=32.7 Hz), 133.32, 130.04, 128.62, 128.42, 128.24, 125.34 (d, JC-F=3.2 Hz), 123.58 (q, JC-F=272.8 Hz), 67.17; MS (70 eV) m/z (%): 280 (100, M+), 281 (16), 282 (1).
2-硝基苯甲酸苄酯(3n)[21]:浅黄色油状物, 产率78%. 1H NMR (500 MHz, CDCl3) δ: 8.09 (d, J=7.5 Hz, 2H), 7.56 (t, J=7.5 Hz, 1H), 7.46~7.44 (m, 3H), 7.42 (d, J=7.5 Hz, 1H), 7.40~7.38 (m, 1H), 7.36~7.33 (m, 1H), 5.37 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.14, 148.12, 134.70, 132.83, 131.73, 129.80, 128.57, 128.54, 128.50, 127.42, 123.83, 68.22; MS (70 eV) m/z (%): 257 (100, M+), 258 (15), 259 (1).
4-硝基苯甲酸苄酯(3o)[21]:浅黄色油状物, 产率80%. 1H NMR (500 MHz, CDCl3) δ: 8.29~8.23 (m, 4H), 7.47~7.45 (m, 2H), 7.43~7.40 (m, 2H), 7.39~7.38 (m, 1H), 5.41 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 164.50, 150.57, 135.48, 135.22, 130.79, 128.71, 128.62, 128.40, 123.51, 67.62; MS (70 eV) m/z (%): 257 (100, M+), 258 (15), 259 (1).
2-呋喃基甲酸苄酯(3p)[25]:浅黄色油状物, 产率80%. 1H NMR (500 MHz, CDCl3) δ: 7.58 (s, 1H), 7.44 (d, J=5.9 Hz, 2H), 7.39~7.34 (m, 3H), 7.21 (s, 1H), 6.50 (s, 1H), 5.35 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 158.49, 146.38, 144.53, 135.57, 128.56, 128.33, 128.30, 118.13, 111.80, 66.47; MS (70 eV) m/z (%): 202 (100, M+), 203 (13).
2-吡啶基甲酸苄酯(3q)[26]:浅黄色油状物, 产率72%. 1H NMR (500 MHz, CDCl3) δ: 8.11 (d, J=7.5 Hz, 2H), 7.57 (t, J=7.5 Hz, 1H), 7.47 (t, J=7.5 Hz, 3H), 7.44~7.40 (m, 2H), 7.39~7.34 (m, 1H), 5.40 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 166.35, 136.02, 132.95, 130.09, 129.64, 128.53, 128.30, 128.17, 128.09, 66.61; MS (70 eV) m/z (%): 213 (100, M+), 214 (14).
4-氯苯甲酸-(2-甲基)苄酯(4a)[27]:浅黄色油状物, 产率90%. 1H NMR (500 MHz, CDCl3) δ: 7.99 (d, J=8.5 Hz, 2H), 7.40~7.40 (m, 3H), 7.28~7.24 (m, 1H), 7.24~7.19 (m, 2H), 5.36 (s, 2H), 2.40 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 165.53, 139.45, 137.06, 133.70, 131.03, 130.43, 129.32, 128.71, 128.65, 128.57, 126.05, 65.42, 18.95; MS (70 eV) m/z (%): 260 (100, M+), 262 (32), 261 (16), 263 (5), 262 (1).
4-氯苯甲酸-(4-甲基)苄酯(4b):浅黄色油状物, 产率91%. 1H NMR (500 MHz, CDCl3) δ: 8.01 (d, J=8.5 Hz, 2H), 7.40 (d, J=8.5 Hz, 2H), 7.35 (d, J=7.5 Hz, 2H), 7.21 (d, J=7.5 Hz, 2H), 5.33 (s, 2H), 2.38 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 165.55, 139.37, 138.19, 132.75, 131.03, 130.93, 129.26, 128.64, 128.38, 66.87, 21.16; MS (70 eV) m/z (%): 260 (100, M+), 262 (32), 261 (16), 263 (5), 262 (1); HRMS (ESI) calcd for C15H13Cl-NaO2 (M+Na)+ 283.0496, found 283.0499.
4-氯苯甲酸-(3, 5-二甲基)苄酯(4c):浅黄色油状物, 产率83%. 1H NMR (500 MHz, CDCl3) δ: 8.04~8.00 (m, 2H), 7.43~7.40 (m, 2H), 7.06 (s, 2H), 7.00 (s, 1H), 5.30 (s, 2H), 2.35 (s, 6H); 13C NMR (125 MHz, CDCl3) δ: 165.56, 139.38, 138.20, 135.60, 131.07, 130.89, 129.99, 128.65, 126.09, 67.01, 21.20; MS (70 eV) m/z (%): 274 (100, M+), 276 (32), 275 (17), 277 (5), 276 (1); HRMS (ESI) calcd for C16H15ClNaO2 (M+Na)+ 297.0653, found 297.0649.
4-氯苯甲酸-(α-甲基)苄酯(4d)[27]:浅黄色油状物, 产率78%. 1H NMR (500 MHz, CDCl3) δ: 8.04 (d, J=8.5 Hz, 2H), 7.47 (d, J=7.5 Hz, 2H), 7.43~7.38 (m, 4H), 7.34~7.32 (m, 1H), 6.17 (q, J=6.5 Hz, 1H), 1.71 (d, J=6.5 Hz, 3H); 13C NMR (125 MHz, CDCl3) δ: 164.77, 141.44, 139.23, 130.93, 128.90, 128.56, 128.50, 127.91, 125.96, 73.15, 22.21; MS (70 eV) m/z (%): 260 (100, M+), 262 (32), 261 (16), 263 (5), 262 (1).
4-氯苯甲酸-(α, α-二甲基)苄酯(4e)[27]:浅黄色油状物, 产率70%. 1H NMR (500 MHz, CDCl3) δ: 7.98 (d, J=8.5 Hz, 2H), 7.44~7.40 (m, 4H), 7.35 (t, J=7.5 Hz, 2H), 7.28~7.25 (m, 1H), 1.92 (s, 6H); 13C NMR (125 MHz, CDCl3) δ: 164.16, 145.48, 139.00, 130.88, 129.89, 128.52, 128.30, 127.08, 124.18, 82.52, 28.62; MS (70 eV) m/z (%): 274 (100, M+), 276 (32), 275 (17), 277 (5), 276 (1).
4-氯苯甲酸-(4-甲氧基)苄酯(4f)[28]:浅黄色油状物, 产率70%. 1H NMR (500 MHz, CDCl3) δ: 8.00 (d, J=8.5 Hz, 2H), 7.39~7.41 (m, 4H), 6.93 (d, J=8.5 Hz, 2H), 5.30 (s, 2H), 3.83 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 165.54, 159.69, 139.30, 130.99, 130.76, 130.08, 128.60, 127.84, 113.95, 66.72, 55.19; MS (70 eV) m/z (%): 276 (100, M+), 278 (32), 277 (16), 279 (5), 278 (1).
4-氯苯甲酸-(2-硝基)苄酯(4g):浅黄色油状物, 产率67%. 1H NMR (500 MHz, CDCl3) δ: 8.09 (d, J=7.5 Hz, 1H), 7.56 (t, J=7.5 Hz, 1H), 7.27~7.54 (m, 3H), 7.40 (d, J=7.5 Hz, 2H), 7.35 (t, J=7.5 Hz, 1H), 5.78 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.11, 139.95, 133.76, 131.98, 131.15, 129.64, 129.10, 128.97, 128.94, 128.02, 125.16, 63.59; MS (70 eV) m/z (%): 291 (100, M+), 293 (32), 292 (15), 294 (4), 293 (1); HRMS (ESI) calcd for C14H10ClNaO4 (M+Na)+ 314.0191, found 314.0195.
4-氯苯甲酸-2-甲基吡啶酯(4h)[29]:浅黄色油状物, 产率91%. 1H NMR (500 MHz, CDCl3) δ: 8.61 (d, J=4.0 Hz, 1H), 8.03 (d, J=8.5 Hz, 2H), 7.72~7.69 (m, 1H), 7.42~7.40 (m, 3H), 7.25~7.22 (m, 1H), 5.46 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.31, 155.65, 149.50, 139.63, 136.80, 131.13, 128.74, 128.24, 122.94, 121.78, 67.35; MS (70 eV) m/z (%): 247 (100, M+), 249 (32), 248 (14), 250 (4).
4-氯苯甲酸-8-甲基喹啉酯(4i)[30]:浅黄色油状物, 产率81%. 1H NMR (500 MHz, CDCl3) δ: 8.97 (dd, J=4.1, 1.5 Hz, 1H), 8.18 (dd, J=8.3, 1.5 Hz, 1H), 8.05 (d, J=8.5 Hz, 2H), 7.85~7.80 (m, 2H), 7.55 (t, J=7.6 Hz, 1H), 7.45 (dd, J=8.3, 4.1 Hz, 1H), 7.41 (d, J=8.5 Hz, 2H), 6.11 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.69, 149.90, 146.11, 139.35, 136.19, 134.16, 131.15, 130.88, 128.85, 128.67, 128.36, 128.13, 126.19, 121.35, 63.44; MS (70 eV) m/z (%): 297 (100, M+), 299 (32), 298 (18), 300 (6%), 299 (1).
4-氯苯甲酸-2-甲基噻吩酯(4j):浅黄色油状物, 产率88%. 1H NMR (500 MHz, CDCl3) δ: 7.99 (d, J=8.5 Hz, 2H), 7.40 (d, J=8.5 Hz, 2H), 7.35 (d, J=5.0 Hz, 1H), 7.18~7.17 (m, 1H), 7.02~7.01 (m, 1H), 5.51 (s, 2H); 13C NMR (125 MHz, CDCl3) δ: 165.39, 139.58, 137.69, 131.12, 128.72, 128.34, 128.01, 126.98, 126.86, 61.22; MS (70 eV) m/z (%): 252 (100, M+), 254 (32), 253 (13), 254 (4), 255 (4), 256 (1); HRMS (ESI) calcd for C12H9Cl-NaO2S (M+Na)+ 274.9904, found 274.9907.
4-氯苯甲酸-(5-甲基)-2-甲基呋喃酯(4k):浅黄色油状物, 产率84%. 1H NMR (500 MHz, CDCl3) δ: 7.99 (d, J=8.4, 2H), 7.39 (d, J=8.4 Hz, 2H), 6.36~6.34 (m, 1H), 5.97~5.95 (m, 1H), 5.24 (s, 2H), 2.31 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 165.38, 153.25, 147.41, 139.40, 131.10, 130.92, 128.60, 112.01, 106.59, 58.90, 13.56; MS (70 eV) m/z (%): 250 (100, M+), 252 (32), 251 (14), 253 (5); HRMS (ESI) calcd for C13H11NaO3 (M+Na)+ 273.0289, found 273.0288.
3.2.3 反应机理研究的控制实验
在25 mL干燥的Schlenk瓶中依次加入1a (0.5 mmol)、Pd(OAc)2 (0.01 mmol), i-Pr•HCl (0.01 mmol), t-BuOK (0.02 mmol), 甲苯(3 mL)和TEMPO (1.0 mmol)或TEMP (1.0 mmol), 110 ℃回流12 h, TLC跟踪反应至完全, 冷至室温, 除去溶剂得粗产品, 再经柱层析分离, 洗脱剂为V(二氯甲烷):(石油醚)=1:2, 可得产物3a产率分别为90%和92%.
在25 mL干燥的Schlenk瓶中依次加入3-氯过氧苯甲酸(1.0 mmol), Pd(OAc)2 (0.05 mmol), i-Pr•HCl (0.05 mmol), t-BuOK (0.10 mmol), 甲苯(3 mL), 110 ℃回流12 h, TLC跟踪反应, 没有发现3a产物.
辅助材料(Supporting Information)反应条件筛选、所有产物的1H NMR和13C NMR谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Lyons, T. W.; Sanford, M. S. Chem. Rev. 2010, 110, 1147. doi: 10.1021/cr900184e
-
[2]
Recent reviews on C-H bond activation and functionalization:
(a) Yuan, Y. -Z. ; Song, S. ; Jiao, N. Acta Chim. Sinica 2015, 73, 1231(in Chinese).
(袁逸之, 宋颂, 焦宁, 化学学报, 2015, 73, 1231. )
(b) Yu, J. -Q. ; Ding, K. -L. Acta Chim. Sinica 2015, 73, 1223(in Chinese).
(余金权, 丁奎岭, 化学学报, 2015, 73, 1223. )
(c) Gang, F. -L. ; Xu, G. -L. ; Dong, T. -S. ; Yang, L. ; Du, Z. -Y. Chin. J. Org. Chem. 2015, 35, 1428(in Chinese).
(刚芳莉, 徐光利, 董涛生, 杨丽, 杜正银, 有机化学, 2015, 35, 1428. )
(d) Liao, G. ; Shi, B. -F. Acta Chim. Sinica 2015, 73, 1283(in Chinese).
(廖港, 史炳锋, 化学学报, 2015, 73, 1283. )
(e) Zhang, J. -R. ; Xu, L. ; Liao, Y. -Y. ; Deng, J. -C. ; Tang, R. -Y. Chin. J. Chem. 2017, 35, 271.
(f) Mkhalid, I. A. I. ; Bamard, J. H. ; Marder, T. B. ; Murphy, J. M. ; Hatwig, J. F. Chem. Rev. 2010, 110, 890.
(g) Sun, C. L. ; Li, B. J. ; Shi, Z. J. Chem. Rev. 2011, 111, 1293.
(h) Chen, X. ; Engle, K. M. ; Wang, D. H. ; Yu, J. Q. Angew. Chem. Int. Ed. 2009, 48, 5094.
(i) Yeung, C. S. ; Dong, V. M. Chem. Rev. 2011, 111, 1215.
(j) Lu, Y. ; Leow, D. ; Wang, X. ; Engle, K. M. ; Yu, J. Q. Chem. Sci. 2011, 2, 967.
(k) Li, B. -J. ; Shi, Z. -J. Chem. Sci. 2011, 2, 488.
(l) Haffemayer, B. ; Gulias, M. ; Gaunt, M. J. Chem. Sci. 2011, 2, 312.
(m) Yeung, C. S. ; Zhao, X. ; Borduas, N. ; Dong, V. M. Chem. Sci. 2010, 1, 331.
(n) Godula, K. ; Sames, D. Science 2006, 312, 67.
(o) Campeau, L. C. ; Fagnou, K. Chem. Commun. 2006, 1253.
(p) Bergman, R. G. Nature 2007, 446, 391.
(q) Alberico, D. ; Scott, M. E. ; Lautens, M. Chem. Rev. 2007, 107, 174.
(r) Ackemann, L. ; Vicente, R. ; Kapdi, A. R. Angew. Chem. , Int. Ed. 2009, 48, 9792.
(s) Giri, R. ; Shi, B. F. ; Engle, K. M. ; Maugel, N. ; Yu, J. Q. Chem. Soc. Rev. 2009, 38, 3242. -
[3]
Recent examples of palladium(Ⅱ)-catalyazed C(sp3)-H activation of methyl and methylene groups:
(a) Gault, B. L. ; Fagnou, K. Organometallics 2008, 27, 4841.
(b) Wasa, M. ; Engle, K. M. ; Yu, J. Q. J. Am. Chem. Soc. 2010, 132, 3680.
(c) Yoo, E. J. ; Wasa, M. ; Yu, J. Q. J. Am. Chem. Soc. 2010, 132, 17378.
(d) Stowers, K. J. ; Fortner, K. C. ; Sanford, M. S. J. Am. Chem. Soc. 2011, 133, 6541.
(e) Novk, P. ; Correa, A. ; Gallardo-Donaire, J. ; Martin, R. Angew. Chem. Int. Ed. 2011, 50, 12236.
(f) Wasa, M. ; Engle, K. M. ; Lin, D. W. ; Yoo, E. J. ; Yu, J. Q. J. Am. Chem. Soc. 2011, 133, 19598.
(g) Ano, Y. ; Yobisu, M. ; Chatani, N. J. Am. Chem. Soc. 2011, 133, 12984.
(h) He, G. ; Chen, G. Angew. Chem. , Int. Ed. 2011, 50, 5192.
(i) Young, A. J. ; White, M. C. Angew. Chem. , Int. Ed. 2011, 50, 6824.
(j) Desai, L. V. ; Hull, K. L. ; Sanford, M. S. J. Am. Chem. Soc. 2004, 126, 9542.
(k) Jazzar, R. ; Htice, J. ; Renaudat, A. ; Sofack-Kreutzer, J. ; Baudoin, O. Chem. Eur. J. 2010, 16, 2654.
(l) Baudoin, O. Chem. Soc. Rev. 2011, 40, 4902.
(m) Chen, X. Engle, K. M. ; Wang, D. H. ; Yu, J. Q. Angew. Chem. Int. Ed. 2009, 48, 5094. -
[4]
Pd(0)-catalyzed C-C bond forming reactions from non-acidic C(sp3)-H bonds:
(a) Htice, J. ; Retailleau, P. ; Baudoin, O. Chem. Eur. J. 2007, 13, 792.
(b) Lafrance, M. ; Gorelsky, S. I. ; Fagnou, K. J. Am. Chem. Soc. 2007, 129, 14570.
(c) Chaumontet, M. ; Piccardi, R. ; Audic, N. ; Hitce, J. ; Peglion, J. L. ; Clot, E. ; Baudoin, O. J. Am. Chem. Soc.2008, 130, 15157.
(d) Wasa, M. ; Engle, K. M. ; Yu, J. Q. J. Am. Chem. Soc. 2009, 131, 9886.
(e) Rousseaux, S. ; Gorelsky, S. I. ; Chung, B. K. W. ; Fagnou, K. J. Am. Chem. Soc. 2010, 132, 10692.
(f) Rousseaux, S. ; Davi, M. ; Sofack-Kreutzer, J. ; Pierre, C. ; Kefalidis, C. E. ; Clot, E. ; Fagnou, K. ; Baudoin, O. J. Am. Chem. Soc. 2010, 132, 10706.
(g) Pierre, C. ; Baudoin, O. Org. Lett. 2011, 13, 1816. -
[5]
Pd-catalyzed arylations of unactivated methylene C-H bonds:
(a) Watanabe, T. ; Oishi, S. ; Fujii, N. ; Ohno, H. Org. Lett. 2008, 10, 1759.
(b) Kim, H. S. ; Gowrisankar, S. ; Kim, S. H. ; Kim, J. N. Tetrahedron Lett. 2008, 49, 3858.
(c) Nakanishi, M. ; Katavev, D. ; Besnard, C. ; Kundig, E. P. Angew. Chem. , Int. Ed. 2011, 50, 7438.
(d) Zaitsev, V. G. ; Shabashov, D. ; Daugulis, O. J. Am. Chem. Soc. 2005, 127, 13154.
(e) Reddy, B. V. S. ; Reddy, L. R. ; Corey, E. J. Org. Lett. 2006, 8, 3391.
(f) Shabashov, D. ; Daugulis, O. J. Am. Chem. Soc. 2010, 132, 3965.
(g) Feng, Y. ; Wang, Y. ; Landgraf, B. ; Liu, S. ; Chen, G. Org. Lett. 2010, 12, 3414.
(h) He, G. ; Chen, G. Angew. Chem. , Int. Ed. 2011, 50, 5192.
(i) Cambeiro, F. ; Lopez, S. ; Varela, J. A. ; Saa, C. Angew. Chem. , Int. Ed. 2012, 51, 723. -
[6]
Li, H.; Li, B.-J.; Shi, Z.-J. Catal. Sci. Technol. 2011, 1, 191. doi: 10.1039/c0cy00076k
-
[7]
(a) Chen, H.; Cai, C.; Liu, X.; Li, X.; Jiang, H. Chem. Commun. 2011, 47, 12224.
(b) Liu, W. B.; Zheng, C.; Zhuo, C. X.; Dai, L. X.; You, S. L. J. Am. Chem. Soc. 2012, 134, 4812.
(c) Li, Q.; Yu, Z. X. Organometallics 2012, 31, 5185. -
[8]
Rakshit, S.; Patureau, F. W.; Glorius, F. J. Am. Chem. Soc. 2010, 132, 9585. doi: 10.1021/ja104305s
-
[9]
(a) Kharasch, M. S.; Fono, A. J. Org. Chem. 1958, 23, 324.
(b) Kharasch, M. S.; Sosnovsky, G.; Yang, N. C. J. Am. Chem. Soc. 1959, 81, 5819.
(c) Andrus, M. B.; Lashley, J. C. Tetrahedron 2002, 58, 845.
(d) Eames, J.; Watkinson, M. Angew. Chem., Int. Ed. 2001, 40, 3567.
(e) Malkov, A. V.; Bella, M.; Langer, V.; Kocovsky, P. Org. Lett. 2000, 2, 3047.
(f) Andrus, M. B.; Zhou, Z. J. Am. Chem. Soc. 2002, 124, 8806.
(g) Rispens, M. T.; Zondercu, C.; Feringa, B. L. Tetrahedron:Asymmetry 1995, 6, 661. -
[10]
(a) Dick, A. R.; Hull, K. L.; Sanford, M. S. J. Am. Chem. Soc. 2004, 126, 2300.
(b) Takahara, S.; Kitamura, A.; Sakuragi, H.; Tokumaru, K. Chem. Lett. 1983, 8, 1315. -
[11]
(a) Li, Z.; Cao, L.; Li, C. J. Angew. Chem., Int. Ed. 2007, 46, 6505.
(b) Pan, S.; Liu, J.; Li, Y.; Li Z. P. Chin. Sci. Bull. 2012, 57, 2382.
(c) Xiong, T.; Li, Y.; Bi, X.; Lv, Y.; Zhang, Q. Angew. Chem., Int. Ed. 2011, 50, 7140. -
[12]
Chen, C.; Xu, X.; Yang, B.; Qing, F. Org. Lett. 2014, 16, 3372. doi: 10.1021/ol501400u
-
[13]
(a) Weaver, J. D.; Recio, A.; Grenning, A. J.; Tunge, J. A. Chem. Rev. 2011, 111, 1846.
(b) Kuwano, R. Synthesis 2009, 1049. -
[14]
(a) Evangelisti, C.; Schiavi, E.; Aronica, L. A.; Caporusso, A. M.; Vitulli, G.; Bertinietti, L.; Martra, G.; Balerna, A.; Mobilo, S. J. Catal. 2012, 286, 224.
(b) Zhang, M. J.; Vedantham, P.; Flynn, D. L.; Hanson, P. R. J. Org. Chem. 2004, 69, 8340. -
[15]
(a) Jovanovic, J.; Hengeveld, W.; Rebrov, E. V.; Nijhuis, T. A.; Hessel, V.; Schouten, J. C. Chem. Eng. Technol. 2011, 34, 1691.
(b) Gathirwa, J. W.; Maki, T. Tetrahedron 2012, 68, 370.
(c) Gok, Y. Alici, B.; Cetinkaya, E.; Ozdemir, I.; Ozeroglu, O.; Turk. J. Chem. 2010, 34, 187. -
[16]
Werner, T.; Barrett, A. G. M. J. Org. Chem. 2006, 71, 4302. doi: 10.1021/jo060562m
-
[17]
(a) Hao, W. Y.; Sha, J. C.; Sheng, S. R.; Cai, M. Z. Catal. Commun. 2008, 10, 257.
(b) Salvadori, J.; Balducci, E.; Zara, S. Petricci, E.; Taddei, M. J. Org. Chem. 2010, 75, 1841.
(c) Ramesh, C.; Nakamura, R.; Kubota, Y.; Miwa, M.; Sugi, Y. Synthesis 2003, 4, 501. -
[18]
苏贤斌, 张奇涵, 武永庆, 许家喜, 有机化学, 2002, 22, 496. doi: 10.3321/j.issn:0253-2786.2002.07.006Su, X.-B.; Zhang, Q.-H.; Wu, Y.-Q.; Xu, J.-X. Chin. J. Org. Chem. 2002, 22, 496(in Chinese). doi: 10.3321/j.issn:0253-2786.2002.07.006
-
[19]
Wu, T.; Mu, X.; Liu, G. Angew. Chem., Int. Ed. 2011, 50, 12578. doi: 10.1002/anie.201104575
-
[20]
Wei, W.; Zhang, C.; Xu, Y.; Wan, X. Chem. Commun. 2011, 47, 10827. doi: 10.1039/c1cc14602e
-
[21]
Liu, H.; Shi, G.; Pan, S.; Jiang, Y.; Zhang, Y. Org. Lett. 2013, 15, 4098. doi: 10.1021/ol401687f
-
[22]
Sather, A. C.; Berryman, O. B.; Ajami, D.; Rebek, Jr. J. Tet-rahedron Lett. 2011, 52, 2100. doi: 10.1016/j.tetlet.2010.11.030
-
[23]
Khan, K. M.; Maharvi, G. M.; Hayat, S.; Zia, U.; Choudhary, M. I.; Rahman, A. Tetrahedron 2003, 59, 5549. doi: 10.1016/S0040-4020(03)00812-3
-
[24]
Shen, H.; Lu, X.; Jiang, K.; Yang, K.; Lu, Y.; Zheng, Z.; Lai, G.; Xu, L. Tetrahedron 2012, 68, 8916. doi: 10.1016/j.tet.2012.08.024
-
[25]
Green, R. A.; Pletcher, D.; Leach, S. G.; Brown, R. C. D. Org. Lett. 2015, 17, 3290. doi: 10.1021/acs.orglett.5b01459
-
[26]
Blaser, H.; Diggelmann, M.; Meier, H.; Naud, F.; Scheppach, E.; Schnyde, A.; Studer, M. J. Org. Chem. 2003, 68, 3725. doi: 10.1021/jo034112v
-
[27]
Majji, G.; Guin, S.; Gogoi, A.; Rout, S. K.; Patel, B. K. Chem. Commun. 2013, 49, 3031. doi: 10.1039/c3cc40832a
-
[28]
Curran, S. P.; Connon, S. J. Angew. Chem., Int. Ed. 2012, 51, 10866. doi: 10.1002/anie.v51.43
-
[29]
Zhang, S.; Luo, F.; Wang, W.; Jia, X.; Hu, M.; Cheng, J. Tetrahedron Lett. 2010, 51, 3317. doi: 10.1016/j.tetlet.2010.04.075
-
[30]
Tatamidani, H.; Yokota, K.; Kakiuchi, F.; Chatani, N. J. Org. Chem. 2004, 69, 5615. doi: 10.1021/jo0492719
-
[1]
-
表 1 反应条件筛选a
Table 1. Optimization of reaction conditions

Entry Catalyst Ligand Temp./℃ Time/h Yieldb/% 1 Pd(OAc)2 — 110 12 70 2 CuBr — 110 12 20 3 Pd(bpy)2Cl2 — 110 12 0 4 Pd(PPh3)4 — 110 12 0 5 Pd(OAc)2 i-Pr"HCl/t-BuOK 110 12 92 6 Pd(OAc)2 Tp*K/t-BuOK 110 12 84 7 Pd(OAc)2 Py/t-BuOK 110 12 0 8 Pd(OAc)2 PPh3/t-BuOK 110 12 0 9 Pd(OAc)2 i-Pr"HCl/t-BuOK 130 12 40 10 — i-Pr"HCl/t-BuOK 110 24 0 11 — — 110 24 0 aReaction conditions: 1a(1.0 mmol), 2a (1.5 mmol), catalyst (0.05 mmol), ligand (0.05 mmol) reacting in 3 mL of PhCF3. bYield detected by 1H NMR. 表 2 芳基过氧叔丁酯的范围a
Table 2. Scope of aromatic perester substrates

表 3 芳烃的范围a
Table 3. Scope of arenes

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 5
- 文章访问数: 1720
- HTML全文浏览量: 203


 下载:
下载:



 下载:
下载:

