 图1
三条[4 Trt+2 Acm]保护的利那洛肽线性前体化合物
Figure1.
Three linear precursors of linaclotide containing [4 Trt+2 Acm] groups
图1
三条[4 Trt+2 Acm]保护的利那洛肽线性前体化合物
Figure1.
Three linear precursors of linaclotide containing [4 Trt+2 Acm] groups

Citation: Ge Weiwei, Chen Jing, Zhang Ye, Zong Liang, Zhang Ming, Dong Junjun. Semiregioselective Formation of Linaclotide with Orthogonal Cysteine Protection Strategy[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2409-2415. doi: 10.6023/cjoc201704020

半选择性氧化形成三对二硫键合成利那洛肽
English
Semiregioselective Formation of Linaclotide with Orthogonal Cysteine Protection Strategy
-
Key words:
- linaclotide
- / disulfide
- / oxidation
- / semiregioselective
-
利那洛肽(linaclotide)是首个鸟苷酸环化酶(GC)激动剂类药物[1], 口服进入人体后通过与肠道中的鸟苷酸环化酶C型受体(GC-C)结合, 使细胞内和细胞外环鸟苷酸(cGMP)浓度升高, 刺激肠液分泌, 加快胃肠道移行, 从而增加排便频率[2, 3]. 2012年, 利那洛肽被美国食品和药物管理局(FDA)批准可以用于治疗成人慢性特发性便秘和便秘型肠易激综合症(IBS-C), 由于其独一无二的作用机制, 很有希望成为一种不但可以治疗便秘, 还可以治疗腹胀、腹痛和其它临床症状的治疗药物.利那洛肽为含有三对二硫键的十四肽, 氨基酸组成为: CCEYCCNPACTGCY, 其肽链中的二硫键连接方式为Cys1-Cys6, Cys2-Cys10, Cys5-Cys13.目前, 对利那洛肽的合成主要以自由氧化法形成三对二硫键为主, 选择性氧化合成利那洛肽的研究很少.
乙酰胺甲基(Acm)和三苯甲基(Trt)是最为常见的两种可以互相正交保护的半胱氨酸保护基, 常用于选择性氧化合成含多对二硫键的多肽[4~6].半胱氨酸上的Trt保护基在用三氟乙酸(TFA)裂解树脂时可以与其它氨基酸的保护基一并脱除, 在此条件下Acm保护基则不受影响, 在下一步反应中可以用I2或重金属盐(Hg2+、Tl3+、Ag+)的方法, 脱去Acm的同时氧化形成二硫键[7~10]. Miriam等[11]在对利那洛肽的合成策略研究中合成了3条[4 Trt+2 Acm]和2条[2 Trt+4 Acm]利那洛肽的线性前体化合物, 先采用TFA脱除Trt, DMSO氧化的方法形成了部分二硫键, 但下一步I2脱除Acm的反应却没有成功, 即使后来作者将氧化条件变为在低温下缓慢滴加I2(以减慢氧化环合的速度), 仍然没有得到目标多肽.文章中, Miriam等还合成了2条[2 Mmt+2 Acm+2 Trt]和2条[2 Acm+2 Trt+2 pMeOBzl]利那洛肽的线性前体化合物, 拟采用选择性氧化的方法形成三对二硫键, 但均没有得到目标多肽, 因此Miriam认为Acm保护的半胱氨酸不适用于利那洛肽的合成.
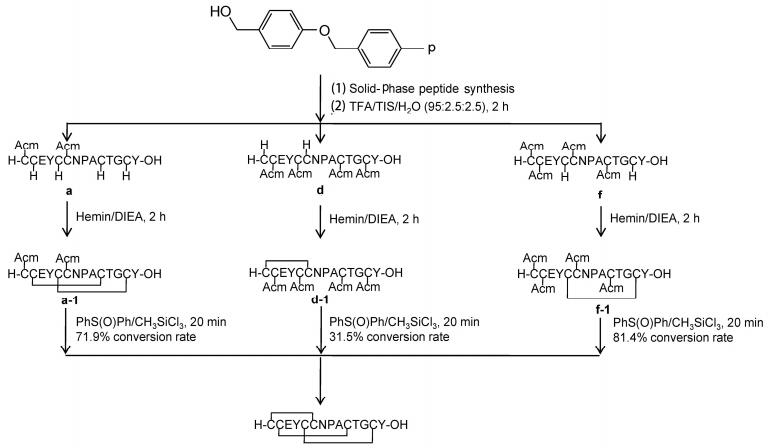
本文利用Fmoc固相合成策略, Wang树脂为载体合成了3条[4 Trt+2 Acm]和3条[2 Trt+4 Acm]利那洛肽的线性前体化合物, 在裂解树脂的同时脱去半胱氨酸上的Trt保护基, 使用氯化血红素催化氧化的方法形成部分二硫键[12].下一步反应, 使用了二苯亚砜[PhS(O)Ph]/三甲基氯硅烷(CH3SiCl3)体系[13], 在TFA中脱除Acm保护基并形成剩余的二硫键.合成的6条线性前体肽中, 有3条可以较高转化率得到利那洛肽, 成功的将Acm保护的半胱氨酸应用于利那洛肽的合成中.通过分析6条线性前体肽中二硫键形成的先后顺序对目标多肽生成的影响, 发现Cys5-Cys13二硫键的形成对利那洛肽的氧化折叠非常关键, 在选择性氧化合成利那洛肽时应当优先形成这对二硫键.
1 结果与讨论
1.1 合成3条利那洛肽前体化合物[4 Trt+2 Acm]
利用Fmoc固相合成策略, Wang树脂为载体, 合成了3条[4 Trt+2 Acm]保护的利那洛肽线性前体化合物(图 1).
 图1
三条[4 Trt+2 Acm]保护的利那洛肽线性前体化合物
Figure1.
Three linear precursors of linaclotide containing [4 Trt+2 Acm] groups
图1
三条[4 Trt+2 Acm]保护的利那洛肽线性前体化合物
Figure1.
Three linear precursors of linaclotide containing [4 Trt+2 Acm] groups
1.1.1 一步氧化形成两对二硫键
将多肽树脂放入反应瓶中裂解, 乙醚沉淀得到粗肽, 粗肽分离纯化后进行质谱检测, a ([M+H]+=1674.8, [M+Na]+=1696.8, [M+K]+=1712.8), b ([M+H]+=1674.9, [M+Na]+=1696.9, [M+K]+=1712.9), c ([M+H]+=1674.7, [M+Na]+=1696.7, [M+K]+=1712.7), 利那洛肽[4 SH+2 Acm]的线性前体肽理论分子量为1673.5, 证明得到的多肽结构为[4 SH+2 Acm].使用氯化血红素催化氧化的方法分别氧化a、b、c, 其中a、b氧化可以得到一个主产物a-1、b-1, 由于c的氧化产物过于复杂(图 2), 没有对其分离及进行下一步反应.分别对a-1、b-1进行分离纯化, 质谱检测a-1 ([M+Na]+=1692.4, [M+K]+=1708.4), b-1 ([M+ H]+=1670.5, [M+Na]+=1692.5, [M+K]+=1708.4), 证明其结构为[2 S-S+2 Acm].
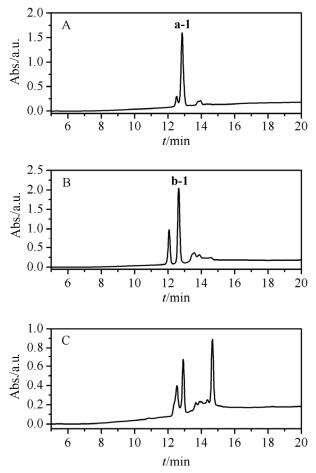 图2
三条[4 Trt+2 Acm]利那洛肽的线性前体肽脱除Trt保护后一步氧化形成两对二硫键HPLC分析
Figure2.
After removing Trt from [4 Trt+2 Acm] linear precursors of three linaclotides were oxidized to form two disulfide bonds (A) a [4 SH(2, 5, 10, 13)+2 Acm(1, 6)], (B) b [4 SH(1, 5, 6, 13)+2 Acm(2, 10)], (C) c [4 SH(1, 2, 5, 10)+2 Acm(5, 13)]
图2
三条[4 Trt+2 Acm]利那洛肽的线性前体肽脱除Trt保护后一步氧化形成两对二硫键HPLC分析
Figure2.
After removing Trt from [4 Trt+2 Acm] linear precursors of three linaclotides were oxidized to form two disulfide bonds (A) a [4 SH(2, 5, 10, 13)+2 Acm(1, 6)], (B) b [4 SH(1, 5, 6, 13)+2 Acm(2, 10)], (C) c [4 SH(1, 2, 5, 10)+2 Acm(5, 13)]
1.1.2 氧化形成第三对二硫键
在下一步脱除Acm保护基形成二硫键的反应中, 我们首先尝试了I2氧化脱除的方法, 但与文献报道一样, 都没有得到目标产物.如前体肽a-1 [2 S-S(2-10, 5-13)+2 Acm(1, 6)], 只含有一对Acm保护基, 理论上脱Acm后HPLC分析应该为一个单峰, 但滴加I2氧化后却生成了三个产物, 且都不是目标多肽.随后我们采用了PhS(O)Ph/CH3SiCl3氧化的方法, 将上面得到的a-1溶于TFA中, 加入过量的CH3SiCl3和PhS(O)Ph搅拌反应20 min, 加入乙醚和4 mol/L的醋酸震荡, 取水相与a-1、利那洛肽标准品共同进样HPLC分析.从色谱图上看, a-1反应完全, 几乎定量得到单一的产物a-2, a-2的色谱行为与标准品一致(图 3).将a-2分离纯化后进行质谱检测, a-2 ([M+H]+=1526.6, [M+Na]+=1548.6, [M+ K]+=1564.6), 利那洛肽的理论分子量为1525.4, 与理论值相符, 可以证明a-2为利那洛肽, 同时也证明了a-1中的两对二硫键连接方式为Cys2-Cys10, Cys5-Cys13.
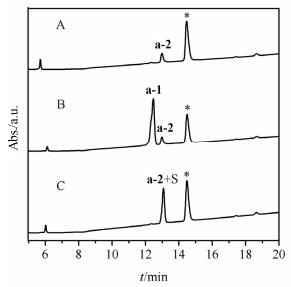 图3
a-1 [2 S-S(2-10, 5-13)+2 Acm(1, 6)]采用PhS(O)Ph/ CH3SiCl3体系氧化后HPLC分析(*为杂质峰)
Figure3.
HPLC analysis of a-1 [2 S-S(2-10, 5-13)+2 Acm(1, 6)] after treatment of (PhS(O)Ph)/(CH3SiCl3) (A) a-1 after treatment of (PhS(O)Ph)/(CH3SiCl3), (B) mixture of A and a-1, (C) mixture of A and standard linaclotide (S). The peak * (retention time at 14.5 min) LCMS observed [M+H]+=247
图3
a-1 [2 S-S(2-10, 5-13)+2 Acm(1, 6)]采用PhS(O)Ph/ CH3SiCl3体系氧化后HPLC分析(*为杂质峰)
Figure3.
HPLC analysis of a-1 [2 S-S(2-10, 5-13)+2 Acm(1, 6)] after treatment of (PhS(O)Ph)/(CH3SiCl3) (A) a-1 after treatment of (PhS(O)Ph)/(CH3SiCl3), (B) mixture of A and a-1, (C) mixture of A and standard linaclotide (S). The peak * (retention time at 14.5 min) LCMS observed [M+H]+=247
在其它条件不变情况下, 将a-1与PhS(O)Ph、CH3SiCl3反应的时间延长至30 min, HPLC分析结果相同, 说明反应没有二硫键重排现象发生[14], PhS(O)Ph/ CH3SiCl3氧化的方法可以用于脱除利那洛肽的线性前体肽中半胱氨酸的Acm保护基, 并氧化形成二硫键.
然而, 在使用相同的方法脱除b-1上半胱氨酸的Acm保护基时, HPLC分析发现b-1与PhS(O)Ph/ CH3SiCl3几乎不反应, 我们在开始尝试用I2脱除b-1中的Acm保护基时也发现存在同样的现象.说明b-1中的两对二硫键形成的特定空间结构, 大大降低了Cys2和Cys10之间相互接触发生反应的几率, 使其不能顺利脱除Acm保护基而形成二硫键.
1.2 合成3条利那洛肽前体化合物[2 Trt+4 Acm]
使用第1.1节中相同的方法合成了3条[2 Trt+4 Acm]保护的利那洛肽线性前体化合物(图 4).
1.2.1 氧化形成第一对二硫键
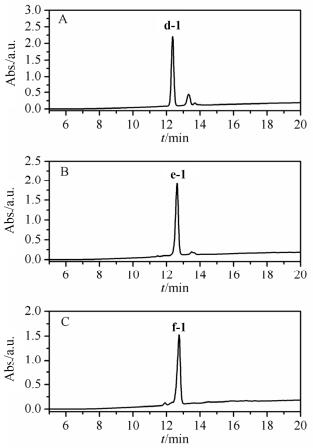
使用第1.1.1节中的相同方法裂解树脂, 得到含自由巯基的利那洛肽线性前体肽d、e、f, 质谱检测d ([M+H]+=1816.9, [M+Na]+=1839.0, [M+K]+=1855.0), e ([M+Na]+=1838.6, [M+K]+=1854.6), f ([M+H]+=1816.7, [M+Na]+=1838.7, [M+K]+=1854.7), 利那洛肽[2 SH+4 Acm]的线性前体肽理论分子量为1815.5, 证明制得的多肽结构为[2 SH+4 Acm].在下一步使用氯化血红素催化氧化形成二硫键时, 由于d、e、f只含有一对自由的巯基, HPLC分析几乎都得到了唯一的产物: d-1、e-1、f-1, 分别将其进行分离纯化进行质谱分析, d-1 ([M+H]+=1813.4, [M+Na]+=1836.6, [M+K]+=1852.5), e-1 ([M+H]+=1814.7, [M+Na]+=1836.6, [M+K]+=1852.6), f-1 ([M+Na]+=1836.7, [M+K]+=1852.7), 证明其结构为[1 S-S+4 Acm].
1.2.2 一步氧化形成剩余两对二硫键
使用(PhS(O)Ph)/(CH3SiCl3)方法一步氧化d-1、e-1、f-1, 加乙醚、醋酸震荡后取水相进行HPLC分析, 发现d-1氧化得到两个主产物d-2、d-3, 色谱峰面积比为57: 43(图 6, A); e-1氧化产物复杂, 没有明显的主产物; f-1氧化得到一个主产物f-2(图 7, A).
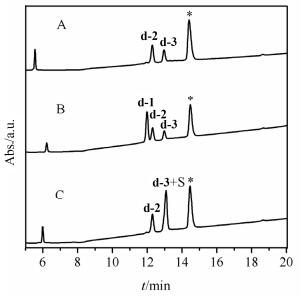 图6
d-1 [1 S-S(1, 6)+4 Acm(2, 5, 10, 13)]采用(PhS(O)Ph)/ (CH3SiCl3)体系氧化后HPLC分析(*为杂质峰)
Figure6.
HPLC analysis of d-1 [2 S-S(1, 6)+4 Acm(2, 5, 10, 13)] after treatment of (PhS(O)Ph)/(CH3SiCl3)(A) d-1 after treatment of (PhS(O)Ph)/(CH3SiCl3), (B) mixture of A and d-1, (C) mixture of A and standard linaclotide(S). The peak* (retention time at 14.5 min) LCMS observed [M+H]+=247
图6
d-1 [1 S-S(1, 6)+4 Acm(2, 5, 10, 13)]采用(PhS(O)Ph)/ (CH3SiCl3)体系氧化后HPLC分析(*为杂质峰)
Figure6.
HPLC analysis of d-1 [2 S-S(1, 6)+4 Acm(2, 5, 10, 13)] after treatment of (PhS(O)Ph)/(CH3SiCl3)(A) d-1 after treatment of (PhS(O)Ph)/(CH3SiCl3), (B) mixture of A and d-1, (C) mixture of A and standard linaclotide(S). The peak* (retention time at 14.5 min) LCMS observed [M+H]+=247
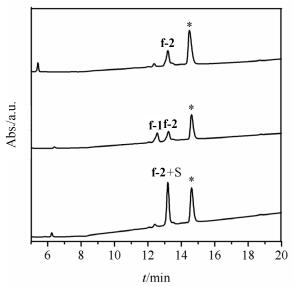 图7
f-1 [1 S-S(5, 13)+4 Acm(1, 2, 6, 10)]采用PhS(O)Ph/ CH3SiCl3体系一步氧化后HPLC分析(*为杂质峰)
Figure7.
HPLC analysis of (A) f-1 [1 S-S(5, 13)+4 Acm (1, 2, 6, 10)] after treatment of (PhS(O)Ph)/(CH3SiCl3) f-1 after treatment of (PhS(O)Ph)/(CH3SiCl3), (B) mixture of A and f-1, (C) mixture of A and standard linaclotide (S). The peak* (retention time at 14.5 min) LCMS observed [M+H]+=247
图7
f-1 [1 S-S(5, 13)+4 Acm(1, 2, 6, 10)]采用PhS(O)Ph/ CH3SiCl3体系一步氧化后HPLC分析(*为杂质峰)
Figure7.
HPLC analysis of (A) f-1 [1 S-S(5, 13)+4 Acm (1, 2, 6, 10)] after treatment of (PhS(O)Ph)/(CH3SiCl3) f-1 after treatment of (PhS(O)Ph)/(CH3SiCl3), (B) mixture of A and f-1, (C) mixture of A and standard linaclotide (S). The peak* (retention time at 14.5 min) LCMS observed [M+H]+=247
将d-1氧化反应的水相与d-1、利那洛肽标准品共进样HPLC分析, 发现d-3的色谱行为与标准品一致(图 6, B、C), 将d-2, d-3分离纯化后进行质谱检测, d-2 ([M+H]+=1526.5, [M+Na]+=1548.6, [M+K]+=1564.5), d-3 ([M+H]+=1526.5, [M+Na]+=1548.5, [M+K]+=1564.4) 都与利那洛肽的理论分子量相符, 证明d-2为利那洛肽的二硫键错配异构体, d-3为利那洛肽.
将f-1氧化反应的水相与f-1、利那洛肽标准品共同进样HPLC分析, 发现f-2的色谱行为与标准品一致(图 7, B、C), 将f-2分离纯化后质谱检测, f-2 ([M+H]+=1526.5, [M+Na]+=1548.5, [M+K]+=1564.5) 与利那洛肽的理论分子量相符, 证明f-2为利那洛肽.
1.3 讨论
从本文的实验结果来看, 二硫键形成的顺序对利那洛肽的氧化折叠结果影响很大, 可以直接决定能否得到目标多肽.合成的6条利那洛肽线性前体肽中, 产率较高两条a [4 Trt(2, 5, 10, 13)+2 Acm(1, 6)]和f [2 Trt(5, 13)+4 Acm(1, 2, 6, 10)]都是先形成的Cys5-Cys13;而最后形成Cys5-Cys13的线性前体肽c [4 Trt(1, 2, 6, 10)+2 Acm(5, 13)]则在第一步氧化反应中就生成了比较复杂的产物, 说明二硫键Cys5-Cys13的形成在利那洛肽氧化折叠过程中非常关键.
Miriam合成了2条利那洛肽的线性前体肽[2 Trt(2, 10)+2 Acm(1, 6)+2pMeOBzl(5, 13)]和[2 Trt(5, 13)+2 Acm(1, 6)+2pMeOBzl(2, 10)]在脱除了半胱氨酸的Trt保护基, 氧化形成第一对二硫键时, 第1条肽可以形成Cys2-Cys10, 而第2条肽无法形成Cys5-Cys13, 因此Miriam认为二硫键Cys5-Cys13对利那洛肽的氧化折叠没有帮助.但本文中合成的利那洛肽线性前体肽d、e、f在氧化形成第一对二硫键时, 均能得到第一对二硫键在不同位置的产物d-1 (Cys1-Cys6)、e-1 (Cys2-Cys10)、f-1 (Cys5-Cys13).产生上述差异的原因, 可能是由于4-甲氧基苄基(pMeOBzl)的空间位阻作用使得Miriam合成的线性前体肽中的Cys5-Cys13难以形成, 因为该报道中, 即使[2 SH(2, 10)+2 Acm(1, 6)+2pMeOBzl(5, 13)]形成了Cys2-Cys10这对二硫键, 也需要DMSO氧化36 h.
此外, Miriam认为利那洛肽中的二硫键Cys1-Cys6非常重要, 在合成时要优先形成.文章中合成的利那洛肽线性前体肽[2 StBu(1, 6)+2 Trt(2, 10)+2pMeO-Bzl(5, 13)]按照先形成Cys1-Cys6, 再形成Cys2-Cys10、Cys5-Cys13的顺序选择性氧化得到了目标多肽(反应同时还生成了几个二硫键错配的异构体).本文中的线性前体肽d也是先形成的Cys1-Cys6, 然后脱除半胱氨酸的Acm保护基并氧化形成剩余两对二硫键得到目标多肽d-3(反应同时也生成一个转化率更高的二硫键错配异构体d-2), 这和Miriam的实验结果是相符的.从本文中线性前体肽a, f(优先形成Cys5-Cys13) 氧化生成目标多肽的数据看, 经过两步氧化后, 线性前体肽a生成目标产物的转化率达到71.9%, 而线性前体肽f生成目标产物的转化率达到81.4%, 大大优于线性前体肽d(优先生成Cys1-Cys6) 的转化率31.5%.因此, 在半选择性氧化及选择性氧化合成利那洛肽时, 二硫键Cys5-Cys13应优先形成.
2 结论
本文运用半选择性氧化策略, Trt和Acm保护的半胱氨酸, 以Wang树脂为载体, 合成了6条不同的利那洛肽线性前体化合物.以此为基础, 对利那洛肽的合成进行研究.首先使用含TFA的裂解剂脱除利那洛肽线性前体肽中半胱氨酸的Trt保护基, 并使用氯化血红素催化氧化的方法形成部分二硫键, 下一步使用PhS(O)Ph/ CH3SiCl3的方法脱除半胱氨酸的Acm保护基并同时氧化形成剩余的二硫键, 成功地将Trt和Acm两种正交保护的半胱氨酸保护基用于利洛那肽合成中.与文献中的反应时间相比, 本文第一步氧化反应需要2 h, 第二步氧化反应需要20 min, 大大缩短了反应时间.
合成的6条线性利那洛肽中, 有3条(a、d、f)可以得到利那洛肽, 转化率分别为71.9%、31.5%、81.4% (Scheme 1).通过比较了二硫键形成顺序对氧化折叠效果的影响, 发现二硫键Cys5-Cys13在利那洛肽氧化折叠过程中非常关键.本文中线性前体肽f先形成了二硫键Cys5-Cys13, 再一步氧化形成剩余的二硫键, 有效降低了在一步氧化过程中的二硫键错配几率, 得到的利那洛肽转化率高于我们在前期研究中使用自由氧化法合成利那洛肽的转化率(75.7%)[15], 可以为利那洛肽的合成提供借鉴.
3 实验部分
3.1 仪器与试剂
Waters 600半制备液相, C18分析柱(3.9 mm×150 mm, 5.0 μm), XB-C18制备柱(21.2 mm×150 mm, 10.0 μm)(美国Waters公司); LP-3型冷冻干燥机(法国JOUAN公司); BIFLEX Ⅲ型MALDI-TOF质谱仪(德国Bruker公司).
利那洛肽标准品(纯度99%), 成都凯捷生物医药科技发展有限公司提供; 氯化血红素(纯度97%), 购自天津生命科学应用研究所; Wang树脂, Fmoc-Cys(Trt), Fmoc-Cys(Acm), Fmoc-Glu(tBu), Fmoc-Tyr(tBu), Fmoc-Asn(Trt), Fmoc-Pro, Fmoc-Ala, Fmoc-Thr(tBu), Fmoc-Gly, 1-羟基苯并三唑(HOBT), 苯并三氮唑-N, N, N', N'-四甲基脲六氟磷酸盐(HBTU), 4-二甲氨基吡啶(DMAP), 成都诚诺新技术有限公司; 三氟乙酸(TFA), 三异丙基硅烷(TIS), 甲基三氯硅烷, 阿拉丁公司; 二苯亚砜, 萨恩化学技术(上海)有限公司; 三羟甲基氨基甲烷(TRIS), SIGMA公司; 乙腈, Fisher Scientiffic公司; N, N-二异丙基乙胺(DIEA), 二氯甲烷(DCM), N, N-二甲基甲酰胺(DMF), 哌啶等其它试剂均为分析纯, 上海国药集团化学试剂有限公司.
3.2 实验方法
3.2.1 多肽的合成
第一个氨基酸与树脂的偶联:称取Wang树脂(1 g, 0.72 mmol/g)于25 mL固相反应器中, 用15 mL DCM溶胀2 h.称取Fmoc-Tyr(tBu) (0.99 g, 2.16 mmol)、HBTU (0.82 g, 2.16 mmol)、HOBT (0.29 g, 2.16 mmol)、催化量的DMAP(仅在树脂与第一个氨基酸偶联时添加)溶于15 mL DMF中, 加入DIEA (1.82 mL, 11.04 mmol)活化后加入固相反应器中, 在室温下摇床震荡反应3 h.加入V(乙酸酐):V(吡啶):V(DMF)=2:1:3 (1×30 min)进行封闭, 依次用DMF, DCM, DMF洗涤树脂4次, 每次1 min.
剩余氨基酸的偶联:按照利那洛肽的氨基酸序列, 重复上述步骤进行偶联和脱Fmoc, 每接完一个氨基酸以后, 用Kasier试剂进行检测, 脯氨酸(Pro)用溴酚兰法检测, 显色反应为阴性则进入下一个偶联循环, 否则重复偶联步骤.
多肽的裂解:完成偶联后, 称取多肽树脂放入反应瓶中, 按照1 g树脂5 mL裂解剂的比例配置裂解液, 在氮气保护下加入TFA-TIS-H2O (V:V:V=95:2.5:2.5), 裂解2 h后抽滤, 加少量TFA和DCM洗涤3次, 合并滤液, 将得到的滤液用氮气吹去3/4体积后, 滴入大量的冰乙醚中析出白色絮状沉淀, 离心得到相应的粗肽.
3.2.2 多肽的纯化及分析
将得到的粗肽溶于少量水, 用Waters 600半制备液相, XB-C18制备柱进行纯化.高效液相条件, 流动相A:水(含体积分数为0.1%的TFA); 流动相B:乙腈(含体积分数为0.1%的TFA); 流动相梯度:流动相B 15%~50%(体积分数), 20 min; 流速为3 mL/min; 检测波长220 nm.收集主峰, 旋转蒸发除去乙腈, 冻干得到多肽纯品.
用Waters 600半制备液相, C18分析柱进行分析.高效液相条件, 流动相A:水(含体积分数为0.1%的TFA); 流动相B:乙腈(含体积分数为0.1%的TFA); 流动相梯度:流动相B 15%~50%(体积分数), 30 min; 流速为1mL/min; 柱温: 40 ℃; 检测波长220 nm.多肽转化率的计算:按照产物的HPLC在220 nm的色谱峰面积进行计算.
3.2.3 二硫键的形成
氯化血红素催化氧化形成二硫键:称取脱除Trt保护基的利那洛肽线性前体肽(3 mg, 2 µmol), 溶于pH=8.0的Tris-HCl的缓冲溶液(5 mL)中, 加入20%(物质的量比)的氯化血红素(含少量DIEA), 室温敞口搅拌2 h, 反应结束用HPLC分析.
PhS(O)Ph/CH3SiCl3脱Acm保护基并形成二硫键:称取多肽(0.6 mg, 0.4 µmol), 溶于TFA (0.4 mL)中, 加入CH3SiCl3 (12 µL, 250 equiv.), PhS(O)Ph (0.8 mg, 10 equiv.), 苯甲醚(4.3 µL, 100 equiv.), 室温敞口搅拌20 min加入干燥乙醚(10 mL), 4 mol/L醋酸(5 mL)震荡, 取水相进行HPLC分析并分离.
辅助材料(Supporting Information) 合成过程中的HPLC分析色谱图及利那洛肽前体肽的质谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Cambridge, M. A. US 7304036, 2007.
-
[2]
Harris, L. A.; Crowell, D. Curr. Opin. Mol. Ther. 2007, 9, 403.
-
[3]
Andresen, V.; Camilleri, M. Drugs Future 2008, 33, 570. doi: 10.1358/dof.2008.033.07.1214164
-
[4]
吴巧玲, 刘珠果, 付超, 林原斌, 戴秋云, 有机化学, 2010, 30, 1517. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339337.shtmlWu Q. L.; Liu Z. G.; Fu C.; Lin Y. B.; Dai Q. Y. Chin. J. Org. Chem. 2010, 30, 1517(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract339337.shtml
-
[5]
Eliasen, R.; Andresen, T. L.; Conde-Frieboes, K. W. Peptides 2012, 34, 144.
-
[6]
Dekan, Z.; Mobli, M.; Pennington, M. W.; Fung, E.; Nemeth, E.; Alewood, P. F. Angew. Chem., Int. Ed. 2014, 53, 1. doi: 10.1002/anie.v53.1
-
[7]
Veber, D. F.; Milkowski, J. D.; Varga, S. L.; Denkewalter, R. G.; Hirschmann, R. J. Am. Chem. Soc. 1972, 94, 5456. doi: 10.1021/ja00770a600
-
[8]
Munson, M. C.; Barany, G. J. Am. Chem. Soc. 1993, 115, 10203. doi: 10.1021/ja00075a040
-
[9]
Kawakami, T.; Aimoto, S. Tetrahedron Lett. 1998, 39, 7901. doi: 10.1016/S0040-4039(98)01752-3
-
[10]
Hunter, M. J.; Komives, E. A. Anal. Biochem. 1995, 228, 173. doi: 10.1006/abio.1995.1333
-
[11]
Miriam, G. B.; Judit, T. P.; Marta, P. B.; Marta, P. B.; Oleg, W.; Matthieu, G.; Fernando, A. Biopolymers 2011, 96, 69. doi: 10.1002/bip.v96.1
-
[12]
葛巍巍, 陈静, 宗良, 李建, 隋少卉, 吴为辉, 张鸣, 董俊军, 高等学校化学学报, 2017, 38, 1052. doi: 10.7503/cjcu20160940Ge, W. W.; Chen, J.; Zong, L.; Li, J.; Sui, S. H.; Wu, W. H.; Zhang, M.; Dong, J. J. Chem. J. Chin. Univ. 2017, 38, 1052(in Chinese). doi: 10.7503/cjcu20160940
-
[13]
Akaji, K.; Tatsumi, T.; Yoshida, M.; Kimura, T.; Fujiwara, Y.; Kiso, Y. J. Am. Chem. Soc. 1992, 114, 4137. doi: 10.1021/ja00037a015
-
[14]
Ildikó, S.; Gitta, S.; Ference, H.; Gábor, M. Biopolymers 2006, 88, 20.
-
[15]
葛巍巍, 陈静, 张也, 宗良, 张鸣, 董俊军, 国际药学研究杂志, 2017, 44, 585. http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htmGe, W. W.; Chen, J.; Zhang, Y.; Zong, L.; Zhang, M.; Dong, J. J. J. Int. Pharm. Res. 2017, 44, 585(in Chinese). http://www.cnki.com.cn/Article/CJFDTOTAL-SYQY201603027.htm
-
[1]
-
图 2 三条[4 Trt+2 Acm]利那洛肽的线性前体肽脱除Trt保护后一步氧化形成两对二硫键HPLC分析
Figure 2 After removing Trt from [4 Trt+2 Acm] linear precursors of three linaclotides were oxidized to form two disulfide bonds (A) a [4 SH(2, 5, 10, 13)+2 Acm(1, 6)], (B) b [4 SH(1, 5, 6, 13)+2 Acm(2, 10)], (C) c [4 SH(1, 2, 5, 10)+2 Acm(5, 13)]
图 3 a-1 [2 S-S(2-10, 5-13)+2 Acm(1, 6)]采用PhS(O)Ph/ CH3SiCl3体系氧化后HPLC分析(*为杂质峰)
Figure 3 HPLC analysis of a-1 [2 S-S(2-10, 5-13)+2 Acm(1, 6)] after treatment of (PhS(O)Ph)/(CH3SiCl3) (A) a-1 after treatment of (PhS(O)Ph)/(CH3SiCl3), (B) mixture of A and a-1, (C) mixture of A and standard linaclotide (S). The peak * (retention time at 14.5 min) LCMS observed [M+H]+=247
图 6 d-1 [1 S-S(1, 6)+4 Acm(2, 5, 10, 13)]采用(PhS(O)Ph)/ (CH3SiCl3)体系氧化后HPLC分析(*为杂质峰)
Figure 6 HPLC analysis of d-1 [2 S-S(1, 6)+4 Acm(2, 5, 10, 13)] after treatment of (PhS(O)Ph)/(CH3SiCl3)(A) d-1 after treatment of (PhS(O)Ph)/(CH3SiCl3), (B) mixture of A and d-1, (C) mixture of A and standard linaclotide(S). The peak* (retention time at 14.5 min) LCMS observed [M+H]+=247
图 7 f-1 [1 S-S(5, 13)+4 Acm(1, 2, 6, 10)]采用PhS(O)Ph/ CH3SiCl3体系一步氧化后HPLC分析(*为杂质峰)
Figure 7 HPLC analysis of (A) f-1 [1 S-S(5, 13)+4 Acm (1, 2, 6, 10)] after treatment of (PhS(O)Ph)/(CH3SiCl3) f-1 after treatment of (PhS(O)Ph)/(CH3SiCl3), (B) mixture of A and f-1, (C) mixture of A and standard linaclotide (S). The peak* (retention time at 14.5 min) LCMS observed [M+H]+=247
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 53
- 文章访问数: 4542
- HTML全文浏览量: 1859

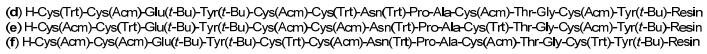

 下载:
下载:







 下载:
下载:

