 图 1
已报道的1-苯甲基-3-苯基吡唑类化合物
Figure 1.
Reported 1-benzyl-3-phenyl pyrazole derivatives
图 1
已报道的1-苯甲基-3-苯基吡唑类化合物
Figure 1.
Reported 1-benzyl-3-phenyl pyrazole derivatives

Citation: Zhang Lei, Li Wenyun, Liu Lai, Zheng Chengyue, Wang Yang, Xu Yingshu, Shi Dabin, Nie Xuqiang, Guo Jiaying, Zhu Chunyuan, Wang Jing. Synthesis of Novel Pyrazole Derivatives Containing Isatins as Potential Apoptosis Inducer in Non-small Lung Cancer A549 Cells[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1721-1729. doi: 10.6023/cjoc201704006

具有靛红结构的吡唑衍生物的合成及其诱导非小细胞肺癌A549细胞凋亡的研究
English
Synthesis of Novel Pyrazole Derivatives Containing Isatins as Potential Apoptosis Inducer in Non-small Lung Cancer A549 Cells
-
Key words:
- pyrazole
- / isatin
- / antineoplastic activity
- / cell apoptosis
- / mitochondrial membrane potential
-
肺癌是一种常见的恶性肿瘤, 对人类健康造成了严重的危害, 全世界每年大约有160万人死于肺癌[1]. 2015年, 中国癌症统计数据显示, 肺癌在我国癌症中发病率最高, 也是癌症死因之首[2].肺癌主要分为两类:非小细胞肺癌(Non-small Cell Lung Cancer, NSCLC)和小细胞肺癌(Small Cell Lung Cancer, SCLC).其中, 非小细胞肺癌约占80%, 它是一种对化疗和放射治疗都不敏感的亚型.尽管已经有一些针对NSCLC的化学药物上市, 但NSCLC患者的治愈率仍然很低[3].因此, 人们迫切需要发现能够有效治疗NSCLC的药物.
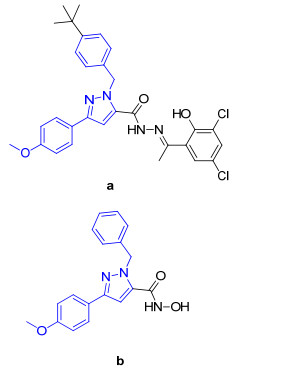
吡唑是一种具有潜在生物活性的氮杂环, 近年来的研究表明吡唑衍生物具有多种药理活性, 如抗肿瘤[4]、抗菌[5]和抗炎[6]等; 此外, 吡唑衍生物还能够作为杀虫剂[7]和除草剂[8].目前, 含有吡唑结构的药物有非甾体抗炎药塞来西布[9]、杀菌剂唑菌胺酯[10]以及抗肿瘤药阿西替尼[11]等.近年来, 赵宝祥课题组[12~15]构建了多种结构类型的1-苯甲基-3-苯基吡唑类化合物库, 如酰肼、希夫碱、糖缀合物和羟肟酸衍生物.实验结果显示, 部分1-苯甲基-3-苯基吡唑衍生物具有显著的抗非小细胞肺癌A549细胞增殖的活性.如图 1所示, 化合物a和b对A549细胞的IC50值分别为2.08和6.77 μmol/L.同时, Bertoša等[16]的研究结果表明, 1-苯甲基-3-苯基吡唑衍生物能够有效抑制A549细胞的增殖.本课题组[17~19]前期合成了一系列1-苯甲基-3-苯基吡唑衍生物, 体外细胞毒测试结果表明, 部分化合物对HepG2细胞具有潜在的抗增殖活性.
此外, 吲哚也是一种常见的氮杂环结构, 存在于众多天然活性产物、内源性物质和药物结构中, 被誉为“成药性”优势骨架[20].其中, 靛红又称吲哚醌, 是吲哚的二酮形式, 其结构被广泛应用于抗肿瘤药物研究领域, 是具有抗肿瘤活性的药效团[21, 22].例如, 靛红片段存在于中药青黛抗肿瘤有效成分靛玉红[23]和小分子多靶点受体酪氨酸激酶抑制剂舒尼替尼[24]结构中.本课题组[25]研究发现, 靛红基团能够有效增强天然产物鬼臼毒素的抗肿瘤细胞耐药性.近年来的研究还表明[26~28], 靛红衍生物对A549细胞也有一定的抗增殖活性.如图 2所示, 化合物c和d对A549的IC50值分别为9.6和27.6 μmol/L.
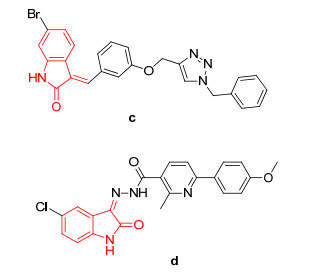
基于1-苯甲基-3-苯基吡唑和靛红结构均有一定的抗A549细胞增殖活性, 为了寻找具有潜在抗非小细胞肺癌的先导化合物, 本工作利用药效团拼合原理[29, 30], 将1-苯甲基-3-苯基吡唑和靛红药效团进行缀合, 设计并合成了两种结构类型的含有靛红结构的吡唑衍生物(图 3), 同时采用CCK-8法测试目标分子对A549细胞的抑制活性, 并对其作用机制进行了初步的探索.合成路线见Schemes 1和2.
1 结果与讨论
1.1 目标化合物的合成
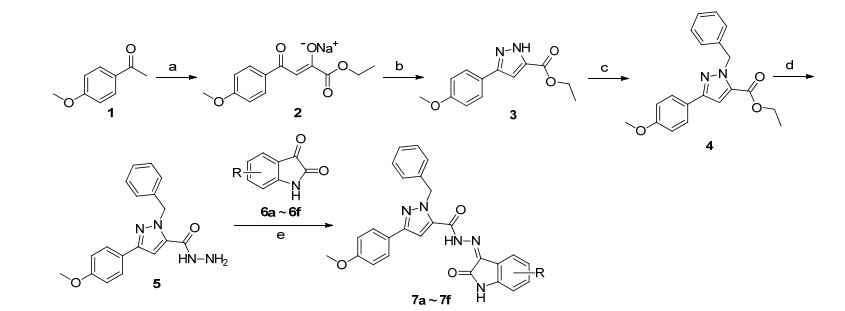
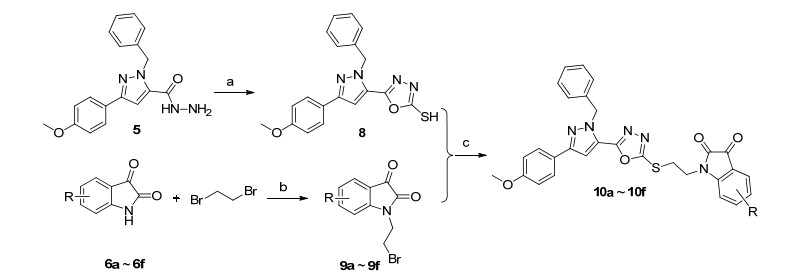
首先以4-甲氧基苯乙酮(1)为原料, 在乙醇/乙醇钠体系中与草酸二乙酯反应, 制备中间体2; 2与水合肼环合得到3-(4-甲氧基苯基)-吡唑-5-羧酸乙酯(3); 3与溴苄进行取代反应得到中间体4; 4与水合肼反应制得酰肼中间体5; 5与(取代)靛红缩合制备得到席夫碱目标产物7a~7f (Scheme 1).其次, 中间体5与二硫化碳反应制得中间体8; (取代)靛红6a~6f与1, 2-二溴乙烷进行取代反应, 制得(取代)靛红溴代物中间体9a~9f; 以碳酸钾为缚酸剂, 8和9a~9f反应得到噁二唑目标产物10a~10f, 合成路线如Scheme 2所示.所有目标产物的结构均经1H NMR, 13C NMR和HRMS确证.
1.2 目标化合物的体外抗肿瘤活性
采用CCK-8法测试目标产物对A549细胞的抑制活性, 顺铂(DDP)作为阳性药, 实验结果如表 1所示.作用72 h后, 大部分目标化合物没有显示出显著的抗A549细胞增殖的活性, 只有部分化合物具有一定的抗肿瘤活性, 例如化合物7e, 7f和10f, 其IC50值分别为30.41, 29.69和58.48 μmol/L, 但均弱于阳性药顺铂(IC50=8.18 μmol/L).
 表 1
目标化合物对A549细胞的体外抗增殖活性
Table 1.
Antiproliferative activity of target compounds against A549 cells in vitro
表 1
目标化合物对A549细胞的体外抗增殖活性
Table 1.
Antiproliferative activity of target compounds against A549 cells in vitro
Compd. R IC50/(μmol•L-1) 7a H >100 7b 4-Cl >100 7c 4-Br >100 7d 5-Cl >100 7e 6-Cl 30.41 7f 6-Br 29.69 10a H >100 10b 4-Cl >100 10c 4-Br >100 10d 5-Cl >100 10e 6-Cl >100 10f 6-Br 58.48 DDP — 8.18 初步构效关系显示, 目标产物的靛红结构片段中, 4位、5位卤素取代(氯代、溴代)对化合物抗肿瘤活性没有影响, 而6位卤素取代则有利于提高化合物的抗肿瘤活性, 如6-氯衍生物7e、6-溴衍生物7f和10f.
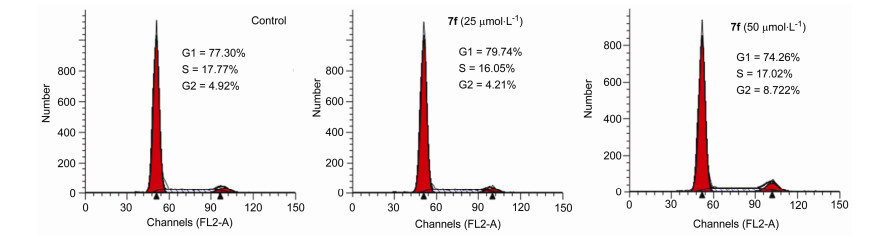
1.3 化合物7f对A549细胞周期的影响
细胞周期与肿瘤的发生发展有着密切的联系, 细胞周期也是抗肿瘤药物重要的作用靶点.为了探索化合物7f的抗肿瘤作用是否与细胞周期相关, 我们采用PI单染法检测化合物7f对A549细胞周期的影响. A549细胞与7f (25和50 μmol/L)共同孵化48 h后经流式细胞术检测, 结果如图 4所示, A549细胞周期分布未发生显著变化, 表明7f并非通过影响肿瘤细胞周期而发挥抗肿瘤作用, 可能与其它分子机制有关.
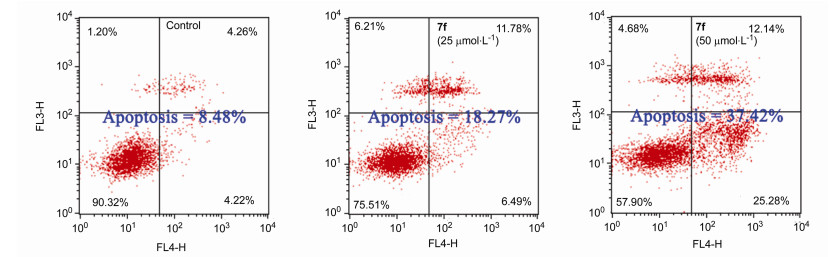
1.4 化合物7f对A549细胞凋亡的影响
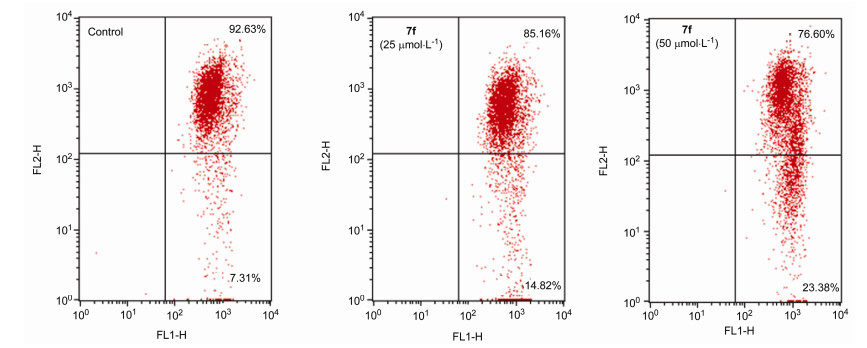
凋亡是一种重要的细胞死亡方式, 大多数抗肿瘤通过诱导细胞凋亡的方式发挥抗肿瘤作用.为了研究化合物7f是否通过诱导肿瘤细胞凋亡的机制而产生抗肿瘤活性, 我们采用Annexin-V FITC/PI双染法对7f诱导A549细胞凋亡情况进行了检测. A549细胞与7f (25和50 μmol/L)共同孵化48 h后经流式细胞术检测, 结果如图 5所示, A549细胞的凋亡率分别为18.27%和37.42%, 而空白对照组的细胞凋亡率为8.48%.上述结果表明, 化合物7f能够有效诱导A549细胞的凋亡, 并且, 7f的浓度越大, 诱导A549细胞的凋亡率越高.
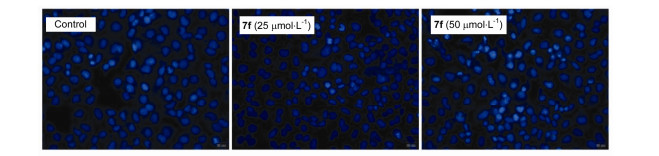
此外, 我们还采用Hoechst 33342染色法进一步确证7f对A549细胞的凋亡诱导活性.如图 6所示, A549细胞与7f (50 μmol/L)共同孵化24 h后, 细胞形态发生显著变化, 如皱缩、染色质固缩和裂解.此外, 凋亡细胞还出现亮蓝色荧光.而7f 在25 μmol/L浓度下的凋亡诱导效应不明显, 这与流式细胞术的检测结果一致, 在该浓度下, 7f诱导A549细胞的凋亡率较低.该结果进一步证明了化合物7f能够诱导A549细胞凋亡.
1.5 化合物7f对A549细胞线粒体膜电位的影响
细胞凋亡过程中往往发生线粒体跨膜电位(Mito-chondrial Membrane Potential, MMP)的下降, 这也是细胞凋亡的标志性事件之一[31].因此, 我们进一步研究化合物7f对A549细胞线粒体膜电位的影响. A549细胞与7f (25和50 μmol/L)共同孵化48 h后, JC-1作为荧光探针, 线粒体膜电位用流式细胞术进行检测.实验结果如图 7所示, 随着7f浓度的增加, A549细胞的线粒体跨膜电位显著降低, 表明化合物7f能够通过线粒体途径诱导A549细胞凋亡.
2 结论
基于药效团拼合原理, 设计并合成了两个系列, 共12个结构新颖的含有靛红片段的吡唑衍生物.体外抗肿瘤活性结果显示, 部分目标产物对非小细胞肺癌A549细胞具有一定的抗增殖活性, 其中化合物7f的活性最强, IC50值为29.69 μmol/L.初步的机制研究表明, 7f能够通过线粒体途径诱导A549细胞凋亡, 但其对细胞周期没有影响.
3 实验部分
3.1 仪器与试剂
熔点用SGWX-4显微熔点仪测定, 质谱仪为Agilent Accurate-Mass-Q-TOF-MS 6520型(HR-MS), 核磁共振仪为Agilent-NMR-vnmrs 400型(DMSO-d6或CDCl3为溶剂, TMS为内标).硅胶和薄层层析板购自青岛海洋化工厂, 所用试剂均为市售分析纯.
3.2 实验方法
中间体5的合成参照文献[12], 中间体8的合成参照文献[17].
3.2.1 N'-(3-亚氨基-(取代)吲哚-2-酮)-1-苯甲基-3-(4-甲氧基苯基)-1H-吡唑-5-甲酰肼(7a~7f)的合成
将0.31 mmol中间体5和0.31 mmol的(取代)靛红6a~6f加入到25 mL的圆底烧瓶中, 加入5 mL乙醇和1滴浓硫酸, N2保护下回流反应4~5 h.薄层色谱(TLC)监测反应完全后, 冷却, 抽滤, 滤饼用冰乙醇洗涤3次, 真空干燥, 得到目标产物7a~7f.
N'-(3-亚氨基-吲哚-2-酮)-1-苯甲基-3-(4-甲氧基苯基)-1H-吡唑-5-甲酰肼(7a):黄色固体, 产率89%. m.p. 297~299 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 13.77 (s, 1H), 11.38 (s, 1H), 7.78 (d, J=7.2 Hz, 2H), 7.58 (d, J=6.8 Hz, 1H), 7.39~7.21 (m, 7H), 7.10 (t, J=6.4 Hz, 1H), 7.01 (d, J=7.2 Hz, 2H), 6.96 (d, J=7.6 Hz, 1H), 5.78 (s, 2H), 3.78 (s, 3H); 13C NMR (DMSO-d6, 100 MHz) δ: 163.34, 159.83, 150.07, 143.08, 137.83, 132.53, 128.98, 128.00, 127.74, 127.15, 124.84, 123.28, 121.55, 120.02, 114.71, 111.76, 55.61, 54.67; HRMS calcd for C26H22N5O3[M+H]+ 452.1717, found 452.1720.
N'-(3-亚氨基-4-氯吲哚-2-酮)-1-苯甲基-3-(4-甲氧基苯基)-1H-吡唑-5-甲酰肼(7b):黄色固体, 产率93%. m.p. 281~283 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 13.96 (s, 1H), 11.59 (s, 1H), 7.75 (d, J=6.8 Hz, 2H), 7.38~7.24 (m, 6H), 7.14 (d, J=8.0 Hz, 1H), 7.01 (d, J=8.0 Hz, 2H), 6.92 (d, J=7.2 Hz, 1H), 5.79 (s, 2H), 3.77 (s, 3H); 13C NMR (DMSO-d6, 100 MHz) δ: 162.82, 159.80, 144.35, 137.93, 133.22, 128.96, 127.94, 127.66, 126.98, 124.92, 124.27, 117.01, 114.74, 110.46, 55.62, 54.85; HRMS calcd for C26H21ClN5O3 [M+H]+ 486.1327, found 486.1331.
N'-(3-亚氨基-4-溴吲哚-2-酮)-1-苯甲基-3-(4-甲氧基苯基)-1H-吡唑-5-甲酰肼(7c):黄色固体, 产率95%. m.p. 272~274 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 13.96 (s, 1H), 11.57 (s, 1H), 7.76 (d, J=7.6 Hz, 2H), 7.32~7.24 (m, 8H), 7.00 (d, J=8.4 Hz, 2H), 6.95 (s, 1H), 5.78 (s, 2H), 3.77 (s, 3H); 13C NMR (DMSO-d6, 100 MHz) δ: 162.87, 159.80, 144.54, 137.94, 133.24, 128.96, 127.94, 127.65, 127.47, 127.02, 124.92, 118.68, 114.73, 110.88, 55.62, 54.81; HRMS calcd for C26H21BrN5O3 [M+H]+ 530.0822, found 530.0824.
N'-(3-亚氨基-5-氯吲哚-2-酮)-1-苯甲基-3-(4-甲氧基苯基)-1H-吡唑-5-甲酰肼(7d):黄色固体, 产率92%. m.p. 310~312 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 13.70 (s, 1H), 11.49 (s, 1H), 7.79 (d, J=7.6 Hz, 2H), 7.56 (s, 1H), 7.45 (d, J=7.6 Hz, 1H), 7.32 (d, J=6.0 Hz, 2H), 7.25 (d, J=7.6 Hz, 4H), 6.99 (t, J=9.2 Hz, 3H), 5.78 (s, 2H), 3.78 (s, 3H); 13C NMR (DMSO-d6, 100 MHz) δ: 163.16, 159.85, 150.10, 141.76, 137.79, 131.90, 128.98, 128.01, 127.74, 127.37, 127.17, 124.79, 121.77, 121.07, 114.71, 113.31, 55.63, 54.73; HRMS calcd for C26H21Cl-N5O3 [M+H]+ 486.1327, found 486.1328.
N'-(3-亚氨基-6-氯吲哚-2-酮)-1-苯甲基-3-(4-甲氧基苯基)-1H-吡唑-5-甲酰肼(7e):黄色固体, 产率88%. m.p. 278~279 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 13.65 (s, 1H), 11.53 (s, 1H), 7.78 (s, 2H), 7.58 (s, 1H), 7.31~7.00 (m, 10H), 5.78 (s, 2H), 3.78 (s, 3H); 13C NMR (DMSO-d6, 100 MHz) δ: 163.34, 159.85, 150.10, 144.25, 137.80, 136.54, 128.98, 128.01, 127.73, 127.17, 124.80, 123.18, 122.96, 114.72, 111.82, 55.63, 54.71; HRMS calcd for C26H20ClN5NaO3 [M+Na]+ 508.1147, found 508.1146.
N'-(3-亚氨基-6-溴吲哚-2-酮)-1-苯甲基-3-(4-甲氧基苯基)-1H-吡唑-5-甲酰肼(7f):黄色固体, 产率97%. m.p. 274~275 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 13.65 (s, 1H), 11.51 (s, 1H), 7.78 (d, J=7.6 Hz, 2H), 7.51 (d, J=7.2 Hz, 1H), 7.30~7.22 (m, 7H), 7.12 (s, 1H), 7.01 (d, J=7.6 Hz, 2H), 5.78 (s, 2H), 3.78 (s, 3H); 13C NMR (DMSO-d6, 100 MHz) δ: 163.21, 159.85, 150.10, 144.29, 137.79, 128.98, 128.01, 127.72, 127.17, 126.05, 125.16, 123.13, 119.34, 114.72, 114.56, 55.63, 54.69; HRMS calcd for C26H21BrN5O3 [M+H]+ 530.0822, found 530.0821.
3.2.2 N1-(2-溴乙基)-(取代)吲哚-2-酮(9a~9f)的合成
将0.68 mmol (取代)靛红6a~6f加入到25 mL的圆底烧瓶中, 再加入4 mL N, N-二甲基甲酰胺(DMF)溶解, 冰水浴冷却至0 ℃, 分批加入1.36 mmol氢化钠, 0 ℃下搅拌反应15 min后再加入6.8 mmol 1, 2-二溴乙烷, 室温反应2~3 h. TLC监测反应完全后, 加入30 mL饱和氯化铵溶液淬灭反应, 二氯甲烷萃取3次, 水洗2次, 饱和氯化钠溶液洗涤1次, 无水硫酸钠干燥, 过滤, 减压除去有机溶剂, 得到粗品, 再经200~300目硅胶柱层析[洗脱剂:二氯甲烷/甲醇(V:V=200:1)]纯化得到中间体9a~9f.
N1-(2-溴乙基)-吲哚-2-酮(9a):红色固体, 产率76%. m.p. 128~129 ℃(文献值[32]: 122~125 ℃); 1H NMR (CDCl3, 400 MHz) δ: 7.61 (t, J=8.0 Hz, 2H), 7.14 (t, J=7.6 Hz, 1H), 7.01 (d, J=8.0 Hz, 1H), 4.15 (t, J=6.8 Hz, 2H), 3.61 (t, J=6.8 Hz, 2H); 13C NMR (CDCl3, 100 MHz) δ: 182.64, 158.18, 150.42, 138.41, 125.68, 124.05, 117.59, 110.22, 41.93, 27.10.
N1-(2-溴乙基)-4-氯吲哚-2-酮(9b):黄色固体, 产率62%. m.p. 167~169 ℃(文献值[32]: 145~149 ℃); 1H NMR (CDCl3, 400 MHz) δ: 7.52 (t, J=8.0 Hz, 1H), 7.09 (d, J=8.4 Hz, 1H), 6.93 (d, J=8.0 Hz, 1H), 4.15 (s, 2H), 3.61 (s, 2H); 13C NMR (CDCl3, 100 MHz) δ: 179.51, 157.29, 151.52, 138.51, 134.21, 125.60, 114.70, 108.54, 42.13, 27.08.
N1-(2-溴乙基)-4-溴吲哚-2-酮(9c):黄色固体, 产率70%. m.p. 177~179 ℃(文献值[32]: 190~193 ℃); 1H NMR (CDCl3, 400 MHz) δ: 7.43 (t, J=8.0 Hz, 1H), 7.29 (d, J=8.0 Hz, 1H), 6.97 (d, J=8.0 Hz, 1H), 4.16 (t, J=6.0 Hz, 2H), 3.61 (t, J=6.4 Hz, 2H); 13C NMR (CDCl3, 100 MHz) δ: 157.23, 151.97, 138.31, 128.78, 122.07, 108.99, 42.03, 27.00.
N1-(2-溴乙基)-5-氯吲哚-2-酮(9d):红色固体, 产率65%. m.p. 111~113 ℃(文献值[32]: 116~118 ℃); 1H NMR (CDCl3, 400 MHz) δ: 7.59 (d, J=8.8 Hz, 2H), 6.99 (d, J=8.0 Hz, 1H), 4.15 (t, J=6.4 Hz, 2H), 3.61 (t, J=6.4 Hz, 2H); 13C NMR (CDCl3, 100 MHz) δ: 181.66, 157.66, 148.79, 137.75, 129.89, 125.53, 118.39, 111.65, 42.17, 27.20.
N1-(2-溴乙基)-6-氯吲哚-2-酮(9e):黄色固体, 产率75%. m.p. 106~108 ℃(文献值[32]: 132~135 ℃); 1H NMR (CDCl3, 400 MHz) δ: 7.58 (t, J=7.6 Hz, 1H), 7.14 (d, J=7.6 Hz, 1H), 7.02 (s, 1H), 4.13 (t, J=6.4 Hz, 2H), 3.62 (t, J=6.4 Hz, 2H); 13C NMR (CDCl3, 100 MHz) δ: 181.12, 158.15, 151.46, 144.91, 126.70, 124.31, 115.89, 111.13, 42.19 27.07.
N1-(2-溴乙基)-6-溴吲哚-2-酮(9f):黄色固体, 产率58%. m.p. 165~166 ℃(文献值[32]: 155~158 ℃); 1H NMR (CDCl3, 400 MHz) δ: 7.49 (d, J=8.0 HZ, 1H), 7.31 (d, J=8.0 Hz, 1H), 7.19 (s, 1H), 4.13 (t, J=6.4 Hz, 2H), 3.61 (t, J=6.4 Hz, 2H); 13C NMR (CDCl3, 100 MHz) δ: 181.39, 158.02, 151.23, 133.70, 127.31, 126.60, 116.26, 113.96, 42.16, 27.07.
3.2.3 2-(1-N'-(取代)吲哚-2, 3-二酮)-乙基-2-硫基)-5-(1-苯甲-3-(4-甲氧基苯基)吡唑-5-基)-1, 3, 4-噁二唑(10a~10f)的合成
将0.27 mmol中间体8, 0.30 mmol N1-(2-溴乙基)-(取代)吲哚-2-酮9、0.41 mmol碳酸钾和催化量的碘化钾加入到10 mL的圆底烧瓶中, 加入4 mL DMF, 80 ℃下搅拌反应1~2 h. TLC检测反应完全后, 将反应液倾入80 mL水中, 抽滤, 固体水洗3次, 真空干燥, 再经200~300目硅胶柱层析(洗脱剂:二氯甲烷/石油醚, V:V=4:1) 纯化得到目标产物10a~10f.
2-(1-N'-吲哚-2, 3-二酮)-乙基-2-硫基)-5-(1-苯甲-3-(4-甲氧基苯基)吡唑-5-基)-1, 3, 4-噁二唑(10a):黄色固体, 产率79%. m.p. 96~98 ℃; 1H NMR (CDCl3, 400 MHz) δ: 7.79 (d, J=8.4 Hz, 2H), 7.61~7.59 (m, 2H), 7.36~7.23 (m, 6H), 7.12 (t, J=7.6 Hz, 1H), 7.07 (s, 1H), 6.97 (d, J=8.8 Hz, 2H), 5.92 (s, 2H), 4.25 (t, J=7.2 Hz, 2H), 3.85 (s, 3H), 3.54 (t, J=7.2 Hz, 2H); 13C NMR (CDCl3, 100 MHz) δ: 182.74, 163.44, 159.82, 158.64, 158.30, 151.50, 150.35, 138.81, 136.55, 128.57, 127.81, 127.64, 127.38, 126.99, 125.61, 124.86, 124.09, 117.52, 114.15, 110.56, 105.61, 55.34, 55.09, 39.13, 29.00; HRMS calcd for C29H23N5NaO4S [M+Na]+ 560.1363, found 560.1368.
2-(1-N'-4-氯吲哚-2, 3-二酮)-乙基-2-硫基)-5-(1-苯甲-3-(4-甲氧基苯基)吡唑-5-基)-1, 3, 4-噁二唑(10b):橙黄色固体, 产率68%. m.p. 200~202 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 7.81 (d, J=8.4 Hz, 2H), 7.61 (t, J=8.0 Hz, 1H), 7.42 (s, 1H), 7.32 (d, J=7.2 Hz, 2H), 7.25 (t, J=8.8 Hz, 4H), 7.09 (d, J=8.0 Hz, 1H), 6.99 (d, J=8.4 Hz, 2H), 5.81 (s, 2H), 4.13 (s, 2H), 3.77 (s, 3H), 3.55 (s, 2H); 13C NMR (DMSO-d6, 100 MHz) δ: 180.26, 164.12, 159.83, 158.23, 157.95, 152.07, 151.13, 139.10, 137.37, 131.54, 129.02, 128.08, 127.66, 127.13, 124.82, 124.66, 114.93, 114.64, 110.04, 105.98, 55.62, 54.71, 29.89; HRMS calcd for C29H22ClN5NaO4S [M+Na]+ 594.0973, found 594.0972.
2-(1-N'-4-溴吲哚-2, 3-二酮)-乙基-2-硫基)-5-(1-苯甲-3-(4-甲氧基苯基)吡唑-5-基)-1, 3, 4-噁二唑(10c):黄色固体, 产率80%. m.p. 193~195 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 7.81 (d, J=8.8 Hz, 2H), 7.52 (t, J=8.0 Hz, 1H), 7.42 (s, 1H), 7.32~7.23 (m, 7H), 7.00 (d, J=8.8 Hz, 2H), 5.81 (s, 2H), 4.13 (s, 2H), 3.77 (s, 3H), 3.55 (s, 2H); 13C NMR (DMSO-d6, 100 MHz) δ: 180.81, 164.11, 159.83, 158.22, 157.91, 152.49, 151.12, 139.01, 137.37, 129.03, 128.07, 127.78, 127.65, 127.13, 124.82, 119.90, 116.55, 114.64, 110.45, 105.98, 55.62, 54.72, 29.86; HRMS calcd for C29H23BrN5O4S [M+H]+ 616.0649, found 616.0647.
2-(1-N'-5-氯吲哚-2, 3-二酮)-乙基-2-硫基)-5-(1-苯甲-3-(4-甲氧基苯基)吡唑-5-基)-1, 3, 4-噁二唑(10d):橙黄色固体, 产率66%. m.p. 219~220 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 7.82 (d, J=8.4 Hz, 2H), 7.68 (d, J=8.0 Hz, 1H), 7.54 (s, 1H), 7.42 (s, 1H), 7.34~7.23 (m, 6H), 6.99 (d, J=8.4 Hz, 2H), 5.81 (s, 2H), 4.13 (s, 2H), 3.77 (s, 3H), 3.56 (s, 2H); 13C NMR (DMSO-d6, 100 MHz) δ: 182.31, 164.08, 159.83, 158.40, 158.22, 151.13, 149.25, 137.43, 137.37, 129.03, 128.07, 127.66, 127.13, 124.84, 124.37, 119.25, 114.64, 113.06, 105.99, 55.62, 54.70, 29.88; HRMS calcd for C29H22ClN5NaO4S [M+Na]+ 594.0973, found 594.0976.
2-(1-N'-6-氯吲哚-2, 3-二酮)-乙基-2-硫基)-5-(1-苯甲-3-(4-甲氧基苯基)吡唑-5-基)-1, 3, 4-噁二唑(10e):黄色固体, 产率72%. m.p. 202~203 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 7.82 (d, J=7.6 Hz, 2H), 7.52 (d, J=8.8 Hz, 2H), 7.43 (s, 1H), 7.33 (d, J=7.2 Hz, 2H), 7.26 (t, J=6.8 Hz, 3H), 7.12 (d, J=7.6 Hz, 1H), 7.00 (d, J=7.6 Hz, 2H), 5.81 (s, 2H), 4.13 (s, 2H), 3.78 (s, 3H), 3.57 (s, 2H); 13C NMR (DMSO-d6, 100 MHz) δ: 182.04, 164.11, 159.83, 158.73, 158.24, 151.85, 151.11, 142.97, 137.36, 129.01, 128.06, 127.70, 127.13, 126.30, 124.84, 123.58, 116.76, 114.64, 111.92, 105.99, 55.62, 55.36, 54.70, 29.85; HRMS calcd for C29H22ClN5NaO4S [M+Na]+ 594.0973, found 594.0972.
2-(1-N'-6-溴吲哚-2, 3-二酮)-乙基-2-硫基)-5-(1-苯甲-3-(4-甲氧基苯基)吡唑-5-基)-1, 3, 4-噁二唑(10f):黄色固体, 产率78%. m.p. 223~224 ℃; 1H NMR (DMSO-d6, 400 MHz) δ: 7.82 (d, J=7.6 Hz, 2H), 7.65 (s, 1H), 7.43 (d, J=8.4 Hz, 2H), 7.34~7.24 (m, 6H), 7.00 (d, J=7.2 Hz, 2H), 5.81 (s, 2H), 4.12 (s, 2H), 3.78 (s, 3H), 3.56 (s, 2H); 13C NMR (DMSO-d6, 100 MHz) δ: 182.30, 164.13, 159.83, 158.65, 158.23, 151.64, 151.12, 137.36, 132.31, 129.02, 128.08, 127.69, 127.15, 126.57, 126.25, 124.83, 117.06, 114.64, 105.99, 55.62, 54.71, 29.87; HRMS calcd for C29H23BrN5O4S [M+H]+ 638.0468, found 638.0468.
3.2.4 体外抗肿瘤活性测试
以顺铂(DDP)为阳性药, 采用CCK-8法测试目标产物对A549细胞的体外抗增殖活性.将A549细胞消化、计数, 接种于96孔板中, 在37 ℃, 5% CO2培养箱中孵化24 h.每孔加入100 μL相应的含药(100 μmol/L)培养基, 同时设立阴性对照组、阳性对照组、溶媒组, 再将96孔板置于培养箱中孵化72 h.药物作用后, 每孔加入10 μL CCK-8溶液, 继续孵化3 h.酶标仪在450 nm处测定吸光度值(OD), 并计算抑制率. 100 μmol/L浓度下, 抑制率大于50%的化合物, 重新设置浓度进行孵化72 h.实验结果通过SPSS17.0软件计算得出IC50值.
3.2.5 PI单染法检测细胞周期
将对数生长期的A549细胞消化接种到6孔板中, 孵化24 h.根据组别设置加入7f培养基, 同时设立阴性对照组.药物作用48 h后, 收集、离心, 并用70%冰乙醇固定细胞.加100 μL RNase A孵化30 min, 再加入400 μL PI染色.流式细胞仪记录488 nm处荧光.
3.2.6 Annexin-V APC/7-AAD双染法检测细胞凋亡
将对数生长期的A549细胞消化接种到6孔板中, 孵化24 h.根据组别设置加入7f培养基, 同时设立阴性对照组.加入500 μL缓冲液(Binding Buffer)后, 再依次加入5 μL别藻蓝蛋白标记的膜联蛋白V (Annexin V-APC)和5 μL 7-氨基放线菌素(7-AAD), 混匀放置15 min.流式细胞仪记录细胞凋亡情况.
3.2.7 Hoechst 33342染色
A549细胞与7f孵化24 h后, 浸入4%的多聚甲醛固定液中30 min, 加入Hoechst 33342染色液, 充分覆盖住待染色的细胞.室温放置10 min后, 抗荧光淬灭封片液封片, 荧光显微镜下观察.
3.2.8 JC-1染色法检测线粒体膜电位
将对数生长期的A549细胞消化接种到6孔板中, 孵化24 h.根据组别设置加入7f培养基, 同时设立阴性对照组.药物作用48 h后, 收集细胞, 加入500 μL JC-1工作液, 在37 ℃, 5% CO2的培养箱中孵化15 min.室温离心收集细胞, 流式细胞仪检测.
辅助材料(Supporting Information)目标产物的1H NMR, 13C NMR, HRMS谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Brody, H. Nature 2014, 513, S1. doi: 10.1038/513S1a
-
[2]
Chen, W.; Zheng, R.; Baade, P. D.; Zhang, S.; Zeng, H.; Bray, F.; Jemal, A.; Yu, X. Q.; He, J. CA Cancer J. Clin. 2016, 66, 115. doi: 10.3322/caac.21338
-
[3]
Chougule, M.; Patel, A. R.; Sachdeva, P.; Jackson, T.; Singh, M. Lung Cancer 2011, 71, 271. doi: 10.1016/j.lungcan.2010.06.002
-
[4]
张磊, 林娅, 王京, 朱心玲, 姚秋丽, 姚其正, 有机化学, 2015, 35, 497. http://sioc-journal.cn/Jwk_yjhx//CN/abstract/abstract344697.shtmlZhang, L.; Lin, Y.; Wang, J.; Zhu, X.; Yao, Q.; Yao, Q. Chin. J. Org. Chem. 2015, 35, 497(in Chinese). http://sioc-journal.cn/Jwk_yjhx//CN/abstract/abstract344697.shtml
-
[5]
Yu, L. G.; Ni, T. F.; Gao, W.; He, Y.; Wnag, Y. Y.; Cui, H. W.; Yang, C. G.; Qiu, W. W. Eur. J. Med. Chem. 2015, 90, 10. doi: 10.1016/j.ejmech.2014.11.015
-
[6]
Chavan, H. V.; Bandgar, B. P.; Adsul, L. K.; Dhakane, V. D.; Bhale, P. S.; Thakare, V. N.; Masand, V. Bioorg. Med. Chem. Lett. 2013, 23, 1315. doi: 10.1016/j.bmcl.2012.12.094
-
[7]
Yan, T.; Yu, S. J.; Liu, P. F.; Liu, Z.; Wang, B. L.; Xiong, L. X.; Li, Z. M. Chin. J. Chem. 2012, 30, 919. doi: 10.1002/cjoc.201100347
-
[8]
温彦鹏, 张爽, 侯广峰, 于颖慧, 高金胜, 有机化学, 2016, 36, 642. doi: 10.6023/cjoc201508008Wen, Y.; Zhang, S.; Hou, G.; Yu, Y.; Gao, J. Chin. J. Org. Chem. 2016, 36, 642(in Chinese). doi: 10.6023/cjoc201508008
-
[9]
Penning, T. D.; Talley, J. J.; Bertenshaw, S. R.; Carter, J. S.; Collins, P. W.; Docter, S.; Graneto, M. J.; Lee, L. F.; Malecha, J. W.; Miyashiro, J. M.; Rogers, R. S.; Rogier, D. J.; Yu, S. S.; Anderson, G. D.; Burton, E. G.; Cogburn, J. N.; Gregory, S. A.; Koboldt, C. M.; Perkins, W. E.; Seibert, K.; Veenhuizen, A. W.; Zhang, Y. Y.; Isakson, P. C. J. Med. Chem. 1997, 40, 1347. doi: 10.1021/jm960803q
-
[10]
侯春青, 李志念, 刘长令, 农药, 2002, 41, 41. doi: 10.3969/j.issn.1009-6485.2002.06.015Hou, Q. Q.; Li, Z. N.; Liu, C. L. Pesticides 2002, 41, 41(in Chinese). doi: 10.3969/j.issn.1009-6485.2002.06.015
-
[11]
Hu-Lowe, D. D.; Zou, H. Y.; Grazzini, M. L.; Hallin, M. E.; Wickman, G. R.; Amundson, K.; Chen, J. H.; Rewolinski, D. A.; Yamazaki, S.; Wu, E. Y.; McTigue, M. A.; Murray, B. W.; Kania, R. S.; O'Connor, P.; Shalinsky, D. R.; Bender, S. L. Clin. Cancer Res. 2008, 14, 7272. doi: 10.1158/1078-0432.CCR-08-0652
-
[12]
Xia, Y.; Dong, Z. W.; Zhao, B. X.; Ge, X.; Meng, N.; Shin, D. S.; Miao, J. Y. Bioorg. Med. Chem. 2007, 15, 6893. doi: 10.1016/j.bmc.2007.08.021
-
[13]
Zheng, L. W.; Wu, L. L.; Zhao, B. X.; Dong, W. L.; Miao, J. Y. Bioorg. Med. Chem. 2009, 17, 1957. doi: 10.1016/j.bmc.2009.01.037
-
[14]
Song, L.; Su, H.; Zhao, B. X.; Liu, W. Y.; Zheng, L. W.; Miao, J. Y. Bioorg. Med. Chem. 2009, 17, 7085. doi: 10.1016/j.bmc.2009.09.004
-
[15]
Zhang, J. F.; Li, M.; Miao, J. Y.; Zhao, B. X. Eur. J. Med. Chem. 2014, 83, 516. doi: 10.1016/j.ejmech.2014.06.065
-
[16]
Vujasinović, I.; Paravić-Radičević, A.; Mlinarić-Majerski, K.; Brajša, K.; Bertoša, B. Bioorg. Med. Chem. 2012, 20, 2101. doi: 10.1016/j.bmc.2012.01.032
-
[17]
王京, 张磊, 姚其正, 合成化学, 2014, 22, 730. doi: 10.3969/j.issn.1005-1511.2014.06.002Wang, J.; Zhang, L.; Yao, Q. Z. Chin. J. Synth. Chem. 2014, 22, 730(in Chinese). doi: 10.3969/j.issn.1005-1511.2014.06.002
-
[18]
张磊, 王京, 朱心玲, 林娅, 姚其正, 化学试剂, 2015, 37, 25. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxsj201501008&dbname=CJFD&dbcode=CJFQZhang, L.; Wang, J.; Zhu, X. L.; Liu, Y.; Yao, Q. Z. Chem. Reag. 2015, 37, 25(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hxsj201501008&dbname=CJFD&dbcode=CJFQ
-
[19]
张磊, 王京, 林娅, 朱心玲, 姚其正, 合成化学, 2015, 23, 499. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hchx201406002&dbname=CJFD&dbcode=CJFQZhang, L.; Wang, J.; Lin, Y.; Zhu, X. L.; Yao, Q. Z. Chin. J. Synth. Chem. 2015, 23, 499(in Chinese). http://kns.cnki.net/KCMS/detail/detail.aspx?filename=hchx201406002&dbname=CJFD&dbcode=CJFQ
-
[20]
Welsch, M. E.; Snyder, S. A.; Stockwell, B. R. Curr. Opin. Chem. Biol. 2010, 14, 347. doi: 10.1016/j.cbpa.2010.02.018
-
[21]
Vine, K. L.; Matesic, L.; Locke, J. M.; Ranson, M.; Skropeta, D. Anti-Cancer Agents Med. Chem. 2009, 9, 397. doi: 10.2174/1871520610909040397
-
[22]
张颖, 吕梦娇, 张娅玲, 陈丽, 王伟, 李宝林, 有机化学, 2017, 37, 1789. doi: 10.6023/cjoc201701037Zhang, Y.; Lv, M.; Zhang, Y.; Chen, L.; Wang, W.; Li, B. Chin. J. Org. Chem. 2017, 37, 1789(in Chinese). doi: 10.6023/cjoc201701037
-
[23]
Hsuan, S. L.; Chang, S. C.; Wang, S. Y.; Liao, T. L.; Jong, T. T.; Chien, M. S.; Lee, W. C.; Chen, S. S.; Liao, J. W. J. Ethnopharmacol. 2009, 123, 61. doi: 10.1016/j.jep.2009.02.028
-
[24]
Sun, L.; Liang, C.; Shirazian, S.; Zhou, Y.; Miller, T.; Cui, J.; Fukuda, J. Y.; Chu, J. Y.; Nematalla, A.; Wang, X.; Chen, H.; Sistla, A.; Luu, T. C.; Tang, F.; Wei, J.; Tang, C. J. Med. Chem. 2003, 46, 1116. doi: 10.1021/jm0204183
-
[25]
Zhang, L.; Chne, F.; Wang, J.; Chen, Y.; Zhang, Z.; Lin, Y.; Zhu, X. RSC Adv. 2015, 5, 97816. doi: 10.1039/C5RA21217K
-
[26]
Nagarsenkar, A.; Guntuku, L.; Guggilapu, S. D.; Bai K, D.; Gannoju, S.; Naidu, V. G. M.; Bathini, N. B. Eur. J. Med. Chem. 2016, 124, 782.
-
[27]
Eldehna, W. M.; Altoukhy, A.; Mahrous, H.; Abdel-Azizc, H. A. Eur. J. Med. Chem. 2015, 90, 684. doi: 10.1016/j.ejmech.2014.12.010
-
[28]
Evdokimova, N. M.; Magedov, I. V.; McBrayer, D.; Kornienko, A. Bioorg. Med. Chem. Lett. 2016, 26, 1558. doi: 10.1016/j.bmcl.2016.02.015
-
[29]
Meunier, B. Acc. Chem. Res. 2007, 41, 69.
-
[30]
Shaveta, S. M.; Singh, P. Eur. J. Med. Chem. 2016, 124, 500. doi: 10.1016/j.ejmech.2016.08.039
-
[31]
Ly, J. D.; Grubb, D. R.; Lawen, A. Apoptosis 2003, 8, 115. doi: 10.1023/A:1022945107762
-
[32]
Cao, S.; Xu, X.; Liao, J.; Ma, L.; Ding, P.; Lin, H.; Gao, M. CN 104311470, 2015[Chem. Abstr. 2015, 162, 272777].
-
[1]
-
表 1 目标化合物对A549细胞的体外抗增殖活性
Table 1. Antiproliferative activity of target compounds against A549 cells in vitro
Compd. R IC50/(μmol•L-1) 7a H >100 7b 4-Cl >100 7c 4-Br >100 7d 5-Cl >100 7e 6-Cl 30.41 7f 6-Br 29.69 10a H >100 10b 4-Cl >100 10c 4-Br >100 10d 5-Cl >100 10e 6-Cl >100 10f 6-Br 58.48 DDP — 8.18 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 10
- 文章访问数: 3374
- HTML全文浏览量: 1205


 下载:
下载:








 下载:
下载:

