 图式 1
有机磷化合物与Selectfluor的反应
Scheme1.
Reactions of organophosphorus compounds with Selectfluor
图式 1
有机磷化合物与Selectfluor的反应
Scheme1.
Reactions of organophosphorus compounds with Selectfluor

Citation: Huang Yulin, Chen Qian. Fluorination Reaction of P(Ⅲ) Compounds with the Electrophilic Fluorinating Reagent Selectfluor[J]. Chinese Journal of Organic Chemistry, 2017, 37(10): 2745-2751. doi: 10.6023/cjoc201704001

三价磷化合物与亲电氟化试剂Selectfluor的氟化反应
English
Fluorination Reaction of P(Ⅲ) Compounds with the Electrophilic Fluorinating Reagent Selectfluor
-
有机磷化合物广泛应用于有机合成[1]、功能材料[2]、药物化学[3]、配位化学[4]和阻燃剂[5]等领域中.其中, 含有磷-氟键的化合物在酶促反应中可作为抑制剂或机理研究的探针分子, 具有广泛的应用性[6].例如, 磷酰氟类化合物能有效地抑制乙酰胆碱酯酶(acetyl cholinesterase)等多种蛋白酶和酯酶.
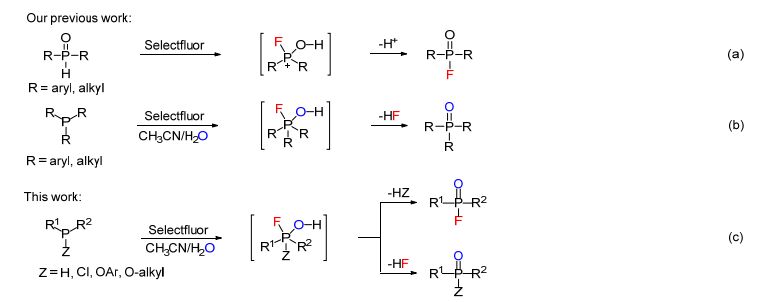
传统的磷酰氟类化合物的合成方法通常需要用到剧毒或对水敏感的试剂、苛刻的反应条件或较长的反应时间, 具有较大的局限性[7].近年来, 以氟离子作为氟源的亚磷酸酯或仲膦氧化物的亲核氟化反应逐渐发展起来[8, 9].由于氟离子亲核能力较弱, 该方法通常需要利用额外的氯化试剂或强氧化剂将有机磷化合物转变成为高活性的磷酰氯或磷酸酯中间体.最近, 我们小组[10]报道了利用亲电氟化试剂Selectfluor [1-氯甲基-4-氟-1, 4-重氮化二环2.2.2辛烷双(四氟硼酸)盐]与仲膦氧化物的反应合成磷酰氟的亲电氟化反应(Scheme 1a).该方法反应条件温和、反应速率快、对水和空气不敏感、具有较好的收率.另一反面, 我们[11]报道了Selectfluor作为氧化剂与叔膦的氧化反应, 在室温条件下以高收率得到叔膦氧化物(Scheme 1b).从可能的反应机理看出, 仲膦氧化物和叔膦与Selectfluor作用均产生五价磷的反应中间体, 随后分别失去质子和氟化氢得到相应的氟化产物和氧化产物.基于此, 我们希望进一步考察带有其它基团的三价磷化合物与Selectfluor的反应.本工作研究了多种三价磷化合物与Selectfluor的反应, 得到了氟化产物或氧化产物, 反应条件温和, 反应收率较好(Scheme 1c).
1 结果与讨论
首先, 我们考察了二苯基膦与Selectfluor的反应.根据我们小组[10, 11]已有的研究经验, 选取了乙腈/水的混合溶剂作为反应溶剂.经过简单的反应条件筛选得到最优反应条件:二苯基膦(1a) (0.4 mmol)、Selectfluor (0.52 mmol)、乙腈/水为溶剂, 室温下反应15 min, 结果以79%的收率得到了二苯基磷酰氟(2a).当加入少量或过量的Selectfluor时, 反应过程中仅检测到微量的氧化产物二苯基氧膦(3a).由于3a不能迅速地转化为2a[10], 因此氟化产物2a主要通过1a的直接亲电氟化得到.将以上反应条件应用于各种三价磷化合物的反应中, 结果如表 1所示.二对甲苯基膦(1b)、二间甲苯基膦(1c)以及二邻甲苯基膦(1d)与Selectfluor的反应均以较高的收率得到相应的磷酰氟2b~2d(表 1, Entries 2~4).值得一提的是, 大位阻的二(1-萘基)膦(1e)在相同反应条件下以较高的收率得到相应的氟化产物2e(表 1, Entry 5), 说明位阻对二芳基膦反应的影响较小; 当磷原子上带有卤素Cl时, 二苯基氯化膦(1f)的反应以81%的收率得到二苯基磷酰氟(2a)(表 1, Entry 6).反应过程中检测到二苯基氧膦(3a), 可能是由1f遇水分解生成.因此, 氟化产物2a可能经1f的直接氟化或水解产物3a的氟化得到.位阻较大的二芳基氯化膦1g和1h的氟化反应同样以较高的收率得到相应的氟化产物2g和2h(表 1, Entries 7, 8), 说明位阻对氯化膦反应的影响较小.由于二烷基氧膦与Selectfluor的反应效果较差[10], 我们进一步尝试了二环己基氯化膦(1i)的氟化反应, 结果以66%的收率得到目标产物2i(表 1, Entry 9).另外, 我们还尝试了对水敏感的二乙基亚磷酰氯(1j)与Selectfluor的反应, 结果原料完全分解, 没有检测到预期的氟化产物(表 1, Entry 10);当磷原子上带有单个烷氧基时, 甲氧基二苯基膦(1k)的反应以70%的收率得到氟化产物2a和氧化产物3k (2a:3k=68:32, 表 1, Entry 11).作为比较, 在相似的反应条件下, 乙氧基二苯基膦则以84%的收率得到氧化产物二苯基磷酸乙酯[11], 说明烷氧基对反应的影响较大; 当磷原子上带有两个烷氧基时, 二甲氧基苯基膦(1l)以88%的收率得到氟化产物2l和氧化产物3l (2l:3l=39:61, 表 1, Entry 12);将芳基膦化合物换成亚磷酸三苯酯(1m)时, 反应仍然可以顺利进行, 生成唯一的氟化产物2m(收率65%, 表 1, Entry 13).作为对比, 亚磷酸二苯酯与Selectfluor的反应仅以20%的收率得到2m[10]; 进一步, 考察了取代基对亚磷酸三芳酯反应的影响.苯环对位带有甲基时, 对反应的影响不大(氟化产物2n, 收率57%, 表 1, Entry 14).苯环邻位带有甲基时, 收率明显下降(氟化产物2o, 收率34%, 表 1, Entry 15).苯环邻位和对位均带有大位阻的叔丁基时, 反应则不能进行, 原料1p仍然保留(表 1, Entry 16), 可能原因是由于1p与Selectfluor作用时的空间位阻较大; 当亚磷酸三芳酯换成亚磷酸三甲酯1q时, 结果原料完全分解, 预期的氟化产物和氧化产物均没有得到(表 1, Entry 17), 与我们报道的亚磷酸三乙酯的反应结果一致[11]; 为了检验本合成方法的可扩大性和实用性, 我们做了放大反应测试, 反应条件为: 6.0 mmol二苯基膦(1a)和7.8 mmol Selectfluor, 乙腈/水溶剂90 mL, 室温下反应30 min, 结果得到二苯基磷酰氟(2a)的收率为55%(表 1, Entry 18), 放大反应的收率有所下降.

Entry 1 2 3 Yieldb/% (2:3) 1 

— 79 2 — 72 3 — 76 4 — 70 5 — 73 6 2a — 81 7 2d — 68 8 
— 72 9 — 66 10 
— — 0 11 2a 
70 (68:32) 12 
88 (39:61) 13 — 65 14 — 57 15 — 34 16 — — 0 17 — — 0 18c 1a 2a — 55 aReaction conditions: 1 (0.40 mmol) and Selectfluor (0.52 mmol) in 6 mL of CH3CN/H2O (V/V=100/1) with stirring at room temperature for 15~60 min; b isolated yield based on 1; c the reaction was performed in a 6.0 mmol scale. 由以上的实验结果, 我们对主反应提出了可能的机理, 如Scheme 2所示.三价磷化合物1与亲电氟化试剂Selectfluor作用生成氟化鏻正离子4, 该中间体进一步与水作用生成五价磷中间体5, 随后中间体5失去质子和磷原子上的取代基后得到氟化产物2 (path a), 或失去氟化氢后得到氧化产物3 (path b).结合我们小组以前的工作[10, 11], 可归纳出有机磷化合物与Selectfluor作用的一些反应规律: (1) 二芳基膦(Ar2PH), 亚磷酸三芳基酯(P(OAr)3)以及二芳(烷)基氯化膦(R2PCl, R=芳基, 烷基)的反应由path a生成氟化产物; (2) 仲膦氧化物(R2P(O)H, R=芳基、苄基)的反应经五价磷中间体失去质子后生成氟化产物[10]; (3) 叔膦(R3P, R=芳基、烷基)的反应由path b生成氧化产物[11]; (4) 烷氧基苯基膦则可以经过两种反应途径生成氟化和氧化两种产物; (5) 其它亚磷酸酯类化合物的反应效果较差.
2 结论
本研究发展了一种三价磷化合物与Selectfluor反应合成磷酰氟的方法.反应经历了氟化、水合和消除三个过程, 不同的消除过程生成不同的产物, 分别为氟化产物和氧化产物.反应条件非常温和, 操作简便, 为磷酰氟类化合物的合成提供了一种新的方法.
3 实验部分
3.1 仪器与试剂
1H NMR, 13C NMR, 19F NMR和31P NMR采用Bruker AVANCE Ⅲ HD 400型核磁共振仪测定, CDCl3为溶剂, TMS为内标; HRMS数据采用质谱仪(Thermo Fisher Scientific LTQ FT ultra, Bremen, Germany)测定.层析用硅胶(200~300目)为青岛海洋化工厂产品.所有试剂均购于试剂公司, 未经进一步纯化.
3.2 实验方法
3.2.1 由二芳基膦1a~1e制备二芳基磷酰氟2a~2e
在25 mL反应瓶中加入二芳基膦1 (0.40 mmol)、Selecfluor (184 mg, 0.52 mmol)和乙腈-水的混合溶剂(6 mL, V/V=100/1), 混合物在室温下搅拌15 min.反应结束后, 反应物经浓缩、柱层析[V(石油醚):V(乙酸乙酯)=2:1]得目标产物二芳基磷酰氟2.
二苯基磷酰氟(2a)[9]:得70 mg淡黄色油状液体, 收率79%. 1H NMR (400 MHz, CDCl3) δ: 7.86~7.77 (m, 4H), 7.63~7.57 (m, 2H), 7.53~7.46 (m, 4H); 31P NMR (162 MHz, CDCl3) δ: 40.90 (d, J=1020 Hz); 19F NMR (376 MHz, CDCl3) δ: -75.15 (d, J=1020 Hz); 13C NMR (100 MHz, CDCl3) δ: 133.4 (d, J=2.3 Hz), 131.4 (dd, J=11.3, 1.9 Hz), 128.9 (d, J=14.1 Hz), 128.8 (dd, J=140.0, 22.3 Hz).
二对甲苯基磷酰氟(2b)[9]:得72 mg淡黄色油状液体, 收率72%. 1H NMR (400 MHz, CDCl3) δ: 7.73~7.65 (m, 4H), 7.32~7.27 (m, 4H), 2.40 (s, 6H); 31P NMR (162 MHz, CDCl3) δ: 42.02 (d, J=1014 Hz); 19F NMR (376 MHz, CDCl3) δ: -74.36 (d, J=1014 Hz); 13C NMR (100 MHz, CDCl3) δ: 144.0 (d, J=2.3 Hz), 131.4 (dd, J=11.7, 1.8 Hz), 129.5 (d, J=14.5 Hz), 125.8 (dd, J=143.0, 22.0 Hz), 21.7.
二间甲苯基磷酰氟(2c)[9]:得75 mg无色油状液体, 收率76%. 1H NMR (400 MHz, CDCl3) δ: 7.69~7.55 (m, 4H), 7.43~7.34 (m, 4H), 2.39 (s, 6H); 31P NMR (162 MHz, CDCl3) δ: 41.63 (d, J=1019 Hz); 19F NMR (376 MHz, CDCl3) δ: -75.47 (d, J=1019 Hz); 13C NMR (100 MHz, CDCl3) δ: 138.8 (d, J=14.0 Hz), 134.1 (d, J=2.8 Hz), 131.8 (dd, J=11.3, 1.9 Hz), 128.8 (dd, J=140.0, 22.0 Hz), 128.7 (d, J=14.8 Hz), 128.5 (dd, J=11.3, 1.9 Hz), 21.3.
二邻甲苯基磷酰氟(2d)[9]:得70 mg白色固体, 收率70%. 1H NMR (400 MHz, CDCl3) δ: 7.80~7.75 (m, 2H), 7.50~7.46 (m, 2H), 7.32~7.24 (m, 4H), 2.43 (s, 6H); 31P NMR (162 MHz, CDCl3) δ: 43.03 (d, J=1018 Hz); 19F NMR (376 MHz, CDCl3) δ: -74.47 (d, J=1018 Hz); 13C NMR (100 MHz, CDCl3) δ: 141.9 (d, J=11.4 Hz), 133.5 (d, J=2.7 Hz), 133.1 (dd, J=11.8, 3.7 Hz), 131.7 (d, J=13.0 Hz), 127.8 (dd, J=136.4, 19.1 Hz), 126.0 (d, J=13.9 Hz), 21.3 (dd, J=4.6, 1.2 Hz).
二(1-萘基)磷酰氟(2e)[10]:得94 mg白色固体, 收率73%. 1H NMR (400 MHz, CDCl3) δ: 8.55~8.54 (m, 2H), 8.10 (d, J=8.2 Hz, 2H), 8.03 (dd, J=17.0, 7.1 Hz, 2H), 7.94~7.92 (m, 2H), 7.57~7.50 (m, 6H); 31P NMR (162 MHz, CDCl3) δ: 44.48 (d, J=1019 Hz); 19F NMR (376 MHz, CDCl3) δ: -67.96 (d, J=1019 Hz); 13C NMR (100 MHz, CDCl3) δ: 134.7 (d, J=3.1 Hz), 134.0 (dd, J=12.0, 3.9 Hz), 133.7 (d, J=11.3 Hz), 132.8 (d, J=10.9 Hz), 129.2 (d, J=1.5 Hz), 128.2, 127.0, 126.4 (d, J=6.0 Hz), 125.7 (dd, J=137.0, 19.0 Hz), 124.7 (d, J=16.2 Hz).
3.2.2 由氯化膦1制备磷酰氟2
在25 mL反应瓶中加入氯化膦1 (0.40 mmol)、Selecfluor (184 mg, 0.52 mmol)和乙腈-水的混合溶剂(6 mL, V/V=100/1), 混合物在室温下搅拌15 min.反应结束后, 反应物经浓缩、柱层析[V(石油醚):V(乙酸乙酯)=2:1) 得目标产物磷酰氟2.
二苯基磷酰氟(2a):得71 mg淡黄色油状液体, 收率81%.
二邻甲苯基磷酰氟(2d):得68 mg白色固体, 收率68%.
二(3, 5-二甲基苯基)磷酰氟(2h)[10]:得80 mg白色固体, 收率72%. 1H NMR (400 MHz, CDCl3) δ: 7.42 (d, J=13.4 Hz, 4H), 7.21 (s, 2H), 2.34 (s, 12H); 31P NMR (162 MHz, CDCl3) δ: 42.31 (d, J=1018 Hz); 19F NMR (376 MHz, CDCl3) δ: -75.92 (d, J=1018 Hz); 13C NMR (100 MHz, CDCl3) δ: 138.7 (d, J=14.7 Hz), 135.1 (d, J=2.7 Hz), 129.0 (dd, J=11.3, 1.9 Hz), 128.8 (dd, J=139.4, 21.8 Hz), 21.3.
二环己基磷酰氟(2i)[9]:得61 mg白色固体, 收率66%. 1H NMR (400 MHz, CDCl3) δ: 1.97~1.90 (m, 2H), 1.90~1.75 (m, 8H), 1.70 (s, 2H), 1.55~1.33 (m, 4H), 1.31~1.15 (m, 6H); 31P NMR (162 MHz, CDCl3) δ: 70.89 (d, J=1036 Hz); 19F NMR (376 MHz, CDCl3) δ: -94.87 (d, J=1036 Hz); 13C NMR (100 MHz, CDCl3) δ: 35.1 (dd, J=86.2, 13.2 Hz), 26.0 (dd, J=14.1, 2.5 Hz), 25.7 (d, J=1.3 Hz), 24.8.
3.2.3 由甲氧基二苯基膦(1k)制备二苯基磷酰氟(2a)和二苯基磷酸甲酯(3k)
在25 mL反应瓶中加入甲氧基二苯基膦(1k) (86 mg, 0.40 mmol)、Selecfluor (184 mg, 0.52 mmol)和乙腈-水的混合溶剂(6 mL, V/V=100/1), 混合物在室温下搅拌45 min.反应结束后, 反应物经浓缩、柱层析V(石油醚):V(乙酸乙酯)=2:1]得42 mg二苯基磷酰氟(2a, 收率48%)和19 mg二苯基磷酸甲酯(3k, 收率22%).
二苯基磷酸甲酯(3k)[10]:得19 mg无色油状液体, 收率22%. 1H NMR (400 MHz, CDCl3) δ: 7.84~7.77 (m, 4H), 7.55~7.49 (m, 2H), 7.48~7.41 (m, 4H), 3.76 (d, J=11.1 Hz, 3H); 31P NMR (162 MHz, CDCl3) δ: 33.26; 13C NMR (100 MHz, CDCl3) δ: 132.2 (d, J=2.8 Hz), 131.7 (d, J=10.1 Hz), 131.1 (d, J=136.0 Hz), 128.6 (d, J=13.1 Hz), 51.5 (d, J=6.0 Hz).
3.2.4 由二甲氧基苯基膦(1l)制备苯基氟磷酸甲酯(2l)和苯基磷酸二甲酯(3l)
在25 mL反应瓶中加入二甲氧基苯膦(1l) (68 mg, 0.40 mmol)、Selecfluor (184 mg, 0.52 mmol)和乙腈-水的混合溶剂(6 mL, V/V=100/1), 混合物在室温下搅拌60 min.反应结束后, 反应物经浓缩、柱层析[V(石油醚):V(乙酸乙酯)=2:1]得24 mg苯基氟磷酸甲酯(2l, 收率34%)和40 mg苯基磷酸二甲酯(3l, 收率54%).
苯基氟磷酸甲酯(2l)[12]:得24 mg无色油状液体, 收率34%. 1H NMR (400 MHz, CDCl3) δ: 7.87~7.81 (m, 2H), 766~7.62 (m, 1H), 7.54~7.48 (m, 2H), 3.94 (d, J=11.2 Hz, 3H); 31P NMR (162 MHz, CDCl3) δ: 18.39 (d, J=1044 Hz); 19F NMR (376 MHz, CDCl3) δ: -66.40 (d, J=1044 Hz); 13C NMR (100 MHz, CDCl3) δ: 133.8, 131.8 (d, J=10.6 Hz), 128.8 (d, J=16.4 Hz), 124.0 (dd, J=201.2, 30.6 Hz), 53.6 (d, J=6.1 Hz).
苯基磷酸二甲酯(3l)[11]:得40 mg无色油状液体, 收率54%. 1H NMR (400 MHz, CDCl3) δ: 7.77~7.70 (m, 2H), 754~7.48 (m, 1H), 7.46~7.37 (m, 2H), 3.71 (s, 3H); 31P NMR (162 MHz, CDCl3) δ: 21.70; 13C NMR (100 MHz, CDCl3) δ: 132.7 (d, J=3.0 Hz), 131.9 (d, J=9.9 Hz), 128.6 (d, J=15.1 Hz), 126.9 (d, J=188.0 Hz), 52.7 (d, J=5.5 Hz).
3.2.5 由亚磷酸三芳酯1m~1o制备氟磷酸二芳酯2m~2o
在25 mL反应瓶中加入亚磷酸三芳酯1 (0.40 mmol)、Selecfluor (184 mg, 0.52 mmol)和乙腈-水的混合溶剂(6 mL, V/V=100/1), 混合物在室温下搅拌60 min.反应结束后, 反应物经浓缩、柱层析[V(石油醚):V(乙酸乙酯)=2:1]得目标产物氟磷酸二芳酯2.
氟磷酸二苯酯(2m)[10]:得66 mg无色油状液体, 收率65%. 1H NMR (400 MHz, CDCl3) δ: 7.42~7.36 (m, 4H), 7.29~7.21 (m, 6H); 31P NMR (162 MHz, CDCl3) δ: -21.49 (d, J=1002 Hz); 19F NMR (376 MHz, CDCl3) δ: -77.83 (d, J=1002 Hz); 13C NMR (100 MHz, CDCl3) δ: 149.8 (d, J=7.1 Hz), 130.1, 126.3, 119.8 (d, J=4.9 Hz).
氟磷酸二对甲苯酯(2n):得64 mg淡黄色油状液体, 收率57%. 1H NMR (400 MHz, CDCl3) δ: 7.18~7.10 (m, 8H), 2.34 (s, 6H); 31P NMR (162 MHz, CDCl3) δ: -20.93 (d, J=1001 Hz); 19F NMR (376 MHz, CDCl3) δ: -78.35 (d, J=1001 Hz); 13C NMR (100 MHz, CDCl3) δ: 147.6 (d, J=7.3 Hz), 135.9 (d, J=1.4 Hz), 130.4, 119.5 (d, J=4.8 Hz), 20.7; HRMS calcd for C14H15FO3P [M+H]+ 281.0737, found 281.0741.
氟磷酸二邻甲苯酯(2o):得38 mg淡黄色油状液体, 收率34%. 1H NMR (400 MHz, CDCl3) δ: 7.27~7.12 (m, 8H), 2.27 (s, 6H); 31P NMR (162 MHz, CDCl3) δ: -20.89 (d, J=1004 Hz); 19F NMR (376 MHz, CDCl3) δ: -76.73 (d, J=1004 Hz); 13C NMR (100 MHz, CDCl3) δ: 148.5 (d, J=7.5 Hz), 131.7, 129.3 (d, J=6.5 Hz), 127.3 (d, J=1.6 Hz), 126.2 (d, J=1.4 Hz), 119.7 (d, J=2.1 Hz), 16.0; HRMS calcd for C14H15FO3P [M+H]+ 281.0737, found 281.0741.
辅助材料(Supporting Information) 化合物2的1H NMR, 13C NMR, 31P NMR和19F NMR, 以及化合物3的1H NMR, 13C NMR和31P NMR图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
唐谦, 涂爱平, 邓真真, 胡梦莹, 钟为慧, 有机化学, 2013, 33, 954. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341793.shtml(a) Kosolapoff, G. M.; Maier, L. Organic Phosphorus Compounds, Wiley-Interscience, New York, 1972.
(b) Bhattacharya, A. K.; Thyagarajan, G. Chem. Rev. 1981, 81, 415.(c) Tang, W.; Zhang, X. Chem. Rev. 2003, 103, 3029.
(d) Tang, Q.; Tu, A. P.; Deng, Z. Z.; Hu, M. Y.; Zhong, W. H. Chin. J. Org. Chem. 2013, 33, 954(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract341793.shtml -
[2]
(a) Steininger, H.; Schuster, M.; Kreuer, K. D.; Kaltbeitzel, A.; Bingol, B.; Meyer, W. H.; Schauff, S.; Brunklaus, G.; Maier, J.; Spiess, H. W. Phys. Chem. Chem. Phys. 2007, 9, 1764.
(b) Spampinato, V.; Tuccitto, N.; Quici, S.; Calabrese, V.; Marletta, G.; Torrisi, A.; Licciardello, A. Langmuir 2010, 26, 8400. -
[3]
(a) Shie, J.-J.; Fang, J.-M.; Wang, S.-Y.; Tsai, K.-C.; Cheng, Y.-S. E.; Yang, A.-S.; Hsiao, S.-C.; Su, C.-Y.; Wong, C.-H. J. Am. Chem. Soc. 2007, 129, 11892.
(b) Shie, J.; Fang, J.; Wong, C. Angew. Chem. 2008, 120, 5872; Angew. Chem., Int. Ed. 2008, 47, 5788.
(c) Wydysh, E. A.; Medghalchi, S. M.; Vadlamudi, A.; Townsend, C. A. J. Med. Chem. 2009, 52, 3317. -
[4]
(a) Pinault, N. Coord. Chem. Rev. 2003, 241, 1.
(b) Knappke, C. E. I.; von Wangelin, A. J. Chem. Soc. Rev. 2011, 40, 4948.
(c) Fernández-Pérez, H.; Etayo, P.; Panossian, A.; Vidal-Ferran, A. Chem. Rev. 2011, 111, 2119. -
[5]
(a) Cho, C.-S.; Chen, L.-W.; Chiu, Y.-S. Polym. Bull. 1998, 41, 45.
(b) Cho, C.-S.; Fu, S.-C.; Chen, L.-W.; Wu, T.-R. Polym. Int. 1998, 47, 203. -
[6]
(a) Engel, R. Chem. Rev. 1977, 77, 349.
(b) Camps, F.; Coll, J.; Fabrias, G.; Guerrero, A. Tetrahedron 1984, 40, 2871.
(c) Sikder, A. K.; Pandey, K. S.; Jaiswal, D. K.; Dube, S. N.; Kumar, D.; Husain, K.; Bhattacharya, R.; Das Gupta, S. J. Pharm. Pharmacol. 1992, 44, 1038.
(d) Sikder, A. K.; Ghosh, A. K.; Jaiswal, D. K. J. Pharm. Sci. 1993, 82, 258.(e) Eyer, P. Toxicol. Rev. 2003, 22, 165.
(f) Kim, T. H.; Oh, K. A.; Park, N. J.; Park, N. S.; Kim, Y. J.; Yum, E. K.; Jung, Y. S. J. Appl. Biomed. 2006, 4, 67. -
[7]
(a) Michalski, J.; Lopusinski, A. Angew. Chem., Int. Ed. 1982, 21, 294.
(b) Dabkowski, W.; Michalski, J. J. Chem. Soc., Chem. Commun. 1987, 755.
(c) Lermontov, S. A.; Popov, A. V.; Zavorin, S. I.; Sukhojenko, I. I.; Kuryleva, N. V.; Martynov, I. V.; Zefirov, N. S.; Stang, P. J. Fluorine Chem. 1994, 66, 233.
(d) Farooq, O. J. Chem. Soc., Perkin Trans. 1 1998, 839.
(e) Wozniak, L. A.; Chworos, A.; Pyzowski, L. A. Tetrahedron Lett. 1999, 40, 9337.
(f) Gololobov, Y. G.; Krasnova, I. Y.; Matveeva, E. V.; Petrovskii, P. V. Russ. Chem. Bull., Int. Ed. 2010, 59, 1059. -
[8]
(a) Kaushik, M. P.; Gupta, A. K.; Acharya, J.; Dubey, D. K. J. Fluorine Chem. 2008, 129, 226.
(b) Dubey, D. K.; Gupta, A. K.; Acharya, J.; Pardasani, D. Tetrahedron Lett. 2008, 49, 2232.
(c) Purohit, A. K.; Pardasani, D.; Kumar, A.; Goud, D. R.; Jain, R.; Dubey, D. K. Tetrahedron Lett. 2015, 56, 4593. -
[9]
Liu, N.; Mao, L.-L.; Yang, B.; Yang, S.-D. Chem. Commun. 2014, 50, 10879. doi: 10.1039/C4CC04830J
-
[10]
Chen, Q.; Zeng, J.; Yan, X.; Huang, Y.; Wen, C.; Liu, X.; Zhang, K. J. Org. Chem. 2016, 81, 10043. doi: 10.1021/acs.joc.6b01932
-
[11]
Chen, Q.; Zeng, J.; Yan, X.; Huang, Y.; Du, Z.; Zhang, K.; Wen, C. Tetrahedron Lett. 2016, 57, 3379. doi: 10.1016/j.tetlet.2016.06.078
-
[12]
Reddy, G. S.; Schmutzler, R. Z. Naturforsch. B 1970, 25, 1199.
-
[1]
-
表 1 三价磷化合物1与Selectfluor的反应a
Table 1. Reactions of P(Ⅲ) compounds 1 with Selectfluor

Entry 1 2 3 Yieldb/% (2:3) 1 

— 79 2 — 72 3 — 76 4 — 70 5 — 73 6 2a — 81 7 2d — 68 8 
— 72 9 — 66 10 
— — 0 11 2a 
70 (68:32) 12 
88 (39:61) 13 — 65 14 — 57 15 — 34 16 — — 0 17 — — 0 18c 1a 2a — 55 aReaction conditions: 1 (0.40 mmol) and Selectfluor (0.52 mmol) in 6 mL of CH3CN/H2O (V/V=100/1) with stirring at room temperature for 15~60 min; b isolated yield based on 1; c the reaction was performed in a 6.0 mmol scale. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 29
- 文章访问数: 4916
- HTML全文浏览量: 1403


 下载:
下载:

 下载:
下载:

