
Citation: Gu Jun, Liu Jiandong, Sun Yuren, Wang Hongyu. Nickel-Catalyzed Reductive Methylation of Alkyl Acid with Methyl p-Tosylate[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1830-1834. doi: 10.6023/cjoc201703042

镍催化烷基羧酸与对甲苯磺酸甲酯还原偶联甲基化成酮反应
English
Nickel-Catalyzed Reductive Methylation of Alkyl Acid with Methyl p-Tosylate
-
Key words:
- methylation
- / nickel-catalyzed
- / alkyl acid
- / reductive coupling
-
甲基或氟甲基[1~5]是有机化合物中常见的官能团, 甲基化或氟甲基化是一类重要的反应, 化合物中引入甲基或氟甲基可以极大地促进分子油溶性[6], 所以在药物分子[7]以及材料中常常被引入[8]来改变物质的性质.酮类化合物是有机化学中一类重要化合物, 将羧酸转换为酮是有机化学中一类既重要又基础的反应[9~12].常见的将羧酸转化成酮的方法是先将羧酸制备成酰氯[13~16]或者Weinreb酰胺, 以此来对羧酸进行活化[17~19], 然后利用有机金属试剂(比如有机锂试剂、格氏试剂等)进行亲核反应来获取相对应的酮类化合物.这类方法可以将羧酸转化成对应的酮, 并且反应高效, 副产物极少, 劣势在于整个转化过程需要经历多步反应.利用有机锂试剂可以直接一步将羧酸制备成酮, 但是这个方法也具有明显的缺陷: (1) 容易形成叔醇副产物; (2) 官能团容忍性低; (3) 反应条件较为苛刻, 需要极低的温度[20~25].
近年来, 利用Ni催化还原偶联[26]将羧酸转化成酮的反应受到广泛的关注. Gosmini等[27]在2003年报道了CoBr2和ZnBr2催化下芳香溴化物和酰氯反应生成芳香酮的反应, 这个反应体系需要在原位生成有机锌, 然后有机锌再参与进反应循环体系, 操作过程较为复杂, 收率也不高.郑建鸿等[28]报道了利用芳香碘代物在Ni/Zn条件下还原偶联得到酰胺或者亚胺类化合物. 2012年, Weix课题组[29]成功实现了在Ni催化下, 由Mn或者Zn作还原剂, 烷基酰氯与烷基卤代物进行交叉偶联反应生成酮.与此同时我们课题组也报道了Ni催化下烷基卤代物与酸及其衍生物(如酰氯[30]、芳香酸酐[31]及酸[32])的羰基化反应, 实现了交叉偶联成酮的方法, 其中烷基碘代物与酰氯的反应放大到克级后产率基本保持一致[33].我们还进一步将MeOTs作为甲基亲电试剂, 实现了芳香酸甲基化生成甲基酮的新方法[34].这也是首次在文献中将非常活泼的甲基亲电试剂用于还原偶联的报道.但该方面的工作仅限于芳香酸底物, 对烷基酸效率很低, 化合物2在该条件下仅有35%的收率.这是因为烷基酸与芳香酸中烷基和芳香基的微弱电性差异导致他们的反应活性的差异.例如, 我们在对芳香酸[32]与卤代烷烃[35]的酮化反应时所采用的条件与烷基酸有较大的不同.本论文实现了新的Ni催化还原偶联条件, 在课题组先前陆文彬工作[33]的基础上, 采用原位形成的缓和酸酐代替酰氯进行反应, 将混合溶剂改为四氢呋喃(THF), 使用位阻更大的配体(化合物3a)代替化合物3d, 一步将烷基羧酸甲基化形成相对应的酮类化合物(Eq. 1).本方法条件温和, 底物适应性好, 有望为现有的甲基酮制备方法提供一个重要的补充.
1 结果与讨论
1.1 条件筛选
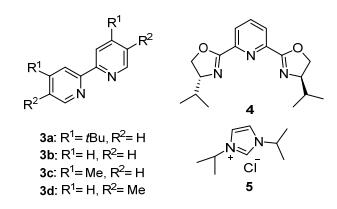
选用1 equiv. 3-苯基丙酸(1)作为模型反应底物, 1.5 equiv.对甲苯磺酸甲酯作为甲基源进行反应的筛选(表 1).首先, 对于催化剂Ni源进行筛选.选用NiBr2•diglyme作催化剂时, 收率较低, 只有41% (Entry 1).使用其他一些常见的Ni催化剂[如Ni(cod)2, NiI2, NiBr2]都不如Ni(acac)2的收率好.因此, Ni源使用Ni(acac)2来作优化催化剂.接着对配体进行筛选.位阻较大的二联吡啶类配体(3a)优于位阻较小的(3b).三齿配体(4)与卡宾配体(5)效果都不理想, 收率下降甚至只有痕量的收率(图 1).可能二齿配体(3)在这个反应中与催化剂Ni(acac)2络合效果更好.随后对于溶剂进行筛选.选用DMSO (Entry 11)、DMA (Entry 12) 和乙腈(Entry 13), 反应的收率都不理想, 因此选择THF作为最佳反应溶剂.最后, 对添加剂进行筛选.反应中去除TBAI (Entry 14), 几乎没有收率; 如果不加入Boc2O (Entry 15), 则完全观察不到产物.在我们课题组[32]先前的工作中发现, Boc2O和MgCl2在以羧酸为底物的反应中, 可以促进羧酸底物形成酸酐中间体, 然后进一步与对甲苯磺酸甲酯进行还原偶联.因此, 经过筛选最优的标准条件为(Entry 5): 10 mol% Ni(acac)2为催化剂, 15 mol% dtbbp (3)为配体, 200 mol%锌粉作为还原剂, 200 mol% MgCl2, 300 mol%. Boc2O, 100 mol% TBAI作为添加剂, 1 mL THF作为溶剂, 在15 ℃或室温下反应12 h.

Entry Cat. Ligand Solvent Additive Yielda/% 1 NiBr2"diglyme 3a THF TBAI 41 2 Ni(cod)2 3a THF TBAI 10 3 NiI2 3a THF TBAI 6 4 NiBr2 3a THF TBAI 32 5 Ni(acac)2 3a THF TBAI 55 6 Ni(acac)2 3b THF TBAI 33 7 Ni(acac)2 3c THF TBAI 39 8 Ni(acac)2 3d THF TBAI 26 9 Ni(acac)2 4 THF TBAI 25 10b Ni(acac)2 5 THF TBAI Trace 11 Ni(acac)2 3a MeCN TBAI 45 12 Ni(acac)2 3a DMA TBAI 20 13 Ni(acac)2 3a DMSO TBAI Trace 14 Ni(acac)2 3a THF No TBAI Trace 15 Ni(acac)2 3a THF No Boc2O N.D. 16 Ni(acac)2 3a THF No MgCl2 20 a Yields were determined by 1H NMR with 2, 5-dimethylfuran as an internal standard (calibrated); b100 mol% pyridine as base. 1.2 底物扩展
通过模板反应筛选出反应最佳条件(Eq. 2), 对反应底物进行普适性考察.以3-苯基丙酸(1)为原料, 作为标准反应物, 反应获得苄基丙酮(2), 可以达到55%的收率.在羧酸上增加一个碳原子后, 以3-苯基丁酸为底物, 化合物6也能够获得55%的收率, 与模板反应相似.接下来选择改变苯环上的取代基来研究标准条件下底物的适应性.可以看到在苯环对位引入甲基(12)以及甲氧基(13)后, 对应产率有少量提高.对位取代基为氯(14)时收率也略微提高, 改为氟(10)时, 收率变化不大, 对位取代基替换三氟甲基时(7), 相对应产物收率有明显降低.总体来说, 对于一级烷基酸而言, 这个标准条件的适应性较好.但是对于二级烷基酸进行尝试, 发现二级烷基酸(8, 11和15)的收率相比一级烷基酸有明显降低.遗憾的是, Boc保护的氨基酸(17和18)在该条件下无法检测到任何产物, 可能含N化合物容易和催化剂络合, 导致无法发生反应.
1.3 可能的反应机理
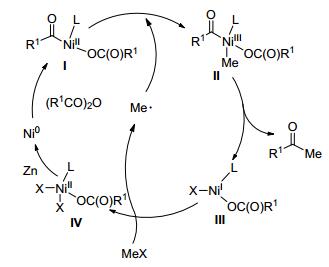
Ni催化还原偶联反应的机理较为复杂, 我们对这个反应的机理进行推测. MeOTs可能会与反应中碘离子(四丁基碘化铵)或氯离子(氯化镁)交换缓慢生成较稀浓度的碘甲烷或者氯甲烷参与反应, 由于生成MeX浓度较稀, 降低了MeX与镍氧化加成的速率, 提高了反应选择性[34].二价Ni中间体Ⅰ与甲基自由基发生氧化加成生成三价Ni中间体Ⅱ, 三价Ni中间体经历还原消除得到甲基酮产物和一价Ni中间体Ⅲ, 一价Ni中间体与MeX作用释放出甲基自由基和二价Ni中间体Ⅳ, 最后二价Ni中间体Ⅳ被锌粉还原为零价Ni中间体完成催化循环(Scheme 1).
2 结论
本论文发展了催化成甲基酮的新方法, 利用金属Ni作为催化剂一步将烷基羧酸甲基化成酮, 获得中等收率, 并且底物的适应性较好, 可以容忍较多种不同烷基酸底物.与传统羧酸甲基化转化成酮的方法相比, 克服了反应条件苛刻, 副产物多, 步骤繁琐等缺陷.本方法为现有的成酮反应, 特别是烷基甲基酮的制备提供了一个新的补充.
3 实验部分
3.1 仪器与试剂
核磁数据均由Bruker 500 MHz核磁共振仪分析, 氘代氯仿在1H NMR和13C NMR谱图中的化学位移分别定于δ 7.26和77.0.高分辨质谱(HRMS)数据由Bruker APEXIII 7.0和IonSpec 4.7 TESLA FTMS分析所得到; 低分辨质谱数据由岛津公司的GCMS-QP2010仪器测试所得.
除非有特别说明, 所有的反应都在氮气条件下操作.无水THF是从钠/二苯甲酮体系中重蒸得到.其它使用的反应溶剂都是分析纯的. Zn (99.9%, powder, 阿拉丁), NiI2 (99.5%, Alaf Aesar), Ni(cod)2 (99%, Stream), NiBr2 (99.5%, Alaf Aesar), Ni(acac)2 (99%, Alaf Aesar), NiBr2•diglyme (99.5%, Strem). N, N-二甲基乙酰胺DMA (99.8%, SuperDry, with molecular sieves), 二甲基亚砜DMSO (99.8%, SuperDry, with molecular sieves), 乙腈CH3CN (99.5%, SuperDry, with molecular sieves).其余反应底物试剂均购自安耐吉、百灵威、伊诺凯等公司.柱层析色谱柱使用300至400目硅胶(购于青岛海洋).
3.2 实验方法与数据
还原甲基化成酮反应标准操作:向装有搅拌子并在煤气灯上干燥过的Schlenk反应瓶中加入羧酸底物(0.15 mmol, 100 mol%)、配体3 (0.0225 mmol, 15 mol%)、MeOTs (0.225 mmol, 150%)、锌粉(0.3 mmol, 200 mol%). Schlenk反应瓶转移到手套箱内, 在30 min内换气3次, 然后在手套箱内加入Ni(acac)2 (0.015 mmol, 10 mol%)和氯化镁(0.3 mmol, 200 mol%). Schlenk反应瓶被移出手套箱, Boc2O (0.45 mmol, 300 mol%)和THF (1 mL)通过注射器加入.反应体系在15 ℃下反应12 h, 反应结束之后直接上层析硅胶柱分离产物, 得到相应的液体产物.
苄基丙酮(2):无色油状液体, 12.2 mg, 产率55%. 1H NMR (500 MHz, CDCl3) δ: 7.33~7.29 (m, 3H), 7.24~7.21 (m, 2H), 2.93 (t, J=7.4 Hz, 2H), 2.78 (t, J=7.4 Hz, 2H), 2.16 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 207.9, 141.1, 128.5, 128.3, 126.1, 45.1, 30.1, 29.7; HRMS (ESI) calcd for C10H12O: 148.0888, found 148.0891.
4-苄基-2-丁酮(6):无色液体, 24.3 mg, 产率55%. 1H NMR (500 MHz, CDCl3) δ: 7.32~7.28 (m, 2H), 7.22~7.19 (m, 2H), 2.65 (t, J=7.6 Hz, 2H), 2.45 (t, J=7.6 Hz, 2H), 2.14 (s, 3H), 1.96~1.91 (m, 2H); 13C NMR (125 MHz, CDCl3) δ: 208.8, 141.5, 128.5, 128.3, 125.9, 42.8, 35.1, 29.9, 25.2; HRMS (ESI) calcd for C11H14O: 162.1045, found 162.1047.
(4-三氟甲基苄基)丙酮(7):无色液体, 14.9 mg, 产率46%. 1H NMR (500 MHz, CDCl3) δ: 7.55 (d, J=8.1 Hz, 2H), 7.32 (d, J=8.1 Hz, 2H), 2.96 (t, J=7.4 Hz, 2H), 2.80 (t, J=7.4 Hz, 2H), 2.17 (s, 3H); 19F NMR (500 MHz, CDCl3) δ: -62.39; 13C NMR (125 MHz, CDCl3) δ: 207.1, 145.1, 128.6 (q, J=37.4 Hz), 125.4 (q, J=3.7 Hz), 123.1 (q, J=276.5 Hz), 44.5, 30.1, 29.3; HRMS (ESI) calcd for C11H11F3O: 216.0762, found 216.0764.
环丁基甲基酮(8): 4.4 mg, 无色液体, 产率30%.1H NMR (500 MHz, CDCl3) δ: 3.26~3.21 (m, 1H), 2.22~2.08 (m, 4H), 2.04 (s, 3H), 2.04~1.91 (m, 1H), 1.81~1.76 (m, 1H); 13C NMR (125 MHz, CDCl3) δ: 209.9, 46.1, 26.9, 24.2, 17.5; HRMS (ESI) calcd for C6H10O: 98.0732, found 98.0734
(2-甲氧基苄基)丙酮(9):无色液体, 14.2 mg, 产率53%. 1H NMR (500 MHz, CDCl3) δ: 7.23~7.15 (m, 2H), 6.92~6.86 (m, 3H), 3.84 (s, 3H), 2.91 (t, J=8.0 Hz, 2H), 2.76 (t, J=8.0 Hz, 2H), 2.16 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 208.6, 157.4, 129.9, 129.2, 127.4, 120.4, 110.2, 55.1, 43.7, 29.9, 25.1; HRMS (ESI) calcd for C11H14O2: 178.0994, found 178.1008.
(4-氟苄基)丙酮(10):无色液体, 13.2 mg, 产率53%. 1H NMR (500 MHz, CDCl3) δ: 7.16 (d, J=8.0 Hz, 2H), 6.98 (d, J=8.0 Hz, 2H), 2.90 (t, J=7.4 Hz, 2H), 2.76 (t, J=7.4 Hz, 2H), 2.16 (s, 3H); 19F NMR (500 MHz, CDCl3)δ: -117.31 (m); 13C NMR (125 MHz, CDCl3) δ: 207.6, 162.3 (d, J=244.8 Hz), 136.6 (d, J=3.1 Hz), 129.7 (d, J=17.8 Hz), 115.3 (d, J=21.3 Hz), 45.2, 30.1, 29.7; HRMS (ESI) calcd for C10H11FO: 166.0794, found 167.0833.
甲基酮环己酯(11):无色液体, 6.6 mg, 产率35%. 1H NMR (500 MHz, CDCl3) δ: 2.35~2.31 (m, 1H), 2.13 (s, 3H), 1.89~1.86 (m, 2H), 1.81~1.76 (m, 2H), 1.69~1.65(m, 1H), 1.36~1.17 (m, 5H); 13C NMR (125 MHz, CDCl3) δ: 212.3, 51.4, 28.4, 27.8, 25.8, 25.6; HRMS (ESI) calcd for C8H14O: 126.1045, found 126.1048.
(4-甲基苄基)丙酮[36](12):无色液体, 14.8 mg, 产率61%. 1H NMR (500 MHz, CDCl3) δ: 7.12~7.07 (m, 4H), 2.86 (t, J=7.0 Hz, 2H), 2.75 (t, J=7.0 Hz, 2H), 2.31 (s, 3H), 2.13 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 207.1, 137.9, 135.7, 129.3, 128.2, 45.4, 30.1, 29.4, 21.1; HRMS (ESI) calcd for C11H14O: 162.1045, found 162.1049.
(4-甲氧基苄基)丙酮(13):无色液体, 16.5 mg, 收率62%. 1H NMR (500 MHz, CDCl3) δ: 7.11 (d, J=8.6 Hz, 2H), 6.85 (d, J=8.6 Hz, 2H), 3.81 (s, 3H), 2.86 (t, J=7.0 Hz, 2H), 2.74 (t, J=7.0 Hz, 2H), 2.15 (s, 3H); 13C NMR (125 MHz, CDCl3)δ: 208.1, 157.9, 133.1, 129.2, 113.9, 55.2, 45.4, 30.1, 28.9; HRMS (ESI) calcd for C11H14O2: 178.0994, found 178.0996.
(4-氯苄基)丙酮(14):无色液体, 17.2 mg, 收率63%. 1H NMR (500 MHz, CDCl3) δ: 7.26 (d, J=8.2 Hz, 2H), 7.14 (d, J=8.2 Hz, 1H), 2.87 (t, J=7.3 Hz, 2H), 2.76 (t, J=7.3 Hz, 2H), 2.15 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 207.5, 139.4, 131.8, 129.7, 128.5, 44.9, 30.1, 28.9; HRMS (ESI) calcd for C10H11ClO: 182.0498, found 182.0477.
环戊基乙酮(15):无色液体, 5 mg, 收率30%. 1H NMR (500 MHz, CDCl3) δ: 2.86~2.81 (m, 1H), 2.12 (s, 3H), 1.83~1.52 (m, 8H); 13C NMR (125 MHz, CDCl3) δ: 211.2, 52.1, 28.6, 25.9; HRMS (ESI) calcd for C7H12O: 112.0888, found 112.0891.
5, 5-二苯基-2-丁酮(16):无色液体, 21.8 mg, 收率61%. 1H NMR (500 MHz, CDCl3) δ: 7.32~7.21 (m, 10H), 4.64 (t, J=7.5 Hz, 1H), 3.22 (d, J=7.5 Hz, 2H), 2.11 (s, 3H); 13C NMR (125 MHz, CDCl3) δ: 206.9, 143.8, 128.6, 127.7, 126.4, 49.6, 46.1, 30.6; HRMS (ESI) calcd for C17H18O: 238.1358, found 238.1364.
辅助材料(Supporting Information)化合物2~16的核磁共振图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
盛卫坚, 金城安, 单尚, 贾义霞, 高建荣, 有机化学, 2016, 36, 325. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345285.shtmlSheng, W.; Jin, C.; Shan, S.; Jia, Y.; Gao, J. Chin. J. Org. Chem. 2016, 36, 325(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345285.shtml
-
[2]
倪传法, 朱林桂, 胡金波, 化学学报, 2015, 73, 90. doi: 10.3866/PKU.WHXB2014Ac02Ni, C.; Zhu, L.; Hu, J. Acta Chim. Sinica 2015, 73, 90(in Chinese). doi: 10.3866/PKU.WHXB2014Ac02
-
[3]
苟宝权, 杨超, 张磊, 夏吾炯, 化学学报, 2017, 75, 66. doi: 10.11862/CJIC.2017.005Gou, B.; Yang, C.; Zhang, L.; Xia, W. Acta Chim. Sinica 2017, 75, 66(in Chinese). doi: 10.11862/CJIC.2017.005
-
[4]
荣健, 倪传法, 王云泽, 匡翠文, 顾玉诚, 胡金波, 化学学报, 2017, 75, 105.Rong, J.; Ni, C.; Wang, Y.; Kuang, C.; Gu, Y.; Hu, J. Acta Chim. Sinica 2017, 75, 105(in Chinese).
-
[5]
Zhuang, H.; Zeng, R.; Zou, J. Chin. J. Org. Chem. 2016, 34, 368. doi: 10.1002/cjoc.201500836
-
[6]
Heike, S.; Tim, C. Angew. Chem., Int. Ed. 2013, 52, 2.
-
[7]
Barreiro, E. J.; Kümmerle, A. E.; Fraga, C. A. M. Chem. Rev. 2011, 111, 5215. doi: 10.1021/cr200060g
-
[8]
Peretti, K. L.; Ajiro, H.; Cohen, C. T.; Lobkovsky, E. B.; Coates, G. W. J. Am. Chem. Soc. 2005, 127, 11566. doi: 10.1021/ja053451y
-
[9]
Nicholson, J. W.; Wilson, A. D. J. Chem. Educ. 2004, 81, 1362. doi: 10.1021/ed081p1362
-
[10]
Wilkinson, M. C. Org. Lett. 2011, 13, 2232. doi: 10.1021/ol200482s
-
[11]
Park, A.; Park, K.; Kim, Y.; Lee, S. Org. Lett. 2011, 13, 944. doi: 10.1021/ol102993y
-
[12]
Gooβen, L.; Rodriguez, N.; Gooβen, K. Angew. Chem., Int. Ed. 2008, 47, 3100. doi: 10.1002/(ISSN)1521-3773
-
[13]
Posner, G. H.; Whitten, C. E.; McFarland, P. E. J. Am. Chem. Soc. 1972, 94, 5106. doi: 10.1021/ja00769a066
-
[14]
Wang, X.; Zhang, L.; Sun, X.; Xu, Y.; Krishnamurthy, D.; Senanayake, C. H. Org. Lett. 2005, 7, 5593. doi: 10.1021/ol052150q
-
[15]
Ryu, I.; Ikebe, M.; Sonoda, N.; Yamato, S.; Yamamura, G.; Komatsu, M. Tetrahedron Lett. 2002, 43, 1257. doi: 10.1016/S0040-4039(01)02346-2
-
[16]
Dieter, R. K. Tetrahedron 1999, 55, 4177. doi: 10.1016/S0040-4020(99)00184-2
-
[17]
Nahm, S.; Weinreb, S. M. Tetrahedron Lett. 1981, 22, 3815. doi: 10.1016/S0040-4039(01)91316-4
-
[18]
Kangani, C. O.; Kelley, D. E.; Day, B. W. Tetrahedron Lett. 2006, 6289.
-
[19]
Qu, B.; Collum, D. B. J. Org. Chem. 2006, 71, 7117. doi: 10.1021/jo061223w
-
[20]
Alonso, F.; Lorenzo, E.; Yus, M. J. Org. Chem. 1996, 61, 6058. doi: 10.1021/jo9605962
-
[21]
Gilman, H.; van Ess, P. R. J. Am. Chem. Soc. 1933, 55, 1258. doi: 10.1021/ja01330a070
-
[22]
Tegner, C. Acta Chem. Scand 1952, 6, 782. doi: 10.3891/acta.chem.scand.06-0782
-
[23]
Jorgenson, M. J. Org. React. 1970, 18, 1.
-
[24]
Bare, T. M.; House, H. O. Org. Synth. 1973, 5, 775.
-
[25]
Lubell, W. D.; Rapoport, H. J. Am. Chem. Soc. 1988, 110, 7447 doi: 10.1021/ja00230a027
-
[26]
(a) Gu, J.; Wang, X.; Xue, W.; Gong, H. Org. Chem. Front. 2015, 2, 1411.
(b) Everson, D. A.; Weix, D. J. J. Org. Chem. 2014, 79, 4793.
(c) Knappke, C. E.; Grupe, S.; Gärtner, D.; Corpet, M.; Gosmini, C.; Jacobi von Wangelin, A. Chem. Eur. J. 2014, 20, 6828.
(d) Weix, D. J. Acc. Chem. Res. 2015, 48, 1767.
(e) Moragas, T.; Correa, A.; Martin, R. Chem. Eur. J. 2014, 20, 8242.
(f) Wang, X.; Dai, Y.; Gong, H. Top. Curr. Chem. 2016, 374, 43. -
[27]
Fillon, F.; Gosmini, C.; Perichon, J. Tetrahedron 2003, 59, 8199. doi: 10.1016/j.tet.2003.08.032
-
[28]
Hsieh, J.-H.; Cheng, C.-H. Chem. Commun. 2005, 4554.
-
[29]
Wotal, A.; Weix, D. J. Org. Lett. 2012, 14, 1476. doi: 10.1021/ol300217x
-
[30]
Wu, F.; Gong, H. Org. Lett. 2012, 14, 3044. doi: 10.1021/ol3011198
-
[31]
Yin, H.; Zhao, C.; You, H.; Lin, Q.; Gong, H. Chem. Commun. 2012, 48, 7034. doi: 10.1039/c2cc33232a
-
[32]
Zhao, C.; Jia, X.; Wang, X.; Gong, H. J. Am. Chem. Soc. 2013, 136, 17645.
-
[33]
Lu, W.; Liang, Z.; Zhang, Y.; Wu, F.; Qian, Q.; Gong, H. Synthesis 2013, 45, 2234. doi: 10.1055/s-00000084
-
[34]
Liang, Z.; Xue, W.; Lin, K.; Gong, H. Org. Lett. 2014, 16, 5620. doi: 10.1021/ol502682q
-
[35]
Jia, X.; Zhang, X.; Qian, Q.; Gong, H. Chem. Commun. 2015, 51, 10302. doi: 10.1039/C5CC03113C
-
[36]
Christelle, P.; François, C.; Bertrand, C. Org. Lett. 2001, 3, 803. doi: 10.1021/ol000338y
-
[1]
-
表 1 反应条件的优化
Table 1. Optimization of reaction conditions

Entry Cat. Ligand Solvent Additive Yielda/% 1 NiBr2"diglyme 3a THF TBAI 41 2 Ni(cod)2 3a THF TBAI 10 3 NiI2 3a THF TBAI 6 4 NiBr2 3a THF TBAI 32 5 Ni(acac)2 3a THF TBAI 55 6 Ni(acac)2 3b THF TBAI 33 7 Ni(acac)2 3c THF TBAI 39 8 Ni(acac)2 3d THF TBAI 26 9 Ni(acac)2 4 THF TBAI 25 10b Ni(acac)2 5 THF TBAI Trace 11 Ni(acac)2 3a MeCN TBAI 45 12 Ni(acac)2 3a DMA TBAI 20 13 Ni(acac)2 3a DMSO TBAI Trace 14 Ni(acac)2 3a THF No TBAI Trace 15 Ni(acac)2 3a THF No Boc2O N.D. 16 Ni(acac)2 3a THF No MgCl2 20 a Yields were determined by 1H NMR with 2, 5-dimethylfuran as an internal standard (calibrated); b100 mol% pyridine as base. 表 2 烷基酸与对甲苯磺酸甲酯成酮底物扩展
Table 2. Scope of alkyl acid with methyl p-tosylate

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 3
- 文章访问数: 1497
- HTML全文浏览量: 191


 下载:
下载:

 下载:
下载:

