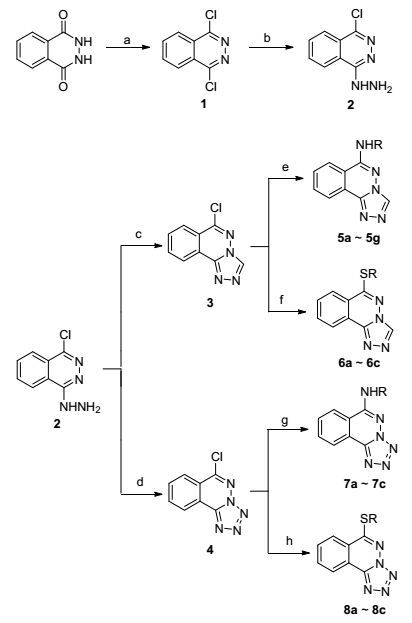
 图式1
酞嗪衍生物的合成路线
Scheme1.
Synthesis of phthalazine derivatives
图式1
酞嗪衍生物的合成路线
Scheme1.
Synthesis of phthalazine derivatives

Citation: Zhang Haiming, Zhang Hongjian, Tian Yushun, Quan Zheshan. Synthesis and Anticonvulsant Activity Evaluation of Phthalazine and Heterocyclic Derivatives[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2322-2327. doi: 10.6023/cjoc201703019

酞嗪并三唑或四唑类衍生物的合成及其抗惊厥活性研究
English
Synthesis and Anticonvulsant Activity Evaluation of Phthalazine and Heterocyclic Derivatives
-
Key words:
- phthalazine
- / triazolo
- / tetrazolo
- / synthesis
- / anticonvulsant
- / the maximal electroshock
-
癫痫是大脑神经元突发性异常放电, 导致短暂大脑功能障碍的一种慢性神经系统疾病, 并且随患病时间的推移反复发作; 癫痫的发病原因非常复杂, 遗传、脑损害与脑损伤、环境因素、发热、精神刺激等是常见的影响因素[1, 2].据世界卫生组织(WHO)研究报告表明, 目前全世界有超过6000万的患者饱受癫痫疾病的困扰, 其中80%在发展中国家, 每年还出现200万新增癫痫病例[3].手术治疗、针灸治疗和药物治疗等方法是常用的治疗方法, 其中, 药物治疗是临床抗癫痫的首选方法, 主要防止和控制癫痫的发作.苯妥英、苯巴比妥、卡马西平、丙戊酸等是目前临床常用的传统抗癫痫药(AEDs). 20世纪80年代以来, 国外开发上市的新抗癫痫药有加巴喷丁、奥卡西平、托吡酯、拉莫三嗪等.但应用现有这些抗癫痫药物治疗癫痫, 只能使60%~70%的癫痫患者的症状得到有效控制, 另有30%~40%的患者得不到良好的效果[4~7].而且如果长期服用这些药物, 会产生全身性毒性作用、神经系统毒性、嗜睡、胃肠道紊乱和巨幼红细胞性贫血等多样的副作用, 增加中毒、致畸的风险[8].因此, 研究低毒有效的新一代抗癫痫药物仍具有重要意义.
文献报道, 酞嗪类化合物具有抗惊厥作用[9].而前期研究工作中, 我们发现三唑类和四唑类衍生物也具有较好抗惊厥作用[10~14], 谭月德等[15]在2016年发现5-三唑苯并[d]噁唑类化合物具有较好的抗惊厥活性.为了获得抗惊厥作用更强的化合物, 本工作利用新药设计中拼合原理, 设计合成了6-取代-1, 2, 4-三氮唑并[3, 4-a]酞嗪和6-取代四氮唑并[5, 1-a]酞嗪四个系列衍生物, 共16个新化合物.其中, 酞嗪并三唑或四唑为结构主体, 而6位不同基团取代用于调节分子的疏水性, 从而改变其脂水分配系数, 以求达到更好的抗惊厥活性.
1 结果与讨论
1.1 目标化合物的合成
目标物的合成参考文献[16~21]方法, 首先以双酮酞嗪为起始原料, 用三氯氧磷进行氯代反应, 得到双氯代产物1.化合物1再与水合肼发生肼代反应, 得到肼代化合物2.化合物2与原甲酸三乙酯在100 ℃下发生环合反应, 得到酞嗪并三唑中间体3.化合物3以N, N-二甲基甲酰胺为溶剂, 与各种吡啶胺类、苯胺类、苯硫醇于100 ℃反应, 得到目标化合物5a~5g和6a~6c.化合物2与亚硝酸钠, 以水作溶剂, 酸性条件发生重氮化及环合反应, 生成酞嗪并四唑中间体4.中间体4以乙腈为溶剂, 于80 ℃下, 与各种苯胺类和苯硫醇类反应得到酞嗪并四唑系列目标化合物7a~7c和8a~8c.
1.2 化合物的生物活性分析
通过Ⅰ期药理实验, 初步评价了目标化合物5a~5g, 6a~6c, 7a~7c和8a~8c的抗惊厥活性.如表 1所示, 在300 mg•kg-1剂量下, 大多数化合物都显示了不同程度的抗惊厥活性, 而在100 mg•kg-1剂量下, 只有部分化合物表现出明显的抗惊厥活性, 其中化合物5c, 5g, 6a~6c, 7a~7c表现最为突出, 化合物6b和7a在30 mg•kg-1仍表现出显著的抗惊厥活性.在酞嗪并三唑系列化合物中, 与硫醇反应后的化合物6其抗惊厥活性明显优于与芳胺反应后的产物5; 酞嗪并四唑系列化合物7a~7c和8a~8c药理结果显示, 其结构中的NH被S替代后使化合物的抗惊厥活性减弱, 说明NH结构对化合物的抗惊厥活性影响较大.化合物8与化合物6相比, 四唑环替代三唑环后, 其活性也呈现减弱趋势, 说明四唑环对化合物的抗惊厥效能不如三唑环高.对化合物7a活性最优的探讨主要分为两个方面:一方面, 化合物6a, 7a和8a的取代R基团上都是p-Br, 化合物6a与8a相比, 化合物6a的活性优于化合物8a, 说明化合物中三唑基团对抗惊厥活性的效能优于四唑基团, 而化合物7a与8a的区别在于NH取代S, 说明NH的抗惊厥效能更高, 然而, 6a抗惊厥活性却不如7a, 说明可能NH对抗惊厥的活性效能优于三唑环的效能, NH是关键活性基团, 可能与某些酶发生相互作用而发挥抗惊厥活性; 另一方面, 化合物7a~7c对位分别是Br, Cl, F原子, 而化合物7a取代基对位恰巧为吸电子能力处于中间的Br原子, 则说明化合物7a的活性最好可能是因为各基团效能综合的结果使此时的脂水分配系数最适合透过血脑屏障从而发挥抗惊厥作用.
Compd. R MES(n1/n2)a 30 mg•kg-1 100 mg•kg-1 300 mg•kg-1 5a 
— 0/3 1/3 5b 
0/3 1/3 3/3 5c 
1/3 2/3 3/3 5d 
0/3 1/3 3/3 5e 
— 0/3 2/3 5f 
— 0/3 1/3 5g 
2/3 3/3 3/3 6a 
0/3 2/3 3/3 6b 
3/3 3/3 3/3 6c 
1/3 3/3 3/3 7a 
3/3 3/3 3/3 7b 
0/3 2/3 3/3 7c 
1/3 2/3 3/3 8a 
— 0/3 1/3 8b 
— 0/3 2/3 8c 
0/3 1/3 2/3 aMES(n1/n2) is number of animals exhibiting activity/number of animals tested; “—” : not test. 根据Ⅰ期药理实验的结果, 进一步进行了Ⅱ期药理实验, 对具有较好活性的化合物6b和7a进行研究, 以定量评价其抗惊厥活性. 2个目标化合物和阳性对照药卡马西平的实验结果见表 2, 化合物6b和7a的ED50分别为14.94和5.84 mg•kg-1, 其中化合物6b活性稍弱于阳性对照药卡马西平, 而化合物7a的ED50明显低于阳性对照药卡马西平(11.80 mg/kg), 具有进一步开发的价值.
Compd. R ED50/(mg•kg-1) 6b 
14.94 (11.78~20.92)a 7a 
5.89 (4.27~7.59)a Carbamazepine 11.80 (8.96~12.81)a a95% confidence intervals given in parentheses. 2 结论
以双酮酞嗪为先导化合物, 经氯代、肼代、环合, 获得双酮呔嗪并三唑或四唑中间体, 然后在其6位引入不同取代基, 最终得到四个系列16个目标化合物, 所合成化合物结构均经过1H NMR、13C NMR、IR和HRMS确证.在对抗最大电惊厥(MES)法实验中, 化合物7a的抗惊厥活性最为显著, 其ED50为5.89 mg/kg, 明显优于阳性对照药卡马西平, 对研究开发新型抗癫痫候选药物具有重要意义.
3 实验部分
3.1 仪器与试剂
熔点用毛细管法测定, 温度计未经校正; 1H NMR和13C NMR用BRUKER AV-300型核磁共振仪器测定(TMS为内标, CDCl3或DMSO-d6为溶剂); IR谱采用FI-1730型红外光谱仪(KBr压片)测定; HRMS数据来源于MALDI-TOF/TOF; 本实验所用试剂均为分析纯或化学纯.
3.2 化合物的合成
3.2.1 1, 4-二氯酞嗪(1)和1-肼基-4-氯酞嗪(2)的合成
按照文献[22]方法制备, 合成方法与数据表征与文献一致.
3.2.2 6-氯-[1, 2, 4]三氮唑并[3, 4-a]酞嗪(3)的合成
将化合物2 (2 g, 10 mmol)溶解在60 mL的原甲酸三乙酯中, 150 ℃搅拌回流2 h, 薄层色谱(TLC) (VDCM:VMeOH=30:1) 显示反应完反应, 减压蒸出溶剂, 水洗干燥, 硅胶柱层析(二氯甲烷)得化合物3为白色固体, 产率: 70%~80%. m.p. 177~179 ℃(文献值[22]: 176~177 ℃); 1H NMR (300 MHz, CDCl3) δ: 9.01 (s, 1H), 8.73 (d, J=7.9 Hz, 1H), 8.30 (d, J=8.2 Hz, 1H), 8.05 (td, J=7.8, 1.2 Hz, 1H), 7.96~7.88 (m, 1H).
3.2.3 化合物5a~5g和6a~6c的合成通法
以N-(5-氟吡啶-2-基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪-6-胺(5a)的合成为例.将化合物4 (0.3 g, 1.5 mmol)、氢氧化钠(0.07 g, 1.8 mmol)和2-氨基-5-氟吡啶(0.2 g, 1.8 mmol)分散在5 mL的N, N-二甲基甲酰胺(DMF)中, 100℃下搅拌反应2 h, TLC (VDCM:VMeOH=30:1) 显示反应结束, 减压蒸出大部分DMF, 加入50 mL冰水, 析出沉淀, 减压抽滤得滤饼, 水洗3遍, 干燥, 用乙醇重结晶得纯品5a.
N-(5-氟吡啶-2-基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪-6-胺(5a):棕色固体, 产率40.9%. m.p. 300~304 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 10.03 (s, 1H, NH), 9.28 (s, 1H, CH), 8.64 (d, J=7.7 Hz, 1H, ArH), 8.50 (d, J=7.4 Hz, 1H, ArH), 8.40 (s, 1H, PyH), 8.14~7.98 (m, 2H, Py-H), 7.91 (d, J=7.6 Hz, 1H, ArH), 7.81 (s, 1H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 154.24, 149.72, 141.67, 139.88, 135.68, 135.35, 134.01, 131.04, 125.91, 125.73, 125.48, 123.90, 123.17, 119.43, 116.51, 110.36; IR (KBr) ν: 3262.86 (N-H), 1520 (C=N) cm-1; ESI-HRMS calcd for C14H10FN6[M+H]+ 281.0951, found 281.0935.
N-(6-氯吡啶-3-基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪-6-胺(5b):合成方法及投料比同上, 产品为棕色固体, 产率40.9%. m.p. 320~322 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.58 (s, 1H, NH), 9.27 (s, 1H, CH), 8.86 (d, J=2.5 Hz, 1H, Py-H), 8.57 (d, J=8.0 Hz, 1H, ArH), 8.49 (d, J=7.7 Hz, 1H, ArH), 8.28 (dd, J=8.7, 2.7 Hz, 1H, Py-H), 8.03 (t, J=7.5 Hz, 1H, ArH), 7.95 (t, J=7.7 Hz, 1H, ArH), 7.54 (d, J=8.7 Hz, 1H, Py-H); 13C NMR (75 MHz, DMSO-d6) δ: 149.89, 143.77, 142.92, 141.53, 139.97, 136.62, 134.10, 132.31, 131.08, 125.23, 124.36, 123.83, 123.36, 119.15; IR (KBr) ν: 3282.28 (N—H), 1517.14(C=N) cm-1; ESI-HRMS calcd for C14H10ClN6[M+H]+ 297.0655, found 297.0641.
N-(3-氟苯基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪-6-胺(5c):合成方法及投料比同上, 产品为淡黄色粉末, 产率65.9%. m.p. 314~318 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.42 (s, 1H, NH), 9.30 (s, 1H, CH), 8.59 (d, J=7.6 Hz, 1H, ArH), 8.48 (d, J=7.3 Hz, 1H, ArH), 8.01 (t, J=7.1 Hz, 1H, ArH), 7.95 (d, J=7.4 Hz, 1H, ArH), 7.79 (d, J=11.7 Hz, 1H, ArH), 7.61 (d, J=7.8 Hz, 1H, ArH), 7.41 (dd, J=14.7, 7.4 Hz, 1H, ArH), 6.91 (t, J=6.9 Hz, 1H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 164.24, 149.82, 142.02, 141.47, 140.02, 133.93, 131.00, 130.55, 125.26, 123.83, 123.31, 119.31, 117.26, 109.91, 109.62, 108.42, 108.07; IR (KBr) ν: 3237.14 (N—H), 1514.29 (C=N) cm-1; ESI-HRMS calcd for C15H11FN5 [M+H]+ 280.0988, found 280.0991.
N-(3-溴苯基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪-6-胺(5d):合成方法及投料比同上, 产品为棕色固体, 产率54.0%. m.p. 302~304 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.39 (s, 1H, NH), 9.27 (s, 1H, CH), 8.59 (d, J=7.6 Hz, 1H, ArH), 8.50 (d, J=7.2 Hz, 1H, ArH), 8.08~7.91 (m, 3H, ArH), 7.86 (d, J=7.3 Hz, 1H, ArH), 7.45~7.21 (m, 2H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 149.90, 141.89, 141.52, 139.98, 133.97, 131.04, 126.02, 125.27, 123.94, 123.85, 123.33, 121.87, 120.49, 120.0, 119.34; IR (KBr) ν: 3188.57 (N—H), 1514.29 (C=N) cm-1; ESI-HRMS calcd for C15H11BrN5[M+H]+ 340.0198, found 340.0190.
N-(4-三氟甲基苯基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪-6-胺(5e):合成方法及投料比同上, 产品为白色粉末, 产率12.3%. m.p. 296~298 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.65 (s, 1H, NH), 9.29 (s, 1H, CH), 8.62 (d, J=8.0 Hz, 1H, ArH), 8.56~8.46 (m, 1H, ArH), 8.09~7.93 (m, 4H, ArH), 7.74 (d, J=8.8 Hz, 2H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 149.80, 144.07, 141.57, 139.97, 134.08, 131.05, 126.32, 126.27, 125.43, 123.89, 123.33, 121.16, 119.39; IR (KBr) ν: 3288.57 (N-H), 1517.72 (C=N) cm-1; ESI-HRMS calcd for C16H11F3N5[M+H]+ 330.0967, found 330.0953.
N-(3, 4-二氯苯基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪-6-胺(5f):合成方法及投料比同上, 产品为黄色粉末, 产率77.1%. m.p. 325~330 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.52 (s, 1H, NH), 9.30 (s, 1H, CH), 8.58 (d, J=8.1 Hz, 1H, ArH), 8.54~8.47 (m, 1H, ArH), 8.13 (d, J=2.5 Hz, 1H, ArH), 8.04 (t, J=7.5 Hz, 1H, ArH), 7.96 (t, J=7.0 Hz, 1H, ArH), 7.83 (dd, J=8.9, 2.5 Hz, 1H, ArH), 7.63 (d, J=8.8 Hz, 1H, ArH); 13C NMR (75 MHz, DMSO-d6)δ: 149.77, 141.51, 140.46, 140.01, 135.60, 134.06, 131.29, 131.06, 130.85, 125.31, 124.74, 123.85, 123.34, 122.71, 121.58, 119.28; IR (KBr) ν: 3237.14 (N—H), 1514.29 (C=N) cm-1; ESI-HRMS calcd for C15H10Cl2N5 [M+H]+ 330.0313, found 330.0301.
N-苯基-1, 2, 4-三氮唑并[3, 4-a]酞嗪-6-胺(5g):合成方法及投料比同上, 产品为淡黄色粉末, 产率20.6%. m.p. 260~263 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.28 (s, 1H, NH), 9.22 (s, 1H, CH), 8.60 (d, J=8.0 Hz, 1H, ArH), 8.48 (d, J=7.7 Hz, 1H, ArH), 8.00 (t, J=7.4 Hz, 1H, ArH), 7.92 (t, J=7.7 Hz, 1H, ArH), 7.79 (d, J=7.6 Hz, 2H, ArH), 7.39 (t, J=7.9 Hz, 2H, ArH), 7.11 (t, J=7.3 Hz, 1H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 150.22, 141.52, 140.10, 139.89, 133.76, 130.97, 129.09, 125.26, 123.80, 123.69, 123.27, 122.16, 119.43; IR (KBr) ν: 3351.7 (N—H), 1517.14 (C=N) cm-1; ESI-HRMS calcd for C15H12N5[M+H]+ 262.1093, found 262.1079
6-(4-溴代硫苯基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪(6a):合成方法及投料比同上, 产品为淡黄色固体, 产率23.1%. m.p. 170~174 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.77 (s, 1H, CH), 8.70 (d, J=7.9 Hz, 1H, ArH), 8.23 (d, J=8.2 Hz, 1H, ArH), 8.08~7.94 (m, 1H, ArH), 7.90~7.81 (m, 1H, ArH), 7.73~7.61 (m, 2H, ArH), 7.58~7.50 (m, 2H, ArH); 13C NMR (75 MHz, CDCl3) δ: 157.33, 137.15, 134.10, 132.85, 130.94, 125.62, 125.47, 124.87, 123.79, 122.86, 122.63; IR (KBr) ν: 1502.86 (C=N) cm-1; ESI-HRMS calcd for C15H10BrN4S[M+H]+ 356.9810, found 356.9814.
6-(4-氯代硫苯基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪(6b):合成方法及投料比同上, 产品为黄色固体, 产率23.9%. m.p. 166~168 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.36 (s, 1H, CH), 8.52 (d, J=7.8 Hz, 1H, ArH), 8.24 (d, J=8.1 Hz, 1H, ArH), 8.07 (t, J=7.6 Hz, 1H, ArH), 7.93 (t, J=7.7 Hz, 1H, ArH), 7.71 (d, J=8.5 Hz, 2H, ArH), 7.58 (d, J=8.5 Hz, 2H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 156.58, 141.84, 140.10, 136.99, 135.32, 135.04, 131.81, 130.23, 126.53, 126.12, 123.42, 122.83, 122.56; IR (KBr) ν: 1502.86 (C=N) cm-1; ESI-HRMS calcd for C15H10ClN4S[M+H]+ 313.0315, found 313.0300.
6-(4-氟代硫苯基)-1, 2, 4-三氮唑并[3, 4-a]酞嗪(6c):合成方法及投料比同上, 产品为白色固体, 产率54.5%. m.p. 194~196 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.32 (s, 1H, CH), 8.51 (d, J=7.9 Hz, 1H, ArH), 8.25 (d, J=8.0 Hz, 1H, ArH), 8.08 (t, J=7.6 Hz, 1H, ArH), 7.94 (t, J=7.7 Hz, 1H, ArH), 7.83~7.73 (m, 2H, ArH), 7.46~7.34 (m, 2H, ArH); 13C NMR (75 MHz, CDCl3) δ: 165.64, 162.31, 157.91, 157.89, 142.12, 139.10, 138.11, 138.00, 134.04, 130.92, 125.38, 123.73, 122.82, 122.52, 121.50, 121.45, 117.10, 116.81; IR (KBr) ν: 1502.29 (C=N) cm-1; ESI-HRMS calcd for C15H10FN4S[M+H]+ 297.0610, found 297.0641.
3.2.4 6-氯-四唑并[1, 5-a]酞嗪(4)的合成
量取盐酸3 mL (6 mol/L), 用40 mL水稀释, 称取化合物2 (2 g, 10 mmol)溶解在稀释备用的盐酸水溶液中, 将亚硝酸钠(0.7 g, 10 mmol)溶解到水(15 mL)中, 缓慢滴加至事先冰浴的反应体系中, 确保整个反应体系温度在5 ℃下, TLC跟踪, 3 h反应完全, 析出淡棕色沉淀, 抽滤得滤饼, 乙醇重结晶得纯品1.36 g, 化合物为土黄色, 产率65%~72%[23]. m.p. 188~190 ℃; 1H NMR (300 MHz, CDCl3) δ: 8.79 (d, J=7.9 Hz, 1H), 8.48 (d, J=8.0 Hz, 1H), 8.23~8.18 (m, 1H), 8.15~8.09 (m, 1H).
3.2.5 化合物7a~7c和8a~8c的合成通法
以N-(4-溴苯基)-四唑[5, 1-a]酞嗪-6-胺(7a)的合成为例.将化合物4 (0.3 g, 1.5 mmol)和对溴苯胺(0.31 g, 1.8 mmol)溶于乙腈(25 mL)中, 再加入碳酸钾(0.25 g, 1.8 mmol), 温度升至80 ℃, 回流2 h, TLC (VDCM:VMeOH=30:1) 监测, 反应完全后, 减压除去大部分乙腈, 倒入碎冰水中, 析出沉淀, 抽滤, 水洗至中性, 真空干燥, 用乙醇进行重结晶得纯品7a.
N-(4-溴苯基)-四唑[5, 1-a]酞嗪-6-胺(7a):淡黄色粉末, 产率62.3%. m.p. 258~260 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.78 (s, 1H, NH), 8.75 (d, J=7.1 Hz, 1H, ArH), 8.63~8.51 (m, 1H, ArH), 8.22~8.02 (m, 2H, ArH), 7.81 (d, J=8.8 Hz, 2H, ArH), 7.64 (d, J=8.8 Hz, 2H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 151.52, 140.53, 138.77, 134.43, 132.70, 132.03, 125.46, 124.71, 124.55, 122.38, 120.55, 116.28; IR (KBr) ν: 3282.66 (N—H), 1505.71 (C=N) cm-1; ESI-HRMS calcd for C14H10BrN6 [M+H]+ 341.0150, found 341.0139.
N-(4-氯苯基)-四唑[5, 1-a]酞嗪-6-胺(7b):制备方法及投料比同上, 产品为黄色粉末, 产率58.1%. m.p. 258~262 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.78 (s, 1H, NH), 8.81~8.70 (m, 1H, ArH), 8.62~8.50 (m, 1H, ArH), 8.19~8.02 (m, 2H, ArH), 7.86 (d, J=8.9 Hz, 2H, ArH), 7.49 (d, J=8.9 Hz, 2H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 151.45, 140.41, 138.25, 134.29, 132.57, 129.01, 128.21, 125.39, 124.61, 124.11, 122.29, 120.41; IR (KBr) ν: 3336.28 (N—H), 1514.29 (C=N) cm-1; ESI-HRMS calcd for C14H10ClN6 [M+H]+ 297.0655, found 297.0641.
N-(4-氟苯基)-四唑[5, 1-a]酞嗪-6-胺(7c):制备方法及投料比同上, 产品为淡黄色固体, 产率46.3%. m.p. 272~274 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 9.72 (s, 1H, NH), 8.71 (d, J=7.1 Hz, 1H, ArH), 8.53 (d, J=7.6 Hz, 1H, ArH), 8.08 (t, J=8.5 Hz, 2H, ArH), 7.80 (dd, J=8.6, 4.9 Hz, 2H, ArH), 7.30 (t, J=8.7 Hz, 2H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 160.81, 158.60, 157.62, 151.88, 140.42, 135.52, 134.32, 132.65, 125.33, 125.16, 125.06, 124.65, 122.29, 120.43, 116.02, 115.73; IR (KBr) ν: 3274.56 (N—H), 1511.43 (C=N) cm-1; ESI-HRMS calcd for C14H10FN6 [M+H]+ 281.0951, found 281.0939.
6-(4-溴代硫苯基)-四唑[5, 1-a]酞嗪(8a):制备方法及投料比同上, 产品为白色粉末, 产率71.1%. m.p. 240~242 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 8.66 (s, 1H, ArH), 8.44 (d, J=7.3 Hz, 1H, ArH), 8.21 (d, J=7.6 Hz, 1H, ArH), 8.15 (d, J=6.9 Hz, 1H, ArH), 7.79 (d, J=7.6 Hz, 2H, ArH), 7.72 (s, 2H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 159.89, 141.98, 137.82, 135.68, 133.61, 133.35, 126.17, 125.89, 124.92, 124.72, 124.44, 121.42; IR (KBr) ν: 1474.29 (C=N) cm-1; ESI-HRMS calcd for C14H9BrN5S [M+H]+ 359.9762, found 359.9729.
6-(4-氯代硫苯基)-四唑[5, 1-a]酞嗪(8b):制备方法及投料比同上, 产品为白色固体, 产率63.1%. m.p. 232~236 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 8.66 (d, J=7.4 Hz, 1H, ArH), 8.45 (d, J=7.7 Hz, 1H, ArH), 8.22 (d, J=7.5 Hz, 1H, ArH), 8.15 (d, J=7.5 Hz, 1H, ArH), 7.79 (d, J=7.8 Hz, 2H, ArH), 7.67 (d, J=7.6 Hz, 2H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 159.99, 141.96, 137.67, 135.98, 135.67, 133.60, 130.43, 126.13, 125.31, 124.90, 124.40, 121.39; IR (KBr) ν: 1480 (C=N) cm-1; ESI-HRMS calcd for C14H9ClN5S[M+H]+ 314.0267, found 314.0258.
6-(4-氟代硫苯基)-四唑[5, 1-a]酞嗪(8c):制备方法及投料比同上, 产品为白色固体, 产率63.1%. m.p. 232~236 ℃; 1H NMR (300 MHz, DMSO-d6) δ: 8.64 (d, J=7.7 Hz, 1H, ArH), 8.44 (d, J=7.9 Hz, 1H, ArH), 8.22 (t, J=7.2 Hz, 1H, ArH), 8.13 (t, J=7.6 Hz, 1H, ArH), 7.82 (dd, J=8.3, 5.4 Hz, 2H, ArH), 7.46 (t, J=8.7 Hz, 2H, ArH); 13C NMR (75 MHz, DMSO-d6) δ: 165.57, 162.27, 160.39, 141.90, 138.72, 138.61, 135.62, 133.57, 126.04, 124.88, 124.31, 121.72, 121.68, 121.30, 117.78, 117.48; IR (KBr) ν: 1494.29 (C=N) cm-1; ESI-HRMS calcd for C14H9FN5S[M+H]+ 298.0563, found 298.0549.
3.2 抗惊厥药理实验
药理实验方法参照美国卫生研究院抗癫痫药物开发计划的抗癫痫药物筛选程序[24, 25].采用最大电惊厥(MES)实验评价化合物抗惊厥药理活性, 此方法能够迅速、全面地筛选化合物的抗惊厥活性.实验釆用昆明种小鼠, 体重18~22 g (鼠龄周4~5周)为测试动物, 雌雄各半.实验前一周饲养于20~25 ℃、相对湿度45%~65%的实验室中, 可以自由采食和饮水.抗惊厥药理实验主要分成两个阶段, Ⅰ期和Ⅱ期药理实验; 在最大电惊厥实验中, 使用50 mA, 60 Hz的交流电, 小鼠耳电极通电0.2 s出现后肢强直的视为惊厥, 正式实验前一天预筛小鼠, 出现惊厥的小鼠用于正式实验.
3.2.1 小鼠体内Ⅰ期实验
在Ⅰ期药理实验中, 将小鼠随机分组, 每组3只.将药物溶解在适量二甲基亚砜(DMSO)中, 分别以30, 100, 300 mg•kg-1不同的剂量, 给与小白鼠腹腔注射; 给药0.5 h后进行最大电惊厥实验, 记录不同剂量下的抗惊厥小鼠的个数, 以此来初步评价化合物的抗惊厥活性.
3.2.2 小鼠体内Ⅱ期实验
为定量评价Ⅰ期药理实验中筛选出的活性化合物, 在Ⅱ期药理实验中主要测定其抗惊厥的半数有效量, 并计算其95%可信限.阳性对照药依然选用临床上常用抗癫痫药卡马西平.
辅助材料(Supporting Information) 化合物5a~5g, 6a~6c, 7a~7c, 8a~8c的核磁共振氢谱、碳谱和高分辨质谱图谱.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
Gasior, M.; Carter, R. B.; Goldberg, S. R.; Witkin, J. M.; Pharmacol, J. Exp. Ther. 1997, 282, 544.
-
[2]
Mccormick, D. A.; Contreras, D. Annu. Rev. Physiol. 2001, 63, 815. doi: 10.1146/annurev.physiol.63.1.815
-
[3]
Strine, T. W.; Kobau, R.; Chapman, D. P.; Thurman, D. J.; Price, P.; Balluz, L. S. Epilepsia 2005, 46, 1133. doi: 10.1111/epi.2005.46.issue-7
-
[4]
Sirven, J. I.; Noe, K.; Hoerth, M.; Drazkowski, J. Mayo. Clin. Proc. 2012, 87, 879. doi: 10.1016/j.mayocp.2012.05.019
-
[5]
Kwan, P.; Brodie, M. J. N. Engl. J. Med. 2000, 342, 315.
-
[6]
Penovich, P. E.; Willmore, L. J. Epilepsia 2009, 50, 38. doi: 10.1111/epi.2009.50.issue-s12
-
[7]
Bialer, M.; Johannessen, S. I.; Kupferberg, H. J.; Levy, R. H.; Perucca, E.; Tomson, T. Epilepsy Res. 2007, 73, 2.
-
[8]
Bootsma, H. P.; Ricker, L.; Hekster, Y. A.; Hulsman, J.; Lambrechts, D.; Majoie, M.; Schellekens, A.; Krom, D. M.; Aldenkamp, A. P. Seizure 2009, 18, 328.
-
[9]
Ramaiya, S.; Sundararaj, K. G.; Somasundaram, R.; Joseph, T. L. Eur. J. Med. Chem. 2002, 37, 793. doi: 10.1016/S0223-5234(02)01405-8
-
[10]
Guo, L. J.; Wei, C. X.; Jia, J. H.; Zhao, L. M.; Quan, Z. S. Eur. J. Med. Chem. 2009, 44, 954. doi: 10.1016/j.ejmech.2008.07.010
-
[11]
Sun, X. Y.; Wei, C. X.; Deng, X. Q.; Sun, Z. G.; Quan, Z. S. Pharmacol. Rep. 2010, 62, 273. doi: 10.1016/S1734-1140(10)70266-8
-
[12]
Wang, S. B.; Deng, X. Q.; Zheng, Y.; Yuan, Y. P.; Quan, Z. S.; Guan, L. P. Eur. J. Med. Chem. 2012, 56, 139. doi: 10.1016/j.ejmech.2012.08.027
-
[13]
Zhu, Z. S.; Wang, S. B.; Deng, X. Q.; Liu, D. C.; Quan, Z. S. Lett. Drug Des. Dis. 2014, 11, 628. doi: 10.2174/1570180810666131122003939
-
[14]
Wang, S. B.; Deng, X. Q.; Liu, D. C.; Zhang, H. J.; Quan, Z. S. Med. Chem. Res. 2014, 23, 4619. doi: 10.1007/s00044-014-1030-0
-
[15]
谭月德, 何晓艳, 饶宝奇, 程彬彬, 宋明霞, 邓先清, 有机化学, 2016, 36, 2449. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345589.shtmlTan, Y. D.; He, X. Y.; Rao, B. Q.; Cheng, B. B.; Song, M. X.; Deng, X. Q. Chin. J. Org. Chem. 2016, 36, 2449(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345589.shtml
-
[16]
Zhang, L.; Guan, L. P.; Sun, X. Y.; Wei, C. X.; Chai, K. Y.; Quan, Z. S. Chem. Biol. Drug Des. 2009, 73, 313. doi: 10.1111/jpp.2009.73.issue-3
-
[17]
Deng, X. Q.; Wei, C. X.; Song, M. X.; Quan, Z. S. Arzneim. Forsch. 2010, 60, 587.
-
[18]
Bian, M.; Deng, X. Q.; Gong, G. H.; Wei, C. X.; Quan, Z. S. J. Enzyme Inhib. Med. Chem. 2013, 28, 792. doi: 10.3109/14756366.2012.684052
-
[19]
Street, L. J.; Sternfeld, F.; Jelley, R. A.; Reeve, A. J.; Carling, R. W.; Moore, K. W.; McKernan, R. M.; Sohal, B.; Cook, S.; Pike, A.; Dawson, G. R.; Bromidge, F. A.; Wafford, K. A.; Seabrook, G. R.; Thompson, S. A.; Marshall, G.; Pillai, G. V.; Castro, J. L.; Atack, J. R.; MacLeod, A. M. J. Med. Chem. 2004, 47, 3642. doi: 10.1021/jm0407613
-
[20]
Wu, Y.; Sun, L. P.; Ma, L. X.; Che, J.; Song, M. X. Chem. Biol. Drug Des. 2013, 81, 591. doi: 10.1111/cbdd.2013.81.issue-5
-
[21]
王超杰, 曹钦坡, 杨慧, 宋攀攀, 薛登启, 崔飞, 顾一飞, 张孝松, 田亚楠, 张秋荣, 刘宏民, 有机化学, 2016, 36, 1627. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345486.shtmlWang, C. J.; Cao, Q. P.; Yang, H.; Song, P. P.; Xue, D. Q.; Cui, F.; Gu, Y. F.; Zhang, X. S.; Tian, Y. N.; Zhang, Q. R.; Liu, H. M. Chin. J. Org. Chem. 2016, 36, 16 27(in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345486.shtml
-
[22]
Xue, D. Q.; Zhang, X. Y.; Wang, C. J.; Ma, L. Y.; Zhu, N.; He, P.; Shao, K. P.; Chen, P. J.; Gu, Y, F.; Zhang, X. S.; Wang, C. F.; Ji, C. H.; Zhang, Q. R.; Liu, H. M. Eur. J. Med. Chem. 2014, 85, 235. doi: 10.1016/j.ejmech.2014.07.031
-
[23]
Bian, M.; Deng, X. Q.; Gong, G. H.; Wei, C. X.; Quan, Z. S. J. Enzyme Inhib. Med. Chem. 2013, 28, 792. doi: 10.3109/14756366.2012.684052
-
[24]
Okada, R.; Negishi, N.; Nagaya, H. Brain Res. 1989, 480, 384.
-
[25]
Liu, D. C.; Deng, X. Q.; Wang, S. B.; Quan, Z. S. Arch. Pharm. (Weinheim, Ger.) 2014, 347, 269.
-
[1]
-
图式1 酞嗪衍生物的合成路线
Scheme 1 Synthesis of phthalazine derivatives
Reagents and conditions: (a) POCl3, 80~110 ℃, 75%~80%; (b) NH2NH2•H2O, CH3CH2OH, reflux, 65%~72%; (c) CH(CH3CH2O)3, 100 ℃, 70%~80%; (d) H2O, HCl, NaNO2, < 5 ℃, 65%~72%; (e) RNH2, DMF, NaOH, 100 ℃; (f) RSH, DMF, NaOH, 100 ℃; (g) RNH2, CH3CN, K2CO3, reflux; (h) RSH, CH3CN, K2CO3, reflux
表 1 化合物的小鼠抗惊厥作用Ⅰ期实验数据a
Table 1. Phase I anticonvulsant data of compounds in mice
Compd. R MES(n1/n2)a 30 mg•kg-1 100 mg•kg-1 300 mg•kg-1 5a 
— 0/3 1/3 5b 
0/3 1/3 3/3 5c 
1/3 2/3 3/3 5d 
0/3 1/3 3/3 5e 
— 0/3 2/3 5f 
— 0/3 1/3 5g 
2/3 3/3 3/3 6a 
0/3 2/3 3/3 6b 
3/3 3/3 3/3 6c 
1/3 3/3 3/3 7a 
3/3 3/3 3/3 7b 
0/3 2/3 3/3 7c 
1/3 2/3 3/3 8a 
— 0/3 1/3 8b 
— 0/3 2/3 8c 
0/3 1/3 2/3 aMES(n1/n2) is number of animals exhibiting activity/number of animals tested; “—” : not test. 表 2 化合物5i和6d的小鼠抗惊厥作用Ⅱ期实验数据
Table 2. Phase Ⅱ anticonvulsant data of compounds 5i and 6d in mice
Compd. R ED50/(mg•kg-1) 6b 
14.94 (11.78~20.92)a 7a 
5.89 (4.27~7.59)a Carbamazepine 11.80 (8.96~12.81)a a95% confidence intervals given in parentheses. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 6
- 文章访问数: 939
- HTML全文浏览量: 86


 下载:
下载:
 下载:
下载:

