 图 图式1
过渡金属催化重氮参与的反应
Figure 图式1.
Transition-metal-catalyzed reactions with diazo compounds
图 图式1
过渡金属催化重氮参与的反应
Figure 图式1.
Transition-metal-catalyzed reactions with diazo compounds

Citation: Liu Lu, Zhang Junliang. Development of Transition-Metal-Catalyzed C(sp2)-H Functionalization of Arenes with Diazo Compounds[J]. Chinese Journal of Organic Chemistry, 2017, 37(5): 1117-1126. doi: 10.6023/cjoc201702020

过渡金属催化重氮化合物参与的芳烃碳(sp2)-氢键官能团化研究进展
English
Development of Transition-Metal-Catalyzed C(sp2)-H Functionalization of Arenes with Diazo Compounds
-
Key words:
- tansition-metal-catalysis
- / diazo compound
- / arene
- / C-H bond functionalization
- / site selective
-
碳-氢键官能团化, 指的是直接将有机分子中未活化的碳-氢键(C—H)转化为碳-碳键(C—C)或碳-杂键(C—X).由于其具有很高的步骤经济性和原子经济性, 符合现代绿色有机合成的发展方向, 在医药、化工、环境、能源、材料等很多领域具有应用价值, 因此受到化学家的广泛关注, 被誉为是“化学的圣杯”, 是化学家不懈努力的方向[1].但是, 要实现一个化合物的高选择性碳-氢键官能团化往往充满挑战性.这是由于一方面碳-氢键具有较高的离解能, 导致反应活性很低; 另一方面化合物中通常存在多个碳-氢键, 导致难以实现选择性活化.
重氮化合物易于制备, 化学性质活泼, 参与的有机转化多样, 是一类非常重要的有机合成中间体, 被广泛地应用在有机合成、化学生物学、材料化学、药物化学等领域[2, 3].自从1906年, Silberrad等[4]报道了第一例金属促进的重氮乙酸乙酯转化反应以后, 一系列重氮化合物参与的杂原子-氢键的插入反应、叶立德形成/重排反应、环丙烷化、环加成反应、偶联反应和碳-氢键官能团化反应等被报道出来(Scheme 1).
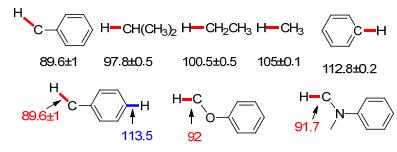
虽然卡宾参与的碳(sp3)-氢键[C(sp3)—H]官能团化反应(碳-氢键插入反应)已经得到了广泛的研究[5], 但是对芳烃的碳(sp2)-氢键官能化反应的研究相对较少, 可能是由于烷基的碳-氢键离解能比相应的芳烃的碳-氢键离解能低[6], 活性较高.尤其是芳烃上带有取代基时, 例如甲苯、苯甲醚和二甲基苯胺等, 这些烷基碳(sp3)-氢键的键能更是大幅度地降低, 因此选择性地实现这些化合物芳烃的碳(sp2)-氢键[C(sp2)—H]官能团化反应具有一定的挑战性(图 1).
根据导向与非导向两种不同的定位模式, 本文将简要介绍过渡金属催化重氮参与的芳烃碳-氢键官能团化反应的研究进展.同时对反应的类型及催化体系进行了总结, 并对代表性的反应进行了机理介绍.最后, 对该类反应的发展方向进行了展望, 希望能为相关的研究者提供一些新的思路.
1 导向的碳-氢键官能团化
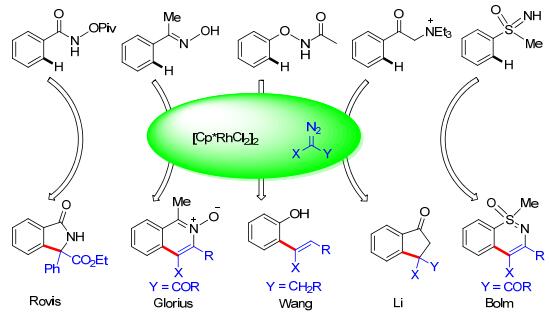
利用导向基团来控制碳-氢键官能团化反应的区域选择性是最常用的方法[7], 这也被应用在重氮化合物参与的碳-氢键官能团化中. 2012年, Yu等[8]报道了第一例Rh络合物([Cp*RhCl2]2) 催化的邻位碳-氢键官能团化.在这个体系中, 肟醚和胺都可以作为导向基团, 当使用胺为导向基团时, 可以发生进一步的关环反应得到异喹啉酮结构(Scheme 2, a).他们提出可能的机理如Scheme 2(b)所示:首先, 导向基团与Rh催化剂配位, 接着发生亲电的碳(sp2)-氢键断裂得到环铑中间体, 随后与重氮化合物作用形成铑卡宾, 最后发生迁移插入并质子解, 得到最终产物并释放出Rh催化物种, 实现催化循环.和其他的碳-氢键活化反应比较, 该反应不需要外加碱和氧化剂, 是一种环境友好的策略.随后很多课题组[9], 包括Rovis[9a], Glorius[9b], 王剑波[9c], 李兴伟[9d, 9e], Bolm[9f], Cui[9g], Chang[9h], Wang[9i, 9j]等, 利用[Cp*RhCl2]2为催化剂前体, 通过改变不同的导向基团来实现芳烃的碳-氢键官能团化.所有这些反应都得到了邻位碳-氢键活化, 卡宾插入在邻位上, 或者发生进一步的关环反应的结果(Scheme 3).
这一类反应也可以在手性Rh催化剂的条件下实现不对称催化. 2014年, Cramer小组[10]利用他们自己发展的具有C2对称性的手性茂环配体, 实现了Rh催化的不对称碳-氢键活化卡宾迁移反应, 取得了较好的收率和对映选择性(Eq. 1).
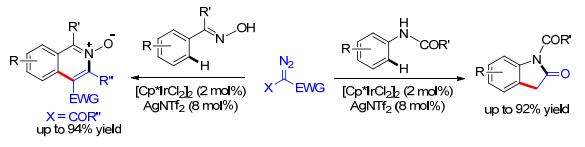
除了Rh催化剂以外, Ir络合物也可以催化这一类的碳-氢键官能团化反应. Patel等[11]使用肟和酰基肟醚为导向基团, 可以实现邻位的碳-氢键官能团化, 得到苯并六元氮杂环结构[11a, 11b]; 利用酰胺为导向基团, 与丙二酸环(亚)异丙酯重氮反应[11c], 得到氧化吲哚结构(Scheme 4).
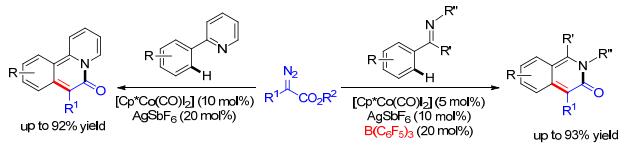
廉价金属Co也能应用在这种导向的通过卡宾迁移插入的碳-氢键官能团化反应中(Scheme 5). Glorius等[12]利用吡啶作为导向基团, 在Co催化剂的作用下, 实现了邻位的碳-氢键官能团化/关环反应, 得到了氮杂稠环体系[12a]; 也可以使用亚胺作为导向基团, 需要加入添加剂B(C6F5)3, 也可以发生类似反应, 得到异喹啉酮结构[12b].硼试剂在这个反应中主要起到两个作用, 既能加速碳-氢键活化的一步, 又能加快卡宾的形成. Ackermann小组[13]也报道了类似的结果.
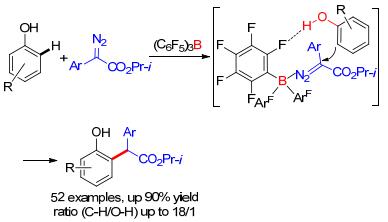
除了利用杂原子导向基团和金属配位来实现邻位选择性以外, 一些弱相互作用, 例如氢键, 也可以用来实现邻位导向的碳-氢键官能团化. 2016年, 我们小组[14]实现了高区域选择性的苯酚邻位碳-氢键官能团化.由于苯酚的羟基具有很强的反应性, 在一般的金属催化条件下很容易得到氧氢键插入的产物.在硼催化剂的条件下, 可以以最高达18:1的化学选择性得到碳-氢键官能团化的产物, 同时只有邻位选择性的产物.实现高区域选择性的关键是苯酚羟基的H和催化剂苯环上的F形成的氢键(Scheme 6).
3 非导向的碳-氢键官能团化
利用导向的策略来实现碳-氢键的官能团化虽然有很好的选择性, 但是也存在一些缺点.首先, 一般需要在底物分子中预先植入一个导向基团, 这对于一些缺乏官能团的分子来说是很难实现的; 其次, 导向基团一般只能导向在邻位, 其它的位置尤其是对位也无法实现.近年来, 非导向的碳-氢键官能化[15]得到了化学家的关注.这种方法通常利用催化剂和试剂来调控反应的位点, 具有更加广泛的应用前景, 但是难度也更大.
3.1 富电子芳烃的碳-氢键官能团化
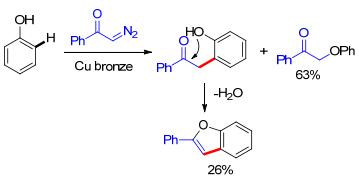
早在1952年, Yates[16]报道了第一例苯酚和重氮苯乙酮的反应, 除了主要的氧-氢键插入的主要产物之外, 还有一种苯并呋喃结构的副产物生成.这个副产物的形成是经过了苯酚邻位碳-氢键官能团化, 这被认为是第一例分子间重氮对芳烃C(sp2)—H官能化反应(Scheme 7).
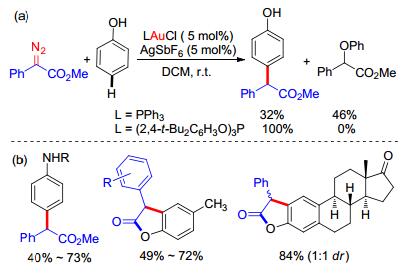
由于苯酚上存在非常活泼的羟基, 在随后的60多年里, 苯酚与重氮化合物的反应都是得到氧氢键插入的产物[17], 高选择性的碳-氢键官能团化问题没有被解决.直到2014年, 我们小组[18]使用金催化剂, 实现了第一例重氮化合物对苯酚高化学选择性和区域选择性的碳-氢键官能团化反应.这个反应和上述Yates的报道具有不同的区域选择性, 能专一地生成对位碳-氢键官能团化的产物.在这个反应中, 金催化剂的配体对化学选择性起到了至关重要的作用.在使用电子云密度较高的三苯基膦时, 产物以氧氢键插入为主; 如果使用缺电子的亚磷酸酯为配体时, 以碳-氢键官能团化产物为主, 反应体系中没有监测到氧氢键插入的产物(Scheme 8, a).这个反应体系中也可以有效地运用在带有活泼氢的苯胺衍生物上面; 同时, 当苯酚的对位有取代基时, 可以发生邻位的碳-氢键官能团化反应, 可以进一步发生关环反应得到苯并呋喃酮结构(Scheme 8, b).
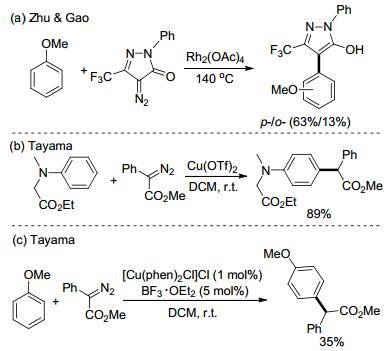
对于不含有活泼氢的富电子芳烃, 当然也可以实现上述的C(sp2)—H键官能化. 2013年, Zhu和Gao小组[19]报道了Rh催化的苯甲醚的对位碳-氢键官能团化, 但是邻对位选择性较差, 同时条件苛刻, 底物受限, 只能使用一种重氮化合物选择性(Scheme 9, a). Tayama课题组[20]报道了Cu催化的N-取代的苯胺对位的碳-氢键官能团化.这个反应条件温和, 选择性也很好, 但是底物仍然比较局限(Scheme 9, b).随后, 该课题组[21]使用了双催化剂(铜盐加上BF3•Et2O), 能够解决不含酯基苯胺的对位碳-氢键官能团化问题, 但是当苯甲醚作为底物时收率很低(Scheme 9, c).
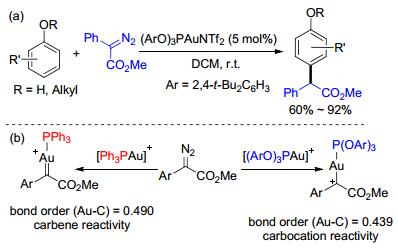
2014年, 史晓东和蓝宇等[22]报道了金催化富电子芳烃对位选择性的碳-氢键官能团化(Scheme 10, a).他们使用了与我们报道的类似催化体系, 并结合计算对反应关键中间体的独特反应性进行了研究(Scheme 10, b).他们认为, 当使用三苯基膦作为配体的时候, Au—C的键级为0.49, 这使得金中间体具有卡宾的反应特性, 例如发生氧氢键插入、烷基的碳-氢键插入和环丙烷化等; 而使用亚磷酸酯作为配体的时候, Au—C的键级为0.439, 这使得金中间体更像碳正离子, 所以更容易发生傅克反应.
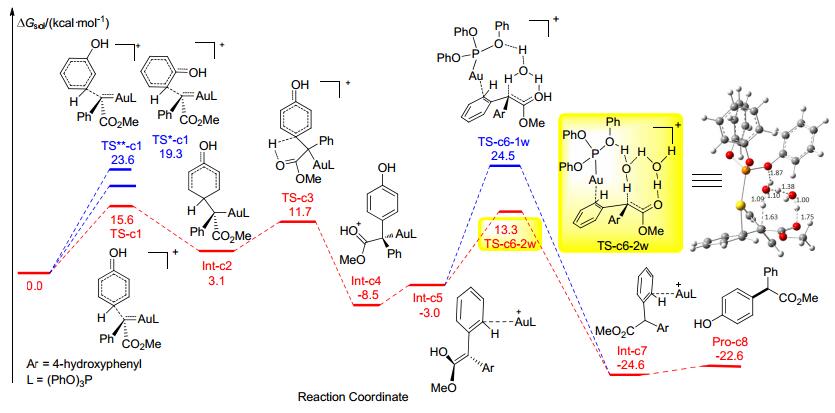
我们课题组[23]也结合计算对金催化苯酚的对位碳-氢键官能团化反应历程进行了研究(图 2).首先, 苯酚对金卡宾中间体加成, 再通过1, 4-氢迁移得到中间体Int-c4;接着发生金转移, 并通过水分子辅助的质子转移得到最终产物.在第一步加成的能垒就决定了这个反应有很好的区域选择性, 水分子的辅助对质子转移步的能垒降低有至关重要的作用.化学选择性主要是由于产物和关键中间体(Int-c4) 与对应的氧氢键插入反应的产物和中间体相比非常稳定.苯甲醚的反应历程与苯酚的类似[24].
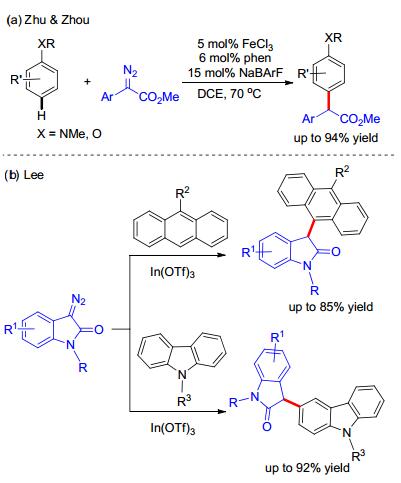
除了上述贵金属催化剂以外, 廉价的金属催化剂也可以用在富电子芳烃的碳-氢键官能团化中. 2016年, 朱守非和周其林小组[25]使用氯化铁为催化剂, 菲啰啉为配体, 全氟苯基硼酸钠为氯离子交换剂, 实现了苯胺和苯甲醚衍生物的高选择性对位碳-氢键官能团化(Scheme 11, a). Lee等[26]使用In催化实现了蒽和咔唑的选择性碳-氢键官能团化(Scheme 11, b).
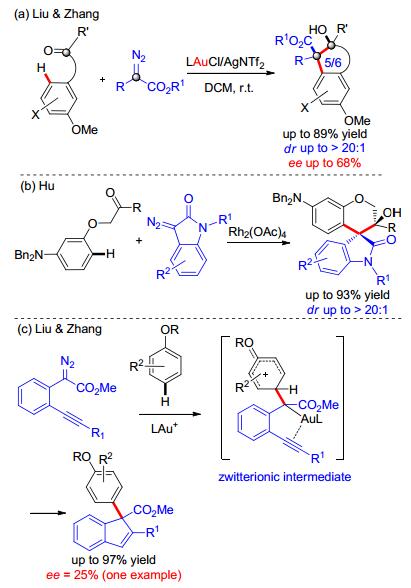
这种碳-氢键官能团化反应也可以设计为串联反应来快速构建一些复杂分子.例如, 我们[27]设计了一种含有羰基的富电子芳烃, 在金催化下, 和重氮化合物发生串联的碳-氢键官能团化/分子内aldol反应, 一步构建具有两个连续季碳中心的茚醇和四氢萘醇结构.这个反应具有很好的底物普适性, 同时非对映选择性也非常好.当使用手性膦配体时也可以实现不对称催化, 但是结果不够理想, ee值最高只有68% (Scheme 12, a).后来, 胡文浩小组[28]利用和我们类似的策略, 实现了香豆素氧化吲哚双螺环结构的快速构建(Scheme 12, b).另外, 我们[29]利用金对炔烃的独特活化能力, 实现了炔烃对金卡宾发生碳-氢键官能团化中间体的捕捉.该反应有很高的效率, 但对映选择性仍然不高(Scheme 12, c).
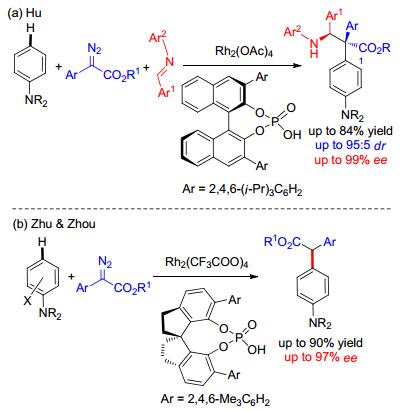
2014年胡文浩课题组[30]利用非手性的Rh催化剂和手性磷酸, 实现了对苯胺衍生物、重氮化合物和亚胺的不对称三组分反应(Scheme 13, a).该反应在第一步Rh催化碳-氢键官能团化的时候, 产生非手性中间体, 在其质子解之前发生手性磷酸催化的不对称Mannich反应, 得到具有两个连续手性中心的产物.由于使用Rh催化剂, 所以芳烃底物只能局限于苯胺衍生物.后来, 朱守非和周其林课题组[31]利用这种策略, 也实现了重氮化合物对苯胺衍生物的不对称直接碳-氢键官能团化(Scheme 13, a).
2016年, 周剑课题组[32]使用金催化剂和手性三级胺催化剂共催化也实现了三组分反应.在这个体系中, 芳烃可以为苯甲醚和苯胺的衍生物, 产率、非对映选择性和对映选择性都比较高(Eq. 2).
3.2 非活化芳烃的碳-氢键官能团化
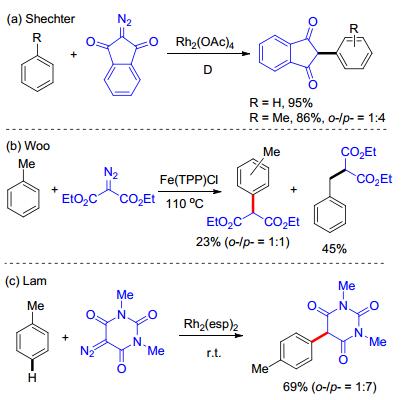
和富电子芳烃相比, 非活化芳烃的碳-氢键官能团化更具有挑战性.由于不具有活化基团, 所以这类芳烃的反应活性相对较低; 同时也缺乏较好的定位效应, 因此区域选择性也是一个较难解决的问题. 1988年, Shechter等[33]首次报道了Rh催化非活化芳烃与双羰基重氮化合物的碳-氢键官能团化.该反应有不错的收率, 但是区域选择性很差(Scheme 14, a). 2008年, Woo小组[34]报道了甲苯与重氮丙二酸二乙酯的反应, 在铁卟啉的催化下, 可以得到芳基碳-氢键官能团化的产物, 但是化学选择性和区域选择性很差, 主产物为甲基C(sp3)—H键官能化产物(Scheme 14, b). 2015年, Lam小组[35]使用巴比妥酸重氮化合物与芳烃反应, 在Rh催化下, 得到了中等的收率和不错的区域选择性(Scheme 14, 这一催化体系对环状的二酯基重氮化合物也适用, 但是收率仍然不高[36].这一类反应都需要这种双拉电子的重氮化合物, 类型非常有限, 而且芳烃大大的过量, 通常必须用作溶剂.
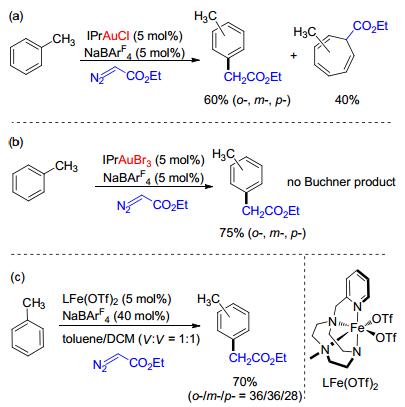
2005年, Nolan等[37]使用Au(Ⅰ)催化剂(IPrAuCl/NaBArF4), 在此体系中, 甲苯和商业可得的重氮乙酸乙酯(EDA)反应可以得到碳-氢键官能团化的产物, 但区域选择性很差, 同时还有大量的Buchner反应的副产物生成(Scheme 15, a).这个体系也可以实现萘的碳-氢键官能团化, 但是同样面临着化学选择性和区域选择性都很差的问题.后来, 他们[38]发展了一种Au(Ⅲ)催化剂(IPrAuBr3/NaBArF4), 可以有效地解决化学选择性的问题, 但是区域选择性仍然很差(Scheme 15, b). 2016年, Pérez等[39]又发展了一种新型的Fe络合物, 虽然这种催化体系有很好的化学选择性, 但是区域选择性的问题还是没有得到解决(Scheme 15, c).
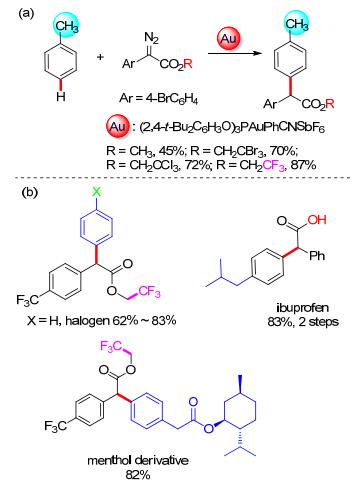
2017年, 我们课题组[40]发展了一种金催化芳基重氮乙酸酯和烷基苯的高对位选择性的碳-氢键官能团化反应.在这个反应中, 我们发现重氮化合物的酯基对反应有至关重要的影响.当使用甲酯的时候产率很低; 使用具有吸电子基团的酯基(尤其是三氟乙基)的时候, 产率明显提高.这主要是因为吸电子基团可以增加重氮分解形成的金卡宾中间体的正电性, 从而提高反应的活性(Scheme 16, a).这个反应区域选择性很高, 没有其它位置的碳-氢键官能团化产物被检测到; 同时, 这个反应也具有很高的效率, 即使使用二氯甲烷为溶剂, 只需要加入2 equiv.的甲苯, 也可以以较高的收率得到产物.苯和卤代苯也适用于这个催化体系; 同时这个反应也可以用来快速合成一种常用的非甾体类消炎药布洛芬衍生物, 也可以有效地应用在天然产物或药物分子的后期修饰中(Scheme 16, b).
4 总结
对过渡金属催化的芳烃和重氮化合物的C(sp2)—H键官能化反应进行了简要的综述, 主要分成了导向和非导向两种策略, 目前已经取得了较大的进展, 有不少成功的例子, 但是仍然存在一些问题.第一, 在区域选择性上, 导向的策略主要生成邻位的产物, 非导向的策略主要选择性得到对位的产物, 目前还没有方法来实现间位的产物; 第二, 对于非导向策略来讲, 芳烃的取代基必须是邻对位定位基团, 对于具有较强吸电子基团的芳烃还无法作为底物; 第三, 只有有限的几个反应实现了不对称催化; 第四, 目前常用的都是一些贵金属催化剂, 廉价金属的应用较少且结果不好; 第五, 对一些卡宾中间体的机理研究还不够深入.这些问题应该是接下来在这个领域研究的重点.
-
-
[1]
(a) Dyker, G. Handbook of C-H Transformations, Applications in Organic Synthesis, Wiley-VCH, Weinheim, 2005.
(b) Jones, W; Fehe, F. Acc. Chem. Res. 1989, 22, 91.
(c) Labinger, J. A. ; Bercaw, J. E. Nature 2002, 417, 507.
(d) Godula, K. ; Sames, D. Science 2006, 312, 67.
(e) Bergman, R. G. Nature 2007, 446, 391.
(f) Yu, J. -Q. ; Ding, K. -L. Acta Chim. Sinica 2015, 73, 1223 (in Chinese).
(余金权, 丁奎岭, 化学学报, 2015, 73, 1223. )
(g) Liao, G. ; Shi, B. -F. Acta Chim. Sinica 2015, 73, 1283 (in Chinese).
(廖港, 史炳锋, 化学学报, 2015, 73, 1283. )
(h) Shang, X. -J. ; Liu, Z. -Q. Acta Chim. Sinica 2015, 73, 1275 (in Chinese).
(尚筱洁, 柳忠全, 化学学报, 2015, 73, 1275. )
(i) He, J. -Q. ; Lou, S. J. ; Xu, D. Q. Chin. J. Org. Chem. 2016, 36, 1218 (in Chinese).
(何将旗, 娄绍杰, 许丹倩, 有机化学, 2016, 36, 1218. ) -
[2]
(a) Liu, L.; Zhang, J. Chem. Soc. Rev. 2016, 45, 506.
(b) Fructos, M. R.; Díaz-Requejo, M. M.; Pérez, P. J. Chem. Commun. 2016, 52, 7326.
(c) Wei, F.; Song, C.; Ma, Y.; Zhou, L.; Tung, C.-H.; Xu, Z. Sci. Bull. 2015, 60, 1479.
(d) Ford, A.; Miel, H.; Ring, A.; Slattery, C. N.; Maguire, A. R.; Mckervey, M. A. Chem. Rev. 2015, 115, 9981.
(e) Davies, H. M. L.; Lian, Y.-J. Acc. Chem. Res. 2012, 45, 923.
(f) Zhang, Z.; Wang, J. Tetrahedron 2008, 64, 6577.
(g) Maas, G. Chem. Soc. Rev. 2004, 33, 183.
(h) Lebel, H.; Marcoux, J.-F.; Molinaro, C.; Charette, A. B. Chem. Rev. 2003, 103, 977.
(i) Doyle, M. P.; McKervey, M. A. Modern Catalytic Methods for Organic Synthesis with Diazo Compounds, Wiley, New York, 1998.
(j) Doyle, M. P.; Forbes, D. C. Chem. Rev. 1998, 98, 911.
(k) Doyle, M. P.; Duffy, R.; Ratnikov, M.; Zhou, L. Chem. Rev. 2010, 110, 704. -
[3]
(a) Davies, H. M. L.; Manning, J.-R. Nature 2008, 451, 417.
(b) Díaz-Requejo, M. M.; Pérez, P. J. Chem. Rev. 2008, 108, 3379.
(c) Liu, Z.; Wang, J. J. Org. Chem. 2013, 78, 10024. -
[4]
Silberrad, O.; Roy, C. S. J. Chem. Soc. 1906, 179.
-
[5]
(a) Davies, H. M. L.; Morton, D. Chem. Soc. Rev. 2011, 40, 1857.
(b) Liao, K.; Negretti, S.; Musaev, D. G.; Bacsa, J.; Davies, H. M. L. Nature 2016, 533, 230. - [6]
-
[7]
(a) Cheng, C.; Hartwig, J. F. Chem. Rev. 2015, 115, 8946.
(b) Song, G.; Li, X. Acc. Chem. Res. 2015, 48, 1007.
(c) Ye, B.; Cramer, N. Acc. Chem. Res. 2015, 48, 1308.
(d) Shin, K.; Kim, H.; Chang, S. Acc. Chem. Res. 2015, 48, 1040.
(e) Daugulis, O.; Roane, J.; Tran, L. D. Acc. Chem. Res. 2015, 48, 1053.
(f) Segawa, Y.; Maekawa, T.; Itami, K. Angew. Chem., Int. Ed. 2015, 54, 66.
(g) Girard, S. A.; Knauber, T.; Li, C.-J. Angew. Chem., Int. Ed. 2014, 53, 74.
(h) Gao, K.; Yoshikai, N. Acc. Chem. Res. 2014, 47, 1208.
(i) Rouquet, G.; Chatani, N. Angew. Chem., Int. Ed. 2013, 52, 11726.
(j) Wencel-Delord, J.; Glorius, F. Nat. Chem. 2013, 5, 369.
(k) Arockiam, P. B.; Bruneau, C.; Dixneuf, P. H. Chem. Rev. 2012, 112, 5879.
(l) Li, B.-J.; Shi, Z.-J. Chem. Soc. Rev. 2012, 41, 5588.
(m) Yeung, C. S.; Dong, V. M. Chem. Rev. 2011, 111, 1215.
(n) Engle, K. M.; Mei, T.-S.; Wasa, M.; Yu, J.-Q. Acc. Chem. Res. 2011, 45, 788; -
[8]
Chan, W.-W.; Lo, S.-F.; Zhou, Z.; Yu, W.-Y. J. Am. Chem. Soc. 2012, 134, 13565. doi: 10.1021/ja305771y
-
[9]
(a) Hyster, T. K.; Ruhl, K. E.; Rovis, T. J. Am. Chem. Soc. 2013, 135, 5364.
(b) Shi, Z.; Koester, D. C.; Boultadakis-Arapinis, M.; Glorius, F. J. Am. Chem. Soc. 2013, 135, 12204.
(c) Hu, F.; Xia, Y.; Ye, F.; Liu, Z.; Ma, C.; Zhang, Y.; Wang, J. Angew. Chem., Int. Ed. 2014, 53, 1364.
(d) Yu, S.; Liu, S.; Lan, Y.; Wan, B.; Li, X. J. Am. Chem. Soc. 2015, 137, 1623.
(e) Yu, X.; Yu, S.; Xiao, J.; Wan, B.; Li, X. J. Org. Chem. 2013, 78, 5444.
(f) Cheng, Y.; Bolm, C. Angew. Chem., Int. Ed. 2015, 54, 12349.
(g) Cui, S.; Zhang, Y.; Wang, D.; Wu, Q. Chem. Sci. 2013, 4, 3912.
(h) Dateer, R. B.; Chang, S. Org. Lett. 2016, 18, 68.
(i) Liang, Y.; Yu, K.; Li, B.; Xu, S.; Song, H.; Wang, B. Chem. Commun. 2014, 50, 6130.
(j) Zhou, T.; Li, B.; Wang, B. Chem. Commun. 2016, 52, 14117.
(k) Zhou, J.; Shi, J.; Liu, X.; Jia, J.; Song, H.; Xu, H. E.; Yi, W. Chem. Commun. 2015, 51, 5868.
(l) Son, J.-Y.; Kim, S.; Jeon, W. H.; Lee, P. H. Org. Lett. 2015, 17, 2518.
(m) Bai, P.; Huang, X.-F.; Xu, G.-D.; Huang, Z.-Z. Org. Lett. 2016, 18, 3058.
(n) Song, C.; Yang, C.; Zhang, F.; Wang, J.; Zhu, J. Org. Lett. 2016, 18, 4510. -
[10]
Ye, B.; Cramer, N. Angew. Chem., Int. Ed. 2014, 53, 7896. doi: 10.1002/anie.201404895
-
[11]
(a) Phatake, R. S.; Patel, P.; Ramana, C. V. Org. Lett. 2016, 18, 292.
(b) Phatake, R. S.; Patel, P.; Ramana, C. V. Org. Lett. 2016, 18, 2828.
(c) Patel, P.; Borah, G. Chem. Commun. 2017, 53, 443. -
[12]
(a) Zhao, D.; Kim, J. H.; Stegemann, L.; Strassert, C. A.; Glorius, F. Angew. Chem., Int. Ed. 2015, 54, 4508.
(b) Kim, J. H.; Greßies, S.; Glorius, F. Angew. Chem., Int. Ed. 2016, 55, 5577. -
[13]
Li, J.; Tang, M.; Zang, L.; Zhang, X.; Zhang, Z.; Ackermann, L. Org. Lett. 2016, 18, 2742. doi: 10.1021/acs.orglett.6b01199
-
[14]
Yu, Z.; Li, Y.; Shi, J.; Ma, B.; Liu, L.; Zhang, J. Angew. Chem., Int. Ed. 2016, 55, 14807. doi: 10.1002/anie.201608937
-
[15]
Hartwig, J. F.; Larsen, M. A. ACS Cent. Sci. 2016, 2, 281. doi: 10.1021/acscentsci.6b00032
-
[16]
Yates, P. J. Am. Chem. Soc. 1952, 74, 5376. doi: 10.1021/ja01141a047
-
[17]
(a) Gillingham, D.; Fei, N. Chem. Soc. Rev. 2013, 42, 4918.
(b) Guo, X.; Hu, W. Acc. Chem. Res. 2013, 46, 2427.
(c) Zhu, S.-F.; Zhou, Q.-L. Acc. Chem. Res. 2012, 45, 1365.
(d) Miller, D. J.; Moody, C. J. Tetrahedron 1995, 51, 10811. -
[18]
Yu, Z.; Ma, B.; Chen, M.; Wu, H.-H.; Liu, L.; Zhang, J. J. Am. Chem. Soc. 2014, 136, 6904. doi: 10.1021/ja503163k
-
[19]
Fan, H.; Zhang, Z.; Li, X.; Zhao, J.; Gao, J.; Zhu, S. Tetrahedron 2013, 69, 1978. doi: 10.1016/j.tet.2012.12.077
-
[20]
Tayama, E.; Yanaki, T.; Iwamoto, H.; Hasegawa, E. Eur. J. Org. Chem. 2010, 6719.
-
[21]
Tayama, E.; Ishikawa, M.; Iwamoto, H.; Hasegawa, E. Tetrahedron Lett. 2012, 53, 5159. doi: 10.1016/j.tetlet.2012.07.070
-
[22]
Xi, Y.; Su, Y.; Yu, Z.; Dong, B.; McClain, E. J.; Lan, Y.; Shi, X. Angew. Chem., Int. Ed. 2014, 53, 9817. doi: 10.1002/anie.201404946
-
[23]
Liu, Y.; Yu, Z.; Zhang, J. Z.; Liu, L, Xia, F.; Zhang, J. Chem. Sci. 2016, 7, 1988. doi: 10.1039/C5SC04319K
-
[24]
Liu, Y.; Yu, Z.; Luo, Z.; Zhang, J. Z.; Liu, L, Xia, F. J. Phys. Chem. A 2016, 120, 1925. doi: 10.1021/acs.jpca.6b00636
-
[25]
Yang, J.-M.; Cai, Y.; Zhu, S.-F.; Zhou, Q.-L. Org. Biomol. Chem. 2016, 14, 5516. doi: 10.1039/C5OB02418H
-
[26]
Magar, K. B. S.; Edison, T. N. J. I.; Lee, Y. R. Org. Biomol. Chem. 2016, 14, 7313. doi: 10.1039/C6OB01315E
-
[27]
Yu, Z.; Qiu, H.; Liu, L.; Zhang, J. Chem. Commun. 2016, 52, 2257. doi: 10.1039/C5CC08880A
-
[28]
Jia, S.; Lei, Y.; Song, L.; Reddy, A. G. K.; Xing, D.; Hu, W. Adv. Synth. Catal. 2017, 359, 58. doi: 10.1002/adsc.v359.1
-
[29]
Ma, B.; Wu, Z.; Huang, B.; Liu, L.; Zhang, J. Chem. Commun. 2016, 52, 9351. doi: 10.1039/C6CC04034A
-
[30]
Jia, S.; Xing, D.; Zhang, D.; Hu, W. Angew. Chem., Int. Ed. 2014, 53, 13098. doi: 10.1002/anie.201406492
-
[31]
Xu, B.; Li, M.-L.; Zuo, X.-D.; Zhu, S.-F.; Zhou, Q.-L. J. Am. Chem. Soc. 2015, 137, 8700. doi: 10.1021/jacs.5b05086
-
[32]
Cao, Z.; Zhao, Y.; Zhou, J. Chem. Commun. 2016, 52, 2537. doi: 10.1039/C5CC10096H
-
[33]
Rosenfeld, M. J.; Shankar, B. K.; Shechter, H. J. Org. Chem. 1988, 53, 2699. doi: 10.1021/jo00247a007
-
[34]
Mbuvi, H. M.; Woo, L. K. Organometallics 2008, 27, 637. doi: 10.1021/om7007502
-
[35]
Best, D.; Burns, D. J.; Lam, H. W. Angew. Chem., Int. Ed. 2015, 54, 7410. doi: 10.1002/anie.v54.25
-
[36]
Best, D.; Jean, M.; van de Weghe, P. J. Org. Chem. 2016, 81, 7760. doi: 10.1021/acs.joc.6b01426
-
[37]
Fructos, M. R.; Belderrain, T. R.; de Frémont, P.; Scott, N. M.; Nolan, S. P.; Díaz-Requejo, M. M.; Pérez, P. J. Angew. Chem., Int. Ed. 2005, 44, 5284. doi: 10.1002/(ISSN)1521-3773
-
[38]
Rivilla, I.; Gõmez-Emeterio, B. P.; Fructos, M. R.; Díaz-Requejo, M. M.; Perez, P. J. Organometallics 2011, 30, 2855. doi: 10.1021/om200206m
-
[39]
Conde, A.; Sabenya, G.; Rodríguez, M.; Postils, V.; Luis, J. S.; Díaz-Requejo, M. M.; Costas, M.; Pérez, P. J. Angew. Chem., Int. Ed. 2016, 55, 6530. doi: 10.1002/anie.201601750
-
[40]
Ma, B.; Chu, Z.; Huang, B.; Liu, Z.; Liu, L.; Zhang, J. Angew. Chem., Int. Ed. 2017, 56, 2749. doi: 10.1002/anie.v56.10
-
[1]
-
-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 18
- 文章访问数: 4458
- HTML全文浏览量: 2040



 下载:
下载:

















 下载:
下载:

