
Citation: Shi Dongdong, Bao Hanyang, Xu Zheng, Liu Yunkui. Synthesis of 6-Aryl Phenanthridines via Iron-Catalyzed sp2-C-H Bond Amination/Aromatization Reaction[J]. Chinese Journal of Organic Chemistry, 2017, 37(5): 1290-1294. doi: 10.6023/cjoc201701054

铁催化分子内sp2-C-H键的胺化/芳构化反应合成6-芳基菲啶
English
Synthesis of 6-Aryl Phenanthridines via Iron-Catalyzed sp2-C-H Bond Amination/Aromatization Reaction
-
Key words:
- iron catalysis
- / C-H activation
- / amination
- / phenanthridines
-
在有机合成中, 芳基C—N键的构建是一类非常重要的反应, 受到化学工作者的广泛关注.传统构建C—N键的方法一般包括亲核取代反应、铜催化的Ullmann偶联反应[1]和钯催化的Buchwald-Hartwig C—N交叉偶联反应[2]等.以上这些方法为芳基C—N键的构建提供了非常有效的手段, 但也存在一些不足.例如, 这些方法通常需要预官能化的前体化合物, 使用较昂贵且有毒的配体以及产生当量无机盐类等废弃物等.因此, 探寻和发展基于C—H键直接官能化[3a]为基础的更为经济、高效地构建C—N键的合成方法, 成为近年来化学家们研究的热点之一[3b].基于C—H键的直接胺化反应无疑最具步骤经济性和原子经济性, 符合绿色化学的理念[4].
在现有的过渡金属催化的基于C—H键官能化构建C—N键的相关文献中, Pd、Rh、Ru等贵金属是最常用的催化剂[4~8].例如, 2007年, Inamoto等[9]报道了在醋酸铜和三氟乙酸银存在下, 钯(Ⅱ)催化二芳基腙的分子内sp2-C—H键胺化/环化反应合成了吡唑类化合物. 2007年, Driver课题组[10]发现在Rh2(O2CC3F7)4催化剂的诱导下, 可将芳香乙烯基叠氮化合物变成吲哚或者其他含氮杂环化合物. 2011年, Ackermann课题组[11]以[RuCl2(p-cymene)]2为催化剂, 实现了酰胺和炔烃分子间的C—H键活化/C—N键关环反应.然而相较于贵金属催化剂方面所做的大量研究, 金属铁催化sp2-C—H键活化构建C—N键的研究目前报道仍然比较少[12a~12d].铁具有价廉易得、低毒环保等优点, 在有机反应中会有更广阔的应用前景[12d~12g].基于我们课题组一直在过渡金属催化C—H键活化/官能化方面的兴趣[13], 加之菲啶类化合物具有潜在的独特的生物活性和光电活性[14], 在此, 我们报道一种FeCl2催化的分子内sp2-C—H键胺化/芳构化反应构建6-芳基菲啶的方法.
1 结果与讨论
1.1 反应条件的优化
我们首先以N-[1-苯基-1-(2'-联苯基)]甲基苯磺酰胺(1a)为底物对反应条件进行了优化(表 1).以氯化亚铁为催化剂, 3 equiv. Selectfluor为氧化剂, 普通乙腈为溶剂, 于100 ℃条件下反应24 h可以顺利地以74%收率得到6-苯基菲啶2a (Entry 3, 表 1).当Selectfluor用量减少到2 equiv.时, 2a收率下降到46% (Entry 5, 表 1).一系列溶剂优化实验表明, 普通乙腈作为溶剂对反应最为有利(Entry 3 vs 1~2, 表 1).接着, 我们考察了不同催化剂对反应的影响, 发现无论是铁粉[Fe(0)]、Fe(Ⅲ)还是Pd(Ⅱ), 其反应活性均不如氯化亚铁(Entry 3 vs 7~11, 表 1).当使用FeCl2•4H2O作为催化剂时, 产量略有降低(Entry 6 vs 3, 表 1).研究发现100 ℃是比较适宜的反应温度; 降低或升高温度都不利于反应的进行(Entry 4, 表 1).我们还对氧化剂进行了考察, 发现当K2S2O8或DDQ作为氧化剂时, 反应均不发生(Entries 14, 15, 表 1).反应较适宜的时间为24 h; 减少或增加反应时间也都不利于反应的进行(Entries 12, 13 vs 3, 表 1).对照实验表明若无铁催化剂或Selectfluor参与, 反应不发生或收率很低(Entries 16, 17, 表 1).当使用高纯度的氯化亚铁时, 产率没有发生明显变化, 表明铁在该反应中发挥了作用(Entry 18)[15].
 表 1
N-[1-苯基-1-(2'-联苯基)]甲基苯磺酰胺(1a)胺化/芳构化反应的条件优化a
Table 1.
Optimization of the reaction conditions for the amination/aromatization of N-[(1, 1'-biphenyl)-2-yl(phenyl)methyl]-benzenesulfonamide (1a)
表 1
N-[1-苯基-1-(2'-联苯基)]甲基苯磺酰胺(1a)胺化/芳构化反应的条件优化a
Table 1.
Optimization of the reaction conditions for the amination/aromatization of N-[(1, 1'-biphenyl)-2-yl(phenyl)methyl]-benzenesulfonamide (1a)

Entry Catalyst Oxidant (equiv.) Solvent Yieldb/% 1 FeCl2 Selectfluor (3) 甲苯 0 2 FeCl2 Selectfluor (3) 丙酮 0 3 FeCl2 Selectfluor (3) CH3CN 74 4 FeCl2 Selectfluor (3) CH3CN 65c, 55d 5 FeCl2 Selectfluor (2) CH3CN 46 6 FeCl2•4H2O Selectfluor (2 CH3CN 68 7 Fe(0) Selectfluor (3) CH3CN 58 8 Fe(NO3)3•9H2O Selectfluor (3) CH3CN 45 9 FeBr3 Selectfluor (3) CH3CN 55 10 FeCl3 Selectfluor (3) CH3CN 72 11 PdCl2 Selectfluor (3) CH3CN 68 12 FeCl2 Selectfluor (3) CH3CN 66e 13 FeCl2 Selectfluor (3) CH3CN 70f 14 FeCl2 K2S2O8 (3) CH3CN 0 15 FeCl2 DDQ (3) CH3CN 0 16 — Selectfluor (3) CH3CN <10 17 FeCl2 — CH3CN 0 18 FeCl2 (>99.99%) Selectfluor (3) CH3CN 75 aAll reactions were carried out with 1a (0.2 mmol), catalyst (15 mol%), Selectfluor (3 equiv.) in solvent (2 mL) at 100 ℃ for 24 h unless otherwise noted. bIsolated yield.cAt 90 ℃. dAt 110 ℃. eThe reaction time is 22 h. fThe reaction time is26 h. 表 1 N-[1-苯基-1-(2'-联苯基)]甲基苯磺酰胺(1a)胺化/芳构化反应的条件优化a
Table 1. Optimization of the reaction conditions for the amination/aromatization of N-[(1, 1'-biphenyl)-2-yl(phenyl)methyl]-benzenesulfonamide (1a)1.2 底物的拓展
在获得最佳反应条件后, 我们对反应底物的适用范围进行了考察(表 2).从表 2可以看出, 一系列具有多种取代模式(邻、间、对)和不同电子效应(给电子和吸电子)的N-[1-芳基-1-(2'-联苯基)]甲基苯磺酰胺(1)都能顺利地发生胺化/芳构化反应, 以中等到良好的产率获得6-芳基菲啶类化合物2a~2q (45%~83%, 表 2).研究发现, 在底物1中发生C—H键胺化的芳环B上, 无论是给电子基团取代基(2d, 2g, 表 2)还是吸电子取代基(2b, 2c, 2f, 2h, 表 2), 均能顺利地得到目标产物.研究表明芳环A尽可能以中性或吸电子基团取代有益于反应进行(2b~2k, 表 2).一系列不同的取代基如叔丁基、卤素(氟、氯)及三氟甲氧基等均能在反应条件下很好地兼容.
 表 2
N-[1-芳基-1-(2'-联苯基)]甲基苯磺酰胺底物的拓展a
Table 2.
Scope of the amination/aromatization of N-([1, 1'-biphenyl]-2-yl(phenyl)methyl)benzenesulfonamide
表 2
N-[1-芳基-1-(2'-联苯基)]甲基苯磺酰胺底物的拓展a
Table 2.
Scope of the amination/aromatization of N-([1, 1'-biphenyl]-2-yl(phenyl)methyl)benzenesulfonamide

Entry R1 R2 R3 Product Yieldb% 1 H H H 2a 74 2 H 4'-OCF3 H 2b 45 3 4-F 4'-Cl H 2c 83 4 4-F 4'-Bu-t H 2d 76 5 5-F H H 2e 57 6 5-F 4'-Cl H 2f 78 7 5-F 4'-Bu-t H 2g 69 8 H 3'-Cl H 2h 51 9 H H 4''-F 2i 61 10 H H 4''-Cl 2j 65 11 4-F H H 2k 52 12 4-Cl H H 2l 50 aReaction conditions: 1a (0.2 mmol), FeCl2 (0.03 mmol), Selectfluor (0.6 mmol) in CH3CN at 100 ℃ for 24 h unless otherwise noted. b Isolated yields. 表 2 N-[1-芳基-1-(2'-联苯基)]甲基苯磺酰胺底物的拓展a
Table 2. Scope of the amination/aromatization of N-([1, 1'-biphenyl]-2-yl(phenyl)methyl)benzenesulfonamide1.3 反应机理假设
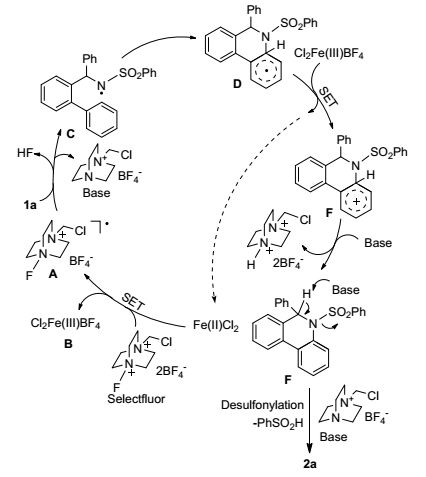
迄今为止, 关于1a的C—H键胺化/构芳化反应的具体机理还不是特别清晰.根据已有文献报道[16~20], 我们提出了一个如Scheme 1所示的可能机理.首先, FeCl2与Selectfluor发生单电子转移(SET)氧化还原反应, 生成自由基中间体A和三价铁中间体B[16], 随后A与底物1a发生自由基攫氢反应生成氮自由基中间体C[17], C进一步发生自由基对芳环的加成/关环反应生成中间体D[18], 中间体D与三价铁中间体B发生单电子转移氧化还原反应, 得到中间体E并再生二价铁催化剂[18]. E在碱的作用下发生拔氢生成F[18, 19], 继而F在碱的作用下发生脱苯磺酰化反应[20], 最终芳构化生成目标产物2a.
2 结论
我们以FeCl2/Selectfluor体系为促进剂, 成功实现了N-[1-芳基-1-(2'-联苯基)]甲基苯磺酰胺类化合物的一步串联胺化/芳构化反应, 高效和高选择性地得到了6-芳基菲啶类化合物.该方法采用价廉易得及低毒的铁为催化剂, 并且具有操作简便、底物简单易得和官能团兼容性较好等优点.
3 实验部分
3.1 仪器与试剂
实验所用试剂均购于Aladdin试剂公司. 1H NMR和13C NMR均在德国Bruker公司500 MHz核磁共振仪上测定, CDCl3为溶剂, TMS为内标.质谱数据的测定采用美国Water公司GCT Premier气相色谱-飞行时间质谱仪.柱层析使用100~200目硅胶, 以石油醚和乙酸乙酯为展开剂.
3.2 N-[1-芳基-1-(2'-联苯基)]甲基苯磺酰胺的制备
在氮气保护的25 mL两口烧瓶中, 加入1.0 mmol邻苯基苯磺酰亚胺和10 mL四氢呋喃(无水), 搅拌溶解.然后缓慢滴加2~3 equiv.的芳基溴化镁溶液, 滴加完毕, 于65 ℃下搅拌反应2 h.反应完毕, 用4 mL饱和氯化铵溶液淬灭, 二氯甲烷(10 mL×3) 萃取, 合并有机相, 用无水硫酸钠干燥, 减压抽滤脱除溶剂, 粗产品经柱层析提纯, 展开剂为石油醚和乙酸乙酯(V/V=5/1).
3.3 6-芳基菲啶的合成通法
在一密闭的反应管中加入0.2 mmol N-[1-芳基-1-(2'-联苯基)]甲基苯磺酰胺(1)、0.03 mmol氯化亚铁、0.6 mmol Selectfluor、2.0 mL乙腈, 封管后反应混合物在100 ℃下搅拌反应24 h.反应停止后, 向反应液中加入10 mL水, 再用二氯甲烷(10 mL×3) 萃取, 有机相用无水Na2SO4干燥, 减压抽滤脱去溶剂, 粗产品经柱层析提纯, 展开剂为石油醚和乙酸乙酯(V/V=15/1).
6-苯基菲啶(2a)[21]:产率74%.白色固体, m.p. 104~106 ℃(文献值[21] m.p. 104~106 ℃); 1H NMR (CDCl3, 500 MHz) δ: 8.68 (d, J=8.5 Hz, 1H), 8.61 (d, J=8.0 Hz, 1H), 8.31 (d, J=8.0 Hz, 1H), 8.13 (d, J=8.0 Hz, 1H), 7.84 (t, J=7.0 Hz, 1H), 7.79 (t, J=6.0 Hz, 1H), 7.69 (t, J=7.0 Hz, 1H), 7.63~7.54 (m, 1H); 13C NMR (CDCl3, 125 MHz) δ: 161.2, 143.8, 139.8, 133.4, 130.5, 130.3, 129.7, 128.9, 128.8, 128.7, 128.4, 127.1, 126.9, 125.2, 123.7, 122.2, 121.9.
6-苯基-3-三氟甲氧基菲啶(2b):产率45%.白色固体, m.p. 116~118 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.56~8.53 (m, 2H), 8.15 (d, J=1.5 Hz, 1H), 8.12 (d, J=8.5 Hz, 1H), 7.82 (t, J=7.0 Hz, 1H), 7.74 (d, J=6.0 Hz, 2H), 7.63~7.55 (m, 4H), 7.51 (d, J=9.0 Hz, 1H); 13C NMR (CDCl3, 125 MHz) δ: 162.6, 149.2 (d, J=1.5 Hz), 144.4, 139.3, 132.8, 130.9, 129.6, 128.9, 128.4, 127.4, 125.0, 123.6, 122.1, 122.0, 120.70, 120.65 (d, J=1.5 Hz), 120.6 (d, J=256.3 Hz), 119.6; HRMS calcd for C20H12-F3NO 339.0871, found 339.0878.
6-苯基-9-氟-3-氯菲啶(2c):产率83%.白色固体, m.p. 181~183 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.39 (dd, J=9.5, 6.0 Hz, 1H), 8.16~8.10 (m, 2H), 7.89 (dd, J=9.5, 2.5 Hz, 1H), 7.72~7.69 (m, 2H), 7.59~7.55 (m, 3H), 7.43~7.39 (m, 1H), 7.33~7.28 (m, 1H); 13C NMR (CDCl3, 125 MHz) δ: 165.0, 163.1 (d, J=247.5 Hz), 162.9, 161.8, 145.3 (d, J=12.5 Hz), 139.1, 135.6 (d, J=10.0 Hz), 132.1 (d, J=8.8 Hz), 129.6, 129.1, 128.5, 124.1 (d, J=10.0 Hz), 121.7, 120.0, 116.1 (d, J=23.8 Hz), 114.8 (d, J=20.0 Hz), 107.1 (d, J=22.5 Hz); HRMS calcd for C19H11ClFN 307.0564, found 307.0559.
3-特丁基-6-苯基-9-氟菲啶(2d):产率76%, 黄色液体. 1H NMR (CDCl3, 500 MHz) δ: 8.40 (d, J=8.5 Hz, 1H), 8.30 (d, J=1.5 Hz, 1H), 8.23 (dd, J=10.5, 2.5 Hz, 1H), 8.09 (dd, J=9.0, 6.0 Hz, 1H), 7.79 (dd, J=8.5, 2.0 Hz, 1H), 7.60~7.53 (m, 3H), 7.32~7.28 (m, 1H), 1.40 (s, 9H); 13C NMR (CDCl3, 125 MHz) δ: 163.8 (d, J=251.3 Hz), 160.7, 153.1, 143.9, 139.5, 135.8 (d, J=8.8 Hz), 131.8 (d, J=10.0 Hz), 129.6, 128.8, 128.5, 126.3, 125.3, 122.0, 121.8, 120.9 (d, J=5.0 Hz), 115.8 (d, J=22.5 Hz), 107.1 (d, J=22.5 Hz); HRMS calcd for C23H20FN 329.1580, found 329.1585.
6-苯基-8-氟菲啶(2e):产率57%.白色固体, m.p. 129~131 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.54 (dd, J=9.0, 5.0 Hz, 1H), 8.52(d, J=8.5 Hz, 1H), 8.29 (dd, J=8.0, 0.5 Hz, 1H), 7.78~7.74 (m, 4H), 7.69 (t, J=7.0 Hz, 1H), 7.61~7.55 (m, 4H); 13C NMR (CDCl3, 125 MHz) δ: 161.2 (d, J=246.3 Hz), 160.3 (d, J=3.8 Hz), 143.4, 139.1, 130.4, 130.1 (d, J=1.3 Hz), 129.0, 128.7, 128.6, 127.3, 126.4 (d, J=7.5 Hz), 124.5 (d, J=7.5 Hz), 123.3, 121.7, 119.7 (d, J=23.8 Hz), 113.3 (d, J=22.5 Hz); HRMS calcd for C19H12FN 273.0954, found 273.0960.
6-苯基-8-氟-3-氯菲啶(2f):产率78%.白色固体, m.p. 159~161 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.60 (dd, J=9.0, 5.5 Hz, 1H), 8.43 (d, J=8.5 Hz, 1H), 8.26 (d, J=1.5 Hz, 1H), 7.77~7.72 (m, 3H), , 7.63~7.56 (m, 5H); 13C NMR (CDCl3, 125 MHz) δ: 161.5 (d, J=3.8 Hz), 161.3 (d, J=247.5 Hz), 144.0, 138.7, 134.4, 129.8 (d, J=1.5 Hz), 129.6, 129.5, 129.3, 128.7, 127.9, 126.4 (d, J=7.5 Hz), 124.8 (d, J=8.8 Hz), 123.1, 121.8, 120.3 (d, J=23.8 Hz), 113.5 (d, J=22.5 Hz); HRMS calcd for C19H11FClN 307.0564, found 307.0568.
3-特丁基-6-苯基-8-氟菲啶(2g):产率69%.白色固体, m.p. 104~106 ℃; 1H NMR(CDCl3, 500 MHz) δ: 8.63 (dd, J=9.0, 5.5 Hz, 1H), 8.47 (d, J=9.0 Hz, 1H), 8.30 (d, J=1.5 Hz, 1H), 7.79 (dd, J=8.5, 2.0 Hz, 1H), 7.75~7.71 (m, 3H), 7.61~7.54 (m, 4H), 1.49 (s, 9H); 13C NMR (CDCl3, 125 MHz) δ: 160.9 (d, J=246.3 Hz), 160.3 (d, J=3.8 Hz), 152.2, 143.4, 139.3, 130.1 (d, J=1.3 Hz), 129.5, 128.9, 128.6, 126.4, 126.2 (d, J=7.5 Hz), 125.6, 124.6 (d, J=8.8 Hz), 121.4, 120.9, 119.8 (d, J=23.8 Hz), 113.3 (d, J=21.3 Hz), 35.0, 31.3; HRMS calcd for C23H20FN 329.1580, found 329.1587.
6-苯基-4-氯菲啶(2h):产率51%.白色固体, m.p. 162~164 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.62 (d, J=8.5 Hz, 1H), 8.58 (d, J=2.5 Hz, 1H), 8.22 (d, J=9.0 Hz, 1H), 8.14 (d, J=8.5 Hz, 1H), 7.91~7.88 (m, 1H), 7.76~7.74 (m, 2H), 7.71 (dd, J=9.0, 2.5 Hz, 1H), 7.69~7.65 (m, 1H), 7.61~7.54 (m, 3H); 13C NMR (CDCl3, 125 MHz) δ: 161.5, 142.0, 139.2, 132.9, 132.5, 131.7, 131.0, 129.8, 129.4, 129.1, 129.0, 128.5, 127.9, 125.4, 124.9, 122.3, 121.6; HRMS calcd for C19H12ClN 289.0658, found 289.0663.
6-(4׳-氟苯基)菲啶(2i):产率61%.白色固体, m.p. 133~135 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.69 (d, J=8.5 Hz, 1H), 8.61 (dd, J=8.0, 1.0 Hz, 1H), 8.26 (dd, J=8.0, 1.0 Hz, 1H), 8.08 (dd, J=8.5, 0.5 Hz, 1H), 7.88~7.84 (m, 1H), 7.79~7.73 (m, 3H), 7.71~7.68 (m, 1H), 7.65~7.61 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 163.2 (d, J=246.3), 160.1, 143.7, 135.8 (d, J=2.5Hz), 133.5, 131.7, 131.6 130.7, 130.3, 128.9, 128.6, 127.2, 127.1, 125.1, 123.7, 122.3, 122.0, 115.5, 115.4; HRMS calcd for C19H12FN 273.0954, found 273.0959.
6-(4׳-氯苯基)菲啶(2j)[22]: 产率65%.白色固体, m.p. 160~162 ℃(文献值[22] m.p. 160~161 ℃); 1H NMR (CDCl3, 500 MHz) δ: 8.71 (d, J=8.0 Hz, 1H), 8.62 (dd, J=8.5, 1.5 Hz, 1H), 8.26 (dd, J=8.0, .0 Hz, ), 8.08 (dd, J=8.5, 0.5 Hz, 1H), 7.89~7.86 (m, 1H), 7.80~7.77 (m, 1H), 7.73~7.69 (m, 3H), 7.66~7.62 (m, 2H); 13C NMR (125 MHz, CDCl3) δ: 159.9, 143.7, 138.2, 134.9, 133.5, 131.2, 130.7, 130.3, 129.6, 129.0, 128.7, 128.5, 128.4, 127.3, 127.2, 125.0, 123.8, 122.3, 122.0.
6-苯基-9-氟菲啶(2k):产率52%.白色固体, m.p. 131~133 ℃; 1H NMR (CDCl3, 500 MHz) δ: 8.43 (d, J=7.5 Hz, 1H), 8.27~8.22 (m, 2H), 8.11 (dd, J=9.0, 6.0 Hz, 1H), 7.79 (t, J=7.0 Hz, 1H), 7.73 (dd, J=8.0, 1.5 Hz, 2H), 7.67 (t, J=8.0 Hz, 1H), 7.60~7.53 (m, 3H), 7.34~7.30 (m, 1H); 13C NMR (125 MHz, CDCl3) δ: 163.7 (d, J=250 Hz), 160.5, 144.0, 139.5, 135.8 (d, J=8.8 Hz), 131.8 (d, J=8.8 Hz), 130.3, 129.6, 129.4, 128.8, 128.4, 126.9, 123.2 (d, J=3.8 Hz), 122.1, 122.0, 116.1 (d, J=23.8 Hz), 107.3 (d, J=2.3Hz); HRMS calcd for C19H12FN 273.0954, found 273.0958.
6-苯基-9-氯菲啶(2l)[23]:产率50%.白色固体, m.p. 145~147 ℃(文献值[23] 123~124 ℃); 1H NMR (CDCl3, 500 MHz) δ: 8.62 (d, J=2.0 Hz, 1H), 8.49 (d, J=8.0 Hz, 1H), 8.26 (d, J=8.0 Hz, 1H), 8.04 (d, J=8.5 Hz, 1H), 7.80~7.77 (m, 1H), 7.73 (d, J=6.5 Hz, 1H), 7.60~7.53 (m, 4H); 13C NMR (125 MHz, CDCl3) δ: 160.6, 144.1, 139.3, 137.1, 134.7, 130.5, 130.4, 129.5, 128.9, 127.7, 127.2, 123.5, 122.7, 121.9, 121.9.
辅助材料(Supporting Information) 产物2a~2l的核磁共振谱图.这些材料可以免费从本刊网站(http://sioc-journal.cn/)上下载.
-
-
[1]
(a) Monnier, F.; Taillefer, M. Angew. Chem., Int. Ed. 2008, 47, 3096. (b) Monnier, F.; Taillefer, M. Angew. Chem., Int. Ed. 2009, 49, 6954.
-
[2]
(a) Surry, D. S.; Buchwald, S. L. Angew. Chem., Int. Ed. 2008, 47, 6338. (b) Hartwig Acc. Chem. Res. 2008, 41, 1534.
-
[3]
(a) Guo, X; Li, Z. ; Li, C. Prog. Chem. 2010, 22, 1434 (in Chinese). (郭兴伟, 李志平, 李朝军, 化学进展, 2010, 22, 1434. ) (b) Yu, J. ; Ding, K. Acta Chim. Sinica 2015, 73, 1223 (in Chinese). (余金权, 丁奎岭, 化学学报, 2015, 73, 1223. )
-
[4]
(a) Xu, H. J. ; Man, Q. S. ; Lin, Y. C. Chin. J. Org. Chem. 2010, 30, 9 (in Chinese). (许华建, 蔄秋石, 林义成, 李源源, 冯乙巳, 有机化学, 2010, 30, 9. ) (b) Xu, J. ; Wei, Z. ; Li, J. Chin. J. Org. Chem. 2012, 32, 1208 (in Chinese). (徐娟, 魏真, 李加荣, 有机化学, 2010, 32, 1208. ) (c) Corbet, J. P. ; Mignani, G. Chem. Rev. 2006, 106, 2651. (d) Colby, D. A. ; Bergman, R. G. ; Ellman, J. A. Chem. Rev. 2010, 110, 624.
-
[5]
(a) Stuart, D. R.; Laperle, M. B.; Burgess, K. M. N.; Fagnou, K. J. Am. Chem. Soc. 2008, 130, 16474. (b) Guimond, N.; Gouliaras, C.; Fagnou, K. J. Am. Chem. Soc. 2010, 132, 6908. (c) Li, J. J.; Mei, T. S.; Yu, J. Q. Angew. Chem., Int. Ed. 2008, 47, 6452.
-
[6]
(a) Wang, J.; Wang, M.; Chen, K.; Zha, S.; Song, C.; Zhu, J. Org. Lett. 2016, 18, 1178. (b) Wang, H.; Li, L.; Yu, S.; Li, Y.; Li, X. Org. Lett. 2016, 18, 2914.
-
[7]
(a) Zhang, Z.; Jiang, H.; Huang, Y. Org. Lett. 2014, 16, 5976. (b) Louillat, M. L.; Patureau, F. W. Org. Lett. 2013, 15, 164.
-
[8]
徐树英, 陈小佳, 黎吉辉, 许文茸, 张玉苍, 有机化学, 2016, 36, 1985. http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345609.shtmlXu, S.; Chen, X.; Li, J.; Xu, W.; Zhang, Y. Chin. J. Org. Chem. 2016, 36, 1985 (in Chinese). http://sioc-journal.cn/Jwk_yjhx/CN/abstract/abstract345609.shtml
-
[9]
Inamoto, K.; Saito, T.; Katsuno, M.; Sakamoto, T.; Hiroya, K. Org. Lett. 2007, 9, 2931. doi: 10.1021/ol0711117
-
[10]
Stokes, B. J.; Dong, H.; Leslie, B. E.; Pumphrey, A. L.; Driver, T. G. J. Am. Chem. Soc. 2007, 129, 7500. doi: 10.1021/ja072219k
-
[11]
Ackermann, L.; Lygin, A. V.; Hofmann, N. Angew. Chem., Int. Ed. 2011, 50, 6379. doi: 10.1002/anie.201101943
-
[12]
(a) Jia, F. ; Li, Z. Org. Chem. Front. 2014, 1, 194. (b) Alt, I. T. ; Plietker, B. Angew. Chem. , Int. Ed. 2016, 55, 1519. (c) Legani, L. ; Cerai, G. P. ; Morandi, B. ACS Catal. 2016, 6, 8162. (d) Sun, C. -L. ; Li, B. J. ; Shi, Z. Chem. Rev. 2011, 111, 1293. (e)Bauer, I. ; Knölker, H. J. Chem. Rev. 2015, 115, 3170. (f) Guo, N. ; Zhu, S. Chin. J. Org. Chem. 2015, 35, 1383 (in Chinese). (郭娜, 朱守非, 有机化学, 2015, 35, 1383. ) (g) Zhu, S. F. ; Zhou, Q. L. Nat. Sci. Rev. 2014, 1, 580.
-
[13]
(a) Zhang, W.; Zhang, J.; Ren, S.; Liu, Y. J. Org. Chem. 2014, 79, 11508. (b) Zhang, W.; Lou, S.; Liu, Y.; Xu, Z. J. Org. Chem. 2013, 78, 5932. (c) Zhang, W.; Ren, S.; Zhang, J.; Liu, Y. J. Org. Chem. 2015, 800, 5973. (d) Wu, D.; Zhang, J.; Cui, J.; Zhang, W.; Liu, Y. Chem. Commun. 2014, 50, 10857.
-
[14]
(a) Ma, L. ; Lü, W. ; Huang, D. ; Niu, T. ; Su, Y. ; Wang, K. ; Hu, Y. Chin. J. Org. Chem. 2014, 34, 962 (in Chinese). (马丽芳, 吕文贤, 黄丹凤, 牛腾, 苏瀛鹏, 王克虎, 胡雨来, 有机化学, 2014, 34, 962. ) (b) Krane, B. D. ; Fagbule, M. O. ; Shamma, M. J. Nat. Prod. 1984, 47, 1. (c) Bernardo, P. H. ; Wan, K. F. ; Sivaraman, T. ; Xu, J. ; Moore, F. K. ; Hung, A. W. ; Mok, H. Y. K. ; Yu, V. C. ; Chai, C. L. L. J. Med. Chem. 2008, 51, 6699. (d) Stevens, N. ; O'Connor, N. ; Vishwasrao, H. ; Samaroo, D. ; Kandel, E. R. ; Akins, D. L. ; Drain, C. M. ; Turro, N. J. J. Am. Chem. Soc. 2008, 130, 7182.
-
[15]
Buchwald, S. L.; Bolm, C. Angew. Chem., Int. Ed. 2009, 48, 5586.
-
[16]
Mazzotti, A. R.; Campbell, M. G.; Tang, P.; Murphy, J. M.; Ritter, T. J. Am. Chem. Soc. 2013, 135, 14012. doi: 10.1021/ja405919z
-
[17]
Michaudel, Q.; Thevenet, D.; Baran, P. S. J. Am. Chem. Soc. 2012, 134, 2547. doi: 10.1021/ja212020b
-
[18]
Su, X.; Yu, S. Chem. Commun. 2016, 52, 10898.
-
[19]
Chang, M. -Y.; Cheng, Y. -C. Org. Lett. 2016, 18, 1682. doi: 10.1021/acs.orglett.6b00603
-
[20]
(a) Tang, E.; Mao, D.; Li, W.; Gao, Z.; Yao, P. Heterocycles 2012, 85, 667. (b) Kitahara, K.; Toma, T.; Shimokawa, J.; Fukuyama, T. Org. Lett. 2008, 10, 2259.
-
[21]
Fernando, P. C.; Scanlan, E. S.; Scottb, J. S.; Walton, J. C. Chem. Commun. 2008, 35, 4189.
-
[22]
Leardini, R. Synthesis. 1985, 1, 107.
-
[23]
Peng, J.; Chen, T.; Chen, G.; Li, B. J. Org. Chem. 2011, 76, 9507. doi: 10.1021/jo2017108
-
[1]
-
表 1 N-[1-苯基-1-(2'-联苯基)]甲基苯磺酰胺(1a)胺化/芳构化反应的条件优化a
Table 1. Optimization of the reaction conditions for the amination/aromatization of N-[(1, 1'-biphenyl)-2-yl(phenyl)methyl]-benzenesulfonamide (1a)

Entry Catalyst Oxidant (equiv.) Solvent Yieldb/% 1 FeCl2 Selectfluor (3) 甲苯 0 2 FeCl2 Selectfluor (3) 丙酮 0 3 FeCl2 Selectfluor (3) CH3CN 74 4 FeCl2 Selectfluor (3) CH3CN 65c, 55d 5 FeCl2 Selectfluor (2) CH3CN 46 6 FeCl2•4H2O Selectfluor (2 CH3CN 68 7 Fe(0) Selectfluor (3) CH3CN 58 8 Fe(NO3)3•9H2O Selectfluor (3) CH3CN 45 9 FeBr3 Selectfluor (3) CH3CN 55 10 FeCl3 Selectfluor (3) CH3CN 72 11 PdCl2 Selectfluor (3) CH3CN 68 12 FeCl2 Selectfluor (3) CH3CN 66e 13 FeCl2 Selectfluor (3) CH3CN 70f 14 FeCl2 K2S2O8 (3) CH3CN 0 15 FeCl2 DDQ (3) CH3CN 0 16 — Selectfluor (3) CH3CN <10 17 FeCl2 — CH3CN 0 18 FeCl2 (>99.99%) Selectfluor (3) CH3CN 75 aAll reactions were carried out with 1a (0.2 mmol), catalyst (15 mol%), Selectfluor (3 equiv.) in solvent (2 mL) at 100 ℃ for 24 h unless otherwise noted. bIsolated yield.cAt 90 ℃. dAt 110 ℃. eThe reaction time is 22 h. fThe reaction time is26 h. 表 2 N-[1-芳基-1-(2'-联苯基)]甲基苯磺酰胺底物的拓展a
Table 2. Scope of the amination/aromatization of N-([1, 1'-biphenyl]-2-yl(phenyl)methyl)benzenesulfonamide

Entry R1 R2 R3 Product Yieldb% 1 H H H 2a 74 2 H 4'-OCF3 H 2b 45 3 4-F 4'-Cl H 2c 83 4 4-F 4'-Bu-t H 2d 76 5 5-F H H 2e 57 6 5-F 4'-Cl H 2f 78 7 5-F 4'-Bu-t H 2g 69 8 H 3'-Cl H 2h 51 9 H H 4''-F 2i 61 10 H H 4''-Cl 2j 65 11 4-F H H 2k 52 12 4-Cl H H 2l 50 aReaction conditions: 1a (0.2 mmol), FeCl2 (0.03 mmol), Selectfluor (0.6 mmol) in CH3CN at 100 ℃ for 24 h unless otherwise noted. b Isolated yields. -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 2
- 文章访问数: 1254
- HTML全文浏览量: 133


 下载:
下载:
 下载:
下载:

