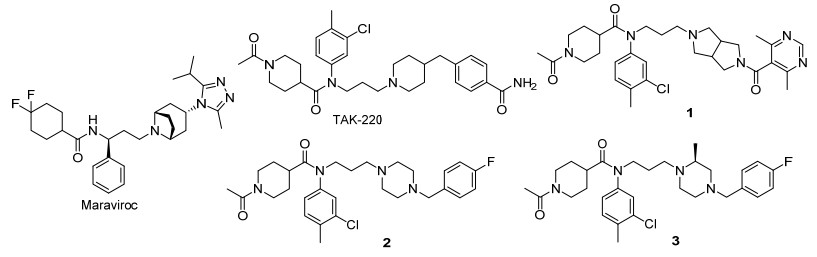
 图1
已报道CCR5抑制剂结构
Figure1.
Structures of CCR5 antagonists
图1
已报道CCR5抑制剂结构
Figure1.
Structures of CCR5 antagonists

Citation: Wang Yujie, Upul Halambage, Zeng Chengchu, Hu Liming. Design, Synthesis, and Biological Activity of Novel Octahydro-1Hpyrrolo[3, 2-c]pyridine Derivatives as C-C Chemokine Receptor Type 5 (CCR5) Antagonists[J]. Chinese Journal of Organic Chemistry, 2017, 37(9): 2385-2391. doi: 10.6023/cjoc201701049

新型八氢吡咯[3, 2-c]吡啶衍生物作为趋化因子受体(CCR5) 抑制剂的设计、合成及生物活性研究
English
Design, Synthesis, and Biological Activity of Novel Octahydro-1Hpyrrolo[3, 2-c]pyridine Derivatives as C-C Chemokine Receptor Type 5 (CCR5) Antagonists
-
Key words:
- HIV-1
- / CCR5 antagonists
- / piperidine derivatives
- / structure-activity relationships
-
获得性免疫缺陷综合症(Acquired Immune Deficiency Syndrome), 简称艾滋病(AIDS), 是由感染人类免疫缺陷病毒1型病毒(Human Immunodeficiency Virus, HIV-1) 感染引起的, 逐步摧毁人体免疫系统的重大传染性疾病.经过三十多年的研究, 人们对艾滋病的致病机理研究取得了重要进展.到目前为止, 被美国食品药品监督管理局(FDA)批准用于临床治疗的艾滋病单组分药物有29种, 以逆转录酶抑制剂和蛋白酶抑制剂为主.目前, 临床中常用的治疗方法为高效抗病毒疗法(Highly Active Antiretroviral Therapy, HAART)[1], 这一疗法很大程度上减少了艾滋病及其相关疾病的发病率和死亡率[2].但由于药物的毒副作用, 病毒的抗药性等问题难以解决, 因此, 研究高效, 低毒的艾滋病治疗药物具有十分重要的意义.
HIV-1生命周期包括感染和复制两部分, 其中感染过程为第一阶段. HIV-1首先通过其表面糖蛋白gp120与细胞膜受体CD4紧密结合, 使gp120膜蛋白的构象发生变化[3, 4]; 继而HIV-1包膜上的gp41与宿主细胞膜上的辅助受体CCR5 (CC-Chemokine Receptor 5) 或CXCR4结合, 其构象进一步发生改变[5, 6].最后, 病毒膜与细胞膜融合, 接着脱去包膜和核衣壳, 病毒核酸进入细胞.
CCR5是G蛋白偶联受体家族的一个成员, 是R5嗜性病毒感染宿主细胞必不可少的辅助受体之一[7, 8].近十年, 许多大型制药公司和科研人员都致力于CCR5抑制剂的研发.最终, 由美国Pfizer公司[9]研发的Maraviroc(图 1)于2007年经美国FDA批准上市, 成为第一个成功上市的小分子CCR5抑制剂.
由日本Takeda公司研发的TAK-220(图 1)具有很好的抗HIV-1活性.该化合物具有较强的CCR5亲和力(IC50=3.5 nmol•L-1), 较好的膜融合抑制活性(IC50=0.42 nmol•L-1)和很好的代谢稳定性[10]. Roche公司使用八氢吡咯[3, 4-c]吡咯桥环结构取代TAK-220中的哌啶结构, 从而得到化合物1(图 1), 其活性与TAK-220相当(IC50=2.7 nmol•L-1)[11]. 2012年, 军事医学科学院戴秋云课题组使用1, 4-二取代哌嗪取代TAK-220的核心母核哌啶结构, 得到化合物2(图 1), 具有很好的抗病毒活性(IC50=6.17 nmol•L-1), 并且较先导化合物TAK-220具有更好的水溶性和口服生物利用度[12]. 2013年, 刘涛课题组[13]将带有手性中心的甲基引入化合物2的哌嗪环中, 得到化合物3, 该化合物具有纳摩尔级抗病毒活性, 且在10 μmol•L-1浓度下未见细胞毒性.
本文在前期文献调研的基础上, 以TAK-220作为先导化合物, 引入二取代八氢吡咯[3, 2-c]吡啶桥环结构取代TAK-220核心结构哌啶环, 来研究哌啶桥环对于抗病毒活性的影响.设计并合成了一系列新型的CCR5抑制剂, 1-取代-N-[3-(1-苄基八氢吡咯[3, 2-c]吡啶)丙基]-N-取代苯基哌啶-4-酰胺类化合物, 最终筛选出了一个IC50值(半数抑制浓度)小于1 μmol•L-1的HIV-1抑制剂.
1 结果与讨论
1.1 化合物的合成
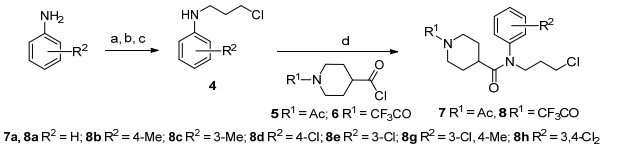
以取代苯胺为原料, 经甲酰基保护, 亲核取代, 脱保护, 酰胺化反应, 生成中间体7和8 (Scheme 1)[14].以3, 3-二乙氧基丙酸乙酯为原料, 在氨水中发生胺解反应, 得到3, 3-二乙氧基丙酰胺12.而后在乙醚中经氢化铝锂还原, 得到3, 3-二乙氧基丙胺13.胺类衍生物13经Boc保护后, 与烯丙基溴反应, 得到化合物15.该化合物在丙酮和水的混合溶剂中, 经对甲苯磺酸吡啶盐催化水解, 得到烯丙基(3-氧代丙基)氨基甲酸叔丁酯16.化合物16与N-苄基-N, O-二(三甲基硅基)甘氨酸(10)发生缩合关环反应, 生成1-苄基八氢吡咯[3, 2-c]吡啶-5-甲酸叔丁酯(17).如果使化合物16与N-苄基甘氨酸(9)直接反应, 也可生成关环产物17, 但收率很低, 主要的副产物为β-消除产物[15].化合物17脱保护后, 与中间体7和8发生亲核取代反应, 生成目标化合物19 (Scheme 2).
1.2 生物活性与讨论
生物活性测试在合作方美国范德堡大学医学院(Vanderbilt University Medical Center)的Aiken实验室完成.使用单周期抗HIV-1活性测试方法[16], 筛选化合物19a~19h抑制R5嗜性毒株感染TZM-bl细胞的能力.大多数化合物表现出了抗病毒活性.其中, 分子中间的取代苯基对于生物活性影响很大.如表 1所示, 在苯环的4位引入甲基或在3位引入氯, 化合物的生物活性得到了很大的提高.特别是化合物19c (3-Cl-4-Me), 具有很好的生物特征, HIV-1抑制活性IC50值为0.8 μmol•L-1, 其细胞毒性CC50值为15 μmol•L-1.

Compd. R1 R2 IC50/(μmol•L-1) CC50/(μmol•L-1) 19a MeCO H >20 >40 19b CF3CO 4-Me 10 >40 19c CF3CO 3-Cl-4-Me 0.8 15 19d CF3CO H >20 >40 19e CF3CO 3-Me 18 40 19f CF3CO 3-Cl 18 >40 19g CF3CO 4-Cl >20 30 19h CF3CO 3, 4-Cl2 8 25 Maraviroc 0.004 为进一步探索该系列化合物的抗HIV-1作用机理, 我们选取两种不同的HIV-GFP病毒, 来测试这一系列中活性最好的化合物19c的抗病毒活性(表 2).其中一种病毒是带有ΔGPVV R8 Bal包膜的R5嗜性毒株, 而另一种是带有ΔGPVV R8包膜的X4嗜性毒株.另外, 使用CCR5抑制剂Maraviroc和CXCR4抑制剂AMD3100作为阳性对照组.实验结果发现化合物19c不仅可以抑制R5嗜性病毒, 对X4嗜性病毒也有一定的抑制作用, 其对R5嗜性毒株的抑制活性(IC50=1.5 μmol•L-1)是X4毒株抑制活性(IC50=5.0 μmol•L-1)的3倍.这一结果说明, 19c除作用于CCR5靶标外, 在HIV-1感染复制的过程中, 该化合物还存在其他的作用靶标.
Compd. IC50 for R5 virus strain IC50 for X4 virus strain 19c 1.5 μmol•L-1 5.0 μmol•L-1 Maraviroc 30 nmol•L-1 None activity AMD3100 None activity <0.5 nmol•L-1 1.3 分子对接研究
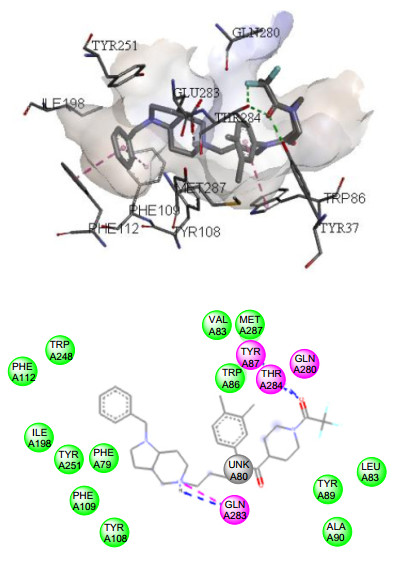
为了研究该系列化合物与CCR5蛋白的作用方式, 我们挑选了活性最好的化合物19c与CCR5蛋白晶体(PDB: 4MBS)[17]在Autodock 4.0程序上进行分子对接实验.如图 2所示, 化合物19c的核心母核结构八氢吡咯[3, 2-c]吡啶中哌啶环上的氮原子质子化后, 与CCR5蛋白上的Glu-283氨基酸形成盐桥, 这一现象与CCR5-Maraviroc复合物的高分辨晶体结构报道特征类似[17].然而, 与前期报道相反的是, 化合物19c分子一端的苄基结构, 进入由Phe-112, Phe-109, Tyr-108等疏水氨基酸组成的疏水口袋中, 并与这些氨基酸发生Pi-Pi相互作用, 而小分子中间的苯环并没有进入这一疏水口袋中.或许这就是这一系列化合物相比先导化合物TAK-220活性降低的主要原因.因此, 在以后的研究中, 我们将尝试在分子一端的苄基中引入弱疏水基团, 从而调整小分子化合物与CCR5蛋白的结合构象.
2 结论
在文献调研的基础上, 我们以TAK-220为先导化合物, 设计并合成了一系列1-苄基八氢吡咯[3, 2-c]吡啶衍生物作为抗HIV-1 CCR5抑制剂, 共合成8个目标化合物, 其结构经1H NMR, 13C NMR, HRMS确认.在抗HIV-1生物活性评价中, 多数化合物表现出了抗HIV-1活性以及可接受的细胞毒性.然而在功能实验中, 活性最好的化合物19c显示出了包括CCR5在内的多重抗病毒活性靶标.因此, 该系列化合物的抗病毒机理还需要进一步验证.
3 实验部分
3.1 仪器与试剂
合成实验中所用到的仪器为Bruker Advance 400核磁共振仪或Bruker Advance 500核磁共振仪; 高分辨质谱仪(型号为G3250AALC/MSD TOF system, 由美国安捷伦公司生产并销售); ESI-MS (Esquire 6000); FA2004A电子天平; 本实验所用化学药品试剂均为市售商品, 常用溶剂及原料等均为分析纯产品.薄层色谱(TLC)使用的是高效薄层硅胶板, 柱层析使用的是300-400目硅胶.
3.2 实验方法
3.2.1 3, 3-二乙氧基丙酰胺(12) 的合成
将3, 3-二乙氧基丙酸乙酯(5 g, 26.3 mmol)溶于氨水(100 mL), 室温下搅拌48 h.用氯仿萃取反应体系, 合并有机相, 用水和饱和食盐水洗涤有机相, 干燥有机相后减压脱溶, 得到的白色固体未经进一步分离纯化, 直接进行下一步反应. 1H NMR (CDCl3, 400 MHz) δ: 6.41 (s, 1H), 4.82 (t, J=5.2 Hz, 1H), 3.71 (tt, J=14.1, 7.1 Hz, 2H), 3.62~3.52 (m, 2H), 2.58 (d, J=5.2 Hz, 2H), 1.23 (t, J=7.1 Hz, 6H).
3.2.2 3, 3-二乙氧基丙胺(13) 的合成
将化合物12 (0.5 g, 3.1 mmol)溶于乙醚(10 mL)中, 冰浴条件下缓慢加入氢化铝锂(0.24 g, 6.2 mmol)乙醚溶液, 体系加热回流5 h.待体系冷却后, 用8%的氢氧化钠溶液淬灭, 有灰白色固体析出.过滤后, 用二氯甲烷萃取滤液, 合并有机相, 减压脱溶.得到的粗产物未经进一步分离纯化, 直接进行下一步反应.
3.2.3 3, 3-二乙氧基丙胺甲酸叔丁酯(14) 的合成
将化合物13 (3.3 g, 22.4 mmol)溶于甲苯(40 mL), 冰浴下加入氢氧化钠(0.9 g, 224 mmol)水溶液, 然后逐滴加入二碳酸二叔丁酯(5.5 g, 25 mmol).体系在室温下搅拌过夜, 分离有机相和水相, 用甲苯多次萃取水相.合并有机相, 减压脱溶.柱层析纯化后得到目标产物. 1H NMR (CDCl3, 400 MHz) δ: 5.07 (s, 1H), 4.40 (t, J=5.4 Hz, 1H), 3.56~3.45 (m, 2H), 3.05 (d, J=5.9 Hz, 2H), 1.65 (dd, J=12.2, 6.2 Hz, 2H), 1.30 (d, J=18.9 Hz, 13H), 1.05 (t, J=7.0 Hz, 6H).
3.2.4 烯丙基(3, 3-二乙氧基丙基)氨基甲酸叔丁酯(15) 的合成
将化合物14 (5 g, 20.2 mmol)溶于N, N-二甲基甲酰胺(50 mL), 加入烯丙基溴(24 g, 202 mmol)和氢氧化钾(11.3 g, 202 mmol).体系在室温下搅拌过夜, 加水淬灭反应体系, 并用甲苯萃取水相.合并有机相, 用水洗涤有机相, 干燥后, 减压脱溶.柱层析纯化后得到目标化合物. 1H NMR (CDCl3, 400 MHz) δ: 5.69 (dd, J=15.7, 9.9 Hz, 1H), 5.03 (d, J=11.1 Hz, 2H), 4.42 (s, 1H), 3.73 (d, J=16.6 Hz, 2H), 3.61-3.51 (m, 2H), 3.47~3.34 (m, 2H), 3.15 (s, 2H), 1.77 (d, J=6.7 Hz, 2H), 1.37 (s, 9H), 1.11 (t, J=6.7 Hz, 6H).
3.2.5 烯丙基(3-氧代丙基)氨基甲酸叔丁酯(16) 的合成
将化合物15 (3.2 g, 11.3 mmol)溶于丙酮(25 mL)和水(6 mL)的混合溶液, 加入对甲苯磺酸吡啶盐(2.8 g, 11.3 mmol), 体系在45 ℃下搅拌2 h.反应体系减压脱溶, 加水稀释, 并用乙酸乙酯萃取, 用饱和食盐水洗涤有机相, 干燥有机相后, 减压脱溶.柱层析纯化后得到目标化合物. 1H NMR (CDCl3, 400 MHz) δ: 9.79 (s, 1H), 5.86~5.68 (m, 1H), 5.13 (d, J=10.5 Hz, 2H), 3.85 (s, 2H), 3.47 (s, 2H), 2.66 (d, J=34.4 Hz, 2H), 1.46 (s, 9H).
3.2.6 N-苄基-N, O-二(三甲基硅基)甘氨酸(10) 的合成
将N-苄基甘氨酸(3 g, 18.2 mmol)溶于干燥二氯甲烷(50 mL), 加入三乙胺(7.35 g, 72.8 mmol)和三甲基氯硅烷(5.9 g, 54.6 mmol), 体系呈泥浆状, 并在室温下搅拌20 h.反应体系减压脱溶, 加入干燥苯(12 mL), 过滤, 将滤液减压脱溶.得到的粗产物未经进一步分离纯化, 立即进行下一步反应.
3.2.7 1-苄基八氢吡咯[3, 2-c]吡啶-5-甲酸叔丁酯(17) 的合成
将化合物10溶于干燥甲苯(20 mL), 加入化合物16 (0.75 g, 3.5 mmol), 体系加热回流16 h.待体系冷却后, 减压脱溶, 柱层析纯化后得到目标化合物. 1H NMR (CDCl3, 400 MHz) δ: 7.40~7.22 (m, 5H), 3.95 (d, J=13.2 Hz, 1H), 3.70~3.50 (m, 1H), 3.46~3.24 (m, 3H), 3.10 (s, 1H), 2.66 (s, 1H), 2.39~2.15 (m, 2H), 1.90~1.68 (m, 3H), 1.54~1.33 (m, 11H).
3.2.8 1-苄基八氢吡咯[3, 2-c]吡啶(18) 的合成
将化合物17溶于二氯甲烷(8 mL), 加入三氟乙酸(1.5 mL), 体系室温搅拌过夜.反应体系减压脱溶, 加入饱和碳酸氢钠溶液.用二氯甲烷萃取体系, 合并有机相并减压脱溶.得到的粗产物未经进一步分离纯化, 直接进行下一步反应.
3.2.9 目标化合物19a~19h的一般合成过程
将化合物18 (80 mg, 0.37 mmol)溶于5 mL乙腈溶液, 加入相应的已知中间体7或8 (0.37 mmol), 加入碳酸钾(260 mg, 1.85 mmol)和碘化钾(60 mg, 0.37 mmol), 体系回流8 h.反应体系减压脱溶, 加入水, 用二氯甲烷萃取体系, 合并有机相后, 减压脱溶, 柱层析分离纯化, 得到目标化合物.
1-乙酰基-N-[3-(1-苄基八氢吡咯[3, 2-c]吡啶)丙基]-N-苯基哌啶-4-甲酰胺(19a): 1H NMR (CDCl3, 400 MHz) δ: 7.50 (t, J=7.5 Hz, 2H), 7.43 (d, J=7.1 Hz, 1H), 7.32 (dd, J=14.0, 6.2 Hz, 7H), 4.52 (d, J=13.3 Hz, 1H), 4.04~3.62 (m, 4H), 3.43~2.96 (m, 8H), 2.92~2.96 (m, 3H), 2.45~2.16 (m, 5H), 2.04 (s, 6H), 1.71 (d, J=11.2 Hz, 2H), 1.67 (d, J=24.3 Hz, 3H). HRMS (ESI) calcd for C31H43N4O2 [M+H]+ 503.3386, found 503.3386.
N-[3-(1-苄基八氢吡咯[3, 2-c]吡啶)丙基]-N-对甲苯基-1-(2, 2, 2-三氟乙酰基)哌啶-4-甲酰胺(19b): 1H NMR (CDCl3, 500 MHz) δ: 7.38~7.22 (m, 9H), 4.42 (d, J=13.1 Hz, 1H), 3.95 (d, J=13.8 Hz, 2H), 3.84~3.57 (m, 2H), 3.21 (dd, J=23.9, 17.2 Hz, 3H), 3.05 (s, 3H), 2.98~2.86 (m, 2H), 2.70~2.64 (m, 2H), 2.53~2.45 (m, 1H), 2.41 (d, J=6.7 Hz, 3H), 2.22 (d, J=15.2 Hz, 2H), 2.02 (s, 2H), 1.84~1.60 (m, 9H); 13C NMR (CDCl3, 101 MHz) δ: 174.70, 155.28, 155.11, 154.75, 138.91, 130.98, 129.78, 128.57, 127.90, 127.52, 117.90, 115.04, 112.97, 57.11, 54.83, 51.46, 47.67, 46.89, 44.87, 42.66, 38.69, 35.43, 28.88, 27.99, 25.66, 23.04, 22.55, 21.11. HRMS (ESI) calcd for C32H41F3N4O2 [M+H]+ 571.3260, found 571.3251.
N-[3-(1-苄基八氢吡咯[3, 2-c]吡啶)丙基]-N-(3-氯-4-甲基苯基)-1-(2, 2, 2-三氟乙酰基)哌啶-4-甲酰胺(19c): 1H NMR (CDCl3, 400 MHz) δ: 7.40~7.23 (m, 6H), 7.09 (dd, J=13.6, 7.0 Hz, 2H), 4.48~4.33 (m, 1H), 4.22~4.14 (m, 1H), 4.08~3.87 (m, 2H), 3.87~3.75 (m, 1H), 3.58 (dt, J=23.5, 6.5 Hz, 4H), 3.37~3.17 (m, 2H), 2.93 (dt, J=22.9, 11.4 Hz, 1H), 2.72~2.53 (m, 2H), 2.38~2.18 (m, 8H), 2.16~1.97 (m, 5H), 1.93~1.84 (m, 1H), 1.82~1.68 (m, 3H), 1.61 (d, J=11.3 Hz, 1H); 13C NMR (CDCl3, 101 MHz) δ: 174.04, 155.27, 140.25, 137.04, 135.46, 132.29, 128.52, 128.19, 127.36, 126.84, 117.89, 115.03, 112.17, 59.23, 56.99, 54.94, 53.97, 51.54, 48.05, 47.23, 44.76, 42.57, 38.67, 35.97, 29.64, 28.84, 27.95, 25.72, 23.63, 23.18, 19.76. HRMS (ESI) calcd for C32H40ClF3N4O2 [M+H]+ 605.2870, found 605.2869.
N-[3-(1-苄基八氢吡咯[3, 2-c]吡啶)丙基]-N-苯基-1-(2, 2, 2-三氟乙酰基)哌啶-4-甲酰胺(19d): 1H NMR (CDCl3, 500 MHz) δ: 7.50 (t, J=7.6 Hz, 2H), 7.44 (d, J=7.3 Hz, 1H), 7.41~7.32 (m, 4H), 7.31 (s, 1H), 7.26 (s, 2H), 4.42 (d, J=13.3 Hz, 1H), 3.95 (d, J=12.9 Hz, 2H), 3.76 (dd, J=21.4, 14.7 Hz, 2H), 3.23 (d, J=6.8 Hz, 2H), 3.06 (s, 3H), 2.92 (dd, J=19.8, 9.2 Hz, 2H), 2.58 (t, J=12.1 Hz, 2H), 2.52~2.42 (m, 1H), 2.20 (s, 2H), 2.02 (s, 2H), 1.87~1.62 (m, 10H). HRMS (ESI) calcd for C31H39F3N4O2 [M+H]+ 557.3103, found 557.3104.
N-[3-(1-苄基八氢吡咯[3, 2-c]吡啶)丙基]-N-(3-甲基苯基)-1-(2, 2, 2-三氟乙酰基)哌啶-4-甲酰胺(19e): 1H NMR (CDCl3, 500 MHz) δ: 7.36 (t, J=7.7 Hz, 2H), 7.26 (s, 5H), 7.22 (d, J=7.8 Hz, 1 H), 7.11 (s, 1H), 4.42 (d, J=13.4 Hz, 1H), 3.95 (d, J=14.3 Hz, 1H), 3.72 (s, 2H), 3.25 (d, J=40.4 Hz, 2H), 3.07 (s, 3H), 2.94 (t, J=12.5 Hz, 1H), 2.65 (d, J=40.6 Hz, 2H), 2.47 (d, J=25.4 Hz, 3H), 2.25 (d, J=26.0 Hz, 2H), 2.02 (s, 2H), 1.76 (d, J=11.1 Hz, 4H), 1.59 (s, 9H); 13C NMR (CDCl3, 101 MHz) δ: 174.51, 155.30, 141.25, 140.72, 131.30, 130.06, 129.52, 128.84, 128.82, 128.47, 125.03, 117.90, 57.10, 54.84, 51.57, 47.12, 44.81, 42.64, 38.67, 35.21, 29.64, 28.88, 27.99, 25.60, 22.96, 22.52, 21.32. HRMS (ESI) calcd for C32H41F3N4O2 [M+H]+ 571.3260, found 571.3252.
N-[3-(1-苄基八氢吡咯[3, 2-c]吡啶)丙基]-N-(3-氯苯基)-1-(2, 2, 2-三氟乙酰基)哌啶-4-甲酰胺(19f): 1H NMR (CDCl3, 500 MHz) δ: 7.55~7.31 (m, 7H), 7.27 (s, 2H), 4.43 (d, J=13.4 Hz, 1H), 3.96 (d, J=13.9 Hz, 1H), 3.74 (d, J=6.8 Hz, 3H), 3.24 (d, J=29.6 Hz, 2H), 3.12 (d, J=37.0 Hz, 3H), 3.00~2.86 (m, 2H), 2.71~2.56 (m, 2H), 2.46 (s, 1H), 2.06 (dd, J=55.0, 29.2 Hz, 5H), 1.91~1.63 (m, 9H); 13C NMR (CDCl3, 101 MHz) δ: 174.18, 155.34, 142.58, 135.79, 131.46, 129.23, 128.09, 126.98, 117.89, 115.03, 54.72, 51.56, 46.91, 44.75, 42.59, 38.79, 34.94, 29.66, 28.83, 27.97, 27.19, 25.49. HRMS (ESI) calcd for C31H38ClF3N4O2 [M+H]+ 591.2714, found 591.2717.
N-[3-(1-苄基八氢吡咯[3, 2-c]吡啶)丙基]-N-(4-氯苯基)-1-(2, 2, 2-三氟乙酰基)哌啶-4-甲酰胺(19g): 1H NMR (CDCl3, 500 MHz) δ: 7.48 (d, J=8.6 Hz, 2H), 7.37 (s, 6H), 7.27 (s, 1H), 4.43 (d, J=13.2 Hz, 1H), 3.96 (d, J=14.0 Hz, 2H), 3.76 (ddd, J=34.0, 25.0, 10.8 Hz, 3H), 3.27 (s, 2H), 3.08 (s, 3H), 3.00~2.85 (m, 2H), 2.62 (dd, J=18.9, 9.4 Hz, 2H), 2.50~2.42 (m, 1H), 2.17 (s, 2H), 2.11~1.90 (m, 3H), 1.89~1.54 (m, 8H); 13C NMR (CDCl3, 101 MHz) δ: 174.37, 155.07, 139.81, 134.86, 133.78, 130.68, 129.76, 128.95, 122.85, 117.89, 116.52, 115.03, 54.75, 51.51, 46.81, 44.81, 42.61, 38.80, 35.11, 29.66, 28.66, 28.00, 25.56, 22.94, 14.07. HRMS (ESI) calcd for C31H38ClF3N4O2 [M+H]+ 591.2714, found 591.2706.
N-[3-(1-苄基八氢吡咯[3, 2-c]吡啶)丙基]-N-(3, 4-二氯苯基)-1-(2, 2, 2-三氟乙酰基)哌啶-4-甲酰胺(19h): 1H NMR (CDCl3, 500 MHz) δ: 7.61 (d, J=8.8 Hz, 1H), 7.46 (s, 1H), 7.37~7.24 (m, 6H), 4.44 (d, J=13.3 Hz, 1H), 3.95 (dd, J=23.7, 14.3 Hz, 2H), 3.74 (dd, J=89.0, 27.5 Hz, 2H), 3.37 (s, 1H), 3.17 (d, J=65.1 Hz, 2H), 2.97 (dd, J=28.5, 17.8 Hz, 4H), 2.85~2.59 (m, 3H), 2.57~2.33 (m, 3H), 2.11 (s, 2H), 2.05~1.89 (m, 3H), 1.89~1.67 (m, 6H); 13C NMR (CDCl3, 101 MHz) δ: 174.06, 155.31, 140.89, 134.08, 133.36, 132.08, 129.83, 128.54, 127.59, 117.88, 115.02, 59.06, 56.98, 54.64, 53.28, 51.47, 47.83, 47.11, 44.71, 42.53, 38.78, 35.62, 29.64, 28.83, 27.97, 25.61, 23.40, 22.73, 14.07. HRMS (ESI) calcd for C31H37Cl2F3N4O2 [M+H]+ 625.2324, found 625.2323.
3.3 生物活性实验
3.3.1 抗HIV-1活性测试
用含牛血清10%的DMEM培养基培养293T细胞, 使用ΔGPVV R8 Bal和R9-Eve两种质粒共转染的方式制备HIV-1假病毒株.将待测试样品溶于二甲基亚砜(DMSO), 浓度为10 mmol•L-1, 并用培养基将母液序列稀释为12个浓度, 其最高浓度为40 μmol•L-1.
用含牛血清10%的DMEM培养基将对数生长期的细胞接种于96孔板中(每孔6000细胞), 之后放置于恒温培养箱(37 ℃, 5%二氧化碳)中培养过夜.加入待测药品和HIV-1假病毒株后, 继续放入恒温培养箱中培养48 h.吸出培养基上清液, 加入细胞裂解液(Reportasol extraction buffer), 用分析仪(Molecular Devices Lmax microplate luminometer)定量分析荧光强度.
3.3.2 细胞毒性测试
使用MTT试剂盒(3-[4, 5-二甲基噻唑-2-基]-2, 5-二苯基四氮唑溴盐, Sigma)测试样品细胞毒性.用含牛血清10%, 无苯酚红指示剂的DMEM培养基将TZM-bl细胞接种于96孔板中(每孔6000细胞), 放置于恒温培养箱(37 ℃, 5%二氧化碳)中培养过夜.加入待测样品, 培养约48 h, 加入5 mg/mL MTT(每孔10 μL).继续放入培养箱中培养2 h.取出96孔板, 加入MTT溶解液(每孔100 μL), 溶解生成的MTT甲鐟沉淀.使用SpectraMax plate reader在570 nmol•L-1波长下定量分析生成的甲鐟浓度.
3.3.3 功能实验
使用PEI转染方式, 用ΔGPVV R8 Bal与HIV-GFP共转染, 生成R5嗜性HIV-1假病毒, 使用ΔGPVV R8与HIV-GFP共转染, 生成X4嗜性HIV-1假病毒.用含10%牛血清蛋白的DMEM培养基将TZM-bl细胞接种于96孔板(每孔6000细胞), 放置于恒温培养箱(37 ℃, 5%二氧化碳)中培养过夜, 加入病毒和待测样品(19c, Maraviroc和AMD3100).继续放入培养箱中培养48 h, 使用typsin将细胞转移至4%多聚甲醛溶液中固定.使用流式细胞仪定量分析细胞中GFP的表达, 计算病毒感染率.
3.3.4 分子对接
使用Discovery Studio 4.0 (DS 4.0) 处理4MBS共晶结构A链, 得到HIV-1 CCR5蛋白模型.使用Gaussian 03软件, 半经验AMI计算方法, 优化目标化合物19c至最低能量构型.
使用Autodock 4.0软件, AutodockTools模块进行对接, 蛋白处理包括加氢和加电荷.分子对接采取半柔性对接, 即以蛋白做刚性处理, 配体可自由转动.在对接过程中, grid box的大小为66 Å×88 Å×66 Å grid points, grid spacing设置约为碳碳单键长度的四分之一0.375 Å.对接算法采用Lamarckian遗传算法, 最大迭代次数为2500000, 其他为采用默认设置.最终产生100个复合物结构构象.
-
-
[1]
Garima, K.; Pamendra, K. S. HIV AIDS Rev. 2012, 3, 5.
-
[2]
Yeni, P. G.; Hammer, S. M.; Carpenter, C. C. J.; Cooper, D. A.; Fischl, M. A.; Gatell, J. M.; Gazzard, B. G.; Hirsch, M. S.; Jacobsen, D. M.; Katezenstein, D. A.; Montaner, J. S. G.; Richman, D. D.; Saag, M. S.; Schechter, M.; Schooley, R. T.; Thompson, M. A.; Vella, S.; Volberding, P. A. J. Am. Chem. Soc. 2002, 288, 222.
-
[3]
Eckert, D. M.; Kim, P. S. Ann. Rev. Biochem. 2001, 70, 777. doi: 10.1146/annurev.biochem.70.1.777
-
[4]
Freed, E. O.; Martin, M. A. J. Biol. Chem. 1995, 270, 23883. doi: 10.1074/jbc.270.41.23883
-
[5]
Feng, Y.; Broder, C. C.; Kennedy, P. E.; Berger, E. A. Science 1996, 272, 872. doi: 10.1126/science.272.5263.872
-
[6]
Moore, J. P.; Trkola, A.; Dragic, T. Curr. Opin. Immunol. 1997, 9, 551. doi: 10.1016/S0952-7915(97)80110-0
-
[7]
Wu, L.; Gerard, N. P.; Wyatt, R.; Cheo, H.; Parolin, C.; Ruffing, N.; Borsetti, A.; Cardoso, A. A.; Desjardin, E.; Newman, W.; Gerard, C.; Sodroski, J. Nature 1996, 384, 179. doi: 10.1038/384179a0
-
[8]
Kwong, P. D.; Wyatt, R.; Robinson, J.; Sweet, R. W.; Sodroski, J.; Hendericks, W. A. Nature 1998, 393, 648. doi: 10.1038/31405
-
[9]
Gulick, R. M.; Lalezari, J.; Goodrich, J.; Clumeck, N.; DeJesus, E.; Horban, A.; Nadler, J.; Clotet, B.; Karlsson, A.; Wohlfeiler, M.; Montana, J. B.; McHale, M.; Sullivan, J.; Ridgway, C.; Felstead, S.; Dunne, M. W.; Van der Ryst, E.; Mayer, H. N. Engl. J. Med. 2008, 359, 1429. doi: 10.1056/NEJMoa0803152
-
[10]
Imamura, S.; Ichikawa, T.; Nichikawa, Y.; Kanzaki, N.; Takashima, K.; Niwa, S.; Iizawa, Y.; Baba, M.; Sugihara, Y. J. Med. Chem. 2006, 49, 2784. doi: 10.1021/jm051034q
-
[11]
Lee, E. K.; Melville, C. R.; Rotstein, D. M. WO 2005121145, 2005[Chem. Abstr. 2005, 144, 69821].
-
[12]
Dong, M. X.; Lu, L.; Li, H. T.; Wang, X. H.; Lu, H.; Jiang, S. B.; Dai, Q. Y. Bioorg. Med. Chem. Lett. 2012, 22, 3284. doi: 10.1016/j.bmcl.2012.03.019
-
[13]
Hu, S. W.; Wang, Z. L.; Hou, T. J.; Ma, X. D.; Li, J.; Liu, T.; Xie, X. Bioorg. Med. Chem. 2015, 23, 1157. doi: 10.1016/j.bmc.2014.12.052
-
[14]
Imamura, S.; Nishikawa, Y.; Ichikawa, T.; Hattori, T.; Matsushita, Y.; Hashiguchi, S.; Kanzaki, N.; Iizawa, Y.; Baba, M.; Sugihara, Y. Bioorg. Med. Chem. 2005, 13, 397. doi: 10.1016/j.bmc.2004.10.013
-
[15]
Hardy, S.; Martin, S. F. Org. Lett. 2011, 13, 3102. doi: 10.1021/ol201010s
-
[16]
Wang, Y. J. Rong, J.; Zhang, B.; Hu, L. M.; Wang, X. L.; Zeng, C. C. Bioorg. Med. Chem. 2015, 23, 735. doi: 10.1016/j.bmc.2014.12.059
-
[17]
Tan, Q.; Zhu, Y.; Li, J.; Zhen, Z.; Han, G. W.; Kufareva, I.; Li, T.; Ma, L.; Fanalti, G.; Li, J.; Zhang, W.; Xie, X.; Yang, H.; Jiang, H.; Cherezov, V.; Liu, H.; Stevens, R. C.; Zhao, Q.; Wu, B. Science 2013, 341, 1387. doi: 10.1126/science.1241475
-
[1]
-
图式2 目标化合物19a~19h的合成方法
Scheme 2 Syntheses of target compounds 19a~19h
Reaction conditions: (a) TMSCl, Et3N, DCM, r.t.; (b) NH3•H2O, r.t.; (c) LiAlH4, Et2O, reflux; (d) Boc2O, NaOH, H2O, PhMe, r.t.; (e) Allyl bromide, KOH, DMF, r.t.; (f) p-MeC6H4SO3·Py, H2O, actone, 45 ℃; (g) 10, PhMe, reflux; (h) TFA, DCM, r.t.; (i) 7 or 8, K2CO3, KI, MeCN, reflux.
表 1 目标化合物19a~19h的抗HIV-1活性和细胞毒性
Table 1. Anti-HIV-1 activities and cytotoxicities of 19a~19h

Compd. R1 R2 IC50/(μmol•L-1) CC50/(μmol•L-1) 19a MeCO H >20 >40 19b CF3CO 4-Me 10 >40 19c CF3CO 3-Cl-4-Me 0.8 15 19d CF3CO H >20 >40 19e CF3CO 3-Me 18 40 19f CF3CO 3-Cl 18 >40 19g CF3CO 4-Cl >20 30 19h CF3CO 3, 4-Cl2 8 25 Maraviroc 0.004 表 2 抗病毒功能评价中的选择性
Table 2. The selectivity of function assay
Compd. IC50 for R5 virus strain IC50 for X4 virus strain 19c 1.5 μmol•L-1 5.0 μmol•L-1 Maraviroc 30 nmol•L-1 None activity AMD3100 None activity <0.5 nmol•L-1 -

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 7
- 文章访问数: 1224
- HTML全文浏览量: 131



 下载:
下载:



 下载:
下载:

