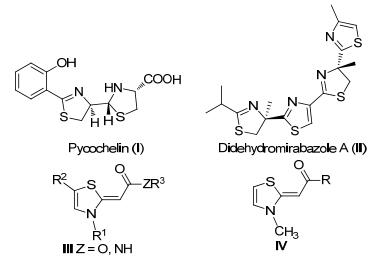
 图 1
具有生物活性的噻唑啉衍生物
Figure 1.
Biologically active thiazolylidene derivatives
图 1
具有生物活性的噻唑啉衍生物
Figure 1.
Biologically active thiazolylidene derivatives

Citation: Yu Le, Liu Ruijuan, Li Ming. Tetrabutylammonium Iodide/t-Butylhydroperoxide Catalytic/Oxidative Synthesis of Thiazolylidene Derivatives[J]. Chinese Journal of Organic Chemistry, 2017, 37(7): 1800-1807. doi: 10.6023/cjoc201701045

四正丁基碘化胺/叔丁基过氧化氢催化氧化合成噻唑啉衍生物的反应研究
-
关键词:
- 噻唑啉
- / β-芳甲酰基硫代酰胺
- / TBAI/TBHP
- / 催化
English
Tetrabutylammonium Iodide/t-Butylhydroperoxide Catalytic/Oxidative Synthesis of Thiazolylidene Derivatives
-
Key words:
- thiazolylidenes
- / β-ketothioamides
- / TBAI/TBHP
- / catalysis
-
噻唑啉类化合物在生物和医药等领域都有重要应用, 与许多生物酶或受体结合表现出多种生物活性[1].例如, Pyochelin (Ⅰ)不仅是微生物的铁载体而且具有抗肿瘤活性[2a], Didehydromirabazole A (Ⅱ)对实体瘤具有特异选择性, 同时还具有广谱抗肿瘤活性[2b].另外, 化合物Ⅲ可作为大麻素受体配体[3], 2-酰基亚甲基-3-甲基噻唑啉(Ⅳ)具有潜在的治疗类风湿性关节炎和其他炎症的作用[4](图 1).目前该类化合物的合成方法研究较少[5], 因此建立新的简单、高效的噻唑啉衍生物合成方法具有重要意义.
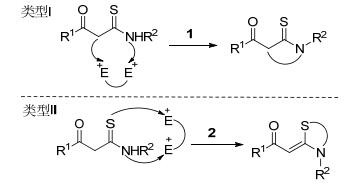
四正丁基碘化胺(TBAI)/叔丁基过氧化氢(TBHP)体系由于其价格低廉且绿色环保而被广泛应用于有机合成领域[6]. β-芳甲酰硫代酰胺(KTAs)分子含有多个反应活性中心, 而且, 由于分子中羰基官能团及其与双键的共轭效应, 使之成为功能多变的1, 3-亲电子平衡体, 显示出奇特的反应性能, 成为合成含N、S杂环类化合物的重要中间体[7].在已报道的KTAs的四种区域选择性反应模式中[8], 以C和N原子为活性中心的成键方式的类型Ⅰ的研究较为普遍[9], 而关于以S和N原子为活性中心的成键方式的类型Ⅱ的研究开展较少(Scheme 1)[10].
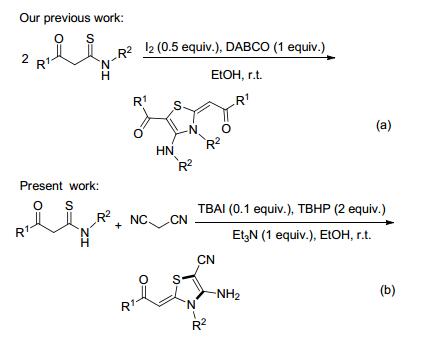
我们课题组曾报道了一种在I2和三乙烯二胺(DABCO)存在下, KTAs发生自身缩合反应合成噻唑啉化合物的方法(Scheme 2a)[11].在我们以KTAs为合成子构建多种杂环化合物的研究工作基础上[12], 本文报道一种以TBAI为催化剂、TBHP为氧化剂, 利用KTAs为合成砌块与丙二腈在室温条件下合成4-氨基噻唑啉类化合物的新方法(Scheme 2b).该方法具有条件温和、反应时间短、合成路线简捷、产率较高、后处理简单等优点.到目前为止, 以TBAI/TBHP体系催化氧化KTAs的反应尚未见文献报道.
1 结果与讨论
1.1 最佳反应条件的选择
以苯甲酰基硫代乙酰苯胺(1a)和丙二腈(2)为模型底物, 分别探讨了碱、催化剂, 氧化剂、溶剂、温度等条件对反应产率的影响, 结果见表 1.不加任何催化剂和氧化剂, 只加入化学计量的Et3N作为碱, 在乙醇中室温条件下反应72 h, 可以得到30%的产物3a(表 1, Entry 1).对照实验显示:没有Et3N的存在, 该反应不发生(Entry 2).对目标产物3a的结构进行仔细分析后, 我们猜想该反应可能存在一个极性转换的过程, 即将KTA转化变为亲电试剂, 然后被亲核试剂丙二腈进攻.因此, 在反应体系中加入氧化剂以期实现KTA的极性转换[11].我们选择了绿色催化氧化体系TBAI/TBHP.正如所料, 当同时加入0.2倍量的TBAI作催化剂及2倍量的TBHP作氧化剂时, 反应产率提高到了72%, 而且反应时间也大为缩短为1 h (Entry 3).其它的溶剂如N, N-二甲基甲酰胺(DMF)和二氯乙烷(DCE)也被筛选, 但它们都不如乙醇, 产率分别降低到45%和54% (Entries 4和5).接着, 对催化剂TBAI的用量进行研究, 当其用量降至0.1倍量时, 依然给出72%的产率(Entry 6);但继续降低催化剂TBAI的量, 产率也随之减少(Entries 7和8).随后, 我们对氧化剂TBHP的用量进行了实验, 将氧化剂的用量由2倍量减少到1倍量时, 产率也降至62% (Entry 9).对碘源筛选的结果显示: KI, NaI, 以及I2的效果都不如TBAI, 甚至反应时间还有所延长(Entries 10~12).对碱的种类也进行了筛选, 尝试了有机碱N, N-二异丙基乙胺(DIPEA), 无机碱NaOH和K2CO3, 它们均给出较低的产率(Entries 13~15).确定Et3N为最佳碱后, 进一步对其用量进行了探讨, 结果表明:减少碱量对该反应明显不利(Entry 16);而增加碱量虽然使反应时间缩短, 但却使副产物增多, 从而降低了反应的产率(Entry 17).另外, 升高温度对该反应不利, 目标物产率显著降低(Entry 18).另外, 我们也尝试了其它氧化剂, 如30% H2O2和间氯过氧苯甲酸(m-CPBA), 很遗憾, 它们均给出较低产率(Entries 19和20).因此, 确定最佳反应条件是: TBAI (0.1 equiv.)为催化剂, TBHP (2.0 equiv.)为氧化剂, Et3N (1 equiv.)为碱, 乙醇为溶剂, 室温条件下反应1 h (Entry 6).

Entry Base (equiv.) Catalyst (equiv.) Oxidant (equiv.) Solvent T/℃ Time/h Isolated yield/% 1 Et3N(1.0) — — EtOH r.t. 72 30 2 — — — EtOH r.t. 72 NRb 3 Et3N (1.0) TBAI (0.2) TBHP (2.0) EtOH r.t. 1 72 4 Et3N (1.0) TBAI (0.2) TBHP (2.0) DMF r.t. 6 45 5 Et3N (1.0) TBAI (0.2) TBHP (2.0) DCE r.t. 2 54 6 Et3N (1.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 72 7 Et3N (1.0) TBAI (0.05) TBHP (2.0) EtOH r.t. 1 60 8 Et3N (1.0) - TBHP (2.0) EtOH r.t. 1 56 9 Et3N (1.0) TBAI (0.1) TBHP (1.0) EtOH r.t. 1 62 10 Et3N (1.0) KI (0.1) TBHP (2.0) EtOH r.t. 1 64 11 Et3N (1.0) NaI (0.1) TBHP (2.0) EtOH r.t. 1 63 12 Et3N (1.0) I2(0.1) TBHP (2.0) EtOH r.t. 5 65 13 DIPEA (1.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 50 14 NaOH (1.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 53 15 K2CO3(1.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 41 16 Et3N (0.5) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 46 17 Et3N (2.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 0.5 53 18 Et3N (1.0) TBAI (0.1) TBHP (2.0) EtOH 80 1 49 19 Et3N (1.0) TBAI (0.1) H2O2 (2.0) EtOH r.t. 1 43 20 Et3N (1.0) TBAI (0.1) m-CPBA (2.0) EtOH r.t. 1 35 a反应条件: 1a (0. 2 mmol), 2 (0. 3 mmol), 溶剂(1 mL); bNo reaction. 1.2 底物拓展
在最佳反应条件下, 我们对该反应的底物适用性进行研究(表 2).从表 2可以看出, 对于底物β-芳甲酰基硫代酰胺1, R1为苯环或者取代苯环时, 改变苯环上取代基位置对产率几乎没有影响(3c, 3g和3j); 从电子效应角度考虑, 苯环上连有强吸电子基产率有所降低; 当R1为杂环如噻吩环时, 产率明显低于苯环及取代苯环产物(3k).当R2为取代苯环时, 电子效应对产率的影响更加明显, 当苯环上连有强吸电子基如三氟甲基时, 产率降到50% (3n).当R2为脂肪族取代基如环己烷时, 只得到痕量的产物.
用苯甲酰乙腈(4)替代丙二腈(2), 也可以得到相应的噻唑啉化合物5(Eq. 1), 但由于其活性较丙二腈小, 只给出35%产率.遗憾地, 使用氰基乙酸乙酯反应时, 得到了难以分离的复杂混合物.
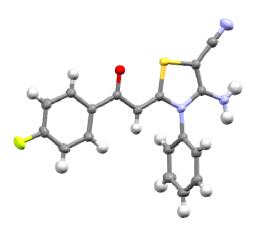
所有产物结构均经1H NMR、13C NMR、HRMS方法表征, 并通过3b的X射线单晶衍射分析证实(图 2, CCDC 1451298).
1.3 控制实验
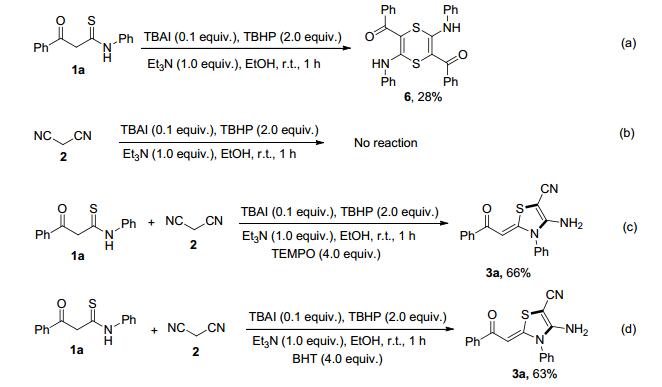
为了进一步理解反应的机理, 我们做了以下四个控制实验.结果显示:在最优反应条件下, 1a会发生自身缩合反应得到1, 4-二噻姻类化合物6, 这与我们之前的报道一致[11] (Scheme 3a); 而丙二腈(2)在此条件下并不发生反应(Scheme 3b); 这说明反应的启动来自于KTAs而非丙二腈.另外, 考虑到在TBAI/TBHP催化氧化的反应模式中, 经常会发生自由基反应[13], 所以又进行了两个自由基捕获实验.可以看出2, 2, 6, 6-四甲基哌啶-1-氧自由基(TEMPO)和2, 6-二叔丁基-4-甲基苯酚(BHT)均未阻碍反应的进行(Schemes 3c和3d), 说明反应不是按照自由基机理进行的.
1.4 可能的反应机理
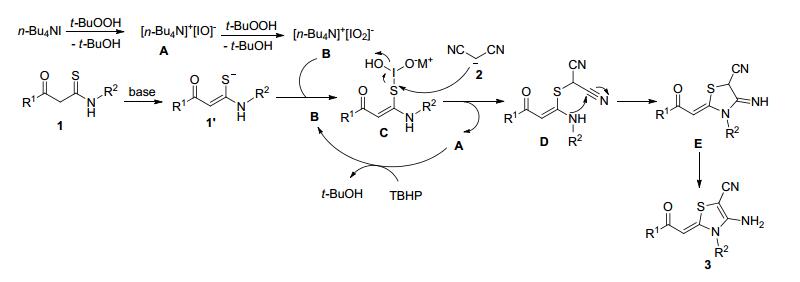
基于以上的实验结果并参考前人的工作[14], 我们推测了该反应可能的机理, 如Scheme 4所示.首先, 催化剂n-Bu4NI (TBAI)被氧化剂t-BuOOH (TBHP)氧化成[n-Bu4N]+[IO]- (A), A可进一步被氧化成[n-Bu4N]+-[IO2]- (B). KTAs 1在Et3N的作用下经烯醇互变, 生成硫醇负离子1', 随后1'与B反应生成C, 后者被丙二腈负离子进攻得到中间体D, 而脱掉的A继续被TBHP氧化生成B, 进一步参与催化氧化循环过程. D再经分子内环化反应得到亚胺噻唑烷中间体E.最后, E经1, 3氢迁移得到产物3.
2 结论
本文建立了一种简单、有效地构建4-氨基噻唑啉衍生物的新方法.该方法以β-芳甲酰硫代酰胺与丙二腈为合成砌块, 采用廉价的TBAI/TBHP为催化氧化体系, 具有操作简便、反应条件温和、反应时间短、后处理简单等特点, 丰富了KTAs的反应类型.
3 实验部分
3.1 仪器与试剂
Bruker AC-500型核磁共振仪, TMS为内标, DMSO-d6为溶剂; Ultima Global质谱仪, ESI源(电喷雾离子源); EYELA, N-1100型旋转蒸发器(上海爱朗仪器有限公司); DLSB-10/40型低温冷却液循环泵(巩义市予华仪器有限责任公司); RY-1型毛细管显微熔点仪, 天津分析仪器厂, 温度计未校正; Nicolet iS10傅立叶变换红外光谱仪, KBr压片; 薄层色谱(TLC)所用硅胶为GF254, 青岛海洋化工厂产品, 紫外254 nm或365 nm观察.
所有溶剂和试剂均为分析纯. β-芳甲酰基硫代酰胺(1)参考文献[7g]合成
3.2 目标化合物3的合成
称取无取代β-芳甲酰基硫代酰胺(1a) (0.5 mmol, 127.5 mg)、丙二腈(2) (0.75 mmol, 50 mg)、三乙胺(0.5 mmol, 50 mg)、TBAI (0.05 mmol, 18 mg)、TBHP (1.0 mmol, 90 mg)于25 mL单口瓶中, 加入溶剂乙醇(2 mL).室温搅拌, 至薄层色谱(TLC)检测1a反应完全后终止反应, 抽滤得到黄色固体.将固体收集起来, 用乙醇溶剂继续洗涤3遍, 得到114 mg黄色固体(Z)-4-氨基-2-(2-氧代-2-苯基亚乙基)-3-苯基-2, 3-二氢噻唑-5-甲腈(3a), 产率72%. m.p. 284~285 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:5.93 (s, 1H), 6.95 (s, 2H), 7.36~7.39 (m, 2H), 7.42~7.45 (m, 1H), 7.53 (d, J=6.6 Hz, 2H), 7.56 (d, J=7.6 Hz, 2H), 7.66~7.70 (m, 3H); 13C NMR(DMSO-d6, 125 MHz) δ:56.6, 90.4, 116.2, 126.8, 129.0, 131.2, 131.4, 134.6, 138.7, 153.5, 161.1, 183.0; HRMS (ESI) calcd for C18H14N3OS [M+H]+ 320.08521, found 320.08521.
化合物3b~3q的合成方法同化合物3a.
(Z)-4-氨基-2-[2-(4-氟苯基)-2-氧代亚乙基]-3-苯基-2, 3-二氢噻唑-5-甲腈(3b):得110 mg黄色固体, 产率65%. m.p. 273~274 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:5.90 (s, 1H), 6.95 (s, 2H), 7.20 (t, J=8.7 Hz, 2H), 7.53 (d, JHF=6.4 Hz, 2H), 7.62~7.64 (m, 2H), 7.68~7.69 (m, 3H); 13C NMR(DMSO-d6, 125 MHz) δ:56.6, 90.2, 116.0 (d, 2JCF=21.4 Hz), 116.3, 129.1, 129.4, 129.5, 131.4, 131.5, 134.6, 135.3, 153.6, 161.3, 164.2 (d, 1JCF=248.5 Hz), 181.7; HRMS (ESI) calcd for C18H13FN3OS[M+H]+ 338.07579, found 338.07578.
(Z)-4-氨基-2-[2-(4-氯苯基)-2-氧代亚乙基]-3-苯基-2, 3-二氢噻唑-5-甲腈(3c):得124 mg黄色固体, 产率70%. m.p. 289~290 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:5.91 (s, 1H), 6.94 (s, 2H), 7.44 (d, J=8.0 Hz, 2H), 7.52~7.53 (m, 2H), 7.58 (d, J=8.2 Hz, 2H), 7.69 (s, 3H); 13C NMR(DMSO-d6, 125 MHz, ) δ:56.8, 90.2, 116.2, 128.7, 129.0, 129.1, 131.4, 134.6, 136.2, 137.4, 153.6, 161.5, 181.5; HRMS (ESI) calcd for C18H13ClN3OS [M+H]+ 354.04624, found 354.04626.
(Z)-4-氨基-2-[2-(4-溴苯基)-2-氧代亚乙基]-3-苯基-2, 3-二氢噻唑-5-腈(3d):得148 mg黄色固体, 产率75%. m.p. 285~286 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:5.90 (s, 1H), 6.95 (s, 2H), 7.50~7.54 (m, 4H), 7.58 (d, J=8.4 Hz, 2H), 7.68~7.70 (m, 3H); 13C NMR(DMSO-d6, 125 MHz) δ:56.8, 90.2, 116.2, 125.1, 128.9, 129.0, 131.4, 132.0, 134.6, 137.7, 153.6, 161.5, 181.6; HRMS (ESI) calcd for C18H13BrN3OS[M+H]+ 397.99572, found 397.99573.
(Z)-4-氨基-2-[2-氧代-2-(对三氟甲基苯基)亚乙基]-3-苯基-2, 3-二氢噻唑-5-甲腈(3e):得122 mg黄色固体, 产率63%. m.p.>300 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:5.96 (s, 1H), 6.99 (s, 2H), 7.54~7.55 (m, 2H), 7.69~7.70 (m, 3H), 7.72~7.77 (m, 4H); 13C NMR(DMSO-d6, 125 MHz) δ:57.3, 90.6, 116.0, 124.5 (q, 1JCF=272.5 Hz), 127.6, 129.0, 131.1 (q, 2JCF=32.6 Hz), 131.5, 134.6, 142.3, 153.7, 161.8, 181.3; HRMS (ESI) calcd for C19H13F3N3OS [M+H]+ 388.07259, found 388.07260.
(Z)-4-氨基-2-[2-氧代-2-(对甲苯基)亚乙基]-3-苯基-2, 3-二氢噻唑-5-甲腈(3f):得120 mg黄色固体, 产率72%. m.p. 284~285 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:2.28 (s, 3H), 5.91 (s, 1H), 6.91 (s, 2H), 7.18 (d, J=8.0 Hz, 2H), 7.46 (d, J=8.1 Hz, 2H), 7.51~7.53 (m, 2H), 7.66~7.71 (m, 3H); 13C NMR(DMSO-d6, 125 MHz) δ:21.4, 56.4, 90.3, 116.3, 126.9, 129.0, 129.6, 131.3, 131.4, 134.7, 136.1, 141.4, 153.5, 160.9, 182.9; HRMS (ESI) calcd for C19H16N3OS [M+H]+ 334.10086, found 334.10089.
(Z)-4-氨基-2-[2-(3-氯苯基)-2-氧代亚乙基]-3-苯基-2, 3-二氢噻唑-5-甲腈(3g):得122 mg黄色固体, 产率69%. m.p.>300 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:5.90 (s, 1H), 6.98 (s, 2H), 7.39~7.42 (m, 1H), 7.46~7.54 (m, 4H), 7.59 (s, 1H), 7.69~7.70 (m, 3H); 13C NMR(DMSO-d6, 125 MHz) δ:57.0, 90.3, 116.1, 125.4, 126.6, 129.0, 131.1, 131.2, 131.5, 134.0, 134.6, 140.7, 153.7, 161.7, 181.1; HRMS (ESI) calcd for C18H13ClN3OS [M+H]+ 354.04624, found 354.04620.
(Z)-4-氨基-2-[2-(3-甲氧基苯基)-2-氧代亚乙基]-3-苯基-2, 3-二氢噻唑-5-甲腈(3h):得122 mg黄色固体, 产率70%. m.p. 254~255 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:3.74 (s, 3H), 5.89 (s, 1H), 6.95 (s, 2H), 7.01 (dd, 1J=8.1 Hz, 2J=2.0 Hz, 1H), 7.04 (d, J=7.7 Hz, 1H), 7.15 (s, 1H), 7.28 (t, J=7.9 Hz, 1H), 7.52~7.54 (m, 2H), 7.66~7.71 (m, 3H); 13C NMR(DMSO-d6, 125 MHz) δ:55.6, 56.7, 90.6, 112.1, 116.2, 117.1, 119.0, 129.0, 130.1, 131.4, 134.7, 140.3, 153.5, 159.8, 161.1, 182.7; HRMS (ESI) calcd for C19H16N3O2S[M+H]+ 350.09577, found 350.09555.
(Z)-4-氨基-2-[2-(2-氟苯基)-2-氧代亚乙基]-3-苯基-2, 3-二氢噻唑-5-甲腈(3i):得130 mg黄色固体, 产率77%. m.p. 292~293 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:5.91 (s, 1H), 6.99 (s, 2H), 7.11~7.15 (m, 1H), 7.23 (t, J=7.5 Hz, 1H), 7.45 (q, JHF=6.3 Hz, 1H), 7.51~7.52 (m, 2H), 7.64~7.67 (m, 3H), 7.72 (t, J=7.2 Hz, 1H); 13C NMR(DMSO-d6, 125 MHz) δ:56.8, 94.9, 116.1, 116.7 (d, 2JCF=23.4 Hz), 125.1, 126.8, 126.9, 129.0, 130.6, 131.3, 133.1, 134.6, 153.6, 160.1 (d, 1JCF=243.3 Hz), 178.8; HRMS (ESI) calcd for C18H13FN3OS [M+H]+ 338.07579, found 338.07587.
(Z)-4-氨基-2-[2-(2-氯苯基)-2-氧代亚乙基]-3-苯基-2, 3-二氢噻唑-5-甲腈(3j):得132 mg黄色固体, 产率75%. m.p. 238~239 ℃; 1H NMR(DMSO-d6, 500 MHz) δ: 5.60 (s, 1H), 7.00 (s, 2H), 7.31~7.32 (m, 1H), 7.35~7.37 (m, 3H), 7.50 (d, J=6.6 Hz, 2H), 7.63~7.64 (m, 3H); 13C NMR(DMSO-d6, 125 MHz) δ:56.5, 94.6, 116.1, 127.7, 129.0, 129.9, 130.1, 130.5, 131.3, 134.5, 139.9, 153.6, 160.4, 183.4; HRMS (ESI) calcd for C18H13ClN3OS [M+H]+ 354.04624, found 354.04630.
(Z)-4-氨基-2-[2-氧代-2-(噻吩-2-基)亚乙基]-3-苯基-2, 3-二氢噻唑-5-甲腈(3k):得80 mg黄色固体, 产率49%. m.p. 280~281 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:5.78 (s, 1H), 6.94 (s, 2H), 7.03 (t, J=4.2, 1H), 7.27 (d, J=3.2, 1H), 7.51~7.53 (m, 2H), 7.68~7.69 (m, 4H); 13C NMR(DMSO-d6, 125 MHz) δ:56.6, 90.3, 116.2, 128.1, 128.7, 129.1, 131.4, 131.5, 134.6, 145.7, 153.6, 160.5, 176.7; HRMS (ESI) calcd for C16H12N3OS2[M+H]+ 326.04163, found 326.04184.
(Z)-4-氨基-3-(4-氟苯基)-2-(2-氧代-2-苯基亚乙基)-2, 3-二氢噻唑-5-甲腈(3l):得92 mg黄色产物, 产率55%. m.p. 290~291 ℃; 1H NMR(DMSO-d6, 500 MHz) δ: 5.97 (s, 1H), 7.00 (s, 2H), 7.37~7.40 (m, 2H), 7.43~7.46 (m, 1H), 7.52 (t, JHF=8.6 Hz, 2H), 7.62~7.63 (m, 4H); 13C NMR(DMSO-d6, 125 MHz) δ: 56.4, 90.5, 116.2, 118.4 (d, 2JCF=22.8 Hz), 126.9, 129.0, 130.9, 131.4, 131.7, 138.7, 153.7, 161.2, 163.5 (d, 1JCF=247.4 Hz), 183.1; HRMS (ESI) calcd for C18H13FN3OS [M+H]+ 338.07579, found 338.07571.
(Z)-4-氨基-3-(4-氯苯基)-2-(2-氧代-2-苯基亚乙基)-2, 3-二氢噻唑-5-甲腈(3m):得141 mg黄色固体, 产率80%. m.p.>300 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:5.99 (s, 1H), 7.00 (s, 2H), 7.37~7.40 (m, 2H), 7.43~7.46 (m, 1H), 7.59 (d, J=8.4 Hz, 2H), 7.63 (d, J=7.4 Hz, 2H), 7.74 (d, J=8.3 Hz, 2H); 13C NMR(DMSO-d6, 125 MHz) δ:56.4, 90.5, 116.2, 127.0, 129.0, 131.2, 131.5, 133.5, 135.9, 138.6, 153.6, 160.9, 183.1; HRMS (ESI) calcd for C18H13ClN3OS[M+H]+ 354.04624, found 354.04626.
(Z)-4-氨基-2-(2-氧代-2-苯基亚乙基)-3-[4-(三氟甲基)苯基]-2, 3-二氢噻唑-5-甲腈(3n):得97 mg黄色固体, 产率50%. m.p.>300 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:6.00 (s, 1H), 7.04 (s, 2H), 7.38 (t, J=7.3 Hz, 2H), 7.43~7.46 (m, 1H), 7.63 (d, J=7.3 Hz, 2H), 7.81 (d, J=8.1 Hz, 2H), 8.06 (d, J=8.2 Hz, 2H); 13C NMR(DMSO-d6, 125 MHz) δ:56.7, 90.6, 116.2, 124.4 (q, 1JCF=272.8 Hz), 127.0, 128.7, 129.0, 130.5, 131.3, 131.6, 138.4 (d, 2JCF=41.4 Hz), 153.5, 160.7, 183.2; HRMS (ESI) calcd for C19H13F3N3OS[M+H]+ 388.07259, found 388.07230.
(Z)-4-氨基-2-(2-氧代-2-苯基亚乙基)-3-(对甲苯基)-2, 3-二氢噻唑-5-甲腈(3o):得123 mg黄色固体, 产率74%. m.p.>300 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:2.45 (s, 3H), 5.96 (s, 1H), 6.90 (s, 2H), 7.37~7.45 (m, 5H), 7.49 (d, J=7.9 Hz, 2H), 7.58 (d, J=7.3 Hz, 2H); 13C NMR(DMSO-d6, 125 MHz) δ:21.4, 56.4, 90.4, 116.2, 126.8, 128.7, 129.0, 131.4, 131.9, 132.0, 138.7, 140.9, 153.6, 161.2, 183.0; HRMS (ESI) calcd for C19H16N3OS [M+H]+ 334.10086, found 334.10077.
(Z)-4-氨基-3-(4-甲氧基苯基)-2-(2-氧代-2-苯基亚乙基)-2, 3-二氢噻唑-5-甲腈(3p):得139 mg黄色固体, 产率80%. m.p. 279~280 ℃; 1H NMR(DMSO-d6, 500 MHz) δ:3.87 (s, 3H), 5.98 (s, 1H), 6.91 (s, 2H), 7.20 (d, J=8.7 Hz, 2H), 7.37~7.40 (m, 2H), 7.43~7.45 (m, 3H), 7.59 (d, J=7.4 Hz, 2H); 13C NMR(DMSO-d6, 125 MHz) δ: 56.0, 90.4, 116.5, 126.8, 129.0, 130.3, 131.4, 138.7, 153.9, 161.0, 161.5, 182.9; HRMS (ESI) calcd for C19H16N3O2S[M+H]+ 350.09577, found 350.09573.
(Z)-4-氨基-3-(3-氯苯基)-2-(2-氧代-2-苯基亚乙基)-2, 3-二氢噻唑-5-甲腈(3q):得144 mg黄色固体, 产率82%. m.p. 282~283 ℃; 1H NMR(DMSO-d6, 500 MHz) δ: 5.97 (s, 1H), 7.04 (s, 2H), 7.37~7.40 (m, 2H), 7.43~7.46 (m, 1H), 7.53 (d, J=7.6 Hz, 1H), 7.62 (d, J=7.3 Hz, 2H), 7.68~7.76 (m, 3H); 13C NMR(DMSO-d6, 125 MHz) δ: 56.5, 90.5, 116.3, 127.0, 128.1, 129.0, 129.5, 131.5, 132.8, 135.3, 135.8, 138.6, 153.5, 160.9, 183.1; HRMS (ESI) calcd for C18H13ClN3OS [M+H]+ 354.04624, found 354.04620.
3.3 化合物5的合成
称取无取代β-芳甲酰基硫代酰胺(1a, 0.5 mmol, 127.5 mg)、苯甲酰乙腈(4, 0.75 mmol, 108.7 mg)、三乙胺(0.5 mmol, 50 mg)、TBAI (0.05 mmol, 18 mg)、TBHP (1.0 mmol, 90 mg), EtOH (1 mL)加入到圆底烧瓶中, 放置于室温中搅拌, 1 h反应完全. TLC监测, 以原料1a反应完全为准.得到的黄色液体通过减压浓缩之后经柱层析分离[V(石油醚):V(乙酸乙酯)=2:1], 得70 mg黄色固体(Z)-2-(4-氨基-5-苯甲酰基-3-苯基噻唑-2(3H)-亚基)-1-苯基乙-1-酮(5), 产率35%. m.p. 189~190 ℃; 1H NMR (DMSO-d6, 500 MHz) δ: 5.94 (s, 1H), 7.37~7.39 (m, 2H), 7.42~7.45 (m, 1H), 7.55~7.59 (m, 5H), 7.62~7.63 (m, 2H), 7.73~7.76 (m, 5H), 8.11 (s, 2H); 13C NMR (DMSO-d6, 125 MHz) δ: 89.2, 90.1, 126.8, 127.3, 128.9, 129.0, 131.2, 131.3, 131.5, 134.1, 139.1, 141.1, 155.0, 160.3, 183.5, 184.9; HRMS (ESI) calcd for C24H19N2O2S[M+H]+ 399.11617, found 399.11606.
3.4 化合物6的合成
称取无取代β-芳甲酰基硫代酰胺1a (0.5 mmol, 255.1 mg)、三乙胺(0.5 mmol, 50 mg)、TBAI (0.05 mmol, 18 mg)、TBHP (1.0 mmol, 90 mg), EtOH (2 mL)加入到圆底烧瓶中, 放置于室温中搅拌, 1 h反应完全.抽滤得到黄色固体, 用乙醇溶剂洗涤3遍, 得35 mg黄色固体[3, 6-双(苯基氨基)-1, 4-二噻姻-2, 5-二基]双(苯基甲酮)(6), 产率28%. m.p. 205~207 ℃; 1H NMR (CDCl3, 500 MHz) δ: 7.09 (d, J=7.05 Hz, 2H), 7.18~7.23 (m, 5H), 7.38 (t, J=7.4 Hz, 1H), 7.52 (d, J=7.0 Hz, 2H), 12.94 (s, 1H); 13C NMR (CDCl3, 125 MHz) δ: 106.5, 124.7, 126.5, 127.6, 128.3, 129.0, 130.5, 138.6, 140.1, 162.4, 191.0; IR (KBr)ν: 3441, 2926, 2852, 1607, 1594, 1577, 1542, 1479, 1443, 1377, 1226, 1175, 1049, 738, 693 cm-1; HRMS (ESI) calcd for C30H23N2O2S2[M+H]+507.1201, found, 507.1209.
辅助材料(Supporting Information)合成的所有新化合物的1H NMR、13C NMR谱图.这些材料可以免费从本刊网站(http: //sioc-journal. cn/)上下载.
-
-
[1]
Kashyap, S. J.; Garg, V. K.; Sharma, P. K.; Kumar, N.; Dudhe, R.; Gupta, J. K. Med. Chem. Res. 2012, 21(8), 2123. doi: 10.1007/s00044-011-9685-2
-
[2]
(a) Meneely, K. M.; Ronnebaum, T. A.; Riley, A. P.; Prisinzano, T. E.; Lamb, A. L. Biochemistry 2016, 55, 5423.
(b) Boyce, R. J.; Pattende, G. Tetrahedron 1995, 51(26), 7313. -
[3]
Carroll, W. A.; Dart, M. J.; Kolasa, T.; Meyer, M. D.; Patel, M. V.; Wang, X.-Q. WO 2008063781, 2008[Chem. Abstr. 2008, 639601]
-
[4]
Takamizawa, A.; Harada, H. DE 2458933, 1975[Chem. Abstr. 1975, 514384]
-
[5]
(a) Iravani, N.; Keshavarz, M.; Monfareda, M.; Hosseini, F. J. Chin. Chem. Soc. 2014, 61, 357.
(b) Yavari, I.; Hosseinpour, R.; Pashazadeh, R.; Ghanbari, E.; Skoulika, S. Tetrahedron 2013, 69, 2462.
(c) Alya, A. A.; Ishaka, E. A.; Brown, A. B. J. Sulfur Chem. 2014, 35(4), 382. -
[6]
(a) Wu, X.-F.; Gong, J.-L.; Qi, X.-X. Org. Biomol. Chem. 2014, 12, 5807.
(b) Hao, W.-J.; Du, Y.; Wang, D.; Jiang, B.; Gao, Q.; Tu, S.-J.; Li, G.-G. Org. Lett. 2016, 18, 1884.
(c) Liu, Z.-J.; Zhang, J.; Chen, S.-L.; Shi, E.-B.; Xu, Y.; Wan, X.-B. Angew. Chem., Int. Ed. 2012, 51, 3231.
(d) Zhang, Y.; Hu, G.-B.; Ma, D.-M.; Xu, P.-X.; Gao, Y.-X.; Zhao, Y.-F. Chem. Commun. 2016, 52, 2815.
[e] Tang, Y.-C.; Zhang, M.; Li, X.-Q.; Xu, X.-S.; Du, X.-H. Chin. J. Org. Chem. 2015, 35, 875(in Chinese). (唐裕才, 张敏, 李小青, 许响生, 杜晓华, 有机化学, 2015, 35, 875.)
(f) Ma, L.-J.; Wang, X.-P.; Yu, W.; Han, B.. Chem. Commun. 2011, 47, 11333.
(g) Wang, Q.; Xu, Z. Chin. J. Org. Chem. 2013, 33, 2430(in Chinese). (王倩, 徐洲, 有机化学, 2013, 33, 2430.)
(h) Yu, H.; Chen, Y.-G.; Zhang, Y.-H. Chin. J. Chem. 2015, 33(5), 531.
(i) Yu, H.; Zhang, Y.-H. Chin. J. Chem. 2016, 34(4), 359. -
[7]
(a) Zhang, L.; Dong, J.-H.; Xu, X.-X.; Liu, Q. Chem. Rev. 2016, 116, 287.
(b) Pan, L.; Bi, X.-H.; Liu, Q. Chem. Soc. Rev. 2013, 42, 1251.
(c) Luo, X.-Y.; Ge, L.-S.; An, X.-L.; Jin, J.-H.; Wang, Y.; Sun, P.-P.; Deng, W.-P. J. Org. Chem. 2015, 80, 4611.
(d) Singh, M. S.; Nandi, G. C.; Samai, S. Green Chem. 2012, 14, 447.
(e) Huang, F.; Wu, P.; Wang, L.-D.; Chen, J.-P.; Sun, C.-L.; Yu, Z.-K. Chem. Commun. 2014, 50, 12479.
(f) Wen, L.-R.; He, T.; Lan, M.-C.; Li, M. J. Org. Chem. 2013, 78, 10617.
(g) Nandi, G. C.; Singh, M. S. J. Org. Chem. 2016, 81, 5824.
(h) Yugandar, S.; Konda, S.; Parameshwarappa, G.; Ila, H. J. Org. Chem. 2016, 81, 5606. -
[8]
Guo, W.-S.; Wen, L-R.; Li, M. Org. Biomol. Chem. 2015, 13, 1942. doi: 10.1039/C4OB02024C
-
[9]
(a) Wen, L.-R.; Sun, J.-H.; Li, M.; Sun, E.-T.; Zhang, S.-S. J. Org. Chem. 2008, 73, 1852.
(b) Li, M.; Zuo, Z.-Q.; Wen, L.-R.; Wang, S.-W. J. Comb. Chem. 2008, 10, 436.
(c) Wen, L.-R.; Shi, Y.-J.; Liu, G.-Y.; Li, M. J. Org. Chem. 2012, 77, 4252.
(d) Li, M.; Hou, Y.-L.; Wen L.-R.; Gong, F.-M. J. Org. Chem. 2010, 75, 8522.
(e) Li, M.; Shao, P.; Wang, S.-W.; Kong, W.; Wen, L.-R. J. Org. Chem. 2012, 77, 8956. -
[10]
(a) Maiboroda, E. I.; Britsun, V. N. Russ. J. Org. Chem. 2008, 44, 1200.
(b) Britsun, V. N. Russ. J. Org. Chem. 2008, 44, 1528. -
[11]
Wen, L.-R.; Men, L.-B.; He, T.; Ji, G.-J. Li, M. Chem.-Eur. J. 2014, 20, 5028. doi: 10.1002/chem.201304497
-
[12]
(a) Li, M.; Cao, H.; Wang, Y.; Lv, X.-L.; Wen, L.-R. Org. Lett. 2012, 14, 3470.
(b) Li, M.; Kong, X.-J.; Wen, L.-R. J. Org. Chem. 2015, 80, 11999.
(c) Guo, W.-S.; Xin, X.; Zhao, K.-L.; Wen, L.-R.; Li, M. RSC Adv. 2015, 5, 70429. -
[13]
(a) Qiu, J.-K.; Hao, W.-J. Wang, D.-C.; Wei, P.; Sun, J.; Jiang, B.; Tu, S.-J. Chem. Commun. 2014, 50, 14782.
(b) Zhang, J.; Shao, Y.; Wang, H.-X.; Luo, Q.; Chen, J.-J.; Xu, D.-M.; Wan, X.-B. Org. Lett. 2014, 16, 3312.
(c) Mondal, B.; Sahoo, S. C. Pan, S. C. Eur. J. Org. Chem. 2015, 3135. -
[14]
(a) Uyanik, M.; Okamoto, H.; Yasui, T.; Ishihara, K. Science 2010, 328, 1376.
(b) Ma, L.-J.; Wang, X.-P.; Yu, W.; Han, B. Chem. Commun. 2011, 47, 11333.
(c) Yuan, Y.-C.; Hou, W.-J.; Zhang-Negrerie, D.; Zhao, K.; Du, Y.-F. Org. Lett. 2014, 16, 5410.
(d) Xu, W.; Nachtsheim, B. J. Org. Lett. 2015, 17, 1585.
-
[1]
-
表 1 反应条件优化a
Table 1. Optimization of reaction conditions

Entry Base (equiv.) Catalyst (equiv.) Oxidant (equiv.) Solvent T/℃ Time/h Isolated yield/% 1 Et3N(1.0) — — EtOH r.t. 72 30 2 — — — EtOH r.t. 72 NRb 3 Et3N (1.0) TBAI (0.2) TBHP (2.0) EtOH r.t. 1 72 4 Et3N (1.0) TBAI (0.2) TBHP (2.0) DMF r.t. 6 45 5 Et3N (1.0) TBAI (0.2) TBHP (2.0) DCE r.t. 2 54 6 Et3N (1.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 72 7 Et3N (1.0) TBAI (0.05) TBHP (2.0) EtOH r.t. 1 60 8 Et3N (1.0) - TBHP (2.0) EtOH r.t. 1 56 9 Et3N (1.0) TBAI (0.1) TBHP (1.0) EtOH r.t. 1 62 10 Et3N (1.0) KI (0.1) TBHP (2.0) EtOH r.t. 1 64 11 Et3N (1.0) NaI (0.1) TBHP (2.0) EtOH r.t. 1 63 12 Et3N (1.0) I2(0.1) TBHP (2.0) EtOH r.t. 5 65 13 DIPEA (1.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 50 14 NaOH (1.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 53 15 K2CO3(1.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 41 16 Et3N (0.5) TBAI (0.1) TBHP (2.0) EtOH r.t. 1 46 17 Et3N (2.0) TBAI (0.1) TBHP (2.0) EtOH r.t. 0.5 53 18 Et3N (1.0) TBAI (0.1) TBHP (2.0) EtOH 80 1 49 19 Et3N (1.0) TBAI (0.1) H2O2 (2.0) EtOH r.t. 1 43 20 Et3N (1.0) TBAI (0.1) m-CPBA (2.0) EtOH r.t. 1 35 a反应条件: 1a (0. 2 mmol), 2 (0. 3 mmol), 溶剂(1 mL); bNo reaction. 表 2 噻唑啉3的合成a, b
Table 2. Synthesis of thiazolylidenes3

-

 扫一扫看文章
扫一扫看文章
计量
- PDF下载量: 1
- 文章访问数: 3222
- HTML全文浏览量: 1098


 下载:
下载:





 下载:
下载:

